Аэртал или аленталь что лучше таблетки
25 марта в рамках V съезда ревматологов России состоялся симпозиум: «Коррекция болевого синдрома при ревматических заболеваниях», на котором прозвучали выступления, в ходе которых ведущие специалисты в области ревматологии из России и Великобр
«Вопросы боли требуют большого внимания, так как данные симптомы существенно влияют на жизнь пациентов» – начала свое выступление академик РАМН Валентина Александровна Насонова. Характерно, по ее словам, то, что в подавляющем большинстве случаев боль сопровождается негативным эмоциональным переживанием. Говоря о современных способах медикаментозного лечения с болевыми воспалительными заболеваниями, В.А.Насонова остановилась на лекарственном препарате, действующим веществом которого является ацеклофенак, как на «препарате выбора по мнению как врачей, так и больных».
Об истории создания действующего вещества рассказал профессор М. Айрани из Эшфордского Лондонского госпиталя. Молекула ацеклофенака была синтезирована в 1982 году, а в 1986 состоялось первое клиническое испытание. В 1992 препарат появился на испанском рынке, а спустя 10 лет и в России под названием «Аэртал». По сведениям г-на М. Айрани, за все это время было проведено большое количество сравнительных, плацебо-контролируемых исследований, в которых приняло участие более 20.000 пациентов. В результате них было показано, что ацеклофенак является «безопасным, высококлассным, качественным, надежным, сильным активным веществом, сфокусированное действие которого помогает быстро достичь желаемого результата – анальгетического и противовоспалительного эффекта».
Как следовало из выступления академика В.А. Насоновой, мировой опыт применения ацеклофенака нашел подтверждение и в России, где он популярен и широко применяется врачами. По ее словам, первые исследования Аэртала (компания «Гедеон Рихтер»), содержащего ацеклофенак продемонстрировали способность препарата быстро снимать болевые ощущения и при этом не повреждать желудочно-кишечный тракт, чем характерны практически все НПВП.
Данные по исследованиям Аэртала как в России, так и за рубежом, представила и профессор Института ревматологии Людмила Ивановна Алексеева. Так, например, в Латвии у 74 пациентов, принимавших ацеклофенак на протяжении месяца, было отмечено улучшение функциональности суставов и уменьшение болевых ощущений. Доказана высокая эффективность ацеклофенака при остеоартрозе, болевые ощущения при котором испытывают 30-40% больных, и ревматойдном артрите.
Обладающий многокомпонентным действием на воспаление оригинальный препарат ацеклофенака не оказывает повреждающего влияния на хрящ, а скорее наоборот, обладает хотдропротективным действием. Хорошая желудочно-кишечная переносимость, о которой говорили все выступающие, а также его большая эффективность по сравнению с классическими нестероидными противовоспалительными препаратами делают Аэртал (ацеклофенак) оптимальным выбором при лечении пациентов с хронической болью при различных ревматических заболеваниях.
Применение Аэртала (ацеклофенака) в клинической практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В ревматологической практике для комплексной терапии воспалительных и болевых синдромов наиболее часто применяются нестероидные противовоспалительные препараты (НПВП), обладающие выраженной противовоспалительной, анальгетической, жаропонижающей, а также антитромботической активностью. Основными показаниями для назначения НПВП являются, прежде всего, воспалительные и дегенеративные заболевания суставов и позвоночника – ревматоидный и реактивные артриты, псориатическая артропатия, острая ревматическая лихорадка, подагра, анкилозирующий спондилит, болезни мягких тканей, боли в нижней части спины (Low Back Pain) и др. НПВП эффективны при лечении приступов мигрени, почечной и печеночной колики, дисменореи и воспалительных заболеваний придатков, посттравматической и послеоперационной боли. В последнее время область применения НПВП значительно расширилась – их стали широко использовать для профилактики раннего развития атеросклероза у больных, страдающих аутоиммунными ревматическими заболеваниями, лечении болезни Альцгеймера, а также для профилактики развития рака толстого кишечника у больных с наследственным аденоматозом толстой кишки и метастазов при злокачественных опухолях различной локализации.
Группа НПВП включает большое количество препаратов, которые различаются по анальгетической и противовоспалительной активности, путям введения препарата в организм, спектру нежелательных явлений и др. В связи с этим подходы к их назначению различаются в зависимости от клинических проявлений заболевания, возраста больных, прогнозируемой длительности лечения и т.д. При этом необходимо учитывать, что при приеме НПВП, особенно длительном, возможно развитие нежелательных явлений – тошноты, неприятных ощущений и болей в эпигастральной области, метеоризма, диареи, а также эрозивно–язвенных поражений, кровотечений и перфораций стенки желудка, 12–перстной кишки и кишечника. Назначение НПВП у некоторых больных может спровоцировать развитие бронхоспазма, головокружения, бессонницы, нарушение костномозгового кроветворения, проявляющееся снижением количества эритроцитов, лейкоцитов и тромбоцитов в периферической крови, которые, впрочем, встречаются нечасто. Некоторые НПВП способствуют повышению АД, на фоне их приема снижается эффективность ингибиторов АПФ, диуретиков и b –адреноблокаторов [2].
Одним из побочных эффектов НПВП является их возможное неблагоприятное воздействие на суставной хрящ, что особенно актуально при лечении больных с суставным синдромом (ревматоидный артрит, остеоартроз и др.). Так, некоторые неселективные НПВП (индометацин, ибупрофен и др.) при длительном применении угнетают пролиферацию хондроцитов, вызывая тем самым усиление процессов деградации хрящевой ткани [6]. Считается доказанным также различное влияние НПВП на синтез протеогликанов хондроцитами. В частности, Dingle J.T. и M. Parker (1997) все НПВП подразделили на 3 группы в зависимости от их влияния на синтез компонентов матрикса хряща in vitro: ингибирующие (индометацин, напроксен, ибупрофен, нимесулид), нейтральные (пироксикам, набуметон) и стимулирующие (тенидап, ацеклофенак) [9]. Имеются также данные о нарастании частоты деструктивных изменений суставного хряща при приеме индометацина и напроксена, выявляемых рентгенологически [4].
Различная степень эффективности и ингибирования ЦОГ, а также вариабельность фармакодинамических и фармакокинетических свойств НПВП, по–видимому, и лежит в основе объяснения (если не объясняет полностью) весьма широкого спектра их фармакологической активности. Такая функциональная гетерогенность применима также и к анальгетической эффективности этих препаратов, хотя определение НПВП как «слабых анальгетиков» не совсем корректно, учитывая тот факт, что при послеоперационных болях некоторые НПВП оказывают значительно лучший обезболивающий эффект, чем опиоидные анальгетики [7]. За последние годы были накоплены данные, свидетельствующие о том, что анальгетический эффект НПВП не всегда можно объяснить только их способностью ингибировать синтез простагландинов в периферических тканях. В частности, было установлено, что некоторые препараты из группы НПВП, проникающие через гематоэнцефалический барьер, препятствуют обработке ноцицептивных сигналов в спинном мозге. Предполагаемыми мишенями НПВП в ЦНС являются нейромедиаторы возбуждения, в частности глутамат, G–белки, серотонинэргические и опиатные пути, а также полиамины. Кроме того, было показано, что некоторые НПВП могут ингибировать синтез простагландинов непосредственно в ЦНС [1].
Одним из препаратов, который получил широкое применение в ревматологической практике, является ацеклофенак ( Аэртал ) – дериват фенилуксусной кислоты, обладающий коротким периодом полужизни (4 часа) и хорошей эффективностью, сопоставимой с другими «стандартными» НПВП [3,14]. Доказано, что ацеклофенак ингибирует оба изофермента циклооксигеназы с преимущественным угнетением ЦОГ–2, а также подавляет синтез ряда провоспалительных цитокинов, в частности, ИЛ–1 [13]. Ацеклофенак быстро всасывается в организме – пиковая концентрация препарата в крови достигается уже через 1–3 часа после приема, при этом в синовиальной жидкости она составляет около 50% от плазменной. Элиминация препарата осуществляется преимущественно (до 66%) с мочой [8]. Лечебная доза Аэртала составляет 200 мг в сутки, поддерживающая – 100 мг в сутки [5].
Фармакокинетика Аэртала (ацеклофенака) не меняется с возрастом, что очень важно при назначении его пожилым больным, а биодоступность не снижается при приеме с пищей [24]. Кроме того, не выявлено взаимодействия препарата с другими фармакологическими средствами, в частности, с диуретиками, ингибиторами АПФ, антикоагулянтами и др. В частности, при сочетанном назначении ацеклофенака и диуретиков не отмечено изменений артериального давления и осмолярности мочи. Не было выявлено также отрицательных клинических эффектов при совместном приеме ацеклофенака с антидиабетическими препаратами, вместе с тем при длительном приеме НПВП все же иногда необходима коррекция дозы сахароснижающих препаратов. Совместный прием ацеклофенака и варфарина приводил к некоторому повышению плазменной концентрации последнего, однако существенного влияния на показатели коагулограммы это не оказывало. Не выявлено каких–либо изменений при совместном приеме ацеклофенака и метотрексата, широко использующегося в комплексной терапии ревматических заболеваний [3].
С учетом того, что Аэртал широко используется в клинической практике с 1992 года (в России препарат был зарегистрирован в 2002 году), то к настоящему времени накоплен большой практический опыт по его применению при различных ревматических заболеваниях. Во многих клинических исследованиях была продемонстрирована сходная эффективность ацеклофенака и других неселективных НПВП (диклофенака, пироксикама, напроксена) при ревматоидном артрите, остеоартрозе, анкилозирующем спондилите и др. В экспериментах на животных было показано, что ацеклофенак при равной эффективности со стандартными НПВП оказывает гораздо меньшее повреждающее действие на слизистую ЖКТ. Так, его ульцерогенная доза в эксперименте оказалась примерно в 4 раза выше, чем у диклофенака, индометацина и напроксена. Проведенное сравнительное исследование ацеклофенака и селективных НПВП (целекоксиба и рофекоксиба) в отношении подавления активности ЦОГ–1 и ЦОГ–2 в цельной крови человека показало, что ацеклофенак ингибирует оба изофермента, но преимущественно экспрессию ЦОГ–2 и, таким образом, по механизму действия приближается к селективным [17].
Доказана способность Аэртала (ацеклофенака) ингибировать синтез ряда провоспалительных цитокинов (ФНО– α и ИЛ–1 β ), что имеет важное значение при использовании его как при воспалительных заболеваниях суставов (ревматоидный артрит, подагрический артрит, анкилозирующий спондилит и др.), так и при остеоартрозе. Результаты исследования Y. Henrotin и соавт. (2001) свидетельствуют о потенциальной способности ацеклофенака оказывать влияние на процессы деградации матрикса хряща за счет ингибирования активности ИЛ–1 β и стимуляции синтеза глюкозаминогликанов (ГАГ) в хряще при остеоартрозе [13]. Как известно, ИЛ–1 β подавляет синтез хондроцитов и инициирует процессы деградации хряща в результате усиления высвобождения протеолитических ферментов. Установлено также стимулирующее влияние ацеклофенака на синтез антагониста рецепторов ИЛ–1 β в человеческих хондроцитах и подавление продукции металлопротеиназ [4]. Таким образом, назначение ацеклофенака в этих случаях оказывает как симптомо–модифицирующий, так и в некоторой степени патогенетический эффект. В частности, в клинических исследованиях был продемонстрирован ингибирующий эффект ацеклофенака на продукцию ПГЕ 2 в синовиальной жидкости больных с гонартрозом.
Важным также является установленный факт, свидетельствующий о том, что анальгетический эффект ацеклофенака у пациентов с ОА сопоставим с другими НПВП, в том числе диклофенаком, пироксикамом и напроксеном. Так, в исследовании D.E. Ward и соавт. (1995) было продемонстрировано, что у двух групп больных с ОА коленных суставов (n=397) через 12 недель терапии ацеклофенаком (200 мг/сут.) и диклофенаком (150 мг/сут.) отмечалось значимое уменьшение болевого синдрома, оцениваемого по 100–мм визуальной аналоговой шкале (ВАШ), при этом в группе ацеклофенака интенсивность боли уменьшилась на 75%, в группе диклофенака – на 70% [23]. Другие параметры заболевания – общее самочувствие, боль при движении и функциональная активность также значимо улучшились в обеих группах, однако, согласно данным опроса, большее предпочтение пациенты отдавали ацеклофенаку (71% против 59%, p=0,005).
В другом 8–недельном двойном слепом исследовании у пациентов с ОА коленных суставов (n=240) использовался ацеклофенак и пироксикам. На фоне терапии в обеих группах отмечалось существенное уменьшение интенсивности боли и улучшение функции суставов согласно индекса тяжести остеоартроза LOSI (Lequense Osteoarthritis Severity Index), однако лучший результат наблюдался у больных, получавших ацеклофенак [21]. Аналогичные результаты были получены и в другом сравнительном исследовании ацеклофенака и пироксикама у больных с гонартрозом [22].
В 12–недельном исследовании, в котором принимали участие 374 больные с ОА коленных суставов, была установлена сопоставимая терапевтическая эффективность ацеклофенака (200 мг/сут., 1–я группа) и напроксена (1000 мг/сут., 2–я группа). К концу курса терапии большинство обследованных пациентов отмечали уменьшение болей в покое и при движении, при этом объем движений в пораженных суставах увеличился у 81% больных 1–й группы и 84% 2–й группы, а улучшение общего состояния отметили 73 и 69% пациентов соответственно [15].
У больных ревматоидным артритом при назначении ацеклофенака наблюдался хороший противовоспалительный и анальгетический эффект, сравнимый с приемом «стандартных» НПВП – диклофенака, индометацина и теноксикама. Так, в многоцентровом двойном слепом 6–месячном исследовании было проведено сравнение ацеклофенака (200 мг/сут., 170 больных) и диклофенака (150 мг/сут., 173 больных) в параллельных группах [19]. Оба препарата достоверно снижали выраженность боли, индекс Ричи и утреннюю скованность уже через 15 дней от начала терапии, при этом достигнутый положительный эффект сохранялся в течение всего периода лечения. По оценке больных, хороший или очень хороший результат терапии был у 70,3% пациентов при лечении ацеклофенаком и у 65,6% – диклофенаком, а по оценке исследователя – у 76,3 и 69,6% больных соответственно.
С учетом того, что при серонегативных спондилоартропатиях НПВП являются основой медикаментозной терапии, то к их эффективности и переносимости предъявляются особые требования. Проведенные исследования эффективности ацеклофенака и стандартных НПВП у больных анкилозирующим спондилитом (АС) показали их эквивалентность, однако лучший профиль переносимости и безопасности продемонстрировал ацеклофенак. Так, в рандомизированном контролированном исследовании назначение ацеклофенака в дозе 200 мг/сут. и напроксена в дозе 1000 мг/сут. одинаково эффективно снижали интенсивность болей и способствовали улучшению функциональной активности у 126 больных АС [20]. В другом исследовании была продемонстрирована равная терапевтическая эффективность ацеклофенака и других НПВП (индометацина, теноксикама и напроксена) в отношении купирования боли, уменьшения продолжительности утренней скованности и улучшения двигательной активности при болезни Бехтерева [10].
Как известно, целесообразность применения того или иного препарата в клинической практике невозможна без всестороннего изучения его переносимости. Одним из серьезных побочных эффектов НПВП, ограничивающих их применение, является развитие НПВП–индуцированных гастропатий, проявляющихся эрозиями (часто множественными) и язвами антрального отдела желудка. Основными факторами риска их развития являются пожилой возраст больных, наличие в анамнезе язвенной болезни, желудочно–кишечного кровотечения или мелены, длительный прием высоких доз НПВП, прием одновременно НПВП и препаратов других фармакологических групп (глюкокортикоидов, антикоагулянтов и др.) [2].
Данные многочисленных клинических исследований свидетельствуют о том, что частота возникновения неблагоприятных явлений со стороны органов ЖКТ при приеме подавляющего большинства неселективных НПВП достигает 30%, а госпитализация пациентов пожилого возраста из–за развития пептической язвы в 4 раза выше по сравнению с лицами той же возрастной группы, не принимающих НПВП.
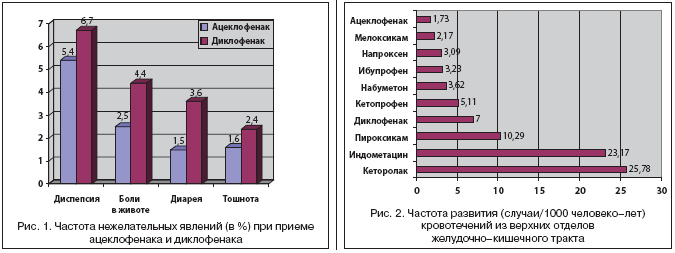
На сегодняшний день общепринятым считается факт, что нет абсолютно безопасных НПВП, в связи с чем они могут быть условно подразделены на 2 группы: с высоким и низким риском развития побочных эффектов со стороны органов ЖКТ. Спектр нежелательных явлений при лечении ацеклофенаком оказался близок таковому при лечении другими НПВП, однако существенно различался по частоте их развития. Это было продемонстрировано в исследовании SAMM (Safety Assessment of Marketed Medicines), в котором принимали участие 10142 больных (7890 пациентам был назначен ацеклофенак, 2252 пациентам – диклофенак), страдающие ревматоидным артритом, остеоартрозом и анкилозирующим спондилоартритом [12]. Результаты исследования свидетельствовали о лучшем профиле переносимости ацеклофенака в сравнении с диклофенаком (рис. 1). Авторы сформулировали вывод о том, что применение ацеклофенака сопровождалось меньшим риском развития НПВП–гастропатий и лучшей переносимостью даже с учетом того, что среди больных, получавших ацеклофенак, было значительно больше пациентов с патологией ЖКТ в анамнезе.
В исследовании А. Yanagawa и соавт. (1998) изучалось возможное побочное действие ацеклофенака и диклофенака на слизистую оболочку 12–перстной кишки (по результатам фиброгастродуоденоскопии) в двойном слепом плацебо–контролируемом исследовании [25]. Эндоскопические изменения после 2–х недельного приема ацеклофенака, диклофенака и плацебо достоверно чаще наблюдались в группе диклофенака. При этом было установлено, что у пациентов, получавших диклофенак, содержание гексозамина (фактора, оказывающего цитопротективное действие) и локальный кровоток в слизистой оболочке желудка и 12–перстной кишки были значимо снижены, в то время как при лечении ацеклофенаком эти показатели достоверно не отличались от группы плацебо.
Результаты этих исследований корреспондируют с работой M.J. Llorente Melero и соавт. (2002), в которой был представлен сравнительный популяционный анализ частоты желудочно–кишечных кровотечений при приеме различных НПВП по данным медицинских учреждений Испании (были изучены данные по 180995 пациентам за 4–летний период) [18]. Как видно из рисунка 2, прием ацеклофенака и мелоксикама сопровождался наименьшим риском развития кровотечений из верхних отделов ЖКТ, в то время как при назначении кеторолака и индометацина риск желудочно–кишечных кровотечений был выше более чем в 10 раз.
Исходя из представленных данных, можно констатировать, что ключевым моментом в выборе НПВП врачом–ревматологом является его высокая клиническая эффективность, безопасность, а также хорошая переносимость. В этом плане интересны результаты Европейского обсервационного когортного исследования, в котором анализировалась эффективность применения ацеклофенака у 23407 больных с воспалительными и дегенеративными ревматическими заболеваниями [16]. В этом исследовании оценивалась степень выраженности боли на фоне проводимой терапии, общая удовлетворенность лечением, а также уровень комплаентности. Полученные результаты продемонстрировали быстрый и продолжительный анальгетический эффект ацеклофенака, при этом улучшение общего состояния наблюдалось у 84% обследованных пациентов, а 93,5% больных отметили удовлетворенность лечением по окончанию исследования.
Таким образом, суммируя данные по эффективности и переносимости ацеклофенака, полученные в многочисленных контролируемых клинических исследованиях, можно заключить, что ацеклофенак (Аэртал) является высокоэффективным НПВП и имеет при этом ряд преимуществ перед другими «стандартными» НПВП : быстрый период полураспада (4 часа), что снижает возможность кумуляции препарата и, соответственно, риск развития побочных эффектов; высокая биодоступность, которая не зависит от приема пищи; сравнимая фармакокинетика у лиц различных возрастных групп; сопоставимая эффективность с диклофенаком, индометацином, напроксеном и кетопрофеном при лечении дегенеративных и воспалительных заболеваний суставов; лучшая желудочно–кишечная переносимость в сравнении с другими «стандартными» НПВП по данным клинико–эндоскопических исследований; возможность сочетанного приема с препаратами других фармакологических групп (непрямыми антикоагулянтами, гипогликемическими препаратами, диуретиками); отсутствие доказательств отрицательного влияния на хрящ.
Применение Аэртала (ацеклофенака) в ревматологической практике
Резюме. В статье российских авторов представлена информация об эффектах и механизмах действия нестероидных противовоспалительных препаратов (НПВП), общих принципах их назначения, а также характерных для этого класса лекарственных средств побочных эффектах. Приведены данные о ряде преимуществ препарата Аэртал (ацеклофенак) перед другими «стандартными» НПВП при лечении ревматических заболеваний.
В практике поликлинического врача одними из наиболее часто назначаемых лекарств являются нестероидные противовоспалительные препараты (НПВП) — группа лекарственных средств, обладающих противовоспалительным, анальгетическим и жаропонижающим действием.
Основными показаниями для назначения НПВП являются:
Препараты этой группы различаются по анальгетической и противовоспалительной активности, побочным эффектам, путям введения и т.д., в связи с чем имеются определенные особенности их назначения в зависимости от клинических проявлений заболевания, возраста больных, прогнозируемой длительности лечения.
Особо следует обратить внимание на то, что при приеме НПВП, особенно длительном, возможно развитие нежелательных явлений — тошноты, неприятных ощущений и болей в эпигастральной области, метеоризма, диареи. Одним из серьезных побочных эффектов НПВП, ограничивающих их применение, является развитие НПВП-индуцированных гастропатий, проявляющихся эрозиями (часто множественными) и язвами антрального отдела желудка и/или двенадцатиперстной кишки. Основными факторами риска их развития являются пожилой возраст больных, наличие в анамнезе язвенной болезни, желудочно-кишечного кровотечения или мелены, длительный прием высоких доз НПВП, прием одновременно НПВП и препаратов других фармакологических групп (глюкокортикоидов, антикоагулянтов и др.).
Данные многочисленных клинических исследований свидетельствуют о том, что частота возникновения неблагоприятных явлений со стороны органов желудочно-кишечного тракта (ЖКТ) при приеме подавляющего большинства неселективных НПВП достигает 30%, а госпитализация пациентов пожилого возраста из-за развития пептической язвы в 4 раза выше по сравнению с лицами той же возрастной группы, не принимающими НПВП. На сегодняшний день общепринятым считается факт, что нет абсолютно безопасных НПВП, в связи с чем они могут быть условно подразделены на 2 группы — с высоким и низким риском развития побочных эффектов со стороны органов ЖКТ.
Среди других неблагоприятных явлений у больных при приеме НПВП могут развиваться головокружение, бессонница, нарушение костно-мозгового кроветворения, проявляющееся снижением количества эритроцитов, лейкоцитов и тромбоцитов в периферической крови, повышением артериального давления. Возможно также неблагоприятное воздействие на суставной хрящ вследствие угнетения пролиферации хондроцитов.
Механизм действия НПВП
По степени ингибирования основного фермента — циклооксигеназы (ЦОГ) все НПВП подразделяются на 2 группы — неселективные («классические», «стандартные»), в равной степени ингибирующие продукцию ЦОГ-1 и ЦОГ-2 (диклофенак, индометацин, ибупрофен и др.), и селективные (специфические) ингибиторы ЦОГ-2 — нимесулид, мелоксикам, коксибы. Различная степень эффективности и ингибирования ЦОГ, а также вариабельность фармакодинамических и фармакокинетических свойств НПВП, по-видимому, и лежит в основе объяснения (если не объясняет полностью) весьма широкого спектра их фармакологической активности. Такая функциональная гетерогенность применима также и к анальгетической эффективности этих препаратов, хотя определение НПВП как «слабых анальгетиков» не совсем корректно, учитывая тот факт, что при послеоперационных болях некоторые НПВП оказывают даже более выраженный обезболивающий эффект, чем опиоидные анальгетики.
Анальгетический эффект НПВП не всегда можно объяснить только их способностью ингибировать синтез простагландинов в периферических тканях. В частности, было установлено, что некоторые препараты группы НПВП, проникающие через гематоэнцефалический барьер, препятствуют «обработке» ноцицептивных сигналов в спинном мозгу. Кроме того, было показано, что ряд НПВП могут ингибировать синтез простагландинов непосредственно в центральной нервной системе.
В последние годы широкое применение в амбулаторной практике врачей разных специальностей (терапевты, ревматологи, травматологи, гинекологи и др.) получил ацеклофенак (Аэртал) — дериват фенилуксусной кислоты, обладающий коротким периодом полужизни (4 ч) и хорошей эффективностью, сопоставимой с другими «стандартными» НПВП. Ацеклофенак ингибирует оба изофермента ЦОГ с преимущественным угнетением ЦОГ-2, а также подавляет синтез ряда провоспалительных цитокинов, в частности интерлейкина-1 (ИЛ-1). Ацеклофенак быстро всасывается в организме — пиковая концентрация препарата в крови достигается уже через 1–3 ч после приема, при этом в синовиальной жидкости она составляет около 50% от плазменной. Элиминация препарата осуществляется преимущественно с мочой. Фармакокинетика ацеклофенака не меняется с возрастом, что очень важно при назначении его пожилым больным, а биодоступность не снижается при приеме с пищей. Не выявлено взаимодействия препарата с другими фармакологическими средствами (ингибиторы ангиотензинпревращающего фермента, антикоагулянты и др.), а при сочетанном назначении с диуретиками не отмечено изменений артериального давления и осмолярности мочи.
Не было установлено также отрицательных клинических эффектов при совместном приеме ацеклофенака с антидиабетическими препаратами, однако при длительном приеме НПВП все же иногда необходима коррекция дозы сахароснижающих препаратов. Совместный прием ацеклофенака и варфарина приводил к некоторому повышению плазменной концентрации последнего, однако существенного влияния на показатели коагулограммы это не оказывало. Не выявлено каких-либо изменений при совместном приеме ацеклофенака и метотрексата, широко использующегося в комплексной терапии ревматических заболеваний в качестве базисного препарата.
Терапевтическая доза Аэртала составляет 200 мг/сут, поддерживающая — 100 мг/сут. Препарат рекомендуется принимать после приема пищи.
Режим дозирования. Взрослым назначают внутрь по 100 мг (1 таблетка) 2 раза в сутки утром и вечером. Таблетки следует проглатывать целиком, запивая достаточным количеством жидкости.
С учетом того, что ацеклофенак широко используется в клинической практике с 1992 г. (в России препарат был зарегистрирован в 2002 г.), к настоящему времени накоплен большой практический опыт по его применению при разных ревматических заболеваниях. Была продемонстрирована сходная эффективность ацеклофенака и других неселективных НПВП (диклофенак, пироксикам, напроксен) при ревматоидном артрите (РА), остеоартрозе (ОА), анкилозирующем спондилите (АС) и др. В экспериментах на животных было показано, что ацеклофенак при равной эффективности со «стандартными» НПВП оказывает гораздо меньшее повреждающее действие на слизистую оболочку ЖКТ. Так, его ульцерогенная доза в эксперименте оказалась примерно в 4 раза выше, чем у диклофенака, индометацина и напроксена.
Проведенное сравнительное исследование ацеклофенака и селективных НПВП (целекоксиба и рофекоксиба) в отношении подавления активности ЦОГ-1 и ЦОГ-2 в цельной крови человека показало, что ацеклофенак ингибирует оба изофермента, но преимущественно экспрессию ЦОГ-2 и, таким образом, по механизму действия приближается к селективным. Доказана его способность ингибировать синтез ряда провоспалительных цитокинов (фактор некроза опухоли α и ИЛ-1β), что имеет важное значение при использовании его при воспалительных (РА, подагрический артрит, АС и др.) и дегенеративных заболеваниях суставов (ОА). Так, результаты исследования Y. Henrotin и соавторов (2001 г.) свидетельствуют о потенциальной способности ацеклофенака оказывать влияние на процессы деградации матрикса хряща за счет ингибирования активности ИЛ-1β и стимуляции синтеза глюкозаминогликанов в хрящевой ткани. Установлено также стимулирующее влияние ацеклофенака на синтез антагониста рецепторов ИЛ-1β в человеческих хондроцитах и подавление продукции матриксных металлопротеиназ.
С учетом представленных данных применение ацеклофенака при ОА является патогенетически обоснованным. Это подтверждают и данные исследования H. Hajjaji и соавторов (2003 г.), выполненного in vitro на хряще, полученном при оперативном лечении больных ОА. Авторами было показано, что применение целекоксиба в отличие от диклофенака увеличивало число [3H]-PG молекул, участвующих в синтезе простагландинов хряща, а также повышало концентрацию вновь синтезированных молекул гиалуроновой кислоты. Подобные эффекты были выявлены и при использовании ацеклофенака, который в исследованиях in vitro приводил к стимуляции синтеза гликозаминогликанов в хрящевой ткани у больных ОА.
Важным также является установленный факт, что анальгетический эффект ацеклофенака у пациентов с ОА сопоставим с таковым других НПВП, в том числе диклофенака, пироксикама и напроксена. Так, в исследовании D. Ward и соавторов (1995 г.) было продемонстрировано, что у 2 групп больных ОА коленных суставов (n=397) через 12 нед терапии ацеклофенаком (200 мг/сут) и диклофенаком (150 мг/сут) отмечалось значимое уменьшение болевого синдрома, оцениваемого по 100 мм визуальной аналоговой шкале — на 75 и 70% соответственно. Другие параметры заболевания — общее самочувствие, боль при движении и функциональная активность также значимо улучшились в 2 группах, однако, согласно данным опроса, большее предпочтение пациенты отдавали ацеклофенаку (71 против 59%, p=0,005).
В другом 8-недельном двойном слепом исследовании у пациентов с ОА коленных суставов (n=240) использовались ацеклофенак и пироксикам. На фоне терапии в 2 группах отмечалось существенное уменьшение интенсивности боли и улучшение функции суставов согласно индекса тяжести ОА LOSI (Lequesne Osteoarthritis Severity Index), однако лучший результат наблюдался у больных, получавших ацеклофенак. В 12-недельном исследовании, в котором принимали участие 374 больных ОА коленных суставов, была установлена сопоставимая терапевтическая эффективность ацеклофенака (200 мг/сут) и напроксена (1000 мг/сут).
У больных РА при назначении ацеклофенака также наблюдался хороший противовоспалительный и анальгетический эффект, сравнимый с приемом «стандартных» НПВП — диклофенака, индометацина и теноксикама. Так, в многоцентровом двойном слепом 6-месячном исследовании было проведено сравнение ацеклофенака (200 мг/сут, 170 больных) и диклофенака (150 мг/сут, 173 больных) в параллельных группах. Оба препарата достоверно снижали выраженность боли, степень припухлости суставов и длительность утренней скованности уже через 15 дней от начала терапии, при этом достигнутый положительный эффект сохранялся в течение всего периода лечения.
С учетом того, что при серонегативных спондилоартропатиях НПВП являются основой медикаментозной терапии, к их эффективности и переносимости предъявляются особые требования. Проведенные исследования эффективности ацеклофенака и «стандартных» НПВП у больных АС показали их эквивалентность, однако лучший профиль переносимости и безопасности продемонстрировал ацеклофенак. В частности, в рандомизированном контролируемом исследовании назначение 126 больным АС ацеклофенака в дозе 200 мг/сут и напроксена в дозе 1000 мг/сут одинаково эффективно снижало интенсивность боли и способствовало улучшению функциональной активности. В другом исследовании была продемонстрирована равная терапевтическая эффективность ацеклофенака и других НПВП (индометацин, теноксикам и напроксен) в отношении купирования боли, уменьшения продолжительности утренней скованности и улучшения двигательной активности при болезни Бехтерева.
Как известно, целесообразность применения того или иного препарата в клинической практике невозможна без всестороннего изучения его переносимости. Спектр нежелательных явлений при лечении ацеклофенаком оказался близок таковому при лечении другими НПВП, однако существенно различался по частоте их развития. Это было продемонстрировано в широко известном исследовании SAMM (Safety Assessment of Marketed Medicines), в котором принимали участие 10 142 больных с разными ревматическими заболеваниями (РА, ОА и АС); 7890 больным был назначен ацеклофенак, 2252 — диклофенак. На основании полученных данных авторы пришли к выводу, что применение ацеклофенака сопровождалось меньшим риском развития НПВП-гастропатий и лучшей переносимостью даже с учетом того, что среди больных, получавших ацеклофенак, было значительно больше пациентов с патологией ЖКТ в анамнезе.
Эти данные корреспондируют с результатами исследования А. Yanagawa и соавторов (1998 г.), изучавших побочные эффекты ацеклофенака и диклофенака на слизистую оболочку двенадцатиперстной кишки (по результатам фиброгастродуоденоскопии) в двойном слепом плацебо-контролируемом исследовании. Было установлено, что эндоскопические изменения после 2-недельного приема ацеклофенака, диклофенака и плацебо достоверно чаще наблюдались у больных, принимавших диклофенак. Выявлено, что у пациентов, получавших диклофенак, содержание гексозамина (фактор, оказывающий цитопротекторное действие) и локальный кровоток в слизистой оболочке желудка и двенадцатиперстной кишки были значимо снижены, в то время как при лечении ацеклофенаком эти показатели достоверно не отличались от группы плацебо.
В работе M. Melero и соавторов (2002 г.) был представлен сравнительный популяционный анализ частоты желудочно-кишечных кровотечений при приеме различных НПВП по данным медицинских учреждений Испании (были изучены данные по 180 995 пациентам за 4-летний период). Авторы делают вывод о том, что прием ацеклофенака и мелоксикама сопровождался наименьшим риском развития кровотечений из верхних отделов ЖКТ, в то время как при назначении кеторолака и индометацина риск желудочно-кишечных кровотечений повышался более чем в 10 раз.

В ряду препаратов, отвечающих этим требованиям, стоит и ацеклофенак (Аэртал), имеющий ряд преимуществ перед другими «стандартными» НПВП: быстрый период полураспада (4 ч), что снижает возможность кумуляции препарата и, соответственно, риск развития побочных эффектов; высокая биодоступность, которая не зависит от приема пищи; сравнимая фармакокинетика у лиц разных возрастных групп; сопоставимая эффективность с диклофенаком, индометацином, напроксеном и кетопрофеном при лечении дегенеративных и воспалительных заболеваний суставов; лучшая желудочно-кишечная переносимость в сравнении с другими «стандартными» НПВП, по данным клинико-эндоскопических исследований; возможность сочетанного приема с препаратами других фармакологических групп (непрямые антикоагулянты, сахароснижающие препараты, диуретики); отсутствие доказательств отрицательного влияния на хрящ.
В заключение следует отметить, что при назначении любого НПВП необходимо основываться на общих принципах, которые заключаются в использовании минимальной эффективной дозы препарата, приеме одновременно не более одного НПВП, оценке клинической эффективности через 7–10 дней от начала терапии и при необходимости замены препарата на другой, а также отмене препарата после купирования болей.
Статья, опубликованная в Справочнике поликлинического врача (№ 8, 2010, с. 47–49), предоставлена представительством компании «Рихтер Гедеон» в Украине.