Ахиллопластика у детей что это
Ахиллопластика у детей что это
Ахиллово сухожилие (tendo calcaneus) – самое крупное и прочное сухожилие в организме человека, отличается высокой устойчивостью к разрыву, значительной эластичностью и пластичностью при незначительной растяжимости. Удлинение ахиллова сухожилия является одной из распространенных операций для устранения эквинусных и эквино-варусных деформаций стоп [1; 6; 10; 13; 14]. Наиболее часто данное вмешательство применяется у растущих детей. Восстановление непрерывности ахиллова сухожилия осуществляется путем сшивания его концов по методу Кюнео, Казакова и других авторов [7; 8]. Данная разновидность швов имеет низкую механическую прочность, которая обусловлена прохождением шовного материала среди сухожильных пучков в продольной плоскости, в результате чего при нагрузке сухожильная ткань подвержена значительному прорезыванию и продавливанию, что увеличивает риск возникновения несостоятельности шва [2]. В этом случае регенерация ахиллова сухожилия происходит в неблагоприятных условиях.
Вопрос о регенерации сухожильной ткани до настоящего времени остается до конца не изученным. Большинство исследователей считают, что сухожильная ткань не имеет истинной регенерации, а сухожильный дефект замещается рубцовой тканью.
«Золотым стандартом» при изучении репаративных процессов ахиллова сухожилия на сегодняшний день остаются гистологические препараты (срезы), взятые во время операции [3]. Однако изучить все фазы репаративной регенерации ахиллова сухожилия возможно лишь в эксперименте, поскольку забрать материал для морфологических исследований у детей, которым выполнялась удлиняющая ахиллопластика, не представляется возможным.
Высокая разрешающая способность современных ультразвуковых аппаратов, информативность и неинвазивность метода создали предпосылки для широкого применения ультрасонографии в травматологии и ортопедии при оценке состояния опорно-двигательного аппарата [4; 5; 12]. С помощью широкополосных высокочастотных датчиков с высокой плотностью элементов обеспечивается высочайшее точное разрешение на сонографических изображениях соединительной ткани. Разрешающая способность современных ультразвуковых аппаратов позволяет достоверно отобразить структуру коллагеновых волокон, которые являются базовой основой сухожилий. Фактически сонографическая картина сухожилий в настоящее время соответствует их гистологическому строению [9; 11].
Метод ультразвуковой диагностики широко применяется при исследовании мягкотканых структур опорно-двигательного аппарата, но его возможности в отношении изучения репаративной регенерации ахиллова сухожилия в реальном времени недостаточно изучены.
Целью настоящей работы явилось ультросонографическое изучение репаративной регенерации ахиллова сухожилия в реальном времени при наложении сухожильного шва.
Материалы и методы исследования
В Нижегородском НИИ травматологии и ортопедии разработан и внедрен способ наложения петлевого сухожильного шва (патент РФ № 2346665 от 24.09.2009г. Лицензия на использование новой медицинской технологии «Наложение петлевого сухожильного шва при ахиллопластике» от Росздравнадзора, ФС № 2011/231 от 04.08.2011 г.).
В работе представлены результаты обследования 42 детей (73 стопы), которым была выполнена удлиняющая ахиллопластика с сшиванием концов сухожилия по типу «конец в конец». Ахиллово сухожилие Z-образно рассекалось в сагиттальной плоскости с наложением петлевого сухожильного шва по предложенному способу. Двусторонняя патология отмечена у 31 ребенка, односторонняя – у 11 (правосторонняя – 4, левосторонняя – 7). Средний возраст составил – 445,0 ± 41,7 дня.
Ультразвуковое исследование выполнялось на аппарате Acuson X 300 (Siemens, Германия), линейными датчиками 13–5 МГц с небольшой рабочей поверхностью для удобства сканирования. Исследование ахиллова сухожилия проводилось в двух взаимно перпендикулярных плоскостях, при этом УЗ-луч составлял с сухожилием прямой угол. Строгое соблюдение данного условия при обследовании позволило исключить возникновение эффекта анизотропии, согласно которому изменяется эхогенность исследуемой структуры. Это снизило вероятность получения неверного заключения о состоянии репаративного процесса в ахилловом сухожилии. Сухожилие исследовалось от места прикрепления к пяточной кости до места перехода в икроножную и камбаловидную мышцы, при этом определялась его толщина в проксимальной и дистальной частях, выраженность паратонона. Оценивалась структура сухожилия, состояние его концов и паратениальных тканей, формирование регенерата (сращения). Ультрасонография ахиллова сухожилия проводилась до оперативного вмешательства, а также на 7, 15, 30 и 48 сутки после него.
Результаты исследования и их обсуждение
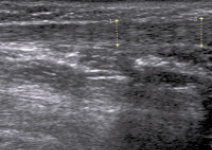
Эхокартина ахиллова сухожилия перед тенотомией. При продольном ультразвуковом сканировании сухожилие имеет трубчатую структуру с параллельными гиперэхогенными линиями (рис. 1). Гиперэхогенные линии являются отражениями ультразвукового луча от коллагена и перегородок эндотелия. Ахиллово сухожилие прослеживается на всем протяжении, хорошо дифференцируется от окружающих его мягких тканей, четко определяются его контуры и волокнистая структура. При ультразвуковом сканировании по краям ахиллова сухожилия визуализируются гиперэхогенные линии – паратенон, толщина которого составляет 0,26 ± 0,05 мм. Передне-задний размер проксимального конца сухожилия равен 3,1 ± 0,15 мм, а дистального конца сухожилия – 3,72 ± 0,26 мм. При поперечном сканировании ахиллово сухожилие лоцируется в виде образования овальной формы с четкими контурами и яркими гиперэхогенными точками.
Рис. 1. Изображение правого ахиллова сухожилия до тенотомии
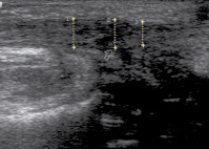
На 7 сутки после тенотомии при ультразвуковом исследовании ахиллова сухожилия при продольном сканировании определяется непрерывность его контура за счет сухожильного шва (рис. 2). Выявляется снижение эхогенности сухожилия и неоднородность его структуры за счет утолщения, разрыхления и набухания соединительнотканной его основы. Концы ахиллова сухожилия имеют нечеткий и неровный контур с утратой упорядочной эхоструктуры, визуализируются гиперэхогенные послеоперационные лигатуры (p 0,05), а дистальной части – 2,5 ± 0,17 мм (p 0,05). Максимальное значение передне-заднего размера определяется в месте наложения сухожильного шва и составляет 4,5 ± 0,31 мм.

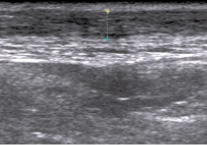
Рис. 8. Та же больная. Изображение правого ахиллова сухожилия на 48 сутки после тенотомии
Рис. 9. Та же больная. Изображение правого ахиллова сухожилия через 1 год после тенотомии
При поперечном и продольном сканировании на уровне шва в толще сухожилия поперечно выявляется тонкая гипоэхогенная полоса с нечеткими контурами, что свидетельствует об относительно неполном восстановлении структуры ахиллова сухожилия. Толщина сухожильной оболочки определяется на всем протяжении сухожилия и составляет 0,28 ± 0,04 мм. Окружающие мягкие ткани без особенностей.
Проведенный анализ эхоструктуры ахиллова сухожилия на разных сроках после операции позволил выявить основные дифференциальные (отличительные) критерии фаз репаративной регенерации сухожильной ткани у детей после шва по методике отдела.
Данные ультрасонографического обследования ахиллова сухожилия на 7 сутки после тенотомии показали, что в зоне сухожильного шва преобладают деструктивные процессы: отмечаются диастаз концов сухожилия с заполнением его гематомой, отечность и утолщение концов, и прерывание контура паратенона, а также развитие лимфостаза и отека в прилежащих тканях. На 15 сутки после операции процессы репаративной регенерации принимают усиленный характер: отмечается уменьшение диастаза концов сухожилия, снижение их отечности с появлением непрерывности контура сухожилия и частичного восстановления контура паратенона. На 48 сутки после тенотомии основные процессы регенерации сухожилия заканчиваются: восстанавливается его анатомическая непрерывность с приближением структуры регенерата к нормальной ткани сухожилия. Результаты ультрасонографического обследования ахиллова сухожилия показывают, что окончательная перестройка сухожилия в зоне наложения швов происходит достаточно длительно и даже через год после операции обнаруживаются изменения в виде тонкой гипоэхогенной полосы с нечеткими контурами.
Данные ультрасонографических исследований показали, что предложенный сухожильный шов обеспечивает хорошую адаптацию между проксимальным и дистальным концами сухожилия и создает благоприятные условия для регенерации сухожильной ткани в оптимальные сроки.
Проведенное ультрасонографическое исследование позволило изучить регенерацию ахиллова сухожилия в динамике, максимально точно определить сроки его сращения с восстановлением анатомической непрерывности, что имеет большое практическое значение для определения длительности периода гипсовой иммобилизации, сроков начала ранней реабилитации у конкретно взятого пациента.
Рецензенты:
Малышев Е.С., д.м.н., профессор кафедры хирургии (курс травматологии и ортопедии) ФПКВ ГБОУ ВПО «НижГМА» Минздрава России, г. Нижний Новгород;
Королев С.Б., д.м.н., профессор, заведующий кафедрой травматологии, ортопедии и военно-полевой хирургии ГБОУ ВПО «НижГМА» Минздрава России, г. Нижний Новгород.
Послеоперационная реабилитация ахиллова сухожилия
Восстановление после операции на ахилловом сухожилии длится от 3-х недель до полугода и больше. Оно зависит от возраста прооперированного, сопутствующих болезней, тяжести травмы, поэтому реабилитация проходит у каждого прооперированного по-своему. Точных цифр стандартных для всех оперированных нет. Весь реабилитационный период делится на 3 этапа. Если есть возможность, надо близким людям заранее продумать все нюансы, которые становятся важными после операции. Так, первые недели после операции пациент будет ходить с помощью костылей, поэтому их необходимо приобрести, выбрав наиболее удобный для пострадавшего вариант и подобрав под его рост, надо подготовить комфортную и устойчивую обувь, по рекомендации врача возможно придется купить специальный брейс (ортез), который позволяет регулировать угол сгибания в голеностопном суставе.
Обычно прооперированный по поводу патологии ахиллова сухожилия выписывается домой через 2-3 дня после операции, но иногда его могут отправить домой в этот же день. Перед выпиской врач дает подробную информацию по ведению реабилитации в домашних условиях в течении первого времени до повторного визита к ортопеду.
Основные рекомендации в послеоперационном периоде после разрыва ахиллова сухожилия
Обычно рекомендации в раннем послеоперационном периоде сводятся к следующим моментам:
В период, когда нога может быть загружена только частично, должна проводиться профилактика тромбоза.
Потенциальные осложнения после хирургического вмешательства.
Осложнений и проблем может быть намного больше, особенно при малоинвазивных вмешательствах, когда врач сопоставляет сухожилия вслепую, поэтому в некоторых случаях для более благоприятного результата приходится в процессе операции делать открытый доступ.
Через 10-14 дней после операции обычно наносят визит к ортопеду, который осматривает прооперированную ногу, снимает швы (если было не чрескожное сшивание). Лонгета обычно остается еще на 1-2 недели в зависимости от состояния пациента. Современные ортезы облегчают восстановление и уменьшают сроки иммобилизации. Так, брейс позволяет регулировать высоту пятки и постепенно менять угол сустава, доводя его до 90 градусов. Через 1,5-2 месяца пациент уже может снять ортез и учиться ходить самостоятельно.
Напоминаем, что все сроки, которые здесь даны – ориентировочные. Они зависят от тяжести травмы, от самочувствия пациента, от динамики выздоровления, от выбранного ортеза. Только лечащий ортопед может дать последующие рекомендации. На каждом приеме он осматривает стопу, общается с пациентом, анализирует увиденное и объясняет, когда ногу можно полностью загрузить, какую обувь выбрать, когда можно сесть за автомобиль, когда можно приступить к работе, как минимизировать риск осложнений и т.д.
Переход от каждого этапа восстановления должен осуществляться только по решению врача. Нельзя форсировать события, расплата за самостоятельность может быть слишком высокой.
Прогноз
Могут ли разрывы ахиллова сухожилия иметь долгосрочные последствия? Да, могут! Поэтому после разрыва пострадавший должен сразу и как можно скорее обратиться к врачу. Если разорванная связка не лечится должным образом, возникают проблемы с подвижностью суставов. Если разорванная связка заживает плохо, сустав может оставаться постоянно нестабильным. Пострадавший человек неоднократно спотыкается, и риск новых травм увеличивается. Конечно, это имеет особое значение для спортсменов. Однако нестабильный голеностопный сустав может также значительно ухудшить нормальную повседневную жизнь и, в результате неправильной нагрузки, привести к болезненному износу суставов (остеоартроз).
Если травма незначительная и лечение своевременное, то прогноз благоприятный. Если разрыв был массивным, лечение было начато поздно, то возможны серьезные осложнения вплоть до инвалидности. Результат лечения зависит от индивидуальных характеристик пострадавшего, его мотивации, добросовестного выполнения всех рекомендаций специалиста.
ДЛЯ СВЯЗИ С НАМИ
Чтобы получить полную информацию о видах лечения и профилактике заболеваний ортопедии, ревматологии или неврологии, пожалуйста, обратитесь к нам:





Лечение косолапости у детей
Заболевание относится к группе врожденных заболеваний опорно-двигательного аппарата и характеризуется стойкой эквинополо-варусной деформацией стопы. Различают две формы косолапости у детей: типичную (80%) и атипичную (20%).
Это один из самых частых пороков опорно-двигательной системы: частота составляет приблизительно 1-3 на 1000 человек. У мальчиков патология встречается в 2-3 раза чаще, чем у девочек. При рождении сразу отмечаются следующие деформации:
увеличен свод стопы.
Причины косолапости
Почему ребенок родился косолапым? Данный вопрос тревожит многих родителей.
Косолапость не является мальформацией, это порок развития. Обычно здоровая ножка плода деформируется в косолапую в течение второго триместра беременности, это период, когда идет усиленное наращивание коллагена в сухожилиях и связках. И на этот процесс могут повлиять десятки факторов: стресс, хронические заболевания, алкоголь, генетическая предрасположенность.
Так, например, если у одного из родителей косолапость, то риск развития ее у ребенка – 3-4%, если оба родителя – 30%.
Заметить данный порок на УЗИ до 16-й недели беременности получается редко.
Когда начинать лечение?
Лечение врожденной косолапости должно всегда начинаться консервативно: с помощью этапных гипсовых повязок! Поэтому начинать консервативное лечение нужно как можно раньше – на 7-10 день после рождения. Сразу после рождения ребенка мягкие ткани имеют более выраженную эластичность, поэтому коррекция стопы до 1 года может быть намного проще, чем в последующем периоде.
С ходом времени эластичность тканей уменьшается. Это не значит, что лечение косолапости становиться невозможно, но есть вероятность, что потребуется большее количество этапов.
В возрасте свыше 9 месяцев консервативное лечение теряет эффективность.
В 3,5-4 лет деформируется скелет стопы, что резко повышает вероятность рецидива;
Лечение оперативными методами целесообразно после завершения костного роста.
В любом возрасте важно носить специальную обувь и делать упражнения.
Что такое гипсования по методу Понсети?
Сегодня основным и признанным во всем мире методом лечения врожденной косолапости является гипсование по Понсети (Ponseti).
Данный метод разработал американский ортопед Игнасио Понсети (Университет Айовы, США) в 40-х годах прошлого века.
Данный метод подходит даже для позднего лечения в раннем детском возрасте. В большинстве случаев требуется хирургическая коррекция, но её объем будет меньшим, чем был бы необходим, без предварительного гипсования по Понсети.
Метод Понсети состоит из 3 этапов:
Лечение косолапости по Понсети простая и понятная методика, однако предусматривает четкое соблюдение последовательности коррекции и этапности.
1. Гипсование
Все начинается с гипсования. На ногу ребенка накладывается гипсовая повязка с учетом коррекции деформации. Повязка меняется один раз в неделю. За это время сухожилия, мышцы, связки и капсула сустава растягиваются. Каждая последующая повязка предполагает еще большее устранение деформации. В среднем требуется 5 гипсований. К этому моменту, как правило, устраняются приведение переднего отдела стопы, супинация, а также нормализуется положение пяточной кости.
2. Ахиллотомия
После повязок остается вопрос тыльного сгибания. У 75% детей остается эквинус или же стопы выводятся только до 900 тыльного сгибания (экстензии). В таких случаях рекомендуется применение ахиллотомии. Это миниоперация, предполагающая подкожное рассечение ахиллова сухожилия. Производится для того, чтобы удлинить это сухожилие, тем самым ослабив патологическое его воздействие на пяточную кость.
После ахиллотомии пятка окончательно занимает свое нормальное положение, опускается пяточный бугор (он теперь может быть пропальпирован) и появляется возможность тыльного сгибания стопы. Накладывается очередная гипсовая повязка, но уже на срок 3 недели. После чего можно переходить к следующему этапу.
3. Брейсы
Это специальное ортопедическое изделие для поддержания коррекции, достигнутой в ходе этапного гипсования. Это пара ботинок, соединенная планкой. На концах планка изогнута под углом 5-100. Ботинки фиксируются на планке в положении отведения:
При двусторонней косолапости фиксируются две стопы с отведением 600;
При коррекции одной стопы, на ней создается отведение в 600, а на здоровой стороне – 30-400.
Рекомендуется носить брейсы по следующей схеме: сразу после снятия гипсовой повязки в течение первых 3-х месяцев – 23-24 часа в сутки. Затем изделия используются во время дневного и ночного сна.
Научно доказано, что при четком выполнении рекомендаций доктора, правильном ношении брейсов, вероятность рецидива составляет менее 10%. А вот при несоблюдении протокола вероятность возрастает практически до 80%. Срок ношения брейсов составляет несколько лет, и продолжается до 4-х летнего возраста.
Как часто случаются рецидивы?
При соблюдении полного протокола рецидивы деформации врожденной косолапости достаточно редки. Также редки рецидивы в возрасте старше 5 лет, после отмены брейсов.
Возникновение рецидива деформации может говорить об ассоциации косолапости с патологией других систем.
При наличии остаточных компонентов косолапости или частичном рецидиве деформации, может потребоваться оперативное вмешательство. Заключение о необходимости хирургического лечения делается на основании жалоб, клинического и рентгенологического обследования пациентов.
Эквинусная деформация стоп у детей с церебральным параличом: вопросы диагностики, лечения
Полный текст:
Аннотация
В статье представлены данные об этиопатогенетических аспектах формирования эквинусной деформации стоп при детском церебральном параличе, а также рассмотрены вопросы диагностики и подходы к лечению данной патологии.
Ключевые слова
Для цитирования:
Шамик В.Б., Рябоконев С.Г. Эквинусная деформация стоп у детей с церебральным параличом: вопросы диагностики, лечения. Медицинский вестник Юга России. 2018;9(4):6-13. https://doi.org/10.21886/2219-8075-2018-9-4-6-13
For citation:
Shamik V.B., Ryabokonev S.G. Ekvinusny deformation of feet at children with a cerebral palsy: questions of diagnostics, treatment. Medical Herald of the South of Russia. 2018;9(4):6-13. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-4-6-13
Актуальность
Детский церебральный паралич (ДЦП) является одним из наиболее тяжёлых заболеваний нервной системы и опорно-двигательного аппарата, которое приводит к инвалидизации ребенка. ДЦП возникает вследствие повреждений головного мозга, которые проявляются во внутриутробном, интранатальном и постнатальном периодах развития ребенка. Характерной особенностью детских церебральных параличей является нарушение моторного развития ребенка, которое обусловлено аномальным распределением мышечного тонуса и нарушением координации движений и походки [1].
Несмотря на активный поиск новых методов диагностики и лечения, предпринятый в последнее время неонатологами, частота возникновения ДЦП остается довольно высокой и достигает 0,1-0,2 % у доношенных младенцев и 1 % у недоношенных [2]. В США более 100 тыс. детей и подростков моложе 18 лет страдают этим заболеванием [3].
Церебральный паралич является основной причиной детской неврологической инвалидности как в России, так и в мире. Врачи и ученые многих стран активно занимаются борьбой с этой патологией. За последние двадцать лет заболеваемость ДЦП не снижается, а имеет тенденцию к росту. Частота этого заболевания в России, в зависимости от региона, составляет 1,5-9 больных на 1000 новорожденных [4]. В соответствии со статистическими данными Минздрава и соцразвития РФ, в 2010 г. в РФ зарегистрированы 71 429 детей с ДЦП в возрасте 0-14 лет и 13 655 детей с таким диагнозом в возрасте 15-17 лет. Уровень заболеваемости ДЦП и темпы ее роста требуют более внимательного изучения этой проблемы с позиций современной медицины [5].
Патогенез
Существует мнение, что есть три отличительных черты, общие для всех больных с церебральным параличом: (1) некоторая степень двигательной недостаточности, которая отличает его от других состояний, таких как общая задержка развития или аутизм; (2) поражение, затрагивающее головной мозг, что делает его отличным от состояний, которые поражают зрелый мозг у детей старшего и младшего возрастов (3), а также неврологический дефицит непрогрессирующего характера, что отличает его от других моторных заболеваний детского возраста, таких как мышечные дистрофии [6].
Мышечный дисбаланс приводит к возникновению различных деформаций чаще всего в дистальных отделах верхних и нижних конечностей. Деформации стоп диагностируются в 60 % больных детским церебральным параличом, при этом не менее 40 % больных с деформациями стоп требуют хирургического вмешательства [8]. U. Cavlak, E. Kavlak при исследовании частоты встречаемости типов деформаций (n=436) установили, что эквиноварусная деформация встречается в 33,5 % (n = 146) [9]. Двигательные нарушения у детей с ДЦП носят первичный характер и связаны с мышечно-тоническими расстройствами. Формирование двигательных нарушений вторично происходит в процессе роста и развития ребёнка на фоне моторно-вегетативного рассогласования и характеризуется контрактурами, деформациями и патологическими установками [10].
Спастичность мышц является одним из основных синдромов, которые приводят к инвалидизации пациентов. На этом фоне у больных возникает ограничение объема активных и пассивных движений, что, в свою очередь, приводит к нарушению моторного развития ребенка и задерживанет формирование новых двигательных навыков. Развиваются патологический паттерн ходьбы, миогенные и фиксированные контрактуры [11].
L. Renee, M. Jurgen в своей работе отмечают, что эквинусное положение стопы в паттерне походки оценивается как дефект ходьбы и зачастую исключается важный аспект того, что именно такая деформация может оказаться эффективной в процессе передвижения с учетом всех мозговых дисфункций [12].
Эквинусная деформация стопы является самой частой среди деформаций нижних конечностей. Спастическое сокращение икроножных мышц в сочетании с относительной слабостью малоберцовых приводят к подошвенному сгибанию стопы и опоре на носок. При ходьбе пациент начинает нагружать передний отдел стопы, что приводит к фиксированному подошвенному сгибанию в голеностопном суставе [1]. Нижняя конечность является самым дистальным отделом в теле человека, а с точки зрения функциональности занимает центральное место в опорно-двигательном аппаратом [12][13]. Знание о происхождении спастического сокращения мышц голени дает общее представление о спастической модели походки, а также является важным при решении вопроса о тактике оперативного вмешательства. Соответственно, становится актуальным вопрос о расширенном использовании неинвазивных методов диагностики.
Диагностика
Лабораторные исследования могут быть использованы, чтобы исключить наследственные или нейродегенеративные расстройства. Обработка изображений исследования с использованием магнитно-резонансной томографии (предпочтительно), компьютерной томографии или УЗИ покажет структурные аномалии. Электромиография и исследования нервной проводимости могут быть использованы, чтобы исключить мышечные и нервные заболевания [14].
Достижения в области изучения мышц привели к увеличению количества исследований, связанных с неинвазивным измерением мышечной архитектуры, работы мышц во время функциональной деятельности у подготовленных и неподготовленных контингентов [15]. Важным моментом является определение взаимосвязи между структурой и функцией мышцы, которая оказывает специфическое действие на походку.
В диагностике степени ригидности деформации многими авторами широко используется непосредственно клиническая картина: симптом Штрумпеля, объем дорсифлексии при согнутом и разогнутом коленном суставе [16]. Анализируя опыт хирургического лечения эквинусной деформации стопы при ДЦП, В.Г. Босых с соавт. (2006 г.) настаивают на проведении трицепс-теста (теста Сильвершельда) в сочетании с листеноновой пробой с целью предотвращения ненужного хирургического вмешательства, а также для выбора метода оперативного лечения [17]. Annelies F. Van Bemmel с соавторами указывают на то, что если контрактура сохраняется при согнутом коленном суставе, то в процесс вовлечены и камбаловидная, и икроножная мышцы. Если тыльное сгибание ограничено при прямом колене, а в согнутом положении нет, то расценивают как патологию исключительно икроножной мышцы [18].
Стремительное развитие современных методов диагностики позволяет в полной мере визуализировать практически все мягкотканные образования конечностей [19].
При изучении литературы были найдены публикации, указывающие на прогностическую ценность спиральной компьютерной томографии, позволяющие выбрать оптимальный способ хирургической коррекции патологии стопы, но только у детей с эквино-плоско-вальгусной деформацией стоп [20].
Исследования Noble J.J. и др. показали, что МРТ- метод позволяет оценить объем мышц [21]. Авторы указывают, что объем мышц на патологической стороне существенно меньше по сравнению со здоровой, а также, что проксимальные мышечные группы больше в объеме относительно дистальных.
Методы визуализации при помощи ультразвука в основном ограничиваются оценкой поверхностных волокон в икроножной мышце [22]. Напротив, магнитнорезонансная томография обеспечивает более глубокую визуализацию, не подвергая субъект вредному излучению [23]. Объемы обеих групп мышц голени у детей с ДЦП были снижены примерно на 28 % по сравнению с непораженной конечностью.
Однако остается интересным и перспективным направлением изучение возможности использования ультразвуковой диагностики мышц голени при ДЦП. Ультрасонография мышц голени позволяет достоверно определить топику триггерной зоны и ее морфологическую характеристику с выявлением нескольких типов патологической перестройки [24].
Ультразвуковое исследование скелетных мышц имеет хорошую практическую значимость и прогностическую ценность (до 95 %) в диагностике нейромышечных заболеваний у детей. Чувствительность этого метода, по данным Brockmann K., в 81 % обладает специфичностью и в 96 % может быть использован для обнаружения любого аномального изменения мышечной ткани [25]. Для обнаружения нейрогенных изменений чувствительность составила 77 % с еще более высокой специфичностью (98 %). Наконец, данный метод визуализации мышц прост в выполнении, трактовке результатов, легко воспроизводим и экономичен [26].
Г.В. Дьячкова и соавторы при сканировании передней группы мышц голени отмечали характерную мышечную исчерченность, хорошо дифференцировались межмы- шечные перегородки, контрактильная функция сохранялась [19].
Alanen A.M., Falck B., Kalimo с соавт. обращают внимание на то, что совместное использование МРТ-метода, УЗИ, электромиографии увеличивает точность биопсии мышц, а также информативность изображений при гистологическом анализе [27].
При нейрогенных расстройствах мышечная ткань подвергается атрофии, некрозу, воспалению и фиброзу, потому сигнал от мышц более эхогенный. Среди преимуществ УЗИ мышц является то, что данный метод может быть использован для отслеживания изменений размера мышц в патологическом процессе [28].
Исследования Gao F., Zhao H., Gaebler-Spira D., Zhang L.Q. показали, что у детей с ДЦП более короткие пучки икроножной мышцы (Р 1. Бадалян Л.О. Детская неврология. – М.: Медицина; 1984.
2. Краснов А.С. Хирургическое лечение эквинусной деформации стопы у детей с детским церебральным параличом (обзор) // Саратовский научно-медицинский журнал. – 2011. – Т. 7. – № 3. – С. 699-703. Доступно по: http:// www.ssmj.ru/system/fles/201103_699-703.pdf Ссылка активна на 12.12.2017.
3. Tyson J.E., Gilstrap L.C. Hope for perinatal prevention of cerebral palsy. // JAMA. – 2003. – V.290(20). – P.2730-2. doi: 10.1001/jama.290.20.2730
4. Буравцов П.П., Неретин А.С. Оперативное лечение эквинусной деформации стоп у пациентов со спастической формой детского церебрального паралича // Гений ортопедии. – 2006. – № 3. – С. 52–53.
5. Батышева Т.Т. Детский церебральный паралич – актуальный обзор // Доктор.ру. – 2012. – № 5. – С. 40-44.
7. Gage J.R. Te treatment of gait problems in cerebral palsy. // J Pediatr Orthop. – 2001. – V.10(4). – P.267-274.
9. Cavlak U., Kavlak E. Analysing of Ankle-Foot Deformities in Cerebral Palsied Children: Retrospective Study. // Journal of Medical Sciences. – 2005. – V.5(1). – P.55–60. doi: 10.3923/jms.2005.55.60
10. Щеколова Н.Б., Белокрылов Н.М., Ненахова Я.В. Ортопедическая коррекция двигательных нарушений у детей с церебральными параличами // Пермский медицинский журнал. – 2008. – Т.25, № 2. – С. 45-49.
12. Renee L., Jurgen M. Research on the performance of the spastic calf muscle of young adults with cerebral palsy. // J Clin Med. – 2011. – V.3(1). – P.8-16. doi: 10.4021/jocmr483w
13. Bennet G.C., Rang M., Jones D. Varus and valgus deformities of the foot in cerebral palsy. // Dev Med Child Neurol. – 1982. – V.24. – P.499-503.
14. Craig J.J., Vuren J. Te importance of gastrocnemius recession in the correction of equinus deformity in cerebral palsy. // J Bone Joint Surg. – 1976. – V.58. – P.84-87. doi: 10.1302/0301-620x.58b1.1270500
15. Bland D.C., Prosser L.A., Bellini L.A., Alter K.E., Damiano D.L. Tibialis anterior architecture, strength, and gait in individuals with cerebral palsy. // Muscle Nerve. – 2011. – V.44(4). – P.509-17. doi: 10.1002/mus.22098.
17. Босых В.Г., Сологубов Е.Г. Хирургическое лечение детей с церебральными параличами и эквинусной деформацией стоп // Вопросы современной педиатрии. – 2006. – Т. 5. – № 1. – С. 74.
18. Van Bemmel AF, van den Bekerom MP, Verhart J, Vergroesen DA. Preliminary results of 97 percutaneous gastrocnemius muscular lengthening operations in neurologically healthy children with an equinus contracture. // Foot Ankle Surg. – 2012. – V.18(3). – P.160-3. doi: 10.1016/j.fas.2011.07.004.
19. Дьячкова Г.В., Меньшикова Т.И., Варки Д.Ш. Информативность различных методов визуализации при исследовании нижних конечностей у больных с ахондропалзией // Медицинская визуализация. – 2002. – № 2. – С. 133-137. Доступно по: http://vidar.ru/_getfle.asp?fd=MV_2002_2_133. Ссылка активна на 12.12.2017.
21. Noble J.J., Fry N.R., Lewis A.P., Keevil S.F., Gough M,. Shortland A.P. Lower limb muscle volumes in bilateral spastic cerebral palsy. // Brain Dev. – 2014. – V.36(4). – P.294300. doi: 10.1016/j.braindev.2013.05.008.
22. Bandholm T., Sonne Holm S., Tomsen C., Bencke J., Pedersen S.A., Jensen B.R. Calf muscle volume estimates: implications for botulinum toxin treatment? // Pediatr Neurol. – 2007. – V.37 (4). – P.263-269. doi: 10.1016/j.pediatrneurol.2007.05.019
23. Blemker S.S., Asakawa D.S., Gold G.E., Delp S.L. Image-based musculoskeletal modeling: applications, advances, and future opportunities. // J Magn Reson Imaging. – 2007. – V.25(2). – P.441-451. doi: 10.1002/jmri.20805
24. Дьякова В.Н. Оптимизация ортопедо-хирургического лечения эквинусной деформации стоп у детей с детским церебральным параличом: автореф. дис. … канд. мед. наук : 14.00.35 / РостГМУ. – Ростов н/Д, 2007. – 15 с.
25. Brockmann K., Becker P., Schreiber G., Neubert K., Brunner E., Bönnemann C. Sensitivity and specifcity of qualitative muscle ultrasound in assessment of suspected neuromuscular disease in childhood. // Neuromuscul Disord. – 2007. – V. 17(7). – P.517-523. doi: 10.1016/j.nmd.2007.03.015
26. Еськин Н.А, Куропаткин А.И., Горбатенко С.А. Ультразвуковые методы исследования в травматологии и ортопедии // Вестник травматологии и ортопедии им. Н.Н.Приорова. – 1996. – № 4. – С. 52-58.
27. Alanen A.M., Falck B., Kalimo H., Komu M.E., Sonninen V.H. Ultrasound, computed tomography and magnetic resonance imaging in myopathies: correlations with electromyography and histopathology. // Acta Neurol Scand. – 1994. – V.89(1). – P.336-346. doi: 10.1111/j.1600-0404.1994.tb02644.x
28. Hunt K.J., Ryu J.H. Neuromuscular Problems in Foot and Ankle. // Foot and Ankle Clinics. – 2014. – V.19(1). – P.1-16. doi: 10.1016/j.fcl.2013.10.002
29. Gao F., Zhao H., Gaebler Spira D., Zhang L.Q. In vivo evaluations of morphologic changes of gastrocnemius muscle fascicles and achillestendon in children with cerebral palsy. // Am J Phys Med Rehabil. – 2011. – V.90(5). – P.364-371. doi: 10.1097/PHM.0b013e318214f699.
30. Pillen S., Verrips A., van Alfen N., Arts I.M.P., Sie L.T.L., Zwarts M.J. Quantitative skeletal muscle ultrasound: Diagnostic value in childhood neuromuscular disease. // Neuromuscular Disorders. – 2007. – V.17(7). – P.509-516. doi: 10.1016/j.nmd.2007.03.008
31. Lieber R.L., Runesson E., Einarsson F. Inferior mechanical properties of spastic muscle bund lesdueto hypertrophic but compromised extracellular matrix material. // Muscle Nerve. – 2003. – V.28. – P.464-471. doi: 10.1002/mus.10446
33. Armand S., Decoulon G., Bonnefoy-Mazure A. Gait analysis in children with cerebral palsy. // EFORT Open Rev. – 2016. – V.1(12). – P.448-460. doi: 10.1302/2058-5241.1.000052.
34. Kedem P., Scher D.M. Foot deformities in children with cerebral palsy. // Curr Opin Pediatr. – 2015. – V.27(1). – P.67-74. doi: 10.1097/mop.0000000000000180
35. Устьянцев В.И., Коломиец Л.А. Способ пластики ахиллова сухожилия у больных дет.ским церебральным параличом // Ортопедия, травматология и протезирование. – 1991. – № 10. – С. 51-53.
36. Тупиков В.А., Шамик В.Б., Тупиков М.В. Применение комплекса биоуправления для прогнозирования исходов хирургического лечения детского церебрального паралича // Известия ЮФУ. Технические науки. – 2012. – № 9(134). – С. 160-164. Доступно по: http://izv-tn.tti.sfedu.ru/wp-content/uploads/2012/9/31.pdf. Ссылка активна на 12.12.2017.
38. Borton D.C., Walker K., Pirpiris M. Isolated calf lengthening in cerebral palsy. Outcome analysis of risk factors. // Bone Joint Surg Br. – 2001. – V.83. – P.364-370. doi: 10.1302/0301-620x.83b3.0830364
39. Sala D.A., Grant A.D., Kummer F.J. Equinus deformity in cerebral palsy: recurrence afer tendo Achillis lengthening. // Dev Med Child Neurol. – 1997. – V.39. – P.45-48. doi: 10.1111/j.1469-8749.1997.tb08203.x
40. Сычевский Л.З., Аносов В.С., Мармыш А.Г. Результаты хирургического лечения эквиноварусных деформаций стоп у больных детским церебральным параличом // Журнал ГрГМУ. – 2009. – № 2. – С. 213-217.
41. Rezzouk J., Laville J.M. Devenir de la correction par appareil d’Ilizarov des déformations sévères du piedLong-term outcome afer Ilizarov corrective fxation for severe foot deformity. // Rev Chir Orthop Reparatrice Appar Mot. – 2001. – V.87(1). – P.61-66. doi: rco-02-2001-87-1-0035-1040-101019-art6 (in France)
42. Wren T.A., Cheatwood A.P., Rethlefsen S.A., Hara R., Perez F.J., Kay R.M. Achilles tendon length and medial gastrocnemius architecture in children with cerebral palsy and equinus gait. // J Pediatr Orthop. – 2010. – V.30(5). – P.479-84. doi: 10.1097/BPO.0b013e3181e00c80.
43. Lipczyk Z., Faflik J., Kraska T. Surgical treatment of spastic equino-varus deformity. // Ortop Traumatol Rehabil. – 2002. – V.4(1). – P.27-29.
44. Семенова К.А. Восстановительное лечение у детей с перинатальными поражениями нервной системы и ДЦП. – М.: Закон и порядок, 2007.
45. Damron T.A., Greenwald T.A., Breed A.L. Chronologic outcomes of surgical tendo Achilles lenghthening and natural history of gastrosoleus contracture in cerebral palsy: a two part study. // ClinOrthop. – 1994. – V.301. – P.249-255. doi: 10.1097/00003086-199404000-00039
46. Сычевский Л.З., Болтрукевич С.И. Биомеханическое обоснование метода хирургического лечения спастических эквинусных деформаций. Биомеханика стопы человека // Материалы I Междунар.науч.-практ. конф. – Гродно, 2008. – С. 150-152.
47. Сычевский Л.З., Аносов В.С., Михович М.С. Результаты оперативного лечения спастических фиксированных эквинусных деформаций методом вентрализации ахиллова сухожилия // Военная медицина. – 2009. – № 3. – С. 44–50.
48. Умнов В.В., Кенис В.М. Поражение нижних конечностей при ДЦП // Травматология и ортопедия: рук-во для врачей: в 4 т. Т. 3: Травмы и заболевания нижних конечностей / под ред. Н.В. Корнилова и Э.Г. Грязнухина. – СПб.: Гиппократ, 2006. – С. 1003–1024.
49. Grzegorzewski A., Borowski A., Pruszczyński B., Wranicz A., Domzalski M., Synder M. Split tibialis posterior tendon transfer on peroneus brevis for equinovarus foot in CP children. // Chir Narzadow Ruchu Ortop Pol. – 2007. – V.72(2). – P.117-120.
50. Чернов А.П., Лосев И.И. Комплексное лечение больных с паралитическими деформациями стоп. – Самара, 2003.
51. Zuhrmann A., Weselov G. Fünfahrergebnissebei der Klumpfut behandlung. // Ortop. Prax. – 1982. – V.18(1). – P.44-46.
53. Чочиев Г.М., Алборов О.И., Филатова Н.Б., Елкина И.А. Хирургическое лечение в комплексе медико-социальной реабилитации больных ДЦП // Актуальные вопросы детской травматологии и ортопедии. – СПб., 2002. – С. 276.
Об авторах
Ростовский государственный медицинский университет, Ростов-на-Дону
Россия
кафедра детской хирургии и ортопедии, профессор
Конфликт интересов: Шамик Виктор Борисович, д.м.н., проф., профессор
кафедры детской хирургии и ортопедии ФГБОУ ВО РостГМУ Минздрава России
Ростовский государственный медицинский университет, Ростов-на-Дону
Россия
врач травматологортопед ГБУ РО «ОДКБ»
Для цитирования:
Шамик В.Б., Рябоконев С.Г. Эквинусная деформация стоп у детей с церебральным параличом: вопросы диагностики, лечения. Медицинский вестник Юга России. 2018;9(4):6-13. https://doi.org/10.21886/2219-8075-2018-9-4-6-13
For citation:
Shamik V.B., Ryabokonev S.G. Ekvinusny deformation of feet at children with a cerebral palsy: questions of diagnostics, treatment. Medical Herald of the South of Russia. 2018;9(4):6-13. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-4-6-13