Армянская болезнь что это такое простыми словами
Современные представления о периодической болезни и клинические рекомендации по диагностике и лечению
В статье представлены современные сведения о патогенезе, клинических проявлениях, диагностике и лечении периодической болезни. Обсуждаются клинические и лабораторные методы оценки активности заболевания и подходы к лечению больных, резистентных к колхицину, на основе подавления эффектов интерлейкина-1.
Периодическая болезнь (ПБ), более известная в англоязычной литературе под названием Средиземноморская лихорадка, является древнейшим заболеванием. Первые наблюдения ПБ были описаны еще на закате средневековья. Так, H. Reimann указывает, что в 1629 г. Aubrey сообщил о своем страдании, которое проявлялось ознобом, тошнотой, рвотой, болями в животе, длящимися до полусуток и возникающими сначала каждые 2 недели, позже ежемесячно, один раз в 3 месяца, один раз в полгода [1].
Как самостоятельная нозологическая единица ПБ была выделена только в середине ХХ столетия. В 1948 г. H. Reimann на основании 6 наблюдений объединил общим термином “периодическая болезнь” ряд синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию [2]. Основными критериями считали периодичность и доброкачественность течения. По этой причине понятие “периодическая болезнь” стало очень широким. Благодаря работам E. S):1–112. ohar и соавт. (1967) [3], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [5] клиническая картина ПБ была очерчена более отчетливо. После открытия гена MEFV, мутации которого приводят к развитию клинических проявлений ПБ, были сформулированы окончательные критерии ПБ.
Тем не менее, сохраняет актуальность выделение особого обобщающего термина для всех периодических синдромов, клинические проявления и принципы диагностики которых сходны. Учитывая их наследственный характер, широко применяется термин семейные периодические лихорадки, которые, помимо ПБ, включают в себя криопиринопатии (семейная холодовая крапивница, синдром Макла-Уэллса, NOMID-CINCA синдром), гипериммуноглобулинемию D (дефицит мевалонаткиназы), TRAPS):1–112. (синдром, обусловленный мутацией гена рецептора к фактору некроза опухоли [ФНО]-α) и некоторые другие. Все эти заболевания характеризуются беспричинно повторяющимися приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [4]. В основе патогенеза ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а механизмы специфического иммунитета – гуморального, связанного с синтезом аутоантител, и Т-клеточного, не имеют значения [5].
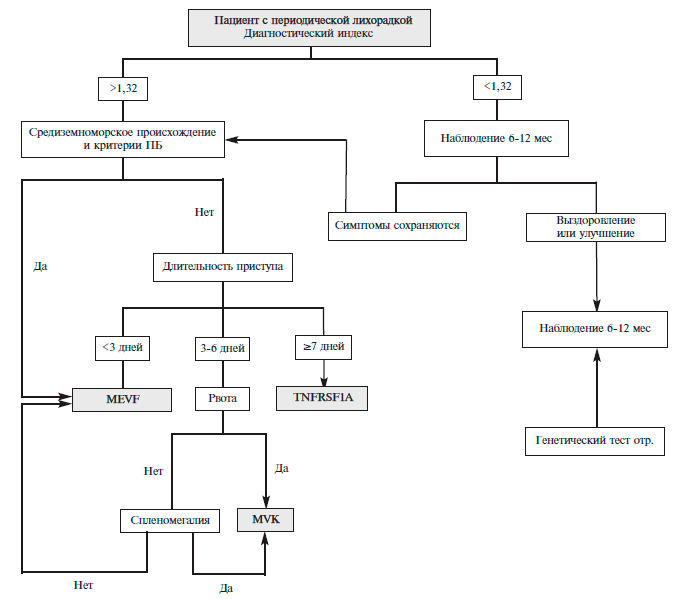
Клиническое предположение о наличии этих синдромов может возникать преимущественно у молодых пациентов с приступами болей в животе, грудной клетке в сочетании с афтозным стоматитом, диареей при наличии подобных признаков у родственников (табл. 1) [8]. Для оценки риска семейных периодических лихорадок предложен специальный индекс [9], автоматизированный расчет которого, предлагается на сайте Eurofever Project (https://www.printo.it/eurofever/index. asp). Паци ен там с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Средиземно морья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты следует думать о дефиците мавалонаткиназы с развитием гипериммуноглобулинемии D, приступы длительностью более недели являются основанием для исключения TRAPS):1–112. (рис. 1). У пациентов с низким риском предлагается наблюдение за течением болезни с последующим повторным обсуждением показаний к генетическому исследованию на семейные периодические лихорадки.
Эпидемиология периодической болезни
Одним из признаков наследственной природы ПБ является этноассоциированный характер болезни – ее широкое распространение у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков, была показана разными авторами на больших группах больных. По данным О.М. Ви но градовой лица других национальностей среди больных ПБ встречались лишь в 2% случаев [4]. Среди 86 носителей гена ПБ, наблюдавшихся J. S):1–112. amuels и соавт. [10], необычно высоким было число итальянцев и евреев-ашкенази. Однако и в этой группе 96% пациентов оказались представителями средиземноморской популяции. В группе из 150 больных ПБ, обследованных О.М. Виноградовой [4], 88,6% составили армяне. В последние годы эту болезнь на территории России широко диагностируют у азербайджанцев, представителей разных народов Северного Кавказа, имеются также отдельные наблюдения ПБ среди русских и украинцев, преимущественно жителей южных регионов России. Болезнь наследуется по аутосомно-рецессивному пути. Это означает, что у родителей симптомы заболевания обычно отсутствуют, однако в больших семьях болезнь может проявиться у родных или двоюродных братьев/ сестер, дяди или дальнего родственника.
Ген, ответственный за ПБ, был клонирован в 1997 году и обозначен аббревиатурой MEFV (MEditerranean FEver) [11,12], в том же году были идентифицированы 8 основных мутаций гена. Ген MEFV располагается на коротком плече 16 хромосомы центромерно к гену гемоглобина- α, рядом с генами, ответственными за аутосомно-доминантный поликистоз почек и туберозный склероз 13. Показано, что среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [15]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Частота носительства среди американских армян составляет 1:7 [16].
Причина сохранения в современной средиземноморской популяции высокой частоты носительства MEFV остается неясной, однако сочетание ее с многочисленностью аллелей MEFV может свидетельствовать в пользу благоприятных условий для естественного отбора гетерозигот-носителей этих аллелей, по аналогии с распространенностью гена серповидноклеточной анемии в эндемичных очагах малярии.
Клиническая картина и диагноз
Продуктом MEFV является белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [11,12]. Одним из отличительных свойств пирина является наличие В30.2-домена. Кроме того, в молекуле пирина обнаружены 2 локуса потенциального связывания с ядром, а α-спиральный и В-box-домены могут обеспечивать взаимодействие с другими белками. Все выявленные в настоящее время мутации, ассоциирующиеся с ПБ, касаются изменений в В30.2-зоне пирина.
Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [11]. Не обнаруживают экспрессию гена и в других тканях. Согласно основной в настоящее время рабочей гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Соответ ственно, структурные изменения в молекуле пирина могут изменить функцию контроля и способствовать постоянному провоспалительному потенциалу нейтрофилов.
Немутантный пирин ингибирует адапторный белок AS):1–112. C, который кроме участия в апоптозе формирует ядро инфламмасомного комплекса путем гомотипического взаимодействия с белком NLRP и каспазой, что ведет к активации интерлейкина (ИЛ)-1 β. Инфламма сома – макромолекулярная платформа в цитоплазме, устойчивая к внутриклеточным механизмам деградации белков и, в силу этого, способная обеспечить реализацию провоспалительной активности клетки. Суще ствует несколько разновидностей инфламмасом. При ПБ и других семейных периодических лихорадках основное значение придают инфламмасоме на основе белка NLRP3 – криопирина. В качестве основной причины развития ПБ рассматривают утрату ингибиторного эффекта мутантного пирина на AS):1–112. C и, как следствие, активацию каспазы-1 [17], либо формирование пирином собственной инфламмасомы [18]. Однако роль мутаций домена B30.2 в развитии ПБ остается спорной; возможно, пирин может проявлять как про-,так и противовоспалительные свойства в зависимости от конкретных условий. Значение мутантного пирина в усилении секреции ИЛ-1 β при ПБ подтверждается купированием приступа ПБ при парентеральном введении ингибиторов ИЛ-1 [19].
Таким образом, в настоящее время несомненным диагностическим критерием ПБ является выявление гомозиготного носительства мутаций пирина. Однако у 20% больных клинические признаки ПБ развиваются при наличии только одной мутации. У таких пациентов сохраняют диагностическое значение клинические критерии болезни, в частности эффективность колхицина. Окончательный диагноз в этом случае может быть установлен только через 6-12 месяцев наблюдения за эффектом колхицина.
Важное значение имеет осмотр пациента во время периодических приступов заболевания, которые проявляются лихорадкой в сочетании с абдоминалгиями, торакалгиями, артралгиями и другими, более редкими, проявлениями. Указанные проявления могут возникать в различных сочетаниях или с разной периодичностью, обычно выделяют абдоминальный, торакальный, лихорадочный, реже суставной варианты ПБ.
Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется хроническим течением с обострениями и ремиссиями, возникающими от разнообразных причин и через различные сроки. Между приступами болезненные проявления отсутствуют, а во время приступа болезни многие пациенты сохраняют работоспособность. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно разрешаются. Продолжительность межприступного периода у одного и того же пациента составляет от нескольких дней до нескольких месяцев, иногда приступы следуют один за другим с промежутками в 1-3 дня, но возможны и длительные ремиссии до нескольких лет. Характерный признак болезни, имеющий диагностическое значение, – стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза.
Лихорадка, которая у нелеченных больных, как правило, достигает высоких значений и сопровождается потрясающими ознобами, является практически постоянным симптомом приступа. Выделение особой лихорадочной формы болезни обосновывается тем, что другие симптомы, включая абдоминалгии, встречаются реже. Однако В.М. Арутюнян и соавт. полагают, что острый асептический серозит, хотя бы и кратковременный, является облигатным проявлением болезни, в связи с чем нецелесообразно расширять классификацию болезни за счет лихорадочной и суставной форм, а достаточно ограничиться тремя формами – абдоминальной, торакальной и смешанной [20].
Абдоминальный вариант наблюдается у 91% больных [11,12]. В основе абдоминального варианта ПБ лежит рецидивирующее доброкачественное воспаление серозной оболочки брюшной полости с преобладанием экссудативной реакции над пролиферативной, что подтверждается малым количеством спаек, несмотря на частоту приступов. В воспалительный процесс вовлекаются брыжейка, серозная оболочка кишки, печени, селезенки, диафрагмы. Абдоминалгии обычно сопровождаются симптомами раздражения брюшины и вялой перистальтикой, что наряду с лихорадкой и лейкоцитозом периферической крови создает существенные дифференциально-диагностические сложности и ведет к необоснованной лапаротомии.
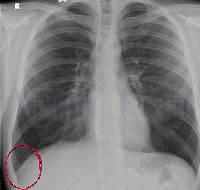
Торакальный вариант, в основе которого лежит асептический плеврит, наблюдается у 57% пациентов [11, 12]. При рентгеноскопии грудной клетки во время приступа отмечают ограничение подвижности купола диафрагмы, небольшой выпот в синусе над диафрагмой, реже дисковидные ателектазы, все эти явления затем полностью исчезают, но у трети больных возникают спайки.
Артрит и артралгии развиваются у 45% больных [11,12], очень редко как единственное проявление болезни. Суставные проявления имеют характер летучих артралгий, моноартрита, реже полиартрита, чаще вовлекаются коленные и голеностопные суставы. По окончании приступа эти явления полностью исчезают, не оставляя пролиферативных изменений. Ревматоид ный фактор, антистрептококковые антитела не определяются.
Редко (13%) встречается рожеподобная эритема в виде болезненных плотноватых пятен диаметром 10-15 см обычно в области голеностопных суставов [11,12].
Самым тяжелым осложнением является АА-амилоидоз, строящийся из циркулирующего белка-предшественника S):1–112. AA, близкого С-реактивному белку. Частота амилоидоза значительно отличается по данным разных авторов. О.М. Виноградова на примере популяции бывшего СССР указывает частоту амилоидоза 41,3%. Аме риканские авторы, обследовавшие популяцию армян, проживающих в США, сообщают о низкой частоте амилоидоза – 2% [8,21]. В любом случае, прогноз болезни определяется наличием и тяжестью амилоидоза. Клинические проявления амилоидоза характерны для АА-типа, при котором основным органом-мишенью являются почки. В течении амилоидной нефропатии обычно удается выделить три стадии – протеинурическую, нефротическую и стадию почечной недостаточности. Особенностью амилоидоза является сохранение высокой протеинурии на стадии хронической почечной недостаточности [22]. Нелеченный ААамилоидоз в рамках ПБ обычно прогрессирует быстрее, чем при других воспалительных заболеваниях: 5- и 10летняя выживаемость составляет соответственно 48% и 24%, соответственно, а при вторичном АА-амилоидозе другой этиологии – 77% и 44% [23].
Широко распространено мнение о наследственном характере амилоидоза при ПБ. Так, у больных ПБ с отягощенным по амилоидозу семейным анамнезом риск амилоидоза увеличивается в 6 раз [24]. Описан так называемый фенотип II ПБ (некоторые исследователи ставят под сомнение наличие фенотипа II, учитывая его исключительную редкость [25]), при котором клинически выраженных приступов не бывает, однако развивается АА-амилоидоз. При этом у родственников нередко регистрируется клиника несомненной ПБ.
Благодаря обнаружению в последние годы гена ПБ и его продукта – белка пирина показаны различные механизмы наследования ПБ и АА-амилоидоза. Пирин непосредственно не участвует в метаболизме S):1–112. AA, а гены обоих белков располагаются в разных хромосомах (гены S):1–112. AA обнаружены в 11 хромосоме). Таким образом, ПБ в настоящее время, подобно другим хроническим воспалительным процессам, рассматривают в качестве пускового фактора вторичного АА-амилоидоза.
У больных ПБ описаны единичные наблюдения асептического менингита, перикардита, миалгий, узелкового полиартериита, гломерулонефрита, пурпуры Шенлейн-Геноха, клиническое значение которых не вполне ясно [4]. Спленомегалия, как правило, сопутствует амилоидозу [4].
Оценка активности аутовоспалительных заболеваний
Первая попытка создания критериев активности аутовоспалительных заболеваний была предпринята группой ученых из Клиники Шиба (Израиль) в отношении ПБ [26]. В разработанной ими шкале учитываются возраст на момент начала заболевания, частота приступов, наличие артритов, рожеподобной эритемы и доза колхицина, необходимая для достижения ремиссии болезни. В 2005 г. ученые из той же клиники провели дополнительное исследование, в котором показали недостаточность этой шкалы для корректной оценки активности болезни [27]. С использованием статистических методов были разработаны новые критерии тяжести ПБ (модифицированные критерии Тель Хашомер), которые отличаются для больных, принимающих и не принимающих колхицин [27].
Эксперты рабочих групп EUROFEVER и EUROTRAPS):1–112. попытались разработать единые критерии активности семейных периодических лихорадок с использованием дельфийского метода и метода номинальных групп [28]. Для каждого заболевания были выделены симптомы, которые, по мнению экспертов и опрошенных больных, свидетельствуют о его высокой активности. В опроснике для больных содержатся ежедневные сведения о наличии и выраженности симптомов в баллах. По завершении месяца сумма баллов делится на количество дней в месяце (30 или 31): максимальной активности соответствует 13 баллов для криопиринопатий и 16 баллов для ПБ, HIDS):1–112. и TRAPS):1–112.
Традиционными методами подтверждения воспалительной природы заболевания и оценки его активности являются подсчет лейкоцитов крови и измерение показателей острофазового воспаления – СОЭ, уровня С-реактивного белка (СРБ), фибриногена и других.
Нередко при аутовоспалительных заболеваниях развивается анемия, как правило, нормохромная нормоцитарная, которая является следствием хронического воспаления (анемия хронических заболеваний). Веду щую роль в ее патогенезе играют провоспалительные цитокины – ФНО-α, ИЛ-1β, ИЛ-6 и интерферон-g [30,31]. Так, ФНО-α снижает эритропоэз за счет непосредственного блокирующего действия на рост эритроидных клеток-предшественниц и активации их апоптоза в костном мозге [32–34]. ИЛ-6 также подавляет костномозговую пролиферацию эритроидных клеток-предшественниц, снижает синтез эритропоэтина, через стимуляцию печеночной продукции гепсидина блокирует макрофагальное депо железа и его абсорбцию энтероцитами [35].
В последнее время исследователи стали уделять внимание новому показателю активности воспаления – отношению нейтрофилы/лимфоциты – ОНЛ (в норме оно равно 0,78-3,53 с медианой 1,65) [36]. Это надежный маркер, который может быть легко определен по результату клинического анализа крови. В настоящее время показана способность этого показателя отражать активность воспаления при ПБ. А. Ahsen и соавт. определяли ОНЛ и концентрацию СРБ у 62 больных ПБ в стадии ремиссии и 41 здорового человека [37]. Как ОНЛ, так и концентрация СРБ у больных с ремиссией ПБ были выше, чем у здоровых людей. Отмечена умеренная корреляция между этими параметрами (r=0,449, p
Лечение периодической болезни
Несмотря на наследственный характер ПБ в настоящее время существуют эффективные методы ее лечения. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина может быть связан с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Известный цитостатический эффект колхицина в применяемых дозах, по-видимому, незначителен. Ежедневный прием 1-2 мг колхицина позволяет прово дить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже развившемся амилоидозе составляет 2 мг/сут. По данным клиники им. Е.М. Тареева колхицин эффективен даже у большинства больных с нефротическим синдромом, однако эффект наступает не сразу, спустя 2-4 года постоянного приема колхицина. Эффективность препарата при амилоидозе почек резко снижается на стадии почечной недостаточности, свидетельствующей о тяжести склеротических изменений.
Указанные дозы обычно хорошо переносятся, в том числе при многолетнем приеме. Нередко развивающаяся в начале лечения диарея носит преходящий характер и, как правило, не требует полной отмены препарата.
Приблизительно у 15-20% больных колхицин оказывается изначально неэффективным. Представление о ПБ как о внешней инфламмасомопатии позволило рекомендовать назначение ингибиторов ИЛ-1 пациентам, резистентным к лечению колхицином. В Рос сийской Федерации зарегистрирован канакинумаб (Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Канакинумаб обладает длительным периодом полувыведения (21-28 дней), что позволяет вводить его подкожно каждые 8 недель. Рекомендуемая стартовая доза у взрослых составляет 150 мг один раз в 4 недели, при необходимости ее можно увеличить до 300 мг.
Эффективность и безопасность канакинумаба изучались у больных с различными аутовоспалитель ными заболеваниями. В двойном слепом, плацебоконтролируемом, рандомизированном исследовании, состоявшем из 3 час тей, 35 пациентов с криопиринассоциированным периодическим синдромом (КАПС; синдром Макла-Уэллса у 33 и синдром NOMID/CINCA у 2) получали канакинумаб в течение 48 недель [52]. Во время части 1 всем пациентам вводили канакинумаб в дозе 150 мг подкожно. Если в течение 15 дней после введения препарата наблюдался полный ответ (отсутствие активности или минимальная активность по оценке исследователя и концентрации СРБ и S):1–112. AA ТАБЛИЦА 1. Эффективность канакинумаба в исследовании CLUSTER
Заключени
Представленная нами проблема ПБ демонстрирует достижения молекулярно-биологических исследований в современной практической медицине, показывает возможности диагностики и лечения на основе знаний о молекулярных механизмах ПБ. Последнее особенно важно с практических позиций, поскольку возможность выделения аутовоспалительных реакций с центральной ролью нейтрофила среди патофизиологических механизмов позволяет определить критерии индивидуального подхода к лечению с выбором патогенетически обоснованного средства подавления активности ПБ. Главным препятствием в диагностике и лечении больных ПБ остается низкая информированность врачей об этом заболевании, хотя в этнических группах высокого риска заболевание встречается с частотой 1-3 на 1000.
Периодическая болезнь
Периодическая болезнь – генетическая патология, характеризующая нарушением регуляции воспалительных процессов, особенно в области серозных (брюшины, плевры) и синовиальных оболочек. Проявления этого заболевания различны, чаще всего регистрируются боли в животе (картина острого перитонита), нарушения со стороны плевральной полости, приступы лихорадки, болезненность и отечность суставов. Диагностика производится на основании клинической картины, изучения наследственного анамнеза и молекулярно-генетических анализов, вспомогательную роль играет определение национальности больного. Лечение периодической болезни только симптоматическое и поддерживающее, специфической терапии на сегодняшний момент не существует.
Общие сведения
Периодическая болезнь (средиземноморская семейная лихорадка) – наследственное заболевание, причиной которого являются нарушения в регуляции воспалительного и иммунного ответа на уровне гранулоцитов. Впервые данная патология была описана в 1948-м году американским врачом Райманном, который из-за повторяющихся тяжелых приступов дал ей название «периодическая болезнь». С первых лет изучения была выявлена главная особенность этой патологии – она возникает только у уроженцев средиземноморского региона и Малой Азии, главным образом у армян, арабов, греков, испанцев, итальянцев, евреев-сефардов и турок. У представителей иных национальностей отмечены лишь спорадические и статистические незначимые случаи периодической болезни. Поэтому фактор национальности больного и его предков играет немаловажную роль в диагностике данного состояния.
Встречаемость периодической болезни у различных этносов средиземноморского региона отличается, она наиболее высока у турок, арабов и армян, несколько ниже у евреев-сефардов, еще реже это заболевание встречается у греков, итальянцев и испанцев. По некоторым данным, носительство патологического гена в определенных регионах затрагивает 20% населения, а заболеваемость составляет 1:1000-2500. Периодическая болезнь наследуется по аутосомно-рецессивному механизму и с одинаковой частотой поражает как мальчиков, так и девочек.
Причины
Долгое время этиология и патогенез периодической болезни оставались неизвестными, лишь достижения современной генетики позволили больше узнать об этом заболевании. Наиболее часто причиной данной патологии являются мутации гена MEFV, расположенного на 16-й хромосоме. Ген кодирует белок под названием маренострин (другое название – пирин), который выполняет функции одного из центральных регуляторов воспалительной реакции и первичного иммунного ответа. Маренострин тормозит дегрануляцию нейтрофилов и угнетает их адгезивные свойства, тем самым ослабляя и ингибируя чрезмерную реакцию иммунной системы. При периодической болезни миссенс-мутации гена MEFV приводят к изменению структуры маренострина, тем самым нарушая его функции. Это снижает порог дегрануляции нейтрофилов, что облегчает развитие острых воспалительных реакций и формирует клиническую картину периодической болезни.
Кроме того, дефекты маренострина приводят к каскадным патологическим реакциям в иммунной системе и организме в целом. Значительно уменьшается активность ингибитора одного из компонентов системы комплемента – С5а. Последний постепенно накапливается в серозных оболочках, а при достижении высоких концентраций провоцирует бурную воспалительную реакцию. Это обстоятельство объясняет определенные свойства периодической болезни – преимущественное поражение серозных оболочек, а также сезонность заболевания (для накопления достаточных концентраций С5а необходимо несколько месяцев). В некоторых случаях для периодической болезни характерно также раннее развитие амилоидоза, однако его патогенез остается неясным.
Все вышеперечисленные процессы возникают при наличии у человека двух аллелей дефектного гена MEFV, то есть у гомозигот, так как периодическая болезнь является аутосомно-рецессивным заболеванием. Существует теория, согласно которой гетерозиготы из-за снижения ингибирования адгезивных свойств гранулоцитов обладают повышенной резистентностью к бактериальным инфекциям. Отчасти это может объяснить столь высокую встречаемость патологической формы гена и его носительства среди этносов средиземноморского региона. Кроме того, существуют указания, что некоторые формы периодической болезни обусловлены дефектом генов на 19-й хромосоме, однако точно идентифицировать их пока не удалось.
Симптомы периодической болезни
Клиническая картина периодической болезни отличается большим разнообразием, однако причины этого пока достоверно неизвестны – предполагается взаимосвязь между отдельными типами мутаций и формами заболевания. Удалось выяснить, что, например, амилоидоз, в среднем поражающий 30-35% больных, намного чаще возникает у арабов и турок, нежели у армян. Постоянным симптомом периодической болезни (наблюдается в 99% случаев) является выраженная лихорадка, которая не купируется традиционными жаропонижающими средствами и антибиотиками. В зависимости от клинической формы заболевания повышение температуры тела может сочетаться с другими проявлениями. На сегодняшний день выделяют четыре основные клинические формы периодической болезни: абдоминальную, торакальную, суставную и псевдомалярийную.
Абдоминальная форма периодической болезни характеризуется типичной картиной «острого живота» при перитоните, включает в себя резкое повышение температуры тела до 40-41 градуса, опоясывающие боли, ригидность мышц брюшной стенки, тошноту и рвоту. Такие проявления сохраняются на протяжении нескольких суток, после чего постепенно стихают. За это время более чем у половины больных периодической болезнью ошибочно диагностируется гнойный перитонит (на самом деле при данной патологии развивается асептическое воспаление брюшины), аппендицит, прободная язва желудка, производятся ненужные хирургические операции. Торакальная форма периодической болезни создает картину выпотного плеврита, который может иметь одно- или двухсторонний характер. Это приводит к болям в грудной клетке, затрудненному дыханию, одышке и другим типичным проявлениям гнойного или экссудативного плеврита, что также нередко становится причиной постановки ошибочного диагноза. Проявления торакальной формы периодической болезни постепенно стихают на протяжении 7-10 дней.
Суставная форма периодической болезни характеризуется развитием отеков и болезненности нескольких (реже – одного) суставов, резким покраснением кожи на пораженной области. Симптомы сохраняются на протяжении 2-4 недель, артралгия может наблюдаться в течение нескольких месяцев. При этом каких-либо постоянных нарушений в суставах (ограничение подвижности, контрактуры) при периодической болезни не возникает. Псевдомалярийная форма заболевания характеризуется приступами сильной лихорадки длительностью 3-7 дней, после чего температура тела больного приходит в норму. Никаких проявлений со стороны других органов на начальных этапах развития патологии при этом не определяется.
По данным медицинской статистики, изолированные клинические формы (абдоминальная, торакальная и другие) имеют место примерно в 20% случаев периодической болезни. Намного чаще встречается сочетание нескольких клинических типов патологии (торакальной и суставной, лихорадки на фоне абдоминальных симптомов). При отсутствии лечения периодической болезни примерно у трети больных развивается амилоидоз почек, который приводит к хронической почечной недостаточности и уремии. В 20% случаев на фоне вышеперечисленных проявлений могут отмечаться дерматологические симптомы: папулезная сыпь, крапивница, рожеподобное воспаление. Редко при периодической болезни развиваются асептические менингиты и перикардиты, а также воспаление яичек (орхит).
Диагностика
В ряде случаев диагностика периодической болезни может быть сопряжена со значительными сложностями по причине выраженности, и, в то же время, неспецифичности ее проявлений. Эта особенность заболевания может стать причиной диагностических ошибок с далеко идущими последствиями – так, при картине «острого живота» больным часто производят ненужные операции, при асептических плевритах и менингитах назначают высокие дозы антибиотиков. В случае артралгии и постановки неправильного диагноза (например, ревматоидный артрит) больному периодической болезнью могут назначать сильнодействующие иммуносупрессивные средства. Поэтому при наличии таких симптомов у пациентов, являющихся уроженцами средиземноморского региона, обязательно следует учитывать возможность наличия этого генетического заболевания.
В процессе диагностики периодической болезни используют данные изучения наследственного анамнеза больных и молекулярно-генетических анализов. Как правило, наследственный анамнез у таких пациентов отягощен (крайне редко встречаются спорадические формы), подобные проявления выявляются у предков или родственников. Окончательно подтвердить или опровергнуть наличие периодической болезни может врач-генетик посредством генетического исследования. Существует распространенная методика поиска наиболее часто встречающихся при этом заболевании мутаций гена MEFV – M694V и V726A, которые обуславливают более 75% всех случаев данной патологии. Однако более редкие дефекты MEFV могут остаться незамеченными – для их определения применяют секвенирование всей последовательности гена.
Лечение периодической болезни
Прогноз и профилактика
Прогноз периодической болезни в значительной степени зависит от наличия или отсутствия амилоидоза. Если его нет, несмотря на тяжелые приступы заболевания, прогноз благоприятный, поскольку в межприступный период больные чувствуют себя удовлетворительно, продолжительность жизни практически не сокращается. В случае развития амилоидоза на фоне периодической болезни выживаемость пациентов резко снижается из-за поражения почек. Риск возникновения амилоидоза уменьшается при ранней диагностике средиземноморской семейной лихорадки и своевременно начатом лечении колхицином. Профилактика периодической болезни возможна только в рамках пренатальной диагностики, которая рекомендуется в тех случаях, когда у обоих родителей имеется подозрение на носительство дефектной формы гена MEFV.