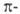Ароматическая связь более устойчивая чем сигма связь
Типы связей в молекулах органических веществ
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Таким образом, число сигма-связей ( σ-связей) в молекуле метана равно четырем:
В молекуле этилена число сигма-связей равно пяти, а также есть одна пи-связь (между атомами углерода):
В молекуле ацетилена всего три сигма-связи и две пи-связи:
H–C≡C–H
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Ароматичность и антиароматичность
Задача
Понятия «ароматичность» и «антиароматичность» в химии не имеют отношения к наличию запаха у вещества. Ароматические соединения — это вещества, в которых замкнутая сопряженная система из π-электронов, образующаяся в результате перекрывания р-электронных облаков соседних атомов, придает молекуле аномально высокую стабильность. Самое, пожалуй, известное ароматическое соединение — бензол С6Н6, гораздо более инертный по сравнению с соединениями, в которых на углерод приходится большее число атомов водорода — С6Н8, С6Н10, С6Н12 и С6Н14. В антиароматических соединениях замкнутая сопряженная система из π-электронов, напротив, делает антиароматическую молекулу крайне неустойчивой, а в ряде случаев антиароматические соединения с желаемой формулой вообще невозможно получить.
В 1931 году Эрих Хюккель сформулировал правила, которые позволяют отнести данное вещество к ароматическим или антиароматическим. В соответствии с правилами Хюккеля ароматической является плоская замкнутая сопряженная система, содержащая 4n + 2 π-электронов, а антиароматическая система должна состоять из 4n π-электронов (n — натуральное число или ноль). Так, у бензола эта система содержит шесть π-электронов, и он удовлетворяет хюккелевскому критерию ароматичности для n = 1.
Ниже приведены структурные формулы десяти веществ, молекулы которых плоские. Определите, какие из них можно отнести к ароматическим, какие — к антиароматическим, а какие не попадают ни в одну из этих категорий.
Подсказка 1
Двойная связь между элементами второго периода Периодической системы состоит из σ-связи и π-связи. Каждую π-связь образуют два π-электрона.
Подсказка 2
В образовании сопряженной системы электронов могут участвовать не только π-электроны, отвечающие за образование химической связи, но также и неподеленная электронная пара или пустая р-орбиталь.
Подсказка 3
Определить, расположена ли на атоме элемента неподеленная электронная пара или пустая р-орбиталь, можно, проанализировав положение элемента в Периодической системе — число электронов на внешнем (валентном) уровне элемента равно номеру группы, в которой он находится. На образование каждой простой (одинарной) связи элемент использует один электрон с валентного уровня.
Решение
Используя информацию из подсказок и Периодическую систему, можно получить следующие выводы:
1) один атом углерода, образующий двойную связь, вносит в сопряженную систему один электрон, атом углерода, образующий только одинарные связи — ни одного (одинарная связь представляет собой σ-связь),
2) атом азота предоставляет в сопряженную систему два электрона,
3) атом бора — ни одного, но замыкает систему сопряжения за счет вакантной (не содержащей электронов) орбитали.
На рисунке ниже указано, сколько электронов в систему сопряжения отдает каждый атом (зеленые числа), и общее число электронов в сопряженной системе (красные числа) каждой из данных молекул.
Соединения с номерами 1, 3, 5, 6, 7 и 10 — ароматические, у них замкнутая система сопряжения, количество электронов в которой (4n + 2) соответствует хюккелевскому критерию. При этом пиррол (№3) и индол (№6) относят к гетероциклическим ароматическим соединениям — в них в образовании единой сопряженной системы участвуют атомы не только углерода, но и других элементов. Боразол («неорганический бензол», №7) —ароматическое соединение, которое не содержит ни одного атома углерода и первый пример того, что ароматичность не является свойством исключительно органических соединений.
К антиароматическим относятся соединения с номерами 4 и 8: у них, соответственно, 4 и 12 электронов в замкнутой системе сопряжения, что отвечает критерию антиароматичности. Именно с безуспешных попыток синтеза циклобутадиена (№4) следует отсчитывать появление термина «антиароматичность».
Вещества с номерами 2 и 9 не относятся ни к ароматическим, ни к антиароматическим: это просто вещества, в структуре которых имеется система сопряжения кратных связей. Можно подумать, что число электронов для №2 соответствует антиароматическим системам, а для №9 — ароматическим, однако для проявления свойств ароматичности или антиароматичности необходимо наличие замкнутой системы сопряжения, которой у этих молекул нет. Гексатриен-1,3,5 (№9) представляет собой ациклическую (разомкнутую) молекулу, а у циклопентадиена-1,3 (№2), хотя он и является молекулой с замкнутой углеродной цепью, атомная группировка –СН2–, в которой углерод образует только простые (одинарные) связи, не позволяет замкнуть систему сопряжения из π-электронов.
Послесловие
Несмотря на то, что в настоящее время понятие «ароматичность» не имеет отношения к запахам, своему происхождению оно обязано именно характерному аромату первого из обнаруженных ароматических веществ. Химики начала XIX века пытались определить строение бензола — неизвестной пахучей жидкости, выделенной Майклом Фарадеем из светильного газа, применявшегося для освещения улиц ночного Лондона.
Чуть позже по результатам анализа, указывавшим на то, что соотношение между атомами С и Н составляет 1:1, и молекулярной массе была установлена его формула — C6H6, которая позволяла говорить о крайней степени ненасыщенности и реакционной способности. Из формулы следовало, что бензол может присоединить четыре молекулы водорода Н2 до образования устойчивого насыщенного углеводорода С6Н14, однако бензол был устойчивым при комнатной температуре и не вступал в реакции присоединения водорода, свойственные для ненасыщенных соединений.
На основании свойств бензола и представлениях о том, что углерод образует четыре химические связи, а также о том, что атомы углерода способны связываться друг с другом двойными и тройными связями, было предложено несколько ошибочных вариантов структурных формул для бензола. Уже в ХХ веке все соединения, соответствующие этим формулам, были синтезированы. Было установлено, что их физические и химические свойства отличаются от свойств бензола. Также было обнаружено, что призман (бензол Ладенбурга) и бензол Дьюара самопроизвольно превращаются в бензол при комнатной температуре.
Правильную — циклическую — формулу этого соединения удалось установить Фридриху Августу Кекуле, который, судя по его воспоминаниям, пришел к этой идее во сне: ему приснилась змея, кусающая себя за хвост, и он решил, что бензол должен представлять собой шестичленный цикл из атомов углерода с чередующимися двойными и одинарными связями.
Правда, в соответствии с формулой Кекуле — и он сам так предполагал, — должно было бы существовать два изомера 1,2-дихлорбензола — в одном атомы хлора должны были быть разделены двойной связью, в другом — одинарной. Поскольку, как оказалось позже, в бензоле нет чередующихся двойных и одинарных связей, все атомы углерода эквивалентны, а π-электроны образуют единую замкнутую систему, такие изомеры и не могут существовать. Естественно, что их так и не удалось обнаружить, а сам Кекуле предполагал, что неудачи обнаружения этих изомеров связаны с очень быстрым превращению их друг в друга.
Именно Кекуле и ввел понятие «ароматичность», которое предложил рассматривать, как особую характеристику бензола и родственных по структуре соединений — их устойчивость и склонность участвовать в реакциях замещения, а не присоединения. Такое химическое поведение нельзя было объяснить формулой Кекуле, предполагавшей наличие в бензольном цикле трех двойных связей — в других соединениях, не относившихся к ароматическому ряду, кратные связи активно вступали в реакции присоединения.
В чем состоит причина такого поведения ароматических соединений удалось объяснить в 1931 году Эриху Хюккелю, который, использовав для изучения бензола упрощенный метод квантовой механики — метод молекулярных орбиталей, показал, что в молекуле бензола нет двойных и одинарных связей углерод–углерод, а р-электроны атомов углерода образуют единое кольцевое электронное облако, которому Хюккель дал название «ароматическая система». Он же разработал и фигурирующие в условии задачи правила, позволяющие относить молекулы к ароматическим или антиароматическим. Два правила Хюккеля одинаковы и для ароматических и для антиароматических соединений: плоское строение молекулы и замкнутая сопряженная система нужны для образования кольцевого электронного облака, а разное количество электронов в таком облаке может стабилизировать или дестабилизировать молекулу.
Хотя ароматичность — одна из важнейших концепций химии, пока нет общепринятого краткого определения этого понятия. Ароматичность понимается как совокупный набор особых признаков, в той или иной мере присущих ряду циклических сопряженных молекул. Часть этих признаков можно наблюдать экспериментально, но другие признаки можно описать, только основываясь на квантовой теории строения молекул (сюда как раз относится правило Хюккеля о числе электронов в замкнутой системе). Невозможно объяснить ароматичность с позиций только классической структурной теории химии.
Экспериментально наблюдать можно следующие проявления ароматичности:
1) Химическое — склонность ароматической молекулы к реакциям замещения, а не присоединения.
2) Структурный — тенденция к плоскому расположению атомов и выравниванию длин связей. У бензола выравнивание длин связей идеально — все шесть связей углерод-углерод одинаковы. У более сложных молекул выравнивание длин связей не идеально, но значительно.
3) Магнитный — замкнутая электронная система ароматических соединений оказывает влияние на параметры спектров ядерного магнитного резонанса ароматических соединений. В ароматических соединениях при приложении к ним внешнего магнитного поля возникает кольцевой ток, который способствует возникновению внутри молекул локального магнитного поля, направленного противоположно внешнему. В результате взаимодействия внутреннего и внешних магнитных полей экранирование атомов водорода и атомов углерода ароматической системы понижается, и их сигналы регистрируются в области слабых полей, которая обычно и называется «областью сигналов ароматических атомов водорода» для ЯМР-спектроскопии 1 Н и «областью сигналов ароматических атомов углерода» для ЯМР-спектроскопии 13 С.
Кроме бензольного кольца и углеводородов ароматические свойства проявляют многие гетероциклические соединения — пиррол, фуран, тиофен, пиридин, индол, оксазол и другие. При этом в сопряженную систему шестичленных гетероциклов гетероатом отдает один электрон (по аналогии с углеродом), в 5-атомных — неподеленную электронную пару. Ароматические свойства могут проявлять не только нейтральные молекулы, но и заряженные частицы, например, циклопропенилий-катион (2π-электронная система), циклопентадиенил-анион (6π-электронная система), циклогептатриенил-катион (6π-электронная система), циклооктатетраенил-дианион (10π-электронная система).
Ароматические «ионы». Слева направо: циклопропенилий-катион, циклопентадиенил-анион, циклогептатриенил-катион, циклооктатетраенил-дианион
В ряде случаев ароматические соединения получают из неароматических веществ в ходе процесса ароматизации. Наибольшее практическое значение имеет каталитический риформинг бензиновых фракций, который увеличивает октановое число моторного топлива (см. послесловие к задаче Зона грибного отчуждения).
главная > справочник > химическая энциклопедия:
Ароматичность
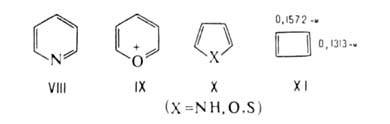
К числу наиболее важных признаков ароматичности принадлежит склонность ароматических соединений к замещению, сохраняющему систему сопряженных связей в цикле, а не к присоединению, разрушающему эту систему. Кроме бензола и его производных, такие реакции характерны для полициклических ароматических углеводородов (напр., нафталина, антрацена, фенантрена и их производных), а также для изоэлектронных им сопряженных гетероциклических соединений. Известно, однако, немало соединений (азулен, фульвен и др.), которые также легко вступают в реакции замещения, но не обладают всеми другими признаками ароматичности.
Реакционная способность не может служить точной характеристикой ароматичности еще и потому, что она отражает свойства не только основного состояния данного соединения, но и переходного состояния (активировованного комплекса) реакции, в которую это соединение вступает. Поэтому более строгие критерии ароматичности связаны с анализом физических свойств основных электронных состояний циклических сопряженных структур. Главная трудность состоит в том, что ароматичности не является экспериментально определяемой характеристикой. Поэтому не существует однозначного критерия для установления степени ароматичности, т.е. степени подобия свойствам бензола. Ниже рассмотрены наиболее важные признаки ароматичности.
Строение электронной оболочки ароматических систем.
Тенденция бензола и его производных к сохранению структуры сопряженного кольца в различных превращениях означает повышенную термодинамическую и кинетическую устойчивость этого структурного фрагмента. Стабилизация (понижение электронной энергии) молекулы или иона. обладающих циклической структурой, достигается при полном заполнении электронами всех связывающих молекулярных 
Для производных соединений II-Х и др. более сложных структур, получаемых изоэлектронным замещением метиновых групп в полиенах I-VII, также характерны высокая термодинамическая устойчивость и общая склонность к реакциям замещения в ядре.
Циклические сопряженные полиены, имеющие в цикле 4n 
Правила, учитывающие число 
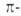
Энергетические критерии ароматичности. Энергия резонанса Для определения количественной меры ароматичности, характеризующей повышенную термодинамическую устойчивость ароматических соединений, было сформулировано понятие энергии резонанса (ЭР), или энергии делокализации.
Теплота гидрирования молекулы бензола, формально содержащей три двойные связи, на 151 кДж/моль больше, чем теплота гидрирования трех молекул этиленароматичности. Эту величину, связываемую с ЭР, можно рассматривать как энергию, дополнительно затрачиваемую на разрушение циклической системы сопряженных двойных связей бензольного кольца, стабилизирующей эту структуру. Таким образом, ЭР характеризует вклад циклического сопряжения в теплоту образования (полную энергию, теплоту атомизации) соединения.
Предложен ряд способов теоретических оценок ЭР. Они различаются главным образом выбором структуры сравнения (т.е. структуры, в которой нарушено циклическое сопряжение) с циклической формой. Обычный подход к вычислению ЭР состоит в сопоставлении 

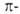
Этого недостатка лишены величины ЭР, рассчитываемые путем сравнения 

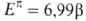


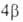
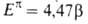
Наибольшей ЭРД/е, то есть наибольшей ароматичностью, обладает бензол. Понижение ЭРД/е отражает понижение ароматических свойств. Приведенные данные хорошо согласуются со сложившимися представлениями о проявлениях ароматичности
Магнитные критерии ароматичности. Циклическое сопряжение 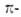
К ароматическим относятся соед., в молекулах которых поддерживаются наведенные диамагнитные 
Для антиароматических систем [4n]аннуленов, наоборот, характерны парамагнитные кольцевые токи, приводящие к сдвигу внешних протонов в сильное поле (паратропные системы). Так, химический сдвиг внешних протонов [16]аннулена равен всего 4,8 м.д.
Предложены различные выражения для количественной характеристики ароматичности по степени альтернирования длин связей, например для углеводородов вводится индекс ароматичности (НОМАd):
где а = 98,89, Хr— длина r-ной связи (в А), n-число связей. Для бензола HOMAd максимален и равен 1, для циклобутадиена минимален (0,863). Азулен с НОМАd = 0,921 занимает промежуточное положение, характерное для неароматических систем.
Развитие концепции ароматичности. Главная характеристика – энергетическая стабилизация структуры при молекулярной геометрии, создающей оптимальные условия для соответствующих электронных взаимодействий. Установление аналогичных связей между пространственным и электронным строением молекул других структурных типов привело к расширению понятия ароматичности
Повышеная устойчивость гомосопряженных систем (относительно др. изомерных форм), в которых число 
К спироароматическим системам принадлежат ненасыщенные спирановые структуры, в которых перекрывание двух ортогональных систем 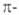

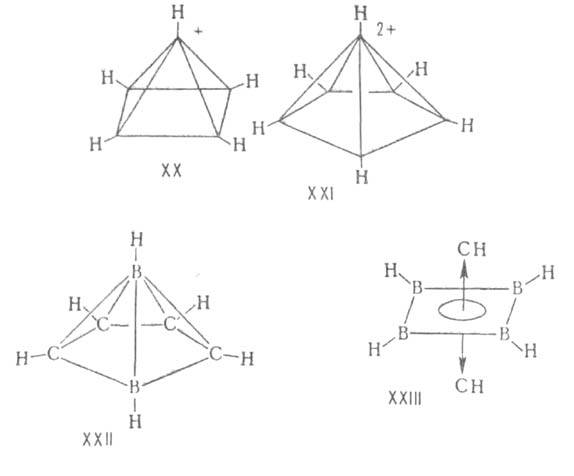
Примеры структур с трехмерной ароматичности-углеводородные катионы (СН)5 + (ф-ла XX), (СН)6 2+ (XXIX производные которых известны, нидо- и клозокарбораны (XXII и ХХIII), 
Понятие ароматичности успешно привлекается для описания энергетических характеристик переходных состояний термических перициклических реакций. Такие реакции осуществляются через переходные состояния, которые в зависимости от конформации цикла содержат 4n+2 (хюккелевские системы) или 4n (мебиусовские системы)