Артериальной реваскуляризации что это
Успешная реваскуляризация рестеноза артерий нижних конечностей с локализованной доставкой Паклитаксела
Faisal Latif, MD and Thomas A. Hennebry, MB BCH BAO, FSCAI, FACC
Процедуры чрескожной реваскуляризации приводят к значительным улучшениям качества жизни и увеличению дистанции ходьбы без хромоты [1]. Рестеноз остается основной проблемой после процедур чрескожной реваскуляризации при заболевании периферических артерий. Антикоагулянты, включая гепарин с низкой молекулярной массой, не приводят в результате к существенным улучшениям [2].
В настоящее время появляются новые методы, дающие в результате краткосрочные и долгосрочные улучшения. Различные процедуры, включая эндоваскулярную брахитерапию, генную терапию артерий и фотоангиопластику, показали некоторые благоприятные результаты, но не были убедительными [3]. Стент с элюирующим лекарственным покрытием проверяли с помощью сиролимуса в периферических сосудах, но результаты не были обнадеживающими [4]. Мы сообщаем о новом методе, опробованном на двух пациентах, с локализованной доставкой Паклитаксела для лечения рестеноза при заболевании периферических артерий.
Случай 1
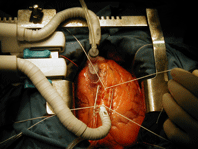
60-летний пациент в анамнезе с заболеванием периферических артерий и многолетней окклюзией правой общей подвздошной артерии, прошедший перекрестное шунтирование вен на бедре 6 лет назад. Впоследствии с течением времени у него развился стеноз левой общей подвздошной артерии. Прошел множество процедур повторной реваскуляризации, включая ангиопластику и стентирование при помощи внешнего инструмента. У пациента наблюдались незначительные улучшения в симптомах хромоты в течение нескольких месяцев после каждой из таких процедур. Его направили в нашу больницу с тяжелыми симптомами и дистанцией ходьбы без хромоты всего лишь 25 ярдов. В анамнезе у пациента была гипертензия и дислипидемия в дополнение к 60 пачкам, выкуриваемым в год. В результате медицинского осмотра у него выявили слабый пульс в тыльной артерии правой стопы (DP), 1 + DP и пульс в задней большеберцовой артерии в левой стопе.
Доступ к артерии обеспечили через левую общую бедренную артерию (CFA) ниже уровня перекрестного шунтирования вен на бедре при помощи ультразвука. Ангиография показала множество чередующихся стентов в левой общей подвздошной артерии с локальным 80% поражением и градиентом давления 60 мм рт. ст. (Рисунок 1). Было известно о полной окклюзии правой общей подвздошной артерии. Левая внешняя и внутренняя подвздошные артерии, поверхностные и глубокие артерии бедра были проходимыми. Перекрестный шунт на бедре также был проходимым. Внутрисосудистый ультразвук (IVUS) стенозированной части левой общей подвздошной артерии показал просвет в 34 мм2 (диаметр 2,7 мм, рисунок 2А), по сравнению со стандартной площадью сосуда 134 мм2 (диаметр 11 мм). Первый стент имел диаметр 8 мм. Провели лазерную атерэктомию левой общей подвздошной артерии, которая увеличила минимальный просвет с 34 до 80 мм (рисунок 2В) и уменьшила градиент давления с 80 до 20 мм рт.ст.
Далее использовали 8 х 10 мм инфузионный баллонный катетер Clearway™ (компания «Atrium», Гудзон, Нью-Гэмпшир) для инфузии 1,7 мг Паклитаксела, разбавленного в 10 см3 физиологического раствора, в месте поражения, наряду с ангиопластикой при 3 атм. IVUS на этой стадии выявил площадь просвета 90 мм2 без градиента давления в поражении (Рис. 2С). На рисунке 3 приведен последний ангиографический снимок левой общей подвздошной артерии. Дистанция ходьбы без хромоты существенно увеличилась. Через четыре месяца после процедуры у пациента продолжал повышаться уровень жизни с увеличением дистанции ходьбы без хромоты до 500 ярдов. На данный момент лодыжечно-плечевой индекс в правой части составляет 1,1 и в левой части 0,73.
Случай 2
У 67-летней пациентки в анамнезе с обходным сосудистым шунтированием коронарной артерии и тяжелым заболеванием периферических артерий в нижних конечностях развилась ишемия 4 стадии по классификации Резерфорда в левой нижней конечности. Было известно об окклюзии левой поверхностной бедренной артерии (SFA) в течение почти 10 лет. У пациентки стоял бедренно-подколенный обходной шунт, который также был закупорен в течение многих лет. Пациентке провели ангиопластику и стентирование, а также криопластику в левой SFA в разное время в течение предыдущего года. В ходе дуплексного сканирования у нее обнаружился рестеноз в левой SFA.
Был получен доступ в правую общую бедренную артерию (CFA). В дополнение к 70% поражению в левой CFA в SFA было обнаружено 90% поражение устья сосуда (Рис. 4). В левую SFA вставили 0,035 дюймовый проводник (Rosen wire; компания «Cook Critical Care») и 30 см интродьюсер (компания «Cook Critical Care») над раздвоением аорты. Провели лазерную атерэктомию, используя 2 мм систему доставки стента по проводнику с турбоускорителем (компания «Spectranetics, Colorado Springs, CO») в левой СFA, а также в SFA. Для доставки 3 мг Паклитаксела в наиболее поврежденные участки использовали 6 х 10 мм инфузионный баллонный катетер Clearway™ (компания «Atrium», Гудзон, Нью-Гэмпшир) (по две инфузии CFA и SFA). В конце процедуры в левой SFA отмечался остаточный стеноз менее 20% (Рис. 5), в то время как в правой CFA сохранился остаточный 20% стеноз. Симптомы существенно улучшились. Повторная ангиограмма, проведенная спустя 3 месяца через интродьюсер в ходе последующей процедуры реваскуляризации в правой нижней конечности, продемонстрировала отсутствие рецидива стеноза в левой SFA (Рис. 6).
Инфузионный баллонный катетер Clearway™ (компания «Atrium», Гудзон, Нью-Гэмпшир) представляет собой ПТФЭ баллонный катетер для инфузий, создающий слой жидкости с низким давлением в баллоне, который отвечает за локальную доставку тромболитических или, как в нашем случае, хемотерапевтических препаратов с целью уменьшения новообразований (Рис. 7). ПТФЭ поверхность, а также низкое давление в баллоне уменьшают возможность разрыва сосуда и повреждения устья при использовании в установленном стенте и вокруг него.
Обсуждение
Уменьшение рестеноза после чрескожной ангиопластики русла периферических сосудов является сложным способом и зачастую требует разумной комбинации различных доступных методов. Оба наших пациента получили разные лечения с использованием различных методов, однако не испытали существенных быстрых улучшений рестеноза. Локальная доставка Паклитаксела через новый инфузионный баллонный катетер (Vascular Clearway™, компания «Atrium») представляет собой новый метод лечения рестенозных поражений периферических сосудов с хорошими, как минимум краткосрочными, результатами. Доставляемая доза паклитексела представляла собой экстраполированную дозу, используемую в стентах с элюирующим покрытием из паклитексела(DES) (коронарный стент «Tаxus», компании «Boston Scientific»),с учетом объема сосуда, в который доставляется препарат.
Использованная доза крайне мала, по сравнению с хемотерапевтической дозой Паклитаксела, и, следовательно, у наших пациентов не наблюдалось системных побочных эффектов. После чрескожной транслюминальной ангиопластики (РТА) наблюдается разрыв атеросклеротических бляшек и процесс экстенсивного ремоделирования стенок артерий. Потеря люминального просвета после РТА обусловлена внутренним ремоделированием сосудов и пролиферацией неоимнтимы [5]. В дополнение, воспаление также оказывает критическое воздействие на реакцию сосуда при поражении и является основным фактором в развитии рестеноза после ангиопластики периферических сосудов, что подтверждается повышением содержания С-реактивного белка, D-димера и Р-селектина после ангиопластики [6].
Паклитаксел стабилизирует микротрубочки в клетках фибробласта и, следовательно, ингибирует пролиферацию гладких мышц после ангиопластики [7, 8]. Основной задачей является введение Паклитаксела глубоко в локальные ткани и, следовательно, ингибирование гиперплазии неоимнтимы и ослабление воспалительной реакции. В отличие от других антипролиферативных препаратов, Паклитаксел обладает свойствами, которые делают его предпочтительным при локальной доставке и предотвращают пролиферацию гладких мышц при рестенозе после ангиоплатики или имплантации стента. Среди таких свойств выделяют: липофильное свойство, которое обеспечивает быстрое клеточное усвоение, а уникальный способ действия обеспечивает долговременное антипролиферативное действие даже после краткосрочной введения одной дозы очень низких концентраций [9, 10]. Локализованную доставку Паклитаксела проверяли на животных. Было отмечено замедление образования неоинтимы [11]. Простетические модели шунтов также продемонстрировали противовоспалительные эффекты Паклитаксела, что подтверждалось наличием меньшего количества макрофагов вокруг шунта [12]. В недавнем исследовании сообщили о локализованной доставке Паклитаксела с использованием различных методов [13].
Вывод
Наш отчет является первым отчетом об использовании локализованной доставки Паклитаксела в ложе периферических артерий у человека с использованием инфузионного баллона. Данный метод дает хорошие краткосрочные результаты. Для подтверждения долгосрочных результатов необходима дальнейшая крупномасштабная оценка.
Артериальной реваскуляризации что это
Современные методы реваскуляризации миокарда
Операция АКШ в условиях искусственного кровообращения и кардиоплегии остается на сегодняшний день «золотым стандартом» лечения ИБС. Тем не менее, существует целый ряд современных методов, которые используются для реваскуляризации миокарда в настоящее время.
1. Множественное реваскуляризация миокарда с использованием обеих ВГА
2.1. Операции без ИК через минидоступ (MIDCAB)
2.2. Операции без ИК через стернотомию (OPCAB)
2.3. Операции по методу port access
2.4. Операции с видеоэндоскопической поддержкой
2.5. Полностью эндоскопическая реваскуляризация миокарда (TECAB)
Миниинвазивная реваскуляризация миокарда (МИРМ) – операция аортокоронарного шунтирования на работающем сердце без искусственного кровообращения (ИК).
Операция получила распространение с середины 80-х годов России, США и странах Западной Европы. Большиство хирургов, оперирующих на бьющемся сердце (без ИК), проводят реваскуляризацию миокарда через стернотомию (OPCAB – Off-pump coronary artery bypass).
Для работы на бьющемся сердце были созданы специальные устройства, позволяющие стабилизировать ограниченный участок миокарда в той области, где накладывают анастомоз с коронарной артерией. В настоящее время используются два основных типа стабилизатора, один из которых стабилизирует миокард путем локального давления, другой – с помощью вакуума. Наибольшее распространение получила система “Octopus”, основанная на вакуумном принципе.
Разработаны специальные анестезиологические приемы для успешного проведения таких операций. Современные достижения хирургии и анестезиологии позволяют выполнять без ИК шунтирование до 6-ти коронарных артерий.
Преимуществами операций коронарного шунтирования без ИК являются:
1. отсутствие травматических повреждений клеток крови,
2. меньшая длительность операции,
3. более быстрая послеоперационная реабилитация,
4. отсутствие осложнений, связанных с ИК.
Показания к МИРМ такие же как и для реваскуляризации миокарда с ИК. В тоже время существуют и противопоказания, которые не позволяют делать операции без ИК: например, постинфарктная аневризма левого желудочка, врожденный или приобретенного порок сердца, требующего хирургической коррекции.
Транмиокардиальная лазерная реваскуляризация (ТМЛР)
ТМЛР предназначена для больных с диффузным поражением коронарных артерий, которым невозможно выполнить прямую реваскуляризацию миокарда. В процессе такой операции в толще сердечной мышцы левого желудочка с помощью лазерного излучения формируются каналы, открывающиеся в полость сердца. Такое воздействие на миокард стимулирует формирование новой сосудистой сети, за счет которой компенсируется перфузия миокарда и устраняются явления ишемии, не смотря на имеющееся сужение коронарных артерий.
Положительный клинический эффект объясняют также механизмом симпатической денервации сердца, поскольку лазерное воздействие приводит к разрушению миокардиальных аксонов и к устранению болевого импульса. В последнее время положительный механизм воздействия ТМЛР связывают со стимуляцией ангиогенеза. В нашей стране пионером клинического использования ТМЛР является академик РАМН Л.А.Бокерия. В НЦ ССХ им. А.Н.Бакулева ТМЛР используется в двух вариантах: изолированно и в сочетании с АКШ (при диффузном поражении одного из коронарных сосудов).
Терапевтический ангиогенез и клеточная терапия
В действительности речь идет о хирургических процедурах. Сущность этого новейшего метода лечения ИБС заключается в генетическом воздействии на эндотелий, приводящем к его пролиферации и образованию новых сосудов. Воздействие производят путем переноса генетической информации в клетку с помощью переносчиков, в качестве которых используют некоторые вирусы и плазмидные комплексы. В клетке происходит считывание генетической информации и синтез белка, так называемых ангиогенных факторов, важнейшими из которых являются васкулоэндотелиальный фактор роста (VEGF) и фибробластный фактор роста (FGF). В 1998 году они были впервые использованы в клинической практике для стимуляции ангиогенеза у больных с диффузным поражением коронарных артерий. Ангиогенные факторы вводят непосредственно в миокард с помощью шприца при выполнении операции АКШ или ТМЛР. Существуют и катетерные методы введения этих факторов (эндокардиальный и интракоронарный).
Другой новый подход к лечению коронарной болезни заключается в использовании клеточных технологий, то есть во введении в миокард стволовых клеток, а точнее, мононуклеаров – предшественников эндотелиоцитов. Считается, что это может привести к формированию новых сосудов, которые позволят компенсировать дефицит коронарного кровотока при диффузном поражении коронарных артерий. Результаты использования этих методов нуждаются в дальнейшем изучении.
Реваскуляризация миокарда
Определение:
К подобным операциям относят:
Чрескожное коронарное вмешательство (стентирование, ангиопластика). Основная идея этих операций заключается в восстановлении и поддержании кровотока в сосудах. В сердечные артерии проводят и устанавливают стент, сперва расширив артерию баллоном. Стент – это тонкая металлическая проволочная трубочка. Расширяя артерию и, тем самым увеличивая ее диаметр, стент и в дальнейшем сохраняет просвет артерии. Это более щадящая операция, чем аорто-коронарное шунтирование. Выполняется под местной анестезией, без наркоза.
Операция аорто-коронарное шунтирование заключается в пришивании к восходящему отделу аорты дополнительных сосудов (шунтов), которые будут кровоснабжать участок сердца, страдающий от нехватки крови и кислорода. В качестве дополнительных сосудов используют артерии, которые располагается в грудной клетке, вены на ногах и некоторые другие сосуды. Операцию выполняют на остановленном сердце, выполняют подключение пациента к аппарату искусственного кровообращения.
Показания для реваскуляризации
Восстановление кровоснабжения сердца хирургическим путем выполняют при отсутствии эффекта (или недостаточном эффекте) от приема медикаментозной терапии. Выбор методики реваскуляризации миокарда – это сложный, комплексный подход, основанный на оценке состояния пациента, особенности поражения коронарных артерий, сопутствующих заболеваниях, сложности послеоперационного периода и др.
Для определения показаний к выполнению того или иного метода лечения рекомендуется пройти полноценное кардиологическое обследование. Мы используем современные методики оборудования, что позволяет минимизировать риск осложнений после операций.
Если Вы обнаружили у себя некоторые, пускай даже незначительные, признаки сердечно-сосудистого заболевания, не откладывайте посещение врача на потом. Если у вас возникла необходимость задать вопрос кардиологу, сделать это можно в режиме «он-лайн» на нашем сайте.
Полная артериальная реваскуляризация
Полная артериальная реваскуляризация
Главной тенденцией современной коронарной хирургии сегодня является направление полной артериальной реваскуляризации без использования искусственного кровообращения в тех случаях, когда не имеется специальных противопоказаний. В англоязычной литературе такие вмешательства обозначаются аббревиатурой OPCAB (Off Pump Coronary Artery Bypass). Такие операции имеют две основные особенности: использование только артериальных кондуитов (шунтов) вместо традиционных венозных, а также отказ от использования искусственного кровообращения на основном этапе, что потенциально имеет определенные преимущества. При проведении подобных вмешательств аппаратура для проведения искусственного кровообращения находится в операционной и может быть использована в случае необходимости в любую минуту.
Полная артериальная реваскуляризация в большинстве случаев осуществляется при использовании обеих внутренних грудных артерий, специально подготовленных при помощи техники, называемой скелетированием. В редких случаях также могут быть использованы желудочно-сальниковая и лучевая артерии. В Уральском Институте Кардиологии все пациенты обязательно получают хотя бы один артериальный шунт, в 99% случаев это левая внутренняя грудная артерия. Количество операций с использованием двух внутренних грудных артерий в нашей клинике является одним из самых высоких в Российской Федерации и составляет 53,4%.
Скелетирование является единственной техникой, применяемой для выделения внутренних грудных артерий в нашей клинике. При этом все окружающие ткани, включая сателлитные вены и нервы, остаются в неприкосновенности. Безусловными преимуществами такой техники является низкая травматичность, сохранение венозного кровоснабжения и иннервации соответствующих участков кожи. Скелетирование также снижает риск инфекционных осложнений, ассоциированных с билатеральным шунтированием, что особенно актуально у пациентов, страдающих сахарным диабетом.
Для полной артериальной реваскуляризации в нашей клинике используется методика формирования так называемого типичного Т-графта, когда коррекция соответствует природному расположению коронарных сосудов. При этом левая внутренняя грудная артерия не отсекается от своего источника (используется in situ) и применяется для восстановления кровотока в передней нисходящей артерии сердца — основном коронарном сосуде. Правая коронарная артерия используется в качестве свободного трансплантата, имплантируемого в левую внутреннюю грудную артерию под прямым углом, что позволяет последовательно (секвенциально) реваскуляризировать все ветви боковой и задней стенки левого желудочка сердца. Подобный тип ревакуляризации восстанавливает нормальную анатомию коронарных артерий, а ткаже позволяет избежать манипуляций с восходящей аортой, что на порядок снижает риск неврологических осложнений. Другой современной методикой является использование обеих внутренних грудных артерий без отсечения (или перекрестное шунтирование), что позволяет значительно ускорить процедуру и уменьшить взаимное влияние кровотока там, где это необходимо.
Вмешательства на работающем сердце являются абсолютно безопасными, что обеспечивается использованием специальных средств мониторинга: прямого артериального, венозного, легочного давления и давления заклинивания легочной артерии, а также минутного объема и сердечного индекса сердца при помощи катетера Сван-Ганц у всех пациентов. Также обязательным является использование в подобных случаях транспищеводной эхокардиографии для определения сократимости миокарда. Для профилактики интраоперационной ишемии во всех случаях при наложениях анастомозов используются внутрикоронарные шунты.
Операции на работающем сердце позволяют избежать негативных последствий искусственного кровообращения у пациентов, имеющих сопутствующие заболевания центральной нервной системы, легких, печени, почек, а также у пожилых пациентов. Такие операции проводятся исключительно с использованием одноразовой аппаратуры, включая стабилизаторы миокарда вакуумного типа и держатели верхушки сердца, а также внутрикоронарные шунты.
Операции на работающем сердце в основном используются у пациентов, не требующих коррекции клапанной болезни сердца и других «открытых» процедур, тем не менее в некоторых случаях шунтирование на работающем сердце выполняется первым этапом операции, чтобы уменьшить общее время искусственного кровообращения.
Выбор метода реваскуляризации у пациентов с многососудистым поражением на основе данных доказательной медицины (обзор литературы)

В статье проведен обзор литературы по выбору метода реваскуляризации миокарда у пациентов с многососудистым поражением, а также приводятся данные о роли результатов рандомизированных исследований в клинических рекомендациях по данной проблеме.
The article reviews literature on the choice of myocardial revascularization method in patients with multivessel coronary disease and also data on the role of randomized research results in clinical guidelines on thi2s problem are presented.
Ишемическая болезнь сердца (ИБС) — одно из наиболее распространенных заболеваний в развитых странах. Каждый год от сердечно-сосудистых заболеваний (ССЗ) и в первую очередь от осложнений ИБС умирают 17,5 млн человек, что составляет 31% всех случаев смерти в мире [1, 2]. В настоящее время в Российской Федерации наблюдается рост численности больных с II–III функциональным классом (ФК) стабильной стенокардии напряжения. Это не только повышает риск смерти от инфаркта миокарда (ИМ) и острого нарушения мозгового кровообращения (ОНМК), но и значительно ограничивает трудоспособность пациентов и качество их жизни, что увеличивает экономические расходы. В настоящее время многососудистое поражение, которое является сложным и морфологически неблагоприятным, встречается гораздо чаще, чем изолированное поражение коронарных артерий (КА). Около 40–60% всех эндоваскулярных вмешательств выполняется именно в таких ситуациях [3]. Такое поражение часто сопровождает коморбидную патологию, которая влияет на выбор тактики лечения. Наибольший интерес представляет сахарный диабет (СД), который является независимым фактором риска развития атеросклероза и значительно повышает риски развития сердечно-сосудистых осложнений (ССО). Это заболевание определяет тяжесть течения ИБС, выбор стратегии ведения и прогноз пациента [4]. Учитывая быстрое прогрессирование атеросклероза, потребность в реваскуляризации миокарда в условиях коморбидности значительно повышается: 20–30% всех вмешательств приходится именно на эту группу [5]. Стоит отметить, что такое поражение ассоциировано с высокой вероятностью дестабилизации состояния с последующим развитием острого коронарного синдрома [6]. Основные методы инвазивной стратегии в настоящее время представлены аортокоронарным шунтированием (АКШ) и чрескожным коронарным вмешательством (ЧКВ). При определении тактики реваскуляризации пациентов с многососудистым поражением КА важную роль играют результаты рандомизированных исследований в рамках доказательной медицины, на которые ссылаются клинические рекомендации Европейского общества кардиологов (European Society of cardiology, ESC) и Европейской ассоциации кардиоторакальных хирургов (European Association for Cardio Thoracic Surgery, EACTS) по реваскуляризации миокарда 2014 г.
Материалы и методы исследования
Были проанализированы основные клинические рандомизированные исследования и метаанализы, а также группы нерандомизированных исследований.
Результаты и обсуждение
Транслюминальная баллонная коронарная ангиопластика (ТБКА) впервые была проведена в 1977 г. A. Gruentzig. Неудовлетворительные результаты при осложненных типах атеросклеротического поражения были отмечены сразу. В итоге в 80-х гг. показанием для ТБКА было однососудистое поражение типа А по классификации Американской коллегии кардиологов (American College of Cardiology, ACC)/Американской ассоциации сердца (American Heart Association, AHA) 1988 г.: концентрические стенозы менее 10 мм по протяженности, с ровными контурами бляшки [7]. В дальнейшем показания к этой процедуре расширялись, что требовало проведения рандомизированных исследований, сравнивающих эффективность АКШ и эндоваскулярного метода для пациентов с многососудистым поражением. В 90-х годах XX века ряд таких исследований был проведен. В исследованиях CABRI (Coronary Angioplasty versus bypass Revascularization Investigation), EAST (Emory Angioplasty versus Surgery Trial) и BARI (Bypass Angioplasty Revascularization Investigation) проводился анализ летальности, ИМ и частоты повторной реваскуляризации (ПР). Наиболее достоверно различимы результаты ПР, что позволило сделать вывод о преимуществе АКШ у данной группы пациентов (табл.) [8–12].
На данный момент ТБКА имеет очень ограниченные показания, а именно калибр сосудов менее 2 мм, некоторые типы поражения, при котором вовлекаются ветви коронарной артерии и рубцовая ткань в месте старого стента, а также в ситуациях, когда пациент не может принимать противосвертывающие препараты.
В поисках путей для повышения эффективности процедуры ТБКА были созданы стенты — эндопротезы, которые вводятся в просвет стенозированного участка для предотвращения окклюзии просвета. Они должны были дать возможность снизить риск развития ранней окклюзии, констриктивного ремоделирования и чрезмерной гиперплазии интимы. Эффективность ТБКА и ЧКВ с имплантацией непокрытых металлических стентов (НМС) можно оценить по результатам группы нерандомизированных исследований Moussa и соавт., Laham и соавт., Mathew и соавт., de Servi и соавт., Kornowsky и соавт. Оцениваемыми критериями были необходимость в экстренном АКШ и в повторной реваскуляризации. Экстренное коронарное шунтирование было необходимо в 6–10% (ТБКА) и в 0–2% (ЧКВ) случаев. Различия между потребностью в ПР были более значимы: 35–55% vs 10,8–30% соответственно [13]. Тот факт, что стенты повышают эффективность баллонного вмешательства, послужил началом для группы исследований, сравнивающих ЧКВ с НМС и АКШ.
В исследовании ARTS I (Arterial Revascularization Therapy Study) принимали участие 67 европейских клиник 19 стран. Общее количество пациентов составляло 1205 человек. Наиболее различимы через 5 лет наблюдения были частота повторной реваскуляризации (30,3% ЧКВ и 8,8% АКШ, p 0,05), ИМ (2,7% и 6,2%, p > 0,05) по сравнению с группой АКШ. Через 3 года результаты по летальности, частоте ИМ были сопоставимы, однако все еще наблюдалась эффективность СЛП в предупреждении развития ССО (22,7% и 29,8%, p = 0,016), что связано с меньшей необходимостью в ПР (14,2% и 24,4%, p = 0,008) относительно пациентов с НМС. По сравнению с группой АКШ преимущество через 3 года наблюдения не отмечалось (22,7%), что объяснялось меньшей потребностью в ПР в группе АКШ (0,9%). В этом исследовании была выделена группа пациентов с СД, в которой основные ССО развивались чаще в группе СД, чем в группе без него: 36,2% и 19,1%, p = 0,018 [18].
В исследовании ARTIS II со сроком наблюдения 5 лет оценивались результаты применения сиролимусных стентов у пациентов, которым в исследовании ARTIS I было проведено АКШ или стентирование с использованием НМС. Через 1 год в группе ЧКВ результаты были лучше относительно летальности (1% vs 2,7%, p > 0,05), ИМ (1,2% vs 3,5%, p > 0,05), ОНМК (0,8% vs 1,8%, p > 0,05), чем в группе АКШ, однако потребность в ПР тем не менее была выше (7,4% vs 3,7%, p > 0,05). Результаты MACCE были сопоставимы. Через 3 года наблюдения частота развития MACCE была значительно выше в группе НМС (34%, p 0,05) [19].
Наиболее крупным исследованием по сравнению эффективности АКШ и ЧКВ у пациентов с многососудистым поражением и СД является FREEDOM (Future Revascularization Evaluation in patients with Diabetes mellitus: Optimal Management of multivessel disease). Основной вопрос: является ли теперь АКШ наиболее предпочтительным методом оперативной стратегии на фоне достижений в ЧКВ? 82% пациентов из 1900 включенных в исследование имели трехсосудистое поражение. Для ЧКВ использовались как стенты, выделяющие сиролимус, так и стенты, выделяющие паклитаксел. Через 5 лет развитие основных сердечно-сосудистых событий наблюдалось чаще в группе ЧКВ (26,6% vs 18,7%, p = 0,005). Через 1 год наблюдения необходимость в ПР составила 12,6% в группе ЧКВ и 4,8% в группе АКШ, p 50%. В исследование были включены 1800 пациентов. Через 1 год наблюдения развитие кардиальных и цереброваскулярных событий чаще наблюдалось в группе ЧКВ (12,4% и 17,8%, p = 0,002). В ходе исследования степень анатомического поражения коронарного русла оценивалась по специально разработанной шкале SYNTAX. В качестве промежуточного вывода было решено, что ЧКВ является более предпочтительным для пациентов с несложными анатомическими вариантами поражения, т. е. при оценке SyntaxSCORE 22 (класс доказательности IA); ЧКВ может рассматриваться как альтернативный метод у пациентов с SyntaxSCORE
Т. В. Огир 1
Е. П. Смуглов, кандидат медицинских наук
ФГАОУ ВО КФУ им. В. И. Вернадского МА им. С. И. Георгиевского, Симферополь
Выбор метода реваскуляризации у пациентов с многососудистым поражением на основе данных доказательной медицины (обзор литературы)/ Т. В. Огир, Е. П. Смуглов
Для цитирования: Лечащий врач № 3/2019; Номера страниц в выпуске: 76-79
Теги: сердечно-сосудистые заболевания, осложнения, качество жизни.
- Артериальной гипертензии в анамнезе что это
- Артериальные кровотечения являются менее опасными чем венозные кровотечения

.gif)