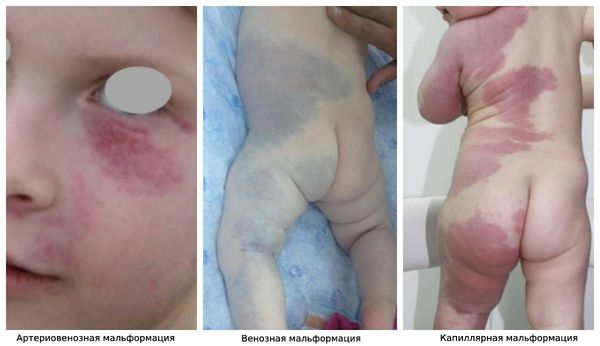
Артериовенозная мальформация печени что это
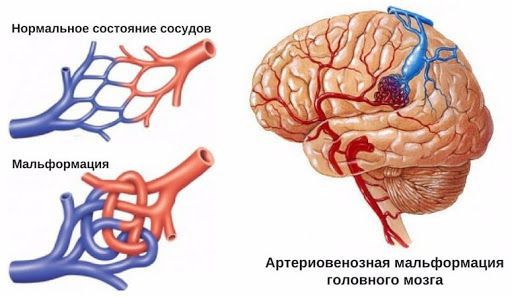
Артериовенозная мальформация
Клинические проявления и последствия артериовенозных мальформаций
Носителями артериовенозной мальформации является около 0,2% населения. Так же, как и при аневризме артериовенозная мальформация может разрываться и приводить к кровоизлиянию в головной мозг (50% всех клинических проявлений). Течение заболевания при этом менее агрессивное, нежели при аневризмах. На втором месте по проявлениям этого заболевания является эпилепсия. Менее встречаемые проявления артериовенозных мальформаций — это псевдотуморозное течение (наподобие опухоли), ишемические нарушения (за счет синдрома обкрадывания), иногда шум (при дуральных артериовенозных мальформациях или фистулах).
Лечение артериовенозных мальформаций
Артериовенозные мальформации можно лечить тремя способами: хирургическое иссечение, эндоваскулярная окклюзия клеевыми композициями, радиохирургическое лечение. Для всех трех способов существуют свои показания. Самым надежным и однозначно радикальным способом является хирургический. Остальные способы практически всегда не являются достаточными для полного выключения из кровотока артериовенозной мальформации и только лишь их комбинация способна приблизить лечение к радикальному результату.
Нейрохирурги
Запишитесь на консультацию нейрохирурга, занимающегося хирургическим лечением артериовенозной мальформации.
Артерио-венозные мальформации
Происхождение сосудистых мальформаций
Артериовенозные соустья часто бывают множественными, имеют разнообразный калибр и форму. В зависимости от диаметра различают макрофистулы, заметные невооруженным глазом, и микрофистулы, которые выявляются только при микроскопическом исследовании тканей конечности.
Окончательно причины развития синдрома Паркса-Вебера-Рубашова не установлены. Ряд авторов рассматривают его как результат мутаций в гене RASA1, который кодирует белок p120-RasGAP, участвующий в передаче химических сигналов из внеклеточного пространства к ядру клетки. Вместе с тем, каким именно образом эти изменения приводят к специфическим сосудистым аномалиям у лиц с синдромом Паркса Вебера-Рубашова, не установлено.
Патологические соустья чаще располагаются в зоне бедренной, ветвей подколенной артерии, а также по ходу большеберцовых артерий. Интенсивный сброс артериальной крови через артерио-венозные свищи ведет к повышению давления крови в венах.
Из-за повышенной функциональной нагрузки изменяется гистологическая структура венозной стенки. Происходит утолщение ее мышечной оболочки и формирование внутренней эластической мембраны («артериализация» вены).
Значительная часть артериальной крови при наличии свищей поступает в венозное русло, минуя капиллярную сеть, поэтому возникает тяжелое кислородное голодание в тканях и нарушаются обменные процессы. Из-за венозной гипертензии усиливается нагрузка на сердце, что постепенно приводит к расширению его границ и сердечной декомпенсации.
Основные симптомы
Преимущества лечения в клинике
Диагностика

Клиническая симптоматика обусловлена нарушениями регионарного кровообращения и центральной гемодинамики. Конечность удлинена на 3-8 см, мягкие ткани ее гипертрофированы. Удлинение конечности обусловлено продуктивной перестройкой костной ткани из-за усиленной васкуляризации эпифизарных линий.
Характерно наличие варикозно расширенных поверхностных вен на нижней или верхней конечности. Их появление связано с высокой венозной гипертензией вследствие заброса крови из артерии. Стенки вен плотноэластической консистенции, с трудом сжимаемые. Расширенные вены не исчезают после придания конечности возвышенного положения. Иногда при осмотре над ними определяется пульсация.
Рука, приложенная к месту проекции артериовенозного соустья, ощущает вибрацию (симптом «кошачьего мурлыкания»). При аускультации в этой области выслушивают непрерывный систоло-диастолический шум, усиливающийся в момент систолы.
Нарушения микроциркуляции, связанные с регионарными гемодинамическими расстройствами, в ряде случаев приводят к образованию язв и некрозов дистальных отделов конечностей. Из язв часто возникают повторные обильные кровотечения, приводящие к тяжелой анемии. Нередко бывает гипертрихоз и гипергидроз.
Ряд клинических симптомов связан с изменениями центральной гемодинамики. При значительной венозной гипертензии увеличивается нагрузка на правые отделы сердца, следствием ее являются гипертрофия сердечной мышцы, увеличение ударного и минутного объема сердца Однако по мере прогрессирования заболевания сократительная функция сердца начинает ослабевать, происходит миогенная дилатация сердца с расширением его полостей Развивается сердечная недостаточность, проявляющаяся одышкой, сердцебиениями, отеками, застойной печенью, асцитом, анасаркой. Для врожденных артериовенозных свищей характерно урежение пульса, наступающее после пережатия приводящей артерии.
Реографическая кривая, записанная с сегмента конечности, где расположены артериовенозные соустья, характеризуется высокой амплитудой, отсутствием дополнительных зубцов на катакроте, увеличением реографического индекса. В дистальных сегментах конечности амплитуда кривой, напротив, снижена. Артериализация венозной крови ведет к увеличению насыщения ее кислородом, содержание которого в расширенных венах увеличивается на 20-30%.
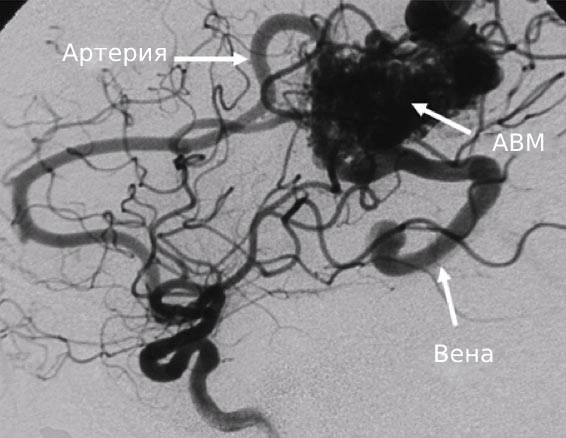
Наиболее важным методом диагностики врожденных артериовенозных свищей является ангиография. Различают прямые и косвенные ангиографические признаки артериовенозных свищей Наличие на ангиограммах контрастированного соустья или сосудистой полости, сообщающейся с артерией и веной, относят к прямым признакам. Косвенно о наличии свища свидетельствуют одновременное контрастирование артерий и вен, расширение просвета приводящей артерии, обеднение сосудистого рисунка дистальнее расположения артериовенозного свища.
Что такое артериовенозная мальформация? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кулагина С. С., сосудистого хирурга со стажем в 9 лет.
Определение болезни. Причины заболевания
Артериовенозная мальформация (АВМ) — сосудистая патология, при которой вены и артерии небольшого диаметра, переплетаясь друг с другом, образуют «сосудистый клубок». Заболевание возникает из-за неправильного развития артерий и вен, также причиной может стать травма.
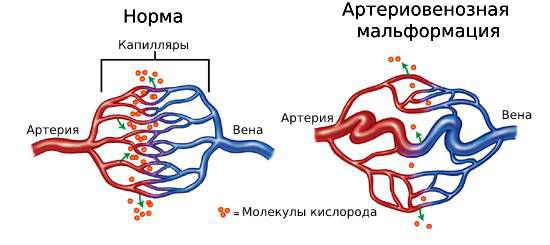
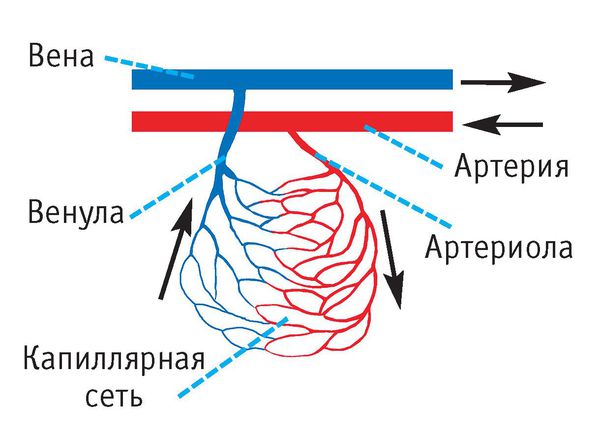
АВМ состоят из трёх компонентов: питающие артерии, очаг (нидус, или гнездо) и дренажные вены. Особенность этого сосудистого образования в том, что в нём нет капилляров, которые в норме соединяют артерии и вены. В капиллярах кровь течёт медленнее, чем в более широких сосудах, кроме этого, у капилляров тонкие стенки. Благодаря этим особенностям в капиллярной сети возможен обмен кислорода и питательных веществ между кровью и тканями организма. При АВМ капилляры отсутствуют, кровь из артерий напрямую попадает в вены, из-за большой скорости кровотока не происходит обмена веществ, то есть ткани не получают из крови достаточно питательных веществ и кислорода.
Синонимы: артериовенозная дисплазия, артериовенозный шунт.
Симптомы артериовенозной мальформации
Симптоматика заболевания многообразна и зависит от локализации АВМ. Возможно как бессимптомное протекание заболевания, так и тяжёлые поражения с проявлениями сердечной недостаточности.
Симптомы при АВД могут включать:
Проявления болезни и дальнейшее её течение зависят от места расположения АВМ и от того, какие мягкие ткани (или органы) затронуты поражением. На ранних стадиях, как правило, можно заметить лишь перегревание кожных покровов поражённой области, однако со временем поражаются мягкие ткани и костные структуры.
Пациент может самостоятельно заметить АВМ, она проявляется пульсацией в зоне, где её не должно быть, чаще в мягких тканях. Также возможен выраженный отёк конечности. Спустя некоторое время отмечается увеличение диаметра артерий и вен с быстрым увеличением окружающих тканей (гипертрофия).
Кровотечение в области АВМ может быть симптомом латентной (скрытой) АВМ. Это возможно при появлении мальформации в центральной нервной системе или при поражениях, которые ведут к язвам кожи или слизистых.
При поражении конечностей возможна гипертрофия мягких тканей и костных структур. Гипертрофия мягких тканей затрагивает чаще всего мышцы и подкожно-жировую клетчатку. АВМ с поражением костей могут вызывать боль, но чаще наблюдается избыточный рост костей, связанный со стимуляцией зоны роста в детском возрасте. Э то приводит к разнице в длине ног и нарушению походки из-за резкого перекоса таза.
Симптомы АВМ на коже
Симптомы АВМ спинного и головного мозга
Из-за постоянного повышенного давления вена может разорваться. Проявления АВМ спинного и головного мозга могут отличаться в зависимости от того, есть разрыв мальформации или нет.
При отсутствии разрыва мальформации спинальные сосудистые АВМ могут вызвать нарушение движений в руках и ногах. Также АВМ могут имитировать такие заболевания, как опухоли спинного мозга, радикулопатию (например, как при сдавлении корешка спинного мозга грыжей диска), рассеянный склероз, воспаление паутинной оболочки спинного мозга. Клинические проявления в каждом конкретном случае будут зависеть от уровня расположения АВМ в спинном мозге.
При разрыве мальформации клиника появляется остро, так как кровь попадет в спинномозговой канал:
При АВМ головного мозга без её разрыва может беспокоить головная боль, нарушения зрения, головокружение, судороги и потеря сознания. Встречается и бессимптомное течение. При разрыве АВМ головного мозга развивается кровоизлияние в головной мозг (геморрагический инсульт).
Симптомы АВМ у детей
У новорождённых детей из-за увеличения количества крови в полостях сердца увеличиваются вены в головном мозге, крупные артерии плечевого пояса, внутренних органов, живота, мышц таза, ягодичных мышц.
При наличии АВМ в лёгких у новорождённых могут наблюдаться самостоятельное закрытие увеличенных сосудов, что приводит к развитию нарушения мозгового кровообращения. Наличие АВМ в головном мозге могут вызвать инсульт с образованием жидкой части крови в веществе головного мозга.
Патогенез артериовенозной мальформации
Патогенез АВМ до конца не изучен. Как уже было отмечено, врождённые АВМ могут быть связаны с генетическими мутациями. Если у пациента диагностирована наследственная геморрагическая телеангиэктазия, то причиной АВМ я вляется мутация генов, которые участвуют в регуляции стабильности сосудов и предотвращают патологическое развитие артерий и вен: ген эндоглин, ACVRL1 и SMAD4. Если они теряют функции, при закладке сосудов изменяется прямой сброс артериальной крови в вены, вследствие чего на каком-либо участке ткани не развивается капиллярная сеть. Межвенозная ткань при этом увеличивается в диаметре и, оплетая артерии, образует «сосудистый клубок».
В ответ на нарушение скорости артериального и венозного кровотока в самом «сосудистом клубке» в зависимости от локализации и объёма патологического сброса из артериальной системы в венозную, можно заметить различные компенсаторные изменения.
Период стабильный (компенсация)
Чтобы поддерживать нормальный кровоток в артериях, увеличивается сердечный выброс — объём крови, который сердце перекачивает в единицу времени. Благодаря этому недостаток кровоснабжения в периферических тканях не проявляется. Однако из-за повышенного сердечного выброса переполняется венозная система, как следствие, увеличивается объём циркулирующей крови.
Сначала переполнение венозной системы компенсируется лимфатической системой, так как они тесно связаны между собой. В результате этого в области АВМ возникает отёк ткани. Однако возможности лимфатической системы ограничены.
Период нарушения (декомпенсации)
Классификация и стадии развития артериовенозной мальформации
В России используют классификацию ангиодисплазий В. Н. Дана (1989), в которой выделяют артериальную форму, венозную форму с поражением глубоких, поверхностных и органных вен, артериовенозную форму и лимфоангиоматоз. Артериовенозную форму разделяют на несколько типов:
Субклассификация основана на эмбриологической стадии и объёме поражения:
Классификация ISSVA выделяет высокоскоростные и низкоскоростные сосудистые мальформации:
Высокоскоростные (преобладает артериальный кровоток с высокой скоростью):
Как видно из классификации, АВМ — высокоскоростная мальформация.
Классификация артериовенозных мальформаций Schöbinger:
Осложнения артериовенозной мальформации
Артериовенозные мальформации могут привести к различным осложнениям:
Диагностика артериовенозной мальформации
Диагноз «артериальная мальформация» устанавливается на основании клинического (осмотр, анамнез, физикальные методы) и лучевого (УЗИ и МРТ) методов исследований.
Клинические методы исследований
Инструментальная диагностика
Ультразвуковые методы исследования — первичный способ диагностики.
Магнитно-резонансная томография (МРТ) и компьютерная томография (КТ) дают чёткое представление и основные сведения о длине патологически изменённых сосудов, отношении сосудов с окружающими их тканями, органами, структурами.
Дифференциальная диагностика
Дифференциальная диагностика проводится со следующими патологиями:
Лечение артериовенозной мальформации
Вне зависимости от типа АВМ, это наиболее опасные изменения среди всех сосудистых патологий, так как поражают практически всю сосудистую систему и имеют тяжёлые гемодинамические осложнения.
Главная цель лечения АВМ — закрытие или полное удаление «главного очага» патологического изменения.
Хирургическое лечение
Единственным хирургическим методом лечения АВМ является перевязка питающего сосуда и удаление по площади самой мальформации с участком ткани, в котором она располагается.
Малоинвазивное лечение
Медикаментозное лечение
Прогноз. Профилактика
Прогноз при АВМ зависит от времени постановки диагноза, локализации и правильности лечения. Если АВМ начинает развиваться в детском возрасте, то заболевание протекает намного тяжелее, чем при появлении в возрасте 40-50 лет. Это связано с тем, что в детском возрасте артерии и вены развиты не полностью, что приводит к частым повторам заболевания. Также у детей АВМ больше по площади, что при лечении может приводить к грубым рубцовым деформациям и частым кровотечениям.
Так как этиология и патогенез развития заболевания до настоящего времени до конца не изучены, специфической профилактики данной патологии не существует.
Методические рекомендации
Российское общество ангиологов и сосудистых хирургов
Ассоциация сердечнососудистых хирургов России
Российское научное общество рентгенэндоваскулярных
хирургов и интервенционных радиологов
Всероссийское научное общество кардиологов
Ассоциация флебологов России
Современные концепции лечения
артериовенозных ангиодисплазий (мальформаций)
Председатель Профильной комисии по сердечно-сосудистой хирургии Экспертного совета Минздрава РФ: академик РАН и РАН Л.А. Бокерия академик РАН и РАН Л.А. Бокерия
Экспертная группа по подготовке рекомендаций
Председатель экспертной группы: академик РАН А.В. Покровский академик РАН А.В. Покровский
Ответственный секретарь: проф. проф. Дан В.Н. (Москва)
Ответственный исполнитель: д.м.н. д.м.н. Сапелкин С.В. (Москва) (Москва)
Члены экспертной группы: проф. Аракелян В.С. (Москва), проф. Богачев В.Ю. (Москва), проф. Бубнова Н.А. (Санкт-Петербург), проф. Дан В.Н. (Москва), проф. Кармазановский Г.Г. (Москва), проф. Карпенко А.А. (Новосибирск), проф. Кательницкий И.И. (Ростов-на-Дону), член-корр. РАН Коков Л.С. (Москва), проф. Купатадзе Д.Д. (Санкт-Петербург), д.м.н Малинин А.А. (Москва), Акад. РАН Покровский А.В. (Москва), проф. Поляев Ю.А. (Москва), к.м.н. Прядко С.И. (Москва), д.м.н. Сапелкин С.В. (Москва), проф. Тимина И.Е. (Москва), проф. Фокин А.А. (Челябинск), к.м.н. Цыганков В.Н. (Москва), проф. Шаробаро В.И. (Москва), проф. Шафранов В.В. (Москва)
Дан В.Н. – Главный научный сотрудник отделения сосудистой хирургии ФГБУ «Институт хирургии им. А.В.Вишневского» МЗ РФ, профессор.
Аракелян В.С. – Руководитель отдела сосудистой хирургии и ангиологии НЦССХ им. А.Н. Бакулева, профессор.
Богачев В.Ю. – Заведующий отделом ангиологии и сосудистой хирургии ГБОУ ВПО РНИМУ РНИМУ им. Н.И. Пирогова МЗ РФ, профессор.
Бубнова Н.А. – Профессор кафедры общей хирургии Первого Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова
Кармазановский Г.Г. – Заведующий отделом лучевой диагностики, заведующий отделением рентгенологии и магнитно-резонансных исследований ФГБУ «Институт хирургии им. А.В.Вишневского» МЗ РФ, профессор.
Карпенко А.А. – Руководитель центра сосудистой и гибридной хирургии Новосибирского НИИ патологии кровообращения им. акад. Е.Н.Мешалкина, профессор.
Кательницкий И.И. – Заведующий кафедрой хирургических болезней №1 РГМУ, профессор.
Коков Л.С. – Руководитель отделения рентгенохирургических методов диагностики и лечения НИИ cкорой помощи им. Н.В.Склифосовского, Заведующий кафедрой лучевой диагностики ИПО ФГБУ ВПО «Первый МГМУ им. И.М.Сеченова» МЗ РФ, член-корр. РАН.
Купатадзе Д.Д. – Профессор кафедры хирургических болезней детского возраста Санкт-Петербургского государственного педиатрического медицинского университета.
Малинин А.А. – Ведущий научный сотрудник отделения венозной патологии и микрососудистой хирургии НЦССХ им. А.Н.Бакулева, д.м.н.
Покровский А.В. – Заведующий отделением сосудистой хирургии ФГБУ «Институт хирургии им. А.В.Вишневского» МЗ РФ, акад. РАН
Поляев Ю.А. – Заведующий отделением рентгенохирургических методов диагностики и лечения ФГБУ «Республиканская детская клиническая больница» МЗ РФ, профессор.
Прядко С.И. – Руководитель отделения венозной патологии и микрососудистой хирургии НЦССХ им. А.Н.Бакулева, к.м.н.
Сапелкин С.В. – Ведущий научный сотрудник отделения хирургии сосудов ФГБУ «Институт хирургии им. А.В.Вишневского» МЗ РФ, д.м.н.
Тимина И.Е. – Руководитель отделения ультразвуковой диагностики ФГБУ Институт хирургии им. А.В.Вишневского МЗ РФ, профессор кафедры лучевой диагностики ИПО ФГБУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава РФ
Фокин А.А. – Заведующий кафедрой хирургии ФДО Южно-Уральского государственного медицинского университета, профессор
Цыганков В.Н. – Руководитель отделения рентгенохирургических методов диагностики и лечения ФГБУ «Институт хирургии им. А.В.Вишневского» МЗ РФ, доцент кафедры лучевой диагностики ИПО ФГБУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава РФ, к.м.н
Шаробаро В.И. – Заведующий отделением реконструктивной и пластической хирургии ФГБУ «Институт хирургии им.А.В.Вишневского» МЗ РФ, профессор.
Шафранов В.В. – Профессор кафедры детской хирургии ГБОУ ВПО РНИМУ РНИМУ им. Н.И. Пирогова МЗ РФ.
Данные клинические рекомендации, предназначенные для специалистов и профессионалов в области обследования и лечения артериовенозных ангиодисплазий (АВД), базируются на принципах доказательной медицины, современных литературных данных и мнении специалистов, имеющих многолетний опыт работы в этом направлении. Согласительный документ отличается широтой изложения и включает в себя как уже доказанные утверждения, так и данные о перспективных направлениях.
За последнее десятилетие мы стали свидетелями быстрого прогрессивного развития как диагностических, так и малоинвазивных эндоваскулярных лечебных методик в этой области. Значительно улучшились визуализационные возможности радионуклидной сцинтиграфии, ультразвука, компьютерной томографии (КТ), компьютерно-томографической ангиографии (КТА) и магнитно-резонансных методов исследования. Достигнутый прогресс в эндоваскулярной терапии дал возможность оказывать высокотехнологичную помощь пациентам с сосудистыми заболеваниями (в том числе и с сосудистыми аномалиями) при различной анатомической локализации.
Несмотря на достаточную редкость АВД вариабельность патологических процессов при этом весьма разнообразна. Осведомленность практических врачей на местах ограничивается достаточно часто постановкой диагноза ангиодисплазии и знанием крупных центров, куда можно направить пациента для оказания квалифицированной помощи. Никоим образом, не стремясь изменить сложившуюся в медицине систему, нам кажется, что основная задача этого документа донести до практической хирургии тот огромный опыт, накопленный ведущими российскими специалистами по этой проблеме. Последние годы показывают быстрое развитие эволюции тактических взглядов с учетом открывающихся новых возможностей научно-технического прогресса.
Лечение таких пациентов в настоящее время целесообразно проводить в специализированных центрах, где есть возможность регулярного наблюдения и лечения командой высококвалифицированных врачей. При таком подходе врачи разных специальностей – эндоваскулярные хирурги, сосудистые и пластические хирурги, ангиологи, педиатры, анестезиологи – работая совместно, обеспечивают воплощение в практику концепции мультидисциплинарного подхода. При этом каждый специалист вносит свой вклад в общее дело. Лечение пациентов на регулярной основе позволяет повышать уровень оказания медицинской помощи, оптимизируя лечебную тактику.
Нельзя не подчеркнуть, что ангиодисплазии представляют собой одну из наиболее сложных проблем в хирургической практике. Скоропалительная лечебная тактика в этой ситуации может вести к серьезным осложнениям и неблагоприятным исходам. Наш практический опыт доказывает, что многих тактических ошибок, предпринятых на первоначальном этапе лечения, можно было бы избежать при соблюдении врачами определенных четко обозначенных рекомендаций.
Эксперты понимают, что часть рекомендаций могут быть не совсем применимы в практике определенных учреждений в силу ограниченного доступа к высокотехнологичным методам лечения. Поэтому экспертный совет объединил наиболее важные положения в этой области с целью формулировки наиболее современных и тщательных положений, базирующихся на доступных научных знаниях.
Артериовенозные дисплазии (АВД) (= артериовенозные мальформации, АВМ) являются одним из вариантов врожденных сосудистых пороков, развивающихся в результате дефекта развития артериальной и венозной системы в процессе онтогенезе с формированием прямых сообщений между сосудами различного диаметра или сетчатой структуры из мельчайших капилляров (ангиоматозные ткани, «центральный очаг мальформации» или англ. «nidus»). Данное поражение характеризуется шунтированием крови с высокими скоростными характеристиками из артериального в венозный отдел сосудистой системы через фистулы различного калибра, отличается большим разнообразием клинических проявлений и сопровождается в ряде случаев тяжелым нарушением кровообращения в той или иной области.
В последние годы среди сосудистых хирургов заметно возрос интерес к данной патологии, что обусловлено как большим желанием понять и объяснить патогенетические процессы на более тонком уровне, так и желанием максимально использовать возможности современной медицины для разработки стратегии диагностики и лечебной тактики. Длительное время эта патология рассматривалась как казуистическое заболевание, а среди врачей существовал не совсем обоснованный пессимизм по отношению как к консервативному, так и хирургическому лечению. И лишь в последние годы на фоне общего прогресса в ангиологии и ангиохирургии были достигнуты и значимые результаты в изучении проблемы пороков развития сосудов и лечении этой тяжелой категории пациентов.
Вне зависимости от наличия или отсутствия ангиоматозных тканей все АВД характеризуются высокоскоростным потоком через микро- или макрофистулы между артериями и венами. С учетом имеющегося артериовенозного шунтирования клиническая симптоматика при АВД отличается чрезвычайной вариабельностью с непредсказуемым клиническим исходом с осложненным анатомическим, патофизиологическим и гемодинамическим статусом. Гемодинамические изменения отмечаются как в центральном так и периферическом отделах, затрагивая при этом артериальную, венозную и лимфатическую систему. Такие изменения дают основание называть АВД комплексным типом врожденных мальформаций с наиболее значимым поражением артериальных и венозных сосудов. Это может вести к появлению целого ряда осложнений: сердечная недостаточность, артериальная недостаточность (критическая ишемия, гангрена), хроническая венозная недостаточность в дистальных отделах с сопутствующей ей лимфатической гипертензией. Эти изменения являются причиной повреждения окружающих тканей и органов при наличии определенной клинической симптоматики и сопровождаются высокой частотой рецидивов после проведенного лечения.
Терминология, используемая в общемедицинской литературе, является неспецифичной и часто запутанной. Термин «АВД» неспециалистами часто использовался для обозначения всей группы врожденных сосудистых мальформаций. Но это, конечно же, не соответствует действительности. Очень часто АВД смешивают с гемангиомами, которые некоторые авторы могут включать в группу «сосудистые мальформации», но с учетом имеющегося опухолевого компонента их лучше всего описывать с использованием классификации ISSVA. Гемангиомы и другие сосудистые опухоли имеют ярко выраженную клиническую картину, этиология, гистологию и патофизиологию и поэтому не совсем правильно объединять их вместе с врожденными сосудистыми мальформациями. Классификация ISSVA наиболее распространена в детской хирургии.
Артериовенозные фистулы и артериовенозные дисплазии
Все АВД являются «фистулезными» поражениями вне зависимости от того, имеется ли «центральный очаг мальформации» или нет. Вследствие применения классификации ISSVA (очень популярной в детской хирургии), где АВД были разделены на «артериовенозные фистулы» (АВФ) и «артериовенозные мальформации» (АВМ), многие стали ошибочно использовать термин АВД по отношению к тем типам поражениям, где шунтирование определялось лишь на уровне капилляров.
Придерживаясь этой концепции, многие специалисты интерпретировали термин «фистулезные» как прямые сообщения (коммуникации) без наличия центрального очага сброса, тогда как термин «нефистулезные» применялся по отношению к поражениям с четко определяемым таким очагом. Однако невозможно себе представить свободное шунтирование крови для формирования высокоскоростных мальформаций, соответственно можно утверждать, что АВД без фистулезных сообщений между артериями и венами НЕ существует.
Принимая во внимание эмбриологическую сущность АВД вследствие нарушения различных стадий эмбриогенеза, можно утверждать, такого понятия, как «нефистулезная форма АВМ», нет. Все АВД по своей натуре являются «фистулезными».
Термин «артериовенозная фистула» по классификации ISSVA является эквивалентом «трункулярной» формы АВД без наличия «центрального очага». Примером подобного поражения является Боталлов проток или легочные АВД в соответствие с Гамбургской классификацией. Термин АВМ в классификации ISSVA эквивалентен экстратрункулярной форме артериовенозной мальформации с наличием «центрального очага» (по Гамбургской классификацией).
Артериовенозные дисплазиии с наличием или отсутствием «центрального очага»
Термин «nidus» (центральный очаг мальформации) был предложен радиологами для описания большого количества (пучка) мелких артериовенозных соустий/шунтов, заполняющихся контрастом при артериографии или других методах визуализации. Он не является гистологическим термином. Естественно «центральный очаг» не является анатомическим/патофизиологическим образованием, это описательное обозначение конгломерата сосудов, формирующих АВД.
«Центральный очаг» всегда представлен при экстратрункулярных поражениях и только нестволовые формы АВД могут иметь такое образование, представляющее собой сеть диспаластических пульсирующих извитых сосудов между артериями и венами. При артериовенозном поражении он поддерживается диффузными множественными мелкими фистулами в отличие от трункулярной формы, где имеются крупные единичные артериовенозные свищи.
С другой стороны, трункулярные формы АВД наряду с прямыми сообщениями между артериями и венами могут иметь «центральный очаг» на артериограмме. Более подробное описание будет приведено в разделе, посвященном классификации экстратрункулярных форм АВД.
Старые нозологические и терминологические описания врожденных сосудистых пороков не давали четкой дифференциации об анатомическом, патофизиологическом или клиническом представлении различных форм ангиодисплазий (например, синдром Клиппель-Треноне, Паркс-Вебера). Для клиницистов, в первую очередь, требуется классификация с возможностью постановки точного диагноза, что должно в конечном итоге определять и лечебную стратегию.
Malan E. и Puglionisi A. (1964) впервые предложили классификацию, дав разделение между артериальными, венозными и комбинированными ангиодисплазиями. Это впоследствии стало базисом для создания двух наиболее известных и используемых зарубежных классификаций: Гамбургской и ISSVA. Эти схемы описывают морфологические различия между поражениями с задействованными крупными сосудами, часто с наличием прямых артериовенозных соустий (трункулярная форма) и вариантами, представленными на периферии сосудистого русла, по отношению к которым первоначально применялся термин «артериовенозные ангиомы».
Для того чтобы избежать путаницы с термином «ангиома» (или «гемангиома») Belov St. во время Гамбургского консенсусного совещания в 1988 г. для обозначения АВД с наличием ангиоматоза в отличие от трункулярных дефектов повторно ввел в практику уже знакомый эмбриологический термин «экстратрункулярный» (термин впервые использован еще в работах Sabin F.R. в 1917 г.).
Введение термина «экстратрункулярный» решило проблему с не совсем правильным использованием в клинике ангиодисплазий таких терминов как «ангиома» и «гемангиома». Соответственно в нашей клинической практике эти термины не применяются.
Первопричина морфологических различий между двумя группами мальформаций (трункулярные и экстратрункулярные) объясняется эмбриологическими механизмами нарушения в формировании сосудистой системы во время различных стадий эмбриогенеза. Данные «поломки» могут произойти как на ранних стадиях, где присутствуют примитивные сосудистые структуры (стадия ретикулярной сети), так и на более поздних сроках, где они превращаются в образования стволового типа.
Экстратрункулярные формы имеют высокий потенциал прогрессирования/рецидивирования в отличие от трункулярных поражений, для которых это не характерно. В соответствие с эмбриологической концепцией прогрессирование АВД связано с типом эндотелиальных клеток, представляющих собой остатки примитивной капиллярной сети, сохраняющей способность к пролиферации с часто непредсказуемым биологическим поведением.
Новый термин, ставший основой модифицированной Гамбургской классификации, базируется на эмбриологической характеристике врожденных пороков развития сосудов (Табл. 1).
Модифицированная Гамбургская классификация сосудистых мальформаций
Основная классификация, базирующая на доминирующем сосудистом компоненте:
Субклассификация, базирующаяся на эмбриологической стадии и объеме поражения:
Mulliken J.B. в своих работах впервые предложил выделить гемангиомы из раздела «сосудистые мальформации». Гемангиомы – это истинные сосудистые опухоли часто с доброкачественным течением и имеющие четкие отличия от ангиодисплазий. Он также предложил новую классификацию врожденных сосудистых мальформаций, созвучную с Гамбургским консенсуссом с подразделением поражений по типу кровотока: низко- и высокоскоростные поражения в классификации ISSVA (Табл. 2).
Эти две классификационные системы, базирующиеся на Гамбургском консенсусе, заменили старую эпонимическую систему описания ангиодисплазий, дав толчок для последующего создания лечебных стратегий при мальформациях. Для этих целей впоследствии были предложены и специальные рабочие схемы: классификация Schöbinger и артериографическая. Классификация Schöbinger описывает АВМ как различные стадии процесса, концентрируясь на клиническом статусе пациента с приведением практических рекомендаций по выбору наиболее удачного времени для проведения лечения.
Классификация артериовенозных мальформаций Schöbinger
| Стадия I – | Покой. Покраснение кожи, гипертермия, артериовенозное шунтирование при допплеровском исследовании. АВМ может скрываться под маской капиллярной мальформации или гемангиомы в стадии регресса. |
| Стадия II – | Экспансия. Стадия I + увеличение в размерах сосудов, дрожание, усиление пульсации, расширение и извитость вен. |
| Стадия III – | Деструкция. Стадия II + трофические нарушения, язвы, кровотечения. Возможен лизис костной ткани. |
| Стадия IV – | Декомпенсация. Стадия III + проявления сердечной недостаточности с увеличенным сердечным выбросом и гипертрофией левого желудочка. |
Артериографическая классификация АВД была предложена для классификации экстратрункулярных АВД, локализующихся на туловище и конечностях, базируясь на артериографическом понятии «центральный очаг» (Рис. 1). Поражения разделены на три типа: тип I (артериовенозные фистулы), тип II (артериоловенозные фистулы) и тип III (артериоловенулярные фистулы).
Рис. 1. Артериографическая классификация ангиодисплазий.
Все три типа поражения имеют радиологическое отображение «центрального очага мальформации», представляющее из себя примитивную ретикулярную сеть мелких диспластических сосудов, которые не достигают зрелости капилляров. Артериографическая классификация, будучи созвучной с эмбриологической, дает нам данные для выбора лечебной стратегии экстратрункулярных АВД.
Она полезна и в оценке результатов эндоваскулярного лечения. Частота полной окклюзии или облитерации выше при артериовенозных и артериоловенозных поражениях и ниже при артериоловенулярных мальформациях.
Обычно, артериоловенулярные мальформации требуют при проведении лечения прямого доступа к «центральному очагу» через прямую пункцию, тогда как при двух других типах поражения может быть использован трансартериальный или трансвенозный доступ.
В дополнении к Гамбургской классификации Дан В.Н. в своей классификации (1989) предлагает дополнительно при АВД форме на основании данных клинического и ангиографического исследования выделять микро- и макрофистулезную форму, а также дополнительно указывать в диагнозе факт наличие ангиоматоза. Это имеет важнейшее значение для принятия конкретных практических решений.
Большинство современных доступных данных о частоте встречаемости АВД посвящены поражениям с цереброспинальной локализацией. Данные формы встречаются редко и обычно не диагностируются до проявления клинических симптомов, что обычно случается в возрасте 20–40 лет. В США примерно 250 тыс. чел. имеют АВД, при этом заболевание у женщин встречается в два раза чаще.
Тем не менее, распространенность периферических АВД, являющихся наименее распространенным типом ангиодисплазий, составляет от 5–10% до 15–20%. Большинство же ангиодисплазий представляют собой венозные или лимфатические формы.
В структуре АВД преобладают экстратрункулярные формы с формированием ангиоматозных тканей. Трункулярные (стволовые) формы распространены значительно реже и бывают представлены, как правило, прямыми артериовенозными сообщениями между сосудами таза, а также между бедренными сосудами. Они представляют собой исключительно фистулезные поражения без наличия «центрального очага», имея определенное сходство с открытым артериальным протоком или артериовенозными легочными фистулами.
Кроме вышеописанных половых различий, других особенностей (расовых, демографических, связанных с условиями среды) по отношению к АВД не приводится.
ЭТИОЛОГИЯ, МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ
В настоящее время достигнут определенный прогресс в генетическом изучении ряда ангиодисплазий, по отношению к которым доказано наличие определенных генных мутаций.
Эти исследования еще не закончены, но они дают лучшее понимание патологических процессов, ведущих к появлению дефектов сосудистой системы с наличием артериовенозного шунтирования и высокоскоростного кровотока в тканях. Существует определенная надежда, что дополнительно полученные данные в будущем дадут возможность построить новую более логичную классификацию АВД.
Тенденция к росту экстратрункулярных АВД может быть объяснена с позиций генетических теорий, базирующихся на генных мутациях в тканях. Обнаружение подобных генов при некоторых видах дефектов может способствовать более точной постановке диагноза, но для понимания этого механизма необходимо проведение дополнительных научных исследований.
Существуют несколько передающихся по наследству генетических мутаций, имеющих предрасположенность к развитию, в т.ч. и сосудистых поражений у последующих поколений. Синдром Osler-Weber-Rendu (врожденная геморрагическая телеангиоэктазия), синдром «голубого пузырчатого невуса» (синдром Bean), мутация RASA 1, PTEN мутации имеют генетическую базу для проявляющихся впоследствии сосудистых поражений. Когда основной механизм не совсем понятен, возможно наличие нескольких мутаций, ответственных за появление АВД.
Врожденная геморрагическая телеангиоэктазия является наиболее изученным наследуемым состоянием, связанным с мутацией в генах, кодирующих активин-рецепторную киназу-1 (ACVRL1), эндоглин (ENG), тканевой фактор роста (TGF). Это аутосомно-доминантная мутация ведет к возникновению телеангиоэктазий на слизистой и кожных покровах. Помимо этого, АВД могут встречаться в мозге, легких и печени. Сосудистые поражения с течением времени прогрессируют, большинство подобных АВД диагностируется во взрослом возрасте. Несмотря на то, что ангиоархитектоника поражения весьма вариабельна, большой процент телеангиоэктатических дисплазий представляют из себя артериовенозные фистулы с имеющимся вариксом, образующимся из непосредственно дренирующих вен. Наилучшие результаты лечения у этих пациентов достигаются с применением ингибиторов ангиогенеза, например, бевацизумаб (Авастин).
RASA1 мутация вызывает другую аутосомно-доминантную патологию. Имеющие ее члены семьи могут иметь капиллярную мальформацию, круглую или овальную по форме, розовую или красную по цвету, иногда с бледным ореолом по окружности. Возможно и возникновение АВД или сочетание с вышеописанной капиллярной мальформацией. Излюбленная локализация при этом поражении – мозг, спина, лицо и конечности. Интракраниальные АВМ могут быть типичными артериовенозными (или артериоловенозными) образованиями, связанными с мягкой мозговой оболочкой. Еще одним типичным проявлением при этой мутации является наличие большого варикса, дренирующего кровь из артериовенозного соустья и включающего в себя аневризматическое расширение вены Галена.
Синдром Parkes Weber (PWS) также ассоциируется с RASA1 мутацией. У этой категории пациентов АВД обычно представляет собой диффузное мелкососудистое поражение мышц или подкожных тканей конечностей со значительным расширением дренирующих вен и относительно пропорциональным ростом окружающих тканей. Пораженные мышцы, кости и подкожно-жировая клетчатка симметрично и пропорционально увеличиваются в объеме. Отмечается увеличение сердечного выброса, регистрируются нарушения лимфатического оттока. Пациенты с синдромом Parkes Weber без дополнительных капиллярных мальформаций обычно не имеют подобной мутации. Необходимо помнить и о возможном наличии у пациентов с АВД различных опухолевых процессов, включая базальную клеточную карциному или невральные опухоли.
PTEN мутации являются ответственными за возникновение избыточного роста, например синдром Cowden или Banyan Riley Ruvalcalba. Такой термин, как PTEN гамартома, применяется к поражениям с локальным избыточным ростом, включающим в себя артериовенозные мальформации. Диагноз может быть предположительно поставлен при наличии макроцефалии, множественных бледных веснушек, ассимметричного роста с эктотипическим отложением жира. Наиболее часто встречающаяся при этом локализация АВД – мышцы конечностей по ходу позвоночника, краниальные (дуральные) поражения. Большой процент пациентов при этом имеет множественные поражения. Ангиоархитектоника характеризуется артериовенозным поражением с дилатацией расширенных вен. АВД при этом являются агрессивными, эмболизации при этом технически очень трудновыполнимы или даже невозможны.
Генетическая теория помогает объяснить морфогенез только ряда групп АВД. Без сомнения, в ближайшем будущем будут найдены новые данные по пониманию механизмов генетических мутаций.
ПАТОФИЗИОЛОГИЯ И КЛИНИЧЕСКАЯ КАРТИНА
Частота обновления патологических эндотелиальных клеток при АВД сравнима с подобными процессами при других сосудистых мальформациях с нормальным клеточным циклом.
Различия в экспрессии различных структурных протеинов и ангиогенных факторов можно отметить при различных сосудистых аномалиях.
Mulliken J.B. и Clowacki J. разделяли сосудистые мальформации в детской практике, основываясь на клеточных характеристиках, в частности за основу был принят такой показатель, как частота обновления эндотелиальных клеток (ЧОЭК, англ. термин ECTR). Они выделяли гемангиомы, характеризующиеся гиперактивностью эндотелиальных клеток во время пролиферативной фазы и уменьшением их активности в дальнейшем в период инволютивной фазы. Сосудистые мальформации при этом характеризовались нормальным показателем ЧОЭК (сравнимым с ЧОЭК нормальных сосудов).
В последние 10 лет исследования в этой области с изучением роли предшественников эндотелиальных клеток дали новое видение молекулярных аспектов АВД.
Первоначально обнаружено, что ЧОЭК в случае АВД значительно выше, чем у нормальных сосудистых клеток (по сравнению с контролем средний индекс Ki-67 выше для сосудов при наличии АВД с примерно семикратным превышением числа функционирующих эндотелиальных клеток).
Дополнительно было показано, что в центре АВД имеется повышенная экспрессия стромального дериватного клеточного фактора (SDF-1), в то время как его экспрессия в нормальных сосудах отмечается крайне редко. Это доказывает, что предшественники эндотелиальных клеток могут играть определенную роль в поддержании активного сосудистого ремоделирования совместно с «центральным очагом» мальформации.
Наконец, экспрессия факторов mRNA, которые увеличивают число предшественников эндотелиальных клеток, VEGF, SDF-1α, фактор роста гепатоцитов (HGF) и гипоксия-индуцирующий фактор-1 (HIF-1) демонстрирует определенные различия в стадии II и III по классификации Schöbinger. Более высокая стадия АВМ характеризуется повышенной экспрессией предшественников эндотелиальных клеток и факторов, стимулирующих увеличение их числа, поэтому неоваскуляризация с участием этих клеток этих клеток является важным фактором, ответственным за эволюцию АВМ.
Эволюционные/клинические особенности связаны с показателями генетической экспрессии и активности предшественников эндотелиальных клеток
В то время как в ранних работах Mulliken J.B. было показано, что рост ангиодисплазий не связан с клеточной пролиферацией, более поздние данные показали, что клеточная пролиферация и регуляция матричными металлопротеиназами при этом все же присутствует, что характерно обычно для симптомных АВД. Эта новая концепция открывает путь к развитию фармакотерапевтической стратегии для лечения сосудистых мальформаций.
Эволюционные/клинические особенности между спорадическими и синдром-ассоциированными АВД
АВД без подтвержденных генетических мутаций рассматриваются как спорадические, но не исключено, что в будущем у многих из них будет доказано наличие генетических аномалий. АВД у пациентов с RASA1 мутацией протекают, как правило, относительно стабильно, хотя симптоматика напрямую связана с анатомической локализацией поражения. Например, поражение центральной нервной системы ведет за собой значимый эффект поражения с возможностью кровотечений.
При синдроме Parkes Weber наблюдается низкая скорость прогрессии АВД, если сравнивать со спорадическими поражениями конечностей у детей. Непреложным является факт, что частота ампутаций во второй или третей декаде жизни значительно чаще у пациентов со спорадическими АВД конечностей, даже если принимать во внимание, что они обычно представляют поражения малых размеров.
Аналогичные суждения можно привести при рассмотрении с висцеральными АВД у пациентов с синдром Rendu-Osler. Хотя кровотечения при этом синдроме возникают не так уж редко, необходимость выполнения резекционных вмешательств на кишечнике чрезвычайно мала. Однако необходимость хирургического доступа для контроля за кровотечением выше у пациентов со спорадическими АВД, чем в группе пациентов с подтвержденным синдромом врожденных геморрагических телеангиоэктазий.
Наиболее агрессивно ведут себя АВД при наличии PTEN мутаций. В этом случае можно наблюдать не только быстрое прогрессирование АВД после эмболизаций или резекционных вмешательств, но и появление новых локализаций поражения. Симптоматика значительно часто ассоциирует с вариабельным течением PTEN гамартомы, весьма отличной от клиники АВД той же локализации.
Гемодинамические изменения и клиническое течение
Кровоснабжение тканей в организме человека между сердцем и тканями осуществляется опосредованно через систему капилляров. В том случае, когда нарушается функционирование данной системы, мы отмечаем ответную реакцию со стороны трех основных звеньев сосудистой системы – артерий, вен и лимфатических сосудов.
Вследствие наличия патологического артериовенозного шунтирования нарушается основная функция системы капилляров – поддержание точного баланса между высоким давлением крови со стороны артерий и низким давлением в венозной системе. Венозное давление при этом повышается с уменьшением тканевой перфузии.
Однако в организме человека могут присутствовать артериовенозные соустья, не являющиеся патологическими. Такие соустья, будучи физиологическими структурами, присутствуют на кончиках пальцев, в твердой мозговой оболочке, языке.
АВД, являясь редкой, комплексной структурой, замыкает по короткому кругу поток крови между артериальной системой с высоким давлением на венозную систему с низким давлением. Данное патологическое соединение (артериовенозная мальформация/фистула) между двумя отделами с разными показателями давления вызывает компенсаторный ответ для минимизации гемодинамических нарушений.
Основные гемодинамические феномены при АВД:
В зависимости от локализации и/или степени (размеры и объем потока) свищевого сброса в артериальной и венозной системах можно наблюдать компенсаторные изменения. Их проявления напрямую связаны и с фазой процесса (компенсация или декомпенсация):
Holman Е. (1949, 1962) продемонстрировал, что помимо проксимальной питающей артерии, обеспечивающей заполнение основной сосудистой емкости при ангиодисплазии, определенный «вклад» вносит и ретроградный кровоток в дистальном сегменте артерии. Он наглядно показал, что процесс развития коллатералей значительно уменьшается в том случае, если дистальная артерия лигируется сразу за фистулой, что прекращает ретроградный кровоток в артериальном русле.
В артериях, расположенных дистально по отношению к АВД, отмечается реверсированный кровоток, а ткани ишемизируются за счет преимущественного шунтирования крови в обход капиллярного русла.
При поражении конечности наиболее выраженное развитие коллатералей отмечается при локализации патологического процесса в проксимальных отделах конечности.
Мощное развитие коллатерального кровообращения наблюдается в случае прерывания кровотока по артерии (или артериям), питающим зону АВД. Данный процесс является прогрессивным, начинаясь от зоны ангиодисплазии и затрагивая все новые и новые регионы. При лигировании афферентных артерий развитие коллатерального кровообращения замедляется.
Эти факты имеют важнейшее значение для обоснования принципов хирургического лечения АВД. При лигировании афферентных артериальных стволов, участвующих в питании зоны патологического сброса, вступают в действие гемодинамические факторы, ведущие к прогрессивному развитию выраженных коллатералей и рецидиву заболевания
Повышенная насосная функция сердца может в какой-то мере способствовать поддержанию артериального потока на прежнем уровне, несмотря на низкое периферическое сопротивление в зоне артериовенозного шунтирования.
Следовательно, ишемия периферических тканей во время периода компенсации может быть устранена. В течение этого периода наблюдается увеличение сердечного выброса с последующим переполнением венозной системы и, соответственно, увеличением объема циркулирующей крови.
Венозная система по-своему реагирует на данные изменения. Негативное влияние увеличенного сердечного выброса на венозную систему первоначально компенсируется лимфатической системой. Но последняя ограничена в своей возможности вследствие уникального лимфодинамического механизма, в основе которого лежит саморегулирующаяся перистальтика с направлением движения жидкости из зоны низкого давления (интерстиций) в зону высокого давления (лимфокапилляры).
Если компенсационные механизмы затрагивают артериальную, венозную и лимфатическую системы без грубых нарушений их деятельности, то период декомпенсации характеризуется патофизиологическими нарушениями в вышеперечисленных системах, включая и сердечный насос.
Кровенаполнение артериальной системы в отделах, расположенных дистальнее зоны шунтирования, уменьшается, вызывая тканевую ишемию. Венозная система в этих отделах также не способна осуществлять нормальную функцию. Это ведет к нарушениям функции венозных клапанов, формированию ретроградных потоков крови и протяженного рефлюкса, затрудняющему нормальный антеградный венозный кровоток с периферии. Все это в конечном итоге ведет к появлению и прогрессированию клиники хронической венозной недостаточности.
Гемодинамика АВД затрагивает каждый компонент артериовенозных коммуникаций, вызывая локальные, периферические и центральные эффекты. Поэтому точная информация о гемодинамике поражения, включающая в себя оценку абсолютно всех сосудов (артерий и вен в проксимальных, дистальных отделах, а также коллатерального кровообращения) при различных стадиях заболевания с оценкой динамических изменений будет являться абсолютно необходимой для выработки лечебной стратегии.
Четкое понимание данных вышеописанных биомеханических факторов, в особенности с позиций гемодинамики, является абсолютно необходимым для точного объяснения биомеханических механизмов при АВД вне зависимости, являются ли они врожденными или приобретенными.
Симптоматика при АВД весьма многообразна и может включать (но необязательно), болевой синдром, нейропатию, дерматологические проявления, гипертрофию кожи, изъязвления, инфекционные осложнения, кровотечения, шумовую симптоматику, нарушения центральной гемодинамики и даже в редких случаях, смертельные исходы.
У новорожденных АВД могут быть представлены в виде розовых макул или красных пятен, похожих на внешние проявления при других врожденных мальформациях. Крайне трудно использовать в этом возрасте возможности визуализационных методов диагностики для постановки диагноза АВД при поражениях небольшого объема. Хотя для образцов тканей с целью исключения диагноза могут быть использованы специальные иммуногистохимические методы окраски. При патологических очагах большего объема могут быть полезными возможности рутинного дуплексного сканирования.
Дифференциальный диагноз при таких высокоскоростных поражениях у новорожденных проводится между АВД и сосудистыми опухолями. Помимо клинической картины определенную помощь здесь могут оказать дуплексное сканирование (ДС) и магнитно-резонансная томография (МРТ). Биопсия проводится редко. Основные жалобы ребенка и его родителей при наличии АВД– боли и гипертермия пораженного сегмента.
Симптоматика и последующее течение заболевания напрямую связаны с тем, какие мягкие ткани (или органы) затронуты поражением. На ранних стадиях, как правило, отмечается лишь гипертермия кожных покровов пораженной области, тогда как со временем поражение затрагивает мягкие ткани и костные структур (гипертрофия).
АВД обычно манифестируют самостоятельно как избыточная пульсация мягких тканей с отеком окружающих структур, последующим увеличением диаметра артерий и вен и усиленным ростом пораженных тканей.
Кровотечение может быть как симптом имеющейся латентной АВД. Это характерно для мальформации центральной нервной системы или поражений, ведущим к изъязвлению кожи или слизистых. АВД центральной нервной системы могут быть представлены в виде поражений со значительным эффектом массы.
АВД с поражением конечностей могут быть представлены гипертрофией мягких тканей и костных структур. Гипертрофия мягких тканей затрагивает чаще всего мышцы и подкожно-жировую клетчатку. При венозных мальформациях мышцы редко бывают гипертрофированными.
АВДМ с поражением костей могут вызывать болевой синдром, но значительно чаще наблюдается избыточный рост костей, связанный со стимуляцией эпифиза. Такое состояние, обозначаемое как «ангио-остеогипертрофия / гипотрофия» в конечном результате ведет наряду с появлением разницы в длине конечностей и нарушению походки из-за тазового наклона. Правильное и своевременное лечение АВМ является в этом случае более логичным по профилактике костно-сосудистого синдрома, чем применение устаревшей методики по стабилизации эпифиза. Однако случаи подобных комплексных мальформаций чрезвычайно разнообразны и сложны для лечения. Избыточный рост тканей, в т.ч. костных, может продолжаться и после лечения, поэтому определенную пользу можно получить при выполнении вмешательств на эпифизе. Эти операции могут выполняться и в современной практике при сочетании с малоинвазивными эндоваскулярными процедурами.
Обширные АВД могут в конечном итоге вести к значительному нарушению функции и даже быть причиной летальных исходов. Значимые изменения, ведущие к тяжелой выраженной лимфовенозной недостаточности при наличии выраженного болевого синдрома, заставляют выполнять ампутации конечностей.
Значимое нарушение сердечного выброса может отмечаться при АВД у новорожденных с поражением вен Галена или твердой мозговой оболочки, а также в случае поражения крупных сосудов плечевого пояса, грудной клетки, живота, печени, почек, таза, ягодиц.
Парадоксальные эмболии с последующим развитием ишемического инсульта могут наблюдаться при легочных АВД (с или без наличия синдрома Rendu Osler) при диаметре фистул свыше 3 мм.
Кровотечения при АВД центральной нервной системы могут стать причиной геморрагического инсульта и смертельного исхода.
Едва различимые кожные проявления могут быть одним из ранних симптомов скрыто протекающих АВД. Эти поражения могут быть представлены бледными участками звездообразной структуры. Такие проявления вызваны шунтированием артериальной крови непосредственно в венозную систему в обход кожных сосудистых сплетений, в результате чего проявляется кожный «синдром обкрадывания». В этой ситуации питание и наполнение кожных сосудов оказывается недостаточным, и соответствующие зоны выглядят более бледными, чем окружающие ткани.
Кожные поражения при обширных АВД с поражением питающих кожу артерий имеют характер сетчатых структур. Это представлено в виде цианотичных кругов, содержащих центральное бледное пятно. Избыточное кровенаполнение кожи может быть представлено дилатированными и расширенными венами, переполненными капиллярами или микроцистными лимфатическими мальформациями.
Одним из специфических кожных проявлений при АВД является акроангиодерматит (псевдосаркома Капоши). В отличие от истинной саркомы Капоши это состояние не ассоциирует с активностью вируса герпеса HHV-8. Акроангиодерматит может быть представлен округлыми пигментными пятнами темно-фиолетового цвета, папулезными или узелковыми образованиями кожи, расположенными дистально по отношению к АВД.
В ряде случаев могут наблюдать хронические изменения, такие как лихенизация или изъязвления. Слияние подобных поражений может значительно увеличивать зоны поражения кожи и может напоминать пигментацию при хронической венозной недостаточности.
При гистологическом исследовании отмечается накопление расширенных сосудов с утончением сосочков дермы, периваскулярная лимфоцитарная инфильтрация, экстравазация эритроцитов и откладывание гемосидерина. Акроангиодерматит может возникать и вследствие других причин, включая хроническую венозную недостаточность, имеющуюся, например, при лимфовенозных мальформациях. Сочетание акроангиодерматита с АВД обозначается термином «синдром Stewart-Blufarb».
Вследствие имеющихся изменений гемодинамики АВД имеют высокую частоту прогрессирования со значительным деструктивным потенциалом. Это обусловлено имеющимися:
Трункулярные АВД характеризуются высокоскоростными потоками, низкорезистивными фистулами. Для экстратрункулярных АВД характерны высокоскоростные потоки, высокий пролиферативный потенциал, «центральный очаг» при наличии макро- или микрофистул.
Тщательный сбор анамнеза болезни и тщательно проведенное физикальное исследование (обязательно включающее пальпацию и аускультацию), при необходимости выполнение неинвазивных методов обследования позволяют дифференцировать АВД от других форм ангиодисплазий. С учетом серьезного прогноза и присущих сложностей при лечении подобных поражений в оценке каждой клинической ситуации необходимо придерживаться систематического подхода. Хотя большинство АВД представлены единичным поражением, в результате дообследования необходимо исключать и возможность сочетания с другими вариантами врожденных мальформаций.
В дополнение к исследованию артериовенозного поражения в обязательном порядке должна быть проведена и оценка других органов и структур, в первую очередь это относится к скелетно-мышечной системе. Ранняя диагностика проявлений костно-сосудистого синдрома при наличии разницы длины костей очень важна для проведения адекватного лечения.
Основные цели инструментальных методов исследований сформулированы ниже:
План обследования первоначально должен включать комбинацию основных неинвазивных или малоинвазивных методов исследования, инвазивные методики выполняются уже непосредственно перед лечебным этапом:
Ультразвуковые методы исследования
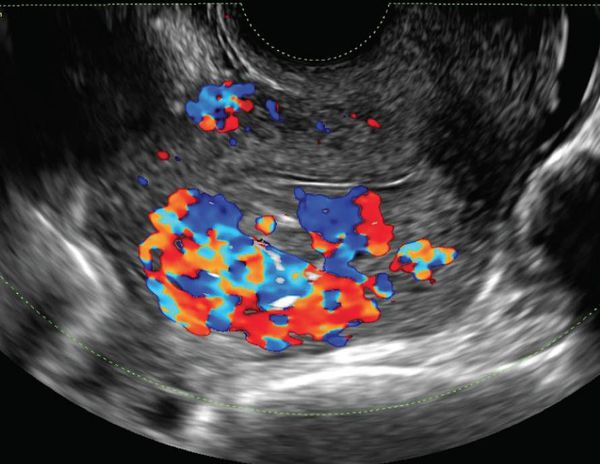
Данные методики относятся к методам первой диагностической линии. Ультразвуковая допплерография (УЗДГ) – простой доступный метод, позволяющий определить тип кровотока (высоко- или низкоскоростной), а также его отсутствие на протяжении поражения. Данный вид исследования может быть использован во время первичной консультации. При венозных мальформациях регистрируется низкоскоростной кровоток, при лимфатических он отсутствует, в то время как при АВД в ангиоматозных тканях отмечается пульсативный тип.
Основополагающим методом инструментальной диагностики на сегодняшний день является комплексное ультразвуковое исследование, включающее в себя дуплексное сканирование (ДС) сосудов, ультразвуковое исследование мягких тканей и костных структур в режиме цветового дуплексного картирования (ЦДК).
ДС является методом выбора среди всех неинвазивных методов как на этапе первоначального обследования, так и в процессе последующего динамического наблюдения. Метод позволяет дифференцировать сосудистые опухоли от АВД на основании данных В-режима исследования и допплеровской кривой. Сосудистые опухоли представляют собой избыточно васкуляризированные, относительно гомогенные мягкие ткани с регистрацией как высокоскоростных артериальных сигналов, так и венозные сигналы различной интенсивности. При АВД отмечается формирование множественные сосудистые структур по типу «медовых сот».
С применением приема компрессии ДС позволяет провести дифференциальный диагноз среди различных групп ангиодисплазий. Артериовенозные и лимфатические мальформации при проведении исследования в В-режиме не сдавливаются датчиком, в то время как нетромбированные венозные каверны подвержены сдавлению. Лимфатические мальформации представлены в виде кистозных структур, в которых в отличие от АВД кровоток не регистрируется.
Спектральный анализ, режимы цветового допплеровского картирования и энергетического допплера являются дополнительными опциональными функциями для дальнейшей оценки афферентных артерий, зоны шунтирования и дренирующих вен. Эти модальности позволяют в режиме реального времени провести анализ артериальных и венозных потоков с определением таких показателей, как скорость, амплитуда, объемный кровоток. АВД характеризуется низкорезистивным кровотоком с высокой амплитудой волны. Другими словами типичные находки при допплеровском исследовании включают в себя наличие зоны шунтирования («центральный очаг») и турбулентный кровоток.
ДС при обследовании пациентов с ангиодисплазиями имеет и ряд ограничений. Этот метод является оператор-зависимым, что требует постоянного совершенствования практического опыта в проведении подобных исследований и всестороннего понимания проблематики. Во-вторых, хотя ДС является наилучшим методом оценки характеристик кровотока, оно не дает полноценной оценки пространственного расположения ангиоматозных тканей, а также их протяженности и степени инфильтрации окружающих тканей. Ограничения в использовании В-режима обусловлены техническими особенностями ультразвуковых систем, частотой используемого датчика и программным обеспечением. Наконец, ДС имеет ограниченные возможности в обследовании глубокорасположенных структур и тканей рядом с воздухом и костями.
Магнитно-резонансная томография и компьютерная томография
МРТ остается главным методом исследования для целой группы ангиодисплазий, включая АВД. Она дает базовую информацию о протяженности поражения и анатомических взаимоотношениях с окружающими тканями/структурами/органами. В отличие от низкоскоростных мальформаций, которые на Т2-взвешенном изображении выглядят светлыми, АВД обычно представлены расширенными сосудистыми каналами с высокими скоростными характеристиками.
Методика магнитно-резонансной ангиографии дает и количественные характеристики с определением объема шунтирования или относительного объема кровотока через АВД, представляя собой неинвазивный тест для оценки результатов лечения. Эти технологии доступны в и медицинских центрах среднего уровня.
Стандартное МРТ не является методикой для четкой демонстрации «центрального очага или артериовенозных соустий. КТ-ангиография дает при этом значительно больше анатомической информации, обеспечивая детальное изображение артерий и вен, однако по многим параметрам ее превосходит МРТ с динамическим контрастным усилением.
КТ, в отличие от МРТ, обладает большей информативностью при оценке костных структур. КТ-ангиография с реконструкцией в ряде случаев может заменить и диагностическую рентгеноконтрастную артериографию, оставляя последнюю в качестве резервного метода, выполняемого непосредственно перед эндоваскулярным вмешательством.
С учетом лучевой нагрузки проведение КТ-ангиографии необходимо избегать у детей и подростков. Несмотря на то, что средняя доза облучения у детей, перенесших рентгенологические исследования, весьма вариабельная величина, уровень облучения при исследовании на 64-срезовом мультидетекторном томографе выше, чем при выполнении ангиографии. Даже если принимать во внимание, что КТ-ангиография обеспечивает более точную анатомическую детализацию по сравнению с МРТ (это особенно выражено при исследовании сосудов мелкого диаметра), польза клинически оправданного КТ-исследования всегда превосходит риски для индивидуального пациента. Соответственно, каждый клинический центр решает для себя, какой методике (КТ-ангиография или МРТ с динамическим контрастным усилением) следует отдавать предпочтение.
Безопасной дозы радиации не существует и высокое качество изображений, требующееся для обследования пациентов с АВД, не должно служить оправданием увеличение радиационной нагрузки. Поэтому МРТ остается методом выбора в диагностике высокоскоростных мальформаций у определенных групп. Только в случае расположения АВД в трудных для лечения зонах, когда качество визуализации будет играть первостепенное значение, исследовательскую программу возможно дополнить проведением КТ.
Сцинтиграфия не является абсолютно необходимым исследованием в диагностической программе при АВД, оставаясь методикой для определенных клинических случаев. Трансартериальная перфузионная сцинтиграфия легких (ТПСЛ) играет важную роль в количественной оценке артериовенозного шунтирования при АВД конечностей. Этот метод имеет специальные возможности для определения микрофистулезного шунтирования, что труднодостижимо для других методик. Микрофистулезное шунтирование часто присутствует при комбинированных формах ангиодисплазий, гемолимфатических формах мальформаций, выявление этого феномена возможно только при ТПСЛ. В случае запоздалой диагностики патологический процесс прогрессирует, упускаются возможности своевременных лечебных мероприятий. ТПСЛ обеспечивает количественное определение объема шунтирования в процессе терапии. Сцинтиграфические исследования могут быть заменой традиционной артериографии в качестве метода наблюдения за пациентами с АВД конечностей в отдаленном периоде.
Сцинтиграфия тела с мечеными эритроцитами также используется в диагностике АВД. Но она чаще бывает полезна, являясь наименее затратным тестом, для скрининга АВД при их локализации в труднодоступных местах и количественного анализа выраженности поражения в случае проведения многоэтапного лечения. Сцинтиграфия с мечеными эритроцитами является также прекрасным методом для рутинного обследования пациентов в отдаленном периоде как в случае прогрессирования симптоматики, так и при плановом обследовании в тех случаях, когда невозможно выполнение ТПСЛ.
Однако проведение двух вышеописанных методик сцинтиграфии в большинстве медицинских учреждений недоступно, хотя практически каждая лаборатория радионуклидных методов диагностики и лечения имеет потенциальные возможности проведения подобных исследований. Это, как правило, обусловлено не проблемами обеспечения, а недостатком знаний в этом направлении у практических врачей и отсутствием интереса к подобным исследованиям.
Решать основные диагностические задачи при АВД с большой долей уверенности можно, опираясь на возможности современных неинвазивных методов исследования (ДС + МРТ). По своим показателям диагностичес-кой чувствительности, специфичности и эффективности эти методы даже при артериовенозных формах вплотную приближаются к возможностям «золотого стандарта» диагностики – рентгеноконтрастной ангиографии.
Для установки первоначального диагноза АВД как одного их вариантов врожденных пороков развития сосудов достаточно комбинации неинвазивных и минимально инвазивных методов исследования, описанных выше. Но окончательный диагноз АВД для уточнения ангиоархитектоники поражения и выработки соответствующей лечебной стратегии должен быть подтвержден инвазивными исследованиями (ангиография). Для минимизации степени облучения ее применение, как правило, сочетается с лечебными процедурами, что имеет наибольшее значение у молодых пациентов.
Ангиографические исследования включают в себя:
Современный метод диагностики: МРТ с динамическим контрастным усилением (МРТ-ДКУ)
МРТ-ДКУ, предоставляя значительно больше информации для исследователей, включая характеристики кровотока, оценку поражения мягких тканей, их взаимоотношения с непораженными структурами, является новой генерацией визуализационных методик.
Эта методика важна как для диагностики самого факта сосудистого поражения, так и проведения дифференциального диагноза между низко- и высокоскоростными мальформациями. При этом может быть определено наличие или отсутствие раннего заполнения вен, дренирующих зону поражения или прямое артериовенозное шунтирование через зону ангиодисплазии. Если при проведении контрастного усиления гадолинием поражение не становится явным до наступления капиллярной фазы или до наступления типичной венозной фазы, будучи сравнимым с визуализацией нормальных сосудов, данное поражение рассматривается как низкоскоростная мальформация.
МРТ-ДКУ дает наиболее важную и приемлемую информацию в тех случаях, когда планируется проведение хирургического лечения. Она обеспечивает не только качественными гемодинамическими данными, но и предоставляет прекрасную визуализационную картину поражения с четкими данными по его протяженности и степени поражения тех или иных массивов мягких тканей.
Гемодинамические и анатомические характеристики, определяемые при МРТ-ДКУ, являются достаточными для планирования сеансов рентгеноэндоваскулярной окклюзии (РЭО) высокоскоростных мальформаций, проведения чрескожной склеротерапии для низкоскоростных поражений, в сочетании или без открытого хирургического вмешательства.
Как большинство современных методов исследования при выполнении МРТ-ДКУ в детской практике требуется использование седации или общей анестезии, что связано с продолжительностью исследования и необходимостью покоя при его выполнении.
Дифференциальный диагноз с приобретенными артериовенозными фистулами
Приобретенные артериовенозные фистулы (АВФ) являются, как правило, последствиями тех или иных травм. Наиболее характерными являются посткатетеризационные артериовенозные фистулы с локализацией в паху, повреждения сосудов (ножевые, пулевые ранения, дробь), ятрогенные послеоперационные фистулы (вмешательства на люмбальных дисках), спонтанные аорто-кавальные фистулы (связанные с разрывом аневризмы аорты в нижнюю полую вену). Ятрогенные АВФ отличны по своему течению от АВД и требуют проведения дифференциального диагноза. Только 1% АВФ связан с имевшей место тупой травмой, в то время как пенетрирующие повреждения (ножевые или пулевые ранения) составляют большинство среди причин подобных поражений (63% и 26% соответственно).
Ятрогенные или посттравматические фистулы характеризуются единичным прямым сообщением между артерией и веной без наличия ангиоматозных тканей. Вариабельность клинического течения и потенциальные последствия наличия АВФ обусловлены характером артериальной травмы, анатомической локализацией и продолжительностью существования фистулы.
Дифференциальный диагноз между АВД и капиллярными мальформациями бывает достаточно сложной проблемой у новорожденных, при этом необходимость проведения в неонатальный период тех или иных диагностических исследований при наличии изолированных поражений в виде кожных пятен дискутируется.
Ранняя постановка точного диагноза при наличии кожных пятен, будь то АВД или капиллярная дисплазия, не так легка, но необходимо все же стремиться исключить артериовенозную мальформацию, т.к. прогноз при этом поражении более серьезен. В последнее время для этих целей стал применяться тест с антителами опухоли Вильмса (WT1), являющийся дополнительным методом, позволяющим дифференцировать АВД от капиллярной мальформации. В проведенных исследованиях все сосудистые мальформации, были негативными на антитела WT1 за исключением АВД, где экспрессия WT1 была положительна.
Есть определенная надежда, что в ближайшем будущем иммуногистохимический анализ с экспрессией WT1 будет серьезным подспорьем при проведении дифференциального диагноза между капиллярными и артериовенозными мальформациями, что в раннем возрасте является крайне важным для выбора адекватной схемы лечения.
На начальном этапе выявления ангиодисплазий вне зависимости от формы и локализации процесса целесообразно проведение комплексного ультразвукового исследования с использованием современных возможностей методики дуплексного сканирования для оценки гемодинамических характеристик. Имеется абсолютная необходимость повышения качества проведения на местах комплексного ультразвукового исследования (артерий, вен, мягких тканей) в силу наибольших технических возможностей для этого неинвазивного метода.
Для контроля эффективности хирургического лечения пациентов с различными формами ангиодисплазий с наличием ангиоматоза целесообразно использовать в ближайшем и отдаленном послеоперационном периоде ультразвуковые методы и магнитно-резонансную томографию, при отсутствии ангиоматоза достаточным является применение ультразвуковых методов.
ЛЕЧЕНИЕ: ОСНОВНЫЕ ПРИНЦИПЫ
Вне зависимости от типа АВД (экстратрункулярные или трункулярные) они остаются наиболее сложными поражениями среди всех сосудистых пороков вследствие поражения практически всей сосудистой системы и тяжелых гемодинамических осложнений. Клиническая симптоматика при АВД связана с анатомической локализацией и объемом, определяющими выраженность кардиальных нарушений, венозной недостаточности. Локальные эффекты при АВД могут включать язвообразование и гангрену.
Показания для лечения экстратрункулярных форм АВД базируются на определении их клинической значимости. Данные критерии сформулированы для экстратрункулярных форм с учетом того, что они представляют абсолютное большинство среди всех артериовенозных поражений.
Процесс прогрессирования АВД весьма вариабелен: некоторые пациенты остаются асимптомными до периода возрастной перестройки, в то время как у других пациентов развитие клинической картины заболевания отмечается уже в детстве. Появление симптоматики обусловлено увеличением шунтирования с развитием артериального обкрадывания и венозной гипертензии, что, в конечном счете, ведет к уменьшению тканевой перфузии. Тканевая ишемия при этом манифестирует появлением болевого синдрома, кровотечений, трофических нарушений.
Прогрессирование АВД связано с воздействием триггерных факторов, которые ведут к повышению уровня системного сосудистого фактора роста (VGF). К этим факторам относят генерализованный рост во время и после пубертатного периода или беременности, а также травматизацию окружающих тканей во время открытого хирургического вмешательства или проксимальной окклюзии афферентных артерий. Для минимизации подобных рисков пациентам с ранними стадиями АВД необходимо учитывать эти данные, что в ряде случаев позволяет отменить прием эстроген-содержащие контрацептивы и отказаться от хирургического вмешательства с неопределенным исходом. Уровень клинической прогрессии в этом случае достаточно точно описывается классификацией Schöbinger.
Неправильно спланированное или неудачно осуществленное оперативное вмешательство (например, паллиативная резекция, лигирование или проксимальная окклюзия афферентных артерий) только стимулируют рост экстратрункулярных поражений с их трансформацией из спящего состояния в пролиферативную фазу, результатом чего является массивный рост ангиоматозных тканей с последующими непредсказуемыми осложнениями. Поэтому для гарантированного предотвращения рецидива заболевания и возможного ухудшения состояния ангиодисплазии необходимо придерживаться тактики активного контроля.
Основной целью лечения должно быть устранение основного очага поражения, которое можно реализовать за счет окклюзии или полного удаления «центрального очага». Обычная окклюзия или лигирование питающих артерий при оставлении интактным основного очага, в конечном счете, приведет к полноценному рецидиву за счет открытия и роста коллатералей, берущих на себя функцию питающих артерий. Поэтому любая лечебная стратегия при АВД должна быть сфокусирована на полной окклюзии основного очага мальформации.
Главной целью лечения АВД должны быть окклюзия или полное удаление «центрального очага» мальформации. Простая окклюзия или лигирование афферентных артерий на сегодняшнем этапе являются недопустимыми вмешательствами.
Лечение трункулярных АВД (функционирующий артериальный проток) является сравнительно более легкой задачей (в сравнении с нетрункулярными формами), т.к. здесь практически отсутствует риск прогрессии и/или роста. Хирургическое (перевязка) или эндоваскулярное вмешательство (окклюзия свища), как правило, обеспечивают перманентное излечение.
По отношению к экстратрункулярным АВД должна быть использована активная лечебная стратегия, только в этом случае уменьшается риск осложнений. Однако в ряде случаев риск вышеописанных вмешательств настолько велик, что не позволяет их выполнить. В этом случае возможно ограничиться паллиативными мероприятиями. Например, для уменьшения отека конечности и уменьшения выраженности субъективной симптоматики назначаются градуированные компрессионные изделия (гольфы или чулки).
Современный новый мультидисциплинарный подход в лечении АВД позволяет достичь значительного прогресса в диагностике и лечении данных поражений. Уменьшение выраженности клинических проявлений, частоты рецидива и даже летальности, что отмечается в практике в последние годы, напрямую обязано внедрению данной стратегии, включающей в себя новые классификационные системы, высокотехнологичные методы диагностики и лечения.
Специализированная команда для лечения АВД должна обеспечивать абсолютно весь спектр эндоваскулярных и открытых вмешательств. Практическая реализация такого мультидисциплинарного подхода способствует максимальной координации среди специалистов различного профиля.
Лечебная стратегия при лечении АВД принципиальным образом отличается от других типов врожденных сосудистых пороков, что обусловлено трудностями на пути лечения высокоскоростных мальформаций. Общая стратегия лечения имеет в этом случае коренные отличия. В то время, как при венозных мальфомациях в большинстве случаев может быть использована прямая чрескожная пункция, при АВД возникает необходимость комбинации или выбора прямого и эндоваскулярных доступов. При выборе хирургического способа лечения АВД также могут быть отличия в проведении подобных вмешательств по сравнению с другими формами ангиодисплазий.
ЛЕЧЕНИЕ: ХИРУРГИЧЕСКАЯ СТРАТЕГИЯ
Хирургическое резекционное вмешательство с удалением очага ангиодисплазии остается на протяжении многих десятилетий «золотым стандартом» лечения АВД. Радикальное удаление ангиоматозных тканей, несмотря на высокую частоту осложнений, позволяет достигнуть полного излечения. Однако даже паллиативная резекция в большинстве случаев сопряжена с предельно высокой частотой тяжелых осложнений, сопоставимой с результатами при радикальных вмешательствах.
Роль хирургических вмешательств изменилась за последнее время с появлением эндоваскулярной хирургии. С внедрением эндоваскулярных методик значительно улучшились результаты хирургических резекций. Для большинства АВД целью рентгеноэндоваскулярной эмболизации (РЭО) является устранение зоны артериовенозного сброса в случае невозможности удаления ангиоматозных тканей «единым блоком». Предоперационная эмболизация (склеротерапия) улучшает безопасность и эффективность последующих резекционных вмешательств за счет значительного уменьшения травматичности и интраоперационной кровопотери. Проведение РЭО в послеоперационном периоде также дает определенные преимущества в комплексном лечении АВД.
Наиболее трудным вопросом в хирургическом лечении экстратрункулярных АВД является вопрос выбора времени вмешательства. Ограниченные по протяженности поражения при локализации в некритических для организма областях могут быть удалены в любое время, хотя во многих клинических случаях перед хирургом может встать проблема выбора правильного времени вмешательства. При планировании вмешательств в раннем возрасте необходимо учитывать повышенную вероятность их нерадикальности, что может усилить рост оставшегося очага ангиоматозных тканей.
Тяжелые осложнения, возникающие во время хирургического вмешательства, могут быть следствием необоснованной задержки с началом лечения. Полноценные знания о патофизиологии АВД подразумевают и правильный выбор подходящей хирургической стратегии лечения. В большинстве случаев только полноценное взаимодействие между интервенционным радиологом и хирургом позволяет достигнуть результата при лечении это сложной группы пациентов.
Наблюдающийся за последнее время прогресс в эндоваскулярной технике и материалах позволил значительно уменьшить агрессивность хирургических вмешательств.
С технической точки зрения для выбора хирургического доступа хирург должен иметь полноценную информацию об анатомии поражения. Четыре различных группы (экстракраниальных) АВД – голова и шея, висцеральные поражения, верхние и нижние конечности – имеют различные характеристики, обусловленные специфическими доступами, возможностями удаления ангиоматоза и последующей реконструкции.
Раньше удаление ангиоматозных тканей планировалось со значительным удалением от очага (т.е. резекция «en block») до тех пор, когда оно не стало комбинироваться с предоперационной эмболизацией.
Определенные преимущества в проведении подобных вмешательств (реконструктивный этап) дало использование баллонного растяжения кожи. Силиконовый баллонный эспандер размещается подкожно вблизи зоны поражения АВД и в течение определенного времени заполняется раствором, обеспечивая постепенное растяжение кожного лоскута. Это в дальнейшем позволяет выполнять реконструктивный этап после удаления ангиоматозных тканей в более спокойных условиях. Техника баллонного растяжения кожи может быть применима при реконструкции практически в любых областях тела, наибольшее клиническое значение она имеет при операциях на лице и шее.
АВД очень часто сочетается с наличием диффузной инфильтрации, при этом достаточно трудно провести дифференциацию от непораженных окружающих тканей и структур даже с использованием интраоперационного гистологического исследования. Резидуальные поражения могут быть вызваны нежелательными дополнительными хирургическими вмешательствами. Удаление видимых непораженных тканей часто является определенной жертвой с целью повышения радикальности, но в то же время увеличивает травматичность вмешательства с ухудшением функциональных и косметических результатов.
Хирургическое лечение АВД при поражении верхних конечностей
При поражении АВД кисти и пальцев нередким осложнением является поражение кожных покровов с возникновением трофических язв и кровотечений. Эндоваскулярные вмешательства при подобных поражениях имеют повышенный риск осложнений (ишемия кончиков пальцев и некрозы).
Хирургическое лечение АВД верхних конечностей требует глубоких практических знаний о клиническом течении этих высокоскоростных мальформаций в дополнении к уникальным реконструктивным подходам, которые реализуются при этом поражении. Анатомия нейрососудистых образований на пальцах является серьезным хирургическим препятствием для осуществления успешного резекционного вмешательства.
Хирурги, сталкивающиеся с проблемой лечения АВД у взрослых и детей, должны быть знакомы с разделом «как удалить АВД на кисти и правильно выполнить при этом реконструкцию дефекта». Основной задачей при этом является сохранение функции и оптимизация косметических результатов. Однако, верхняя конечность (плечо, предплечье и кисть) имеют ограниченные по объему мягкие ткани, что несколько суживает возможности для проведения пластических этапов. Возможные варианты закрытия раны после удаления ангиоматозных тканей при такой локализации – пластика местными тканями или применение лоскутов на микрососудистых анастомозах.
Принципы хирургического вмешательства могут включать в себя восстановление магистральных сосудов (прежде всего, артерий), фиксацию костей и, при необходимости, восстановление других структур (мышцы, нервы, сухожилия) с последующим закрытием их мягкими тканями.
Экспозиция нервов, сухожилий, сосудов и костей часто требует последующей пластики свободным кожным лоскутом. В редких случаях после массивного вмешательства с удалением АВД требуется применение мышечного лоскута и даже пересадка сухожилий.
Общие послеоперационные осложнения связаны с проблемами со стороны мягких тканей (например, сокращение кожного трансплантата, фасциальная адгезия из-за движения сухожилий, уменьшение объема мышечной амплитуды), инфекцией. Поэтому оперирующие хирурги должны учитывать возможности подобных осложнений для принятия мер профилактики и осуществления соответствующего лечения.
Возможность проведения радикального вмешательства полностью определяется локализацией и обширностью поражения. Единственным способом полного излечения такого больного является полное иссечение пораженных тканей. Но степень возможной инвалидизации вследствие имеющегося поражения всегда должна сопоставляться со степенью возможной потери трудоспособности вследствие нарушения функции органов после операции. Малые ампутации при наличии дистальных поражений (пальцы кисти, стопы) в ряде случаев позволяют полностью устранить зону патологического сброса. В тех ситуациях, когда полное иссечение ангиоматоза невозможно, могут быть использованы паллиативные методики. Несмотря на исключительную паллиативность этих вмешательств, оценка такого показателя, как качество жизни, позволяет не исключать их из арсенала. Основными среди них по отношению к АВД являются эмболизация афферентных артерий, лигирование прямых артериовенозных свищей, частичное удаление ангиоматозных тканей. Нельзя забывать о необходимости постоянной эластической компрессии (при поражении конечностей), что позволяет замедлить прогрессирование патологического процесса и трофических расстройств.
Хирургическое лечение АВД требует взаимодействия различных хирургических специальностей с учетом возраста пациентов, анатомических особенностей поражения и возможных реконструктивно-пластических вмешательств.
Эндоваскулярное лечение с применением различных вариантов эмболизаций или склеротерапии в настоящее время признается как наиболее предпочтительная «лечебная опция» в лечении большинства экстратрункулярных АВД. Рентгеноэндоваскулярная окклюзия и/или склеротерапия при самостоятельном проведении могут рассматриваться как метод выбора при поражениях, где хирургическое вмешательство не может быть выполнено по тем или иным причинам или оно сопряжено с крайне высоким риском травматичности – при расположении глубоко под фасцией с обширным поражением мышц, сухожилий и костей, т.е. при диффузном инфильтративном типе экстратрункулярной формы АВД.
Необходимо напомнить, что для достижения адекватного результата эмболизирующие субстанции (эмболы, клеевые частицы) или склерозант должны вводиться непосредственно в зону прямого шунтирования («центральный очаг»).
Для максимального воздействия на зону артериовенозного шунтирования необходимо использовать возможности всех трех доступов – трансартериальный, трансвенозный или прямая чрескожная пункция очага.
Необходимо стремиться к проведению многосессионного лечения, во время каждой сессии необходимо прилагать все усилия для минимизации риска возможных осложнений. К наиболее доступным эмболизирующим агентам для первичного применения при АВД относятся абсолютный алкоголь, Onyx, N-бутил-цианокрилат (NBCA) и венозные спирали. Применение только NBCA или Onyx является, как правило, недостаточным и неадекватным для достижения излечения или обеспечения длительного контроля за АВД.
В лечении АВД используют достаточно широкий спектр из известных эмболизирующих агентов. Наиболее распространенными для этих целей являются эмболы из поливинилалкоголя (ПВА), микросферы, гелеобразные формы, коллагеновый порошок. Их использование без сочетания или в сочетании с другими агентами хорошо описано в литературе. Однако, эти субстанции не обладают в полной мере необходимыми для лечения АВД свойствами. Эти частицы являются слишком большими и вызывают окклюзию афферентных артерий, не достигая непосредственно очага артериовенозного шунтирования. В случаях артериовенозных фистул крупного и среднего калибра (прямые шунты) данные частицы могут мигрировать через них, не приводя к устранению сброса. С учетом вышесказанного, их первичное действие при АВД ограничено влиянием на гемодинамику в зоне поражения для улучшения результатов комплексного лечения.
Спирали были разработаны для локальной окклюзии крупных сосудов и не имеют возможности проникновения непосредственно в зону поражения. Другим недостатком подобной эмболизации является механизм действия, ограниченный окклюзией и последующим тромбозом сосуда (артерии или вены) с установленной спиралью.
Необратимого повреждения эндотелия в этом случае не наступает, что в конечном итоге ведет к его регенерации и восстановлению. Следствием этого является реканализация и рецидив поражения. Данный процесс наиболее характерен для экстратрункулярных форм АВД, где имеется значительный потенциал для пролиферации.
При экстратрункулярных формах АВД применение спиралей для проведения эмболизации афферентных артерий является грубейшей ошибкой. Ранее выполненная РЭО спиралями значительно затрудняет проведение эмболизации другими материалами с возникновением соответствующих клинических последствий. В этих ситуациях спирали, как правило, могут использоваться как вторичные агенты со стороны венозного участка поражения.
Эмболизационные спирали, как и выполнение лигирования афферентных артерий, не должны применяться вследствие доказанной неэффективности подобных вмешательств. Данные вмешательства относятся в разряд гемодинамически необоснованных.
Спирали могут устанавливаться в вены, осуществляющие отток от зоны АВД, с поддержкой основной лечебной программы. Это может быть наиболее эффективно при II артериографическом типе поражения (множественные артерии через зону шунтирования соединяются с единичной дренирующей веной). При этом подтипе АВД окклюзия венозного оттока спиралями может быть эффективной, уменьшая риск повреждения тканей вследствие эмболизации афферентных артерий (Рис.1).
При АВД с наличием аневризматической дилатации дренирующих вен с наличием множественных дренирующих вен (ангиографический тип III) эмболизация спиралями может быть использована в комбинации с введением абсолютного спирта, что дает возможность достичь определенного результата. В ряде работ было показано, что введение спирта в вены при нахождении в них спиралей за счет рефлюксного потока ведет к повреждению стенки аневризматически расширенных вен, вызывая стойкую окклюзию АВД.
Применение спиралей в качестве метода выбора показано при лечении прямых артериовенозных свищей. Эти трункулярные формы поражения являются подходящими для успешного применения спиралей или других окклюзирующих устройств (например, Amplatz-окклюдер). Однако, данные трункулярные поражения для достижения результата часто требуют множества спиралей и лечение при этом ассоциируется с определенными гемодинамическими проблемами (сердечная недостаточность, артериальная ишемия, венозная недостаточность).
Жидкие субстанции отличаются возможностью проникновения в самый центр ангиодисплазии и с этой точки зрения являются идеальными для лечения этого типа поражения. Они делятся на две группы: склерозанты (этанол, Тетрадецил сульфата натрия (STS), полидоканол и блеомицин) и полимеризующие агенты N-бутилцианоакрилат и Onyx). Среди группы склерозантов наибольшее практическое значение для лечения АВМ имеет этанол, оставшиеся субстанции в основном используются для лечения низкоскоростных венозных и лимфатических мальформаций.
NBCA является адгезивным жидкостным агентом, полимеризующимся при контакте с ионическими растворами. Для уменьшения времени полимеризации и улучшения рентгеновской визуализации цианокрилаты могут смешиваться c йодолиполом.
В дополнении к возникающему механическому окклюзирующему эффекту NBCA обладает островоспалительным эффектом за счет повышения температуры во время процесса полимеризации и индуцирует хроническое воспаление за счет имеющегося химического воздействия. Данный воспалительный эффект имеет определенное значение в достижении длительного результата выполненной окклюзии. В дополнении к воспалительной реакции в достижении стойкой облитерации играет и гомогенность клея.
Большинство специалистов рассматривают NBCA «лучшим паллиативным средством». Нет никаких сомнений, что данный метод лечения дает определенные результаты только при небольших размерах АВД (которые могут быть удалены и хирургическим способом). Абсолютное большинство поражений этого типа с имеющейся клинической симптоматикой нуждаются в других тактических подходах. Кроме того, в отдаленные сроки наблюдения для NBCA характерна «резорбция» и его исчезновение, что ведет к рецидиву клинической симптоматики.
Onyx является новым полимеризующим агентом с меньшей адгезивной способностью, который медленно вводится в зону поражения. Активным компонентом является кополимер этилена и винилалкоголя (EVOH), растворенный в диметиле сульфоксиде (DMSO). Его применение является очень эффективным для воздействия на большую зону ангиодисплазии с наличием макрошунтов. Однако эффективность препарата не является универсальной, и у ряда пациентов эмболизация ониксом может приводить к распространенной артериальной окклюзии без проникновения препарата непосредственно в зону артериовенозного шунтирования.
Onyx по сравнению с NBCA имеет ряд преимуществ. Во-первых, за счет необходимости медленного введения у врача-рентгенолога больше возможностей влиять на процесс эмболизации и делать его более управляемым. Кроме того, Onyx является менее адгезивным и его полимеризация проходит медленнее, поэтому риск закупорки просвета микрокатетера при длительном (более 60 мин) осуществлении данной процедуры и его выход за пределы сосуда в зоне мальформации значительно снижается. Данная техническая неудача может вести к пенетрации различных участков ангиодисплазии до того времени, когда желаемый результат достигнут. Еще одним преимуществом Onyx считается сниженный риск эмболии легочной артерии по сравнению с другими эмболизирующими субстанциями. Болььшое распространение препарат получил в нейрохирургии при лечении мальформаций головного мозга.
Однако при АВД, расположенных на периферии конечностей, Onyx не рассматривается в качестве идеального средства. Он является паллиативным препаратом или средством, как и NBCA, для предоперационной эмболизации. При проведении расширенной эмболизации данной препаратом (в случае обширных АВД) практически во всех случаях через некоторое время наблюдается процесс «неоваскулярной стимуляции», характеризующийся в появлении новых коллатералей, питающих мальформацию и формированием массивной сети артерий малого калибра и артериол.
Вышеописанный процесс «неоваскулярной стимуляции» может вести к возникновению клиники рецидива заболевания, при этом возможности проведения как открытых, так и эндоваскулярных вмешательств у этой тяжелой категории пациентов резко ограничиваются.
STS (Тетрадецил сульфата натрия)
STS является натриевой солью жирной кислотой с высокими детергентными свойствами. Препарат является очень эффективным при склерозировании вен за счет повреждения сосуда на уровне эндотелиального слоя. Данный эффект не сравним с действием этанола, поэтому интраартериальное применение STS резко лимитировано в отличие от его популярности при лечении венозных мальформаций.
К сожалению, в описании редких случаев применения STS с введением в артериальное русло отмечены серьезные осложнения, связанные со свойством препарата вызывать обширный тромботический процесс. Тромбоз в этих случаях, как правило, выходил за пределы зоны введения и сопровождался кожными некрозами.
Доксициклин и блеомицин
Оба агента являются склерозантами с умеренными свойствами и используются в лечении лимфатических и венозных мальформаций. При лечении АВД препараты не применяются из-за чрезвычайно малой эффективности в достижении значимого сосудистого повреждения при введении в высокоскоростные мальформации.
В случае низкоскоростных повреждений контакт препаратов с эндотелием является более значимым и его эффективность становится выше.
Препаратам свойственны и системные реакции. Блеомицин может служить причиной возникновения легочного фиброза, выпадения волос и пигментации, поэтому доза препарата при лечении должна быть строго лимитирована.
PMMA является двухкомпонентной субстанцией из неорганического элемента (гидроксид алюминия) и акрилового полимера. Взаимодействие двух продуктов активирует процесс полимеризации с образованием стойкого, инертного и плотного материала. Данный препарат часто используется при проведении чрескожной вертебропластики. В последнее время появились сообщения успешного его применения при лечении артериовенозных мальформаций с поражением костей. Лечение осуществляется путем прямых внутрикостных инъекций в пораженную кость. Однако на сегодняшний день данные с оценкой реальной эффективности подобного лечения отсутствуют.
96% спирт является самым мощным препаратом в группе склерозантов. Механизм его действия заключается в отслоении эндотелиальной выстилки от венозной стенки с последующей преципитацией протоплазмы эндотелиальных клеток и повреждения венозной стенки на уровне внутренней эластической мембраны. На обнаженной поверхности венозной стенке отмечается агрегация тромбоцитов. Тромботический процесс прогрессивно распространяется от венозной стенки по направлению к центру венозного просвета. При процессе такого рода не остается возможностей для активности «хемотаксического клеточного фактора» или факторов ангиогенеза, т.к. эндотелиальные клетки здесь полностью разрушаются.
Негативным моментом проведения терапии этанолом является высокий риск кардиопульмонарных нарушений, что требует в большинстве случае проведения вмешательств под общей анестезией и тщательного мониторного контроля за состоянием сердечно-легочной системы. Катетеризация легочной артерии во время склеротерапии этанолом позволяет мониторировать в ней артериальное давление в процессе лечения.
Легочная гипертензия является потенциально фатальным осложнением данного метода лечения, ее возникновение связано с большой дозой склерозанта, достигающего легких. В патофизиологиии легочной гипертензии придается особое значение механизмам спазма легочных капилляров и избыточной микротромбоэмболизации. Развитие легочной гипертензии может вести к кардиопульмонарному шоку, из которого в дальнейшем крайне сложно вывести пациента.
Общая доза этанола в объеме менее 1 мл/кг массы тела считается безопасной, в то время как превышение дозы может вести к вышеописанным токсическим эффектам. В ряде работ было показано, что в тех случаях, когда необходимо применение больших доз этанола при лечении обширных поражений, использование небольших доз (до 0,14 мл/кг массы тела) с интервалом 10 мин. устраняет вероятность кардиопульмонарного шока. При соблюдении вышеописанных принципов риск попадания больших количеств этанола в малый круг кровообращения с последующей картиной острой сердечной недостаточности становится незначительным.
Применение абсолютного алкоголя ассоциируется с различными местными осложнениями. Безопасное применение этанола при эмболизации АВД должно предусматривать точное введение склерозанта непосредственно в зону артериовенозного сброса («центральный очаг») без попадания в питающие сосуды и капиллярную сеть. Проксимальные инъекции 96% спирта в афферентные сосуды могут вызвать обширные кожные некрозы.
Для лечения поверхностно-расположенных АВД, где выше потенциальный риск кожных некрозов и повреждения нервных структур, можно использовать меньшие концентрации этанола. Последовательное использование малых объемов также позволяет минимизировать риск повреждения окружающих тканей. Избыточные объемы этанола могут дренироваться еще до удаления иглы. Поэтому прямая компрессия вен во время проведения сеанса лечения может предупредить раннее дренирование этанола из зоны его введения.
Для достижения денатурации и склерозирующего эффекта на эндотелиальные клетки высокоэффективным средством замедление скорости кровотока в АВД является, позволяющим увеличить время контакта этанола с эндотелием. Эта цель может достигаться различными путями.
При повышенных показателях оттока преимущество имеют компрессия отводящих вен (манульная или с применением компрессионных устройств). Это ведет к изменению направления кровотока по направлению к зоне артериовенозного сброса.
При аневризматическом расширении дренирующих вен для замедления кровотока целесообразно использовать предварительную эмболизацию спиралями или применение J-проводника. В этом случае применение этанола ведет не только к тромбозу, но и к повреждению сосудистого эндотелия, что является залогом стойкой облитерации в зоне АВД.
Для снижения риска ишемических осложнений со стороны нормальных окружающих тканей при лечении АВД необходимо использовать технику множественных сеансов. При микрофистулезных формах, где имеется диффузное инфильтративное расположение источников питания АВД, можно пользоваться приемом разведения этанола с неионным контрастным препаратом в соотношении 1:1.
Дополнительным приемом уменьшения побочных эффектов применения этанола, например, отека и болей в области поражения, является рутинное применение гидрокортизона, как и НПВС. Использование этих препаратов обеспечивает профилактику или минимизирует риск развития синдрома сдавления с последующим возможным повреждением нервных структур.
Тем не менее, до сих пор нет общего мнения по поводу рутинного применения этанола при всех АВД с учетом риска серьезных осложнений (легочный вазоспазм, повреждения нервов, кожные некрозы). Как правило, тактика лечения АВД и выбор склерозанта определяется с учетом клинического варианта ее течения и риска серьезных местных или системных осложнений (острое кровотечение).
Методика применения этанола при лечении АВД имеет много «подводных камней», требует тщательного планирования каждого сеанса вмешательства, сопряжена с достаточно большим числом осложнений, с чем и связано в конечном итоге ее не слишком широкое распространение в реальной клинической практике.
Выбор эмболизирующих субстанций
Существует общее неправильное представление, что в лечении АВД должен быть «один золотой» стандарт эмболизирующего агента. Выбор препарата базируется на учете трех факторов: локализации поражения, его морфологии и клинической картины.
Локализация поражения часто является ведущим обстоятельством при выборе эмболизирующего/склерозирующего агента. Наличие рядом с мальформацией важных неврологических структур является, как правило, противопоказанием к применению этанола. Его использование может привести к некрозам мягких тканей и серьезным неврологическим расстройствам. В этих случаях преимуществом обладают другие жидкие препараты, а также NBCA и Onyx. Сложной для лечения локализацией является поражение кожных покровов. В этих случаях при лечении этанолом часто отмечаются серьезные осложнения в виде некрозов и изъязвлений.
Клиническая картина в каждом индивидуальном случае имеет определенное значение при выборе препарата для эмболизации/склеротерапии. Если перед нами стоит задача уменьшить артериовенозный сброс, то мы можем использовать крупные эмболизационные агенты. К примеру, у новорожденного при наличии выраженной сердечной недостаточности из-за АВД в бассейне подвздошных артерий наилучшим выбором может быть эмболизация спиралями. Данный выбор хотя и далек от идеала, но позволяет в короткое время скорригировать гемодинамические нарушения, сохранить жизнь пациента с целью проведения в дальнейшем более адекватной терапии.
В тех случаях, когда не ставится задача только уменьшить васкуляризацию поражения перед проведением хирургического вмешательства, эмболизирующий агент необходимо выбирать с учетом возможных ближайших и отдаленных результатов. Это особенно важно при внутримозговой локализации АВД. При имеющемся небольшом поражении с минимальной клинической симптоматикой риск применения такого мощного агента, как этанол, может превышать потенциальный эффект излечения. Это утверждение верно и для низкоскоростных венозных мальформаций.
Не менее важную роль при выборе агент для эмболизации играет и морфология поражения. Прямые артериовенозные фистулы (трункулярное артериовенозное поражение), например, при легочном поражении могут быть успешно устранены с применением крупных эмболизирующих субстанций (спирали, механические окклюдеры) без большого риска рецидивов. Однако для экстратрункулярных АВД при наличии многообразия в строении очага дисплазии определенные особенности анатомии артерий и вен заставляют использовать в лечении комбинацию различных эмболизирующих/ склерозирующих агентов. Для достижения максимального результата здесь требуется грамотное сочетании возможностей применения спиралей, жидких склерозантов и полимеризующих агентов.
Проблема максимального закрытия зоны артериовенозного сброса с применением материальных эмболов, как правило, до конца не решается из-за невозможности воздействия с их помощью на само микроциркуляторное русло. Жидкие склерозанты (этанол) имеют определенные преимущества в этом отношении, но их полная неуправляемость делает их полноценное применение практически невозможным в реальной практике. Актуальным вопросом остается поиск «золотой середины» между двумя этими направлениями с использованием достижения современной химии полимеров и разработки новых технических решений.
Применение эндографтов и стентов с покрытием
В литературе описано применение эндографтов с хорошим результатом для устранения приобретенных артериовенозных фистул с локализацией в подключичных, подвздошных и бедренных сосудах. Эндографты также могут быть использованы и при лечении АВД. Их применение может быть обоснованным в случае наличия аневризм, развивающихся в проекции афферентных артерий. Эндопротезирование может быть выполнено и в случае наличия единичного прямого артериовенозного сообщения (трункулярная форма АВД). Применение эндопротезирования при экстратрункулярных формах АВМ является грубой тактической ошибкой, вызывая гемодинамический эффект, аналогичный проксимальному лигированию или эндоваскулярной окклюзии питающих артерий. При этом зона артериовенозного сброса остается интактной, что, в конечном счете, ведет к рецидиву заболевания.
Применение покрытых стентов при АВД возможно лишь в исключительных случаях. При наличии тяжелых осложнений АВД (кровотечения, сердечная недостаточность), когда проведение и открытого хирургического вмешательства и стандартного эндоваскулярного лечения по тем или иным причинам невозможно, эндопротезирование может быть признано в качестве последней паллиативной лечебной процедуры с целью спасения жизни пациента.
Пластическая хирургия в лечении АВД лица и шеи
Частота встречаемости ангиодисплазий с локализацией в области головы и шеи составляет от 5–14% от их общего количества. Учитывая особенности кровоснабжения и расположение рядом с важными анатомическими образованиями и органами (головным мозгом, эндокринными железами, нервными структурами), данная область считается самой трудной как для сосудистых хирургов, так и для специалистов эндоваскулярной и пластической хирургии. Значимость проблемы лечения врожденных ангиодисплазий определяется реальной опасностью развития тяжелых осложнений заболевания: трофических нарушений, язв, массивных кровотечений из ангиоматозных тканей, а также нарушением центральной гемодинамики при неустраненном патологическом артериовенозном сбросе.
Хирургическое удаление патологического сосудистого образования является единственным радикальным методом лечения. Основной целью должно быть выполнение резекционного вмешательства в максимально полном объеме. Применение селективной и суперселективной ангиографии, появление новых материалов для эндоваскулярной окклюзии сосудов, питающих ангиоматоз, позволяет обеспечить адекватную эмболизацию с целью подготовки к резекционному вмешательству. Однако при поражении эстетически значимых участков, таких как лицо и шея, это становится сложной задачей. Данное обстоятельство заставляет искать новые пути закрытия раневой поверхности после удаления ангиоматозных тканей.
Оперативные вмешательства при этой локализации, вне зависимости от формы поражения, имеют ряд особенностей, в первую очередь связанных со стремлением избежать избыточной кровопотери. К сожалению, простой и надежный метод наложения турникета, позволяющий выполнять оперативные вмешательства в «бескровных» условиях, при этой локализации неприемлим. В этой группе пациентов с целью уменьшения объема кровопотери использовались этапные РЭО, предварительное прошивание афферентных артерий по периметру ангиоматозных тканей до апоневроза с последующим удалением гемостатических швов, управляемая гипотензия, а также обкалывание ангиоматозных тканей раствором с адреналином. При тяжелых поражениях выполнение оперативного вмешательства должно проводиться с использованием аппаратов возврата крови, что позволяет избежать осложнений, связанных с использованием донорских компонентов крови и оперировать пациентов, ранее считавшихся неоперабельными.
Несмотря на множественные публикации в российской и зарубежной литературе по тактике лечения АВД головы и шеи, многими хирургами как в регионах России, так и в Москве, применяется такая порочная операция, как перевязка наружной сонной артерии (НСА). Это является грубейшей тактической ошибкой в плановой хирургии ангиодисплазий. После перевязки НСА кровоснабжение ангиоматозных тканей продолжается через сеть коллатералей, в том числе и через бассейн внутренней сонной артерии, однако проведение этапных суперселективных эмболизаций после данной операции не представляется возможным, а риск развития интраоперационных кровотечений возрастает.
Для обширных артериовенозных ангиодисплазий головы и шеи в качестве подготовки к удалению ангиоматозных тканей возможно выполнение этапных РЭО афферентных артерий с использованием эмболов и эмболизирующего агента (тканевого клея). Период между РЭО и хирургическим вмешательством не должен превышать 7–10 дней для уменьшения риска коллатеральной реваскуляризации зоны патологического сброса. В случаях нерезектабельности ангиоматозных тканей возможно проведение паллиативных эмболизаций для предупреждения прогрессирования заболевания. РЭО должна выполняться поэтапно во всех сосудистых бассейнах с применением суперселективной катетеризации афферентных ветвей в зоне ангиодисплазии. Проведение РЭО и открытых вмешательств при локализации ангиодисплазии в области головы и шеи всегда несут в себе опасность эмболии функционально значимых сосудов головного мозга, поэтому перед проведением эмболизации необходимо проведение не только суперселективной ангиографии артерий из бассейна наружной сонной артерии, но раздельной ангиографии бассейнов внутренней сонной артерии с обеих сторон.
Учитывая молодой, трудоспособный возраст большей части пациентов, косметический результат после иссечения ангиоматозных тканей на лице и шее крайне важен и напрямую связан с качеством жизни пациентов и их социальной адаптацией, в связи с чем необходимо стремиться к широкому применению пластических методов закрытия раны. Различные способы пластического закрытия раневой поверхности позволяют улучшить результаты хирургического лечения больных с ангиодисплазиями лица и шеи и могут быть методом выбора для хирургов.
Трофические нарушения при АВД
Наибольшие сложности для определения тактических действий представляет группа пациентов с трофическими нарушениями при АВД. Основные гемодинамические феномены при этом связаны с:
Вследствие этого уменьшается давления в дистальных сегментах артерий, увеличивается венозный градиент, происходит уменьшение артериовенозного градиента и редукция капиллярного кровотока, что является основой возникновения трофических расстройств.
Трофические расстройства при АВД в случаях неустраненного патологического сброса отличаются чрезвычайной стойкостью к проводимой местной терапии. Основными целями консервативной терапии в случае наличия трофических нарушений при АВД является обеспечение адекватной компрессии (низкорастяжимые эластичные бинты или трикотаж 3 класса) и применение средств местного лечения. Возможности системной фармакотерапии, учитывая артериовенозное шунтирование, в этом случае значительно ниже, чем при лечении венозных трофических язв. Определенное значение имеет применение активаторов клеточного метаболизма, ведущих к увеличению потребление клетками кислорода и глюкозы и интенсификации процессов метаболизма.
Значимость местного лечения возрастает и имеет при АВД определенные особенности. Язвенные дефекты при этом отличаются чрезвычайной полиморфностью морфологических изменений – на поверхности язвы одномоментно наблюдаются проявления различных фаз раневого процесса (воспаления, некроза, грануляции и элементы эпителизации). Принцип влажного заживления является в этих ситуациях основополагающим. Мазевые повязки используются крайне редко. Преимущество имеют «многофункциональные» антисептики с широком спектром действия, обладающих разнонаправленным действием на раневой процесс. Как правило, необходимо учитывать длительность местной терапии (многие месяцы и даже годы) и потенциальную возможность местных аллергических реакций в таком случае.
Показания к хирургическому лечению подобных форм АВД являются, как правило, абсолютными.
При диффузных макрофистулезных поражениях (выраженный патологический сброс), вне зависимости от наличия или отсутствия осложнений, следует придерживаться активной хирургической тактики с проведением эмболизация и/или оперативного вмешательства. Время выполнения подобных вмешательств зависит от показателей центральной гемодинамики, выраженности клинической симптоматики и наличия осложнений.
Больные с микрофистулезной формой и ограниченными макрофистулезными формами, особенно при поражениях дистальных отделов конечностей, должны наблюдаться, хирургическое лечение у этой группы пациентов показано при наличии абсолютных показаний. Лечение малосимптомных или асимтомных ангиодисплазий оправдано в случае ограниченных поражений – в этом случае есть вероятность выполнения радикального вмешательства.
Оперативные вмешательства не всегда могут обеспечить ликвидацию артериовенозного сброса, трофические расстройства в этом случае при АВД отличаются чрезвычайной резистентностью к проводимой консервативной терапии, высокой частотой рецидивирования.
За последние десятилетия накоплен определенный опыт применения лазерного излучения в лечения врожденных мальформаций. Лечение венозных мальформаций с применением диодного лазера 1470 нм является достаточно эффективной процедурой у детей, позволяя избежать негативных эффектов склерозирующей терапии. Наилучшие результаты достигаются при лечении поверхностных венозных поражений при непосредственном контакте с очагом поражения. В литературе есть сообщения об успешном опыте применения трех видов лазеров (Nd-YAG, импульсный на красителях и диодный) для фотокоагуляции кожных поражений при АВД.
В клинической практике могут быть использованы две различные техники. При чрескожном доступе лазерный световод вводится к зоне артериовенозного сброса под рентгенологическим контролем. В случае интраоперационного доступа лазерное волокно вводится в расширенные афферентные артерии и эфферентные вены при непосредственной визуализации в случае предварительно выполненной резекции мальформации. Сообщений подобного рода в литературе очень мало, до конца не ясны показания и противопоказания к подобным вмешательствам, возможности сочетания со стандартными эмболизирующими вмешательствами, нет данных и про результаты подобных операций.
Варианты лазерного лечения для АВД в дальнейшем будут уточняться, перспективным здесь являются потенциальные возможности окклюзии сосудов, что в первую очередь снижает риск кровотечений. Возможные варианты доступа в этих случаях: внутрисосудистый (посредством катетеризации), чрескожный пункционный с или без ультразвукового контроля.
В заключении необходимо констатировать, что эмболизация при АВД остается методикой выбора, являясь наиболее патофизиологическим вмешательством. Лазерная коагуляция с применением Nd-YAG лазера может дополнительно после РЭО применяться при обширных микрофистулезных поражениях с целью более радикального устранения ангиоматоза или замедления процесса «коллатерализации» образования.
Трункулярные формы АВД являются основанием для эндоваскулярного лечения. Только единичные формы с периферическим расположением свищей малого диаметра могут рассматриваться для потенциального лазерного лечения с применением KTP- лазера, импульсного или непрерывного Nd-YAG лазера с паравазальным или интралюминальным доступом с возможностью охлаждения. В зависимости от размеров поражения используется техника множественных пункций и сессий.
Наилучшие результаты при лазерной коагуляции достигаются при так называемых гамартомных типах АВД (т.н. «рацемозная ангиома»), где этот метод опять же используется в комбинации со стандартной РЭО.
Для ликвидации очагов гастроинтестинального кровотечения при синдроме Rendu-Osler-Weber (наследственная геморрагическая телеангиоэктазия) целесообразнее всего использовать аргоновую коагуляцию. Для очагов другой локализации методом выбора будет применение Nd-YAG лазера.
Для устранения очагов на слизистой носа и рта, включая слизистую языка, наиболее эффективным является контактное воздействие Nd-YAG лазера с 600 мк волокном с мощностью 12–15 Вт в импульсном режиме.
Медикаментозное лечение в случае АВД может использоваться у новорожденных. Есть сообщения о применении ингибиторов металлопротеиназ (Marimostat) с целью контроля за прогрессией АВД. Применение данного препарата (продолжительность лечения достигала 13 лет) позволило в некоторых клинических случаях достичь инволюции внутрикостной АВД. Однако длительное применение сопряжено и с серьезными побочными эффектами.
Доксициклин может применяться у пациентов с внутричерепными АВД, его применение ведет к снижению частоты кровотечений. Он также ингибирует металлопротеиназы и обладает эффектом подавления ангиогенеза. Однако к каким-либо значимым клиническим изменениям применение данного препарата не ведет.
Для лечения симптомных АВД у детей применялся и Талидомол. Его назначение вело к значительном уменьшению отечного синдрома и болей, особенно у пациентов с наличием PTEN-гамартомы. Какого-либо уменьшения в размерах со стороны АВД не отмечалось.
Авастин/бевасизумаб использовался при лечении пациентов с врожденной наследственной телеангиоэктатической болезнью, приводя к значимому уменьшению носовых кровотечений, связанным с артериовенозным шунтированием. Но его применение может провоцировать кровотечения других локализаций.
Иммунодепресант рапамицин показал высокую эффективность в сокращении размеров болезненной гамартомы при PTEN-синдроме. Добиться полного исчезновения АВД не удается и при отмене препарата клиника вновь возвращается.
Прогноз при АВД зависит, как правило, от двух аспектов: время постановки диагноза и адекватности лечения. В случае появления и прогрессирования АВД в детском возрасте течение мальформации значительно тяжелее по сравнению с теми клиническими случаями, когда АВД начинает прогрессировать в возрасте 40–50 лет.
Терапевтической стратегией у детей при наличии обширного и неоперабельного поражения является стабилизация клинического состояния и предотвращение трофических расстройств и кровотечений. Лечение АВД в этих случаях позволяет замедлить прогрессию заболевания без значимого влияния на качество жизни.
К сожалению, неправомочная лечебная тактика при АВД остается главной причиной осложнений, которых можно было бы избежать. Превентивное лечение и здесь играет весьма значимую роль. Пациенты с АВД должны быть под постоянным наблюдением команды высококвалифицированных специалистов, это позволит избежать использования неэффективных и потенциально опасных методов лечения. Весьма важной задачей завтрашнего дня является и разработка определенных маркеров, которые помогут облегчить задачу скрининга как самих поражений, так и их прогрессии в процессе лечения и динамического наблюдения за этой категорией пациентов.
Артериовенозные дисплазии – врожденные сосудистые мальформации в результате нарушения развития артериальной и венозной системы в процессе онтогенезе. Данные дефекты характеризуются формированием прямых сообщений между сосудами различного диаметра или сетчатой структуры из мельчайших капилляров, которые будучи неполноценными, формируют сосудистую структуру, называемую «центральный очаг» (англ. «nidus»). Поражение при АВД характеризуется как зона патологического артериовенозного шунтирования с низким сопротивлением и кровотоком с высокими скоростными характеристиками, направленным из артериального в венозный отдел через соустья различного диаметра. Различными группами экспертов были предложены несколько классификаций АВД (Гамбургская, ISSVA, Schöbinger, ангиографическая классификации), ставшие результатом лучшего понимания биологии и онтогенеза данных поражений и помогая в то же время в улучшении результатов лечения ангиодисплазий. Гамбургская классификация, базирующаяся на эмбриологической дифференциации трункулярных и экстратрункулярных форм поражения, позволяет указать на потенциальные возможности прогрессирования и/или рецидива заболевания. Большинство АВД относятся к экстратрункулярным формам с наличием шунтирования, реже наблюдаются трункулярные (стволовые) формы. Вне зависимости от типа артериовенозное шунтирование, в конечном счете, ведет к значимым анатомическим, патофизиологическим и гемодинамическим изменениям. Несмотря на более низкую частоту встречаемости (10–20% среди всех ангиодисплазий), АВД являются в клиническом плане наиболее значимой проблемой, неся за собой потенциальный риск потери конечности и даже угрозы для жизни. АВД могут отмечаться в любых частях тела. Клиническая картина зависит от локализации и объема и варьирует от асимптомных вариантов до тяжелых поражений с выраженным патологическим сбросом и проявлениями сердечной недостаточности.
Диагностика и обследование на первом этапе могут быть обеспечены неинвазивными или малоинвазивными методами – дуплексное сканирование, магнитно-резонансная томография и МР-ангиография, компьютерная томография или КТ-ангиография. Ангиография остается «золотым стандартом» диагностики и ее проведение является необходимым для планирования последующего лечения. Для достижения оптимального результата необходимо в рамках мультидисциплинарного подхода интегрировать хирургические и нехирургические возможности лечения. Доступные в настоящее время методики лечения ассоциируют с повышенным риском осложнений. Однако осуществление своевременного вмешательства, пусть даже агрессивного, несмотря на имеющиеся определенные риски, при устранении очага поражения ведет к положительному результату. Такие варианты оперативных вмешательств, как эмболизация афферентных артерий спиралями или лигирование афферентных артерий (скелетизация), оставляют интактной зону артериовенозного сброса и могут являться дополнительными факторами пролиферации в зоне поражения. К тому же данные вмешательства блокируют доступ к зоне артериовенозного сброса в случае необходимости проведения в будущем эндоваскулярных лечебных процедур. В случае трудноудалимых при хирургическом вмешательстве экстратрункулярных инфильтративных форм АВД наиболее приемлемым методом лечения является использование эндоваскулярных методик. Проблема максимального закрытия зоны артериовенозного сброса с применением материальных эмболов (особенно крупных по диаметру), как правило, до конца не решается из-за невозможности воздействия с их помощью на само микроциркуляторное русло. Жидкие склерозанты (этиловый спирт) имеют определенные преимущества в этом отношении, но их полная неуправляемость делает их полноценное применение крайне затруднительным в реальной практике. Соответственно, весьма актуальным вопросом остается поиск наилучших препаратов и отработки методик их применения при эндоваскулярном лечении. Проведение подобного лечения для снижения числа осложнений и достижения определенного результата требует достаточного опыта и специального обучения. В ряде случаев с хорошими перспективами возможно использование техники хирургического удаления ангиоматозных тканей. Подобные вмешательства для снижения травматичности и интраоперационной кровопотери могут быть дополнены предоперационной склеротерапией или эмболизацией. Именно с использованием такого комбинированного подхода достигаются наилучшие результаты в лечении АВД. Адекватная лечебная тактика обеспечивается за счет внедрения мультидисциплинарного подхода и вмешательств, выполняемых высококвалифицированными и специально подготовленными специалистами.