Аш2о 2 что это
Вода: физические, химические свойства, химическая формула, плотность
Содержание:
Вода, или оксид (окись) водорода Н2О – важнейшая среда, в которой проходят все химико-биологические реакции. На 65-70 % организмы животных и человека состоят из воды. Ее содержание в растениях еще выше – 90 %. Вода – это основа жизни.
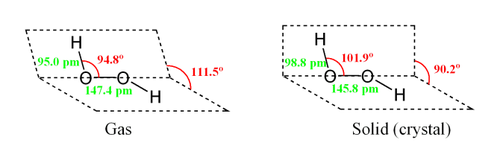
Строение воды
Кислород – электроотрицательный элемент, к которому смещены общие электронные пары. На кислороде возникает частично отрицательный заряд, а на водороде – частично положительный. Вода – электрический диполь. Многие свойства воды обусловлены ее полярностью.
Молекулы воды между собой образовывают водородные связи, которые объясняют высокую плотность и температуру кипения. Чем выше температура реакции, тем меньшее количество связей образуется.
Физические свойства воды
Лед всегда всплывает в водоемах или стаканах с водой. Это связано с тем, что плотность горячей и холодной воды отличается. Лед обладает меньшей плотностью, чем жидкая вода.
Воде свойственна высокая теплоемкость, поэтому она медленно нагревается и остывает. С помощью теплофизических свойств воды регулируется климат. Водные бассейны регулируют температуру на нашей планете. Вода задерживает до 60 % теплового излучения нашей планеты, не позволяя ей охлаждаться.
Теплопроводность воды небольшая. Вода в водоемах нагревается не с помощью молекулярной теплопроводности, а путем перемешивания с помощью волн и течений. Если вода не перемешивается, то она нагревается частями и образуется термическая слоистость (стратификация).
Физсвойства воды отражаются в агрегатных состояниях:
В химии физические свойства воды отражаются в количестве связей между молекулами. В парах находятся отдельные молекулы, в жидкостях между ними образуются водородные связи. Если вода находится в состоянии льда, то каждая молекула соединена с соседними молекулами с помощью четырех водородных связей.
Растворимость веществ в воде
Большинство твердых веществ при нагревании растворяется быстрее. Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
Растворы
Химические свойства воды
Вода – важнейший компонент такой реакции как гидролиз. Гидролиз – взаимодействие соли с водой, в результате которого происходит ионный обмен между молекулами.
Очистка воды
В питьевой воде не должны содержаться примеси и болезнетворные бактерии. Чтобы вода из озер и рек была пригодна для питья, ей дают отстояться в специальных бассейнах. Затем ее фильтруют через слой песка. Очищенную от нерастворимых веществ воду обрабатывают хлором, озоном или ультрафиолетовыми лучами.
Для очищения воды от растворенных в ней веществ используют перегонку, или дистилляцию. Этим способом получают дистиллированную воду. Ее применяют в лабораториях, аптеках, охладительных системах машин и т. д.
Применение воды
Развитие промышленности привело к тому, что многие водоемы загрязнены отходами производства. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию природных ресурсов.
Вода – важный ресурс для всего живого на планете. Если ее запасы на Земле иссякнут, то растения, животные и человек погибнут. Вода является более ценным природным богатством, чем нефть и газ, железо и уголь и т. д. Это связано с тем, что воду невозможно ничем заменить.
Оксид водорода
Оксид водорода
| Вода | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид водорода |
| Традиционные названия | вода |
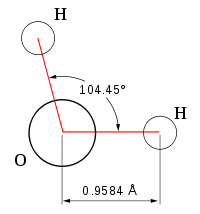
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,9982 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Динамическая вязкость (ст. усл.) | 0,00101 Па·с (при 20 °C) |
| Кинематическая вязкость (ст. усл.) | 0,01012 см²/с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 0 °C |
| Температура кипения | 99,974 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Критическая точка | 374 °C, 22,064 MПа |
| Молярная теплоёмкость (ст. усл.) | 75,37 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | 0,56 Вт/(м·K) |
Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Содержание
Физические и химические свойства
Физические свойства
Вода обладает рядом необычных особенностей:
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а так же того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух. При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект слабее, чем обычное тепловое расширение; при испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
По сходным причинам вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. [2] Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чем основан принцип действия микроволновой печи.
Агрегатные состояния
При атмосферном давлении вода замерзает (превращается в лёд) при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C. При снижении давления температура плавления воды медленно растёт, а температура кипения — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находится в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Изотопные модификации воды
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Химические свойства
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+ анион OH-). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ ок. 16.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода в природе
Атмосферные осадки
Осадки согласно направлению
| «Вертикальные» осадки | «Горизонтальные» осадки | Свободно-парящие структуры |
|---|---|---|
| Дождь | Роса | Облака |
| Дождь со снегом | Иней | Туман |
| Изморось | Атмосферное оледенение | Морская пена |
| Переохлаждённая морось | Гололёд | |
| Снег | ||
| Снежная крупа | ||
| Снежные зерна | ||
| Ледяная крупа | ||
| Ледяной дождь | ||
| Град | ||
| Ледяные кристаллы |
Осадки согласно состоянию
| Жидкие осадки | Твёрдые осадки |
|---|---|
| Дождь | Снег |
| Дождь со снегом | Снежная крупа |
| Изморось | Снежные зерна |
| Переохлаждённая морось | Ледяная крупа |
| Роса | Ледяной дождь |
| Град | |
| Ледяные кристаллы | |
| Иней | |
| Атмосферное оледенение | |
| Гололёд |
Виды воды
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и в свою очередь приобретать самые разные формы, которые зачастую соседствуют друг с другом. Водный пар и облака в небе, морская вода и айсберги, горные ледники и горные же реки, водоносные слои в земле. Вода способна растворять в себе много веществ, приобретая тот или иной вкус. Из-за важности воды, «как источника жизни» её нередко подразделяют на типы.
Характеристики вод
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Исследования воды
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Биологическая роль
Вода играет уникальную роль, как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Применение
Земледелие
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90% в некоторых странах.
Питьё и приготовление пищи
Живое человеческое тело содержит от 55% до 78% воды, в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. Для нормального функционирования организма человеку нужно усвоить от 1 до 7 литров воды за день в зависимости от температуры и влажности окружающей среды, физической активности и пр.
Растворитель
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Теплоноситель
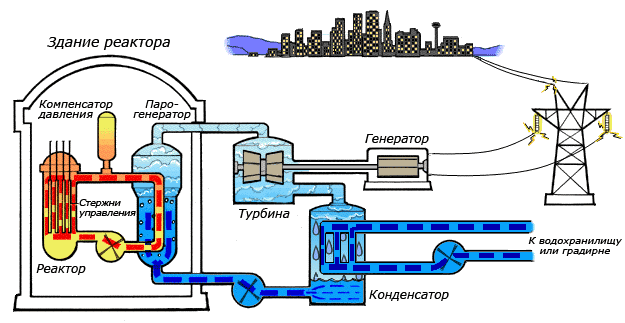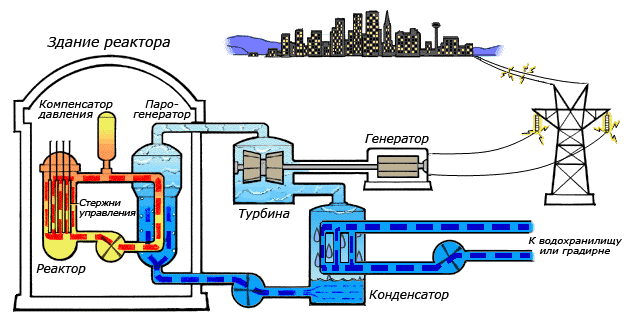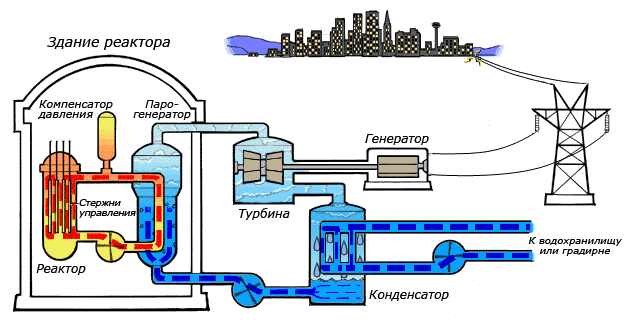
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в качестве льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Пожаротушение
В пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции от огня в составе пены.
Спорт
Многие вида спорта проходят на водных поверхностях, на льду, на снегу и даже в воде. Это подводное плавание, хоккей, лодочные виды спорта, биатлон и пр.
Инструмент
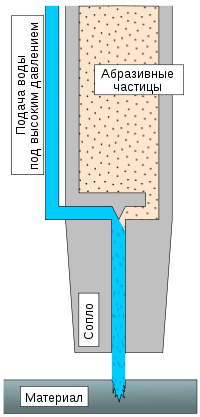
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Перекись водорода
Перекись водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Физические свойства | |
| Плотность вещества | 1.4 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная г/100 мл |
| Классификация | |
| номер CAS | [7722-84-1] |
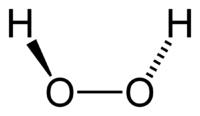
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение:
Содержание
Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температуре, немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Химические свойства
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10 –12 ). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получаются в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2009 год) — около 6 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 3, 30, 38, 50, 60, 85, 90 и 98%. 30% водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.