Аспергиллез что это такое простыми словами
Аспергиллез
Аспергиллез – болезнь, вызываемая различными видами плесневых грибов рода Aspergillus. Чаще протекает с преимущественным поражением легких, у лиц с иммунодефицитами принимает тяжелое септическое (генерализованное) течение.
Что такое Аспергиллы
Возбудители – различные виды рода Aspergillus. Наибольшее значение в патологии человека имеют A. niger, A. flavus, встречаются и другие виды (A. fumigatus, A. nidulans). Морфологически состоят из однотипного мицелия (шириной 4-6 мкм), иногда обнаруживаются «головки» с конидиями. При посеве на среду Сабуро быстро растут, образуя плоские колонии, сначала белые, слегка пушистые или бархатистые, затем принимают синеватую, коричневую, желтоватую и другую окраску (в зависимости от вида); при этом поверхность их становится мучнистой, порошковатой. Аспергиллы обладают большой биохимической активностью, образуют различные ферменты (протеолитический, сахаролитический, липолитический), а некоторые виды содержат эндотоксины, при введении которых экспериментальным животным развиваются параличи и наступает их гибель. Обладают аллергизирующим действием. Из дезинфицирующих средств на аспергиллы наиболее активно действуют растворы карболовой кислоты и формалин.
Как происходит заражение
Аспергиллы широко распространены в природе. Их постоянно можно обнаружить в почве, зерне, муке, сене (особенно заплесневелых), в пыли помещений, где обрабатываются шкуры, шерсть, пенька. Обнаруживались аспергиллы даже в пыли лечебных учреждений, что обусловливало внутрибольничное инфицирование.
Заражение аспергиллезом просиходит следующим образом. Возбудитель проникает в организм, как правило, через воздух с пылью. Из профессиональных групп чаще поражаются работники сельского хозяйства, работники ткацких и бумагопрядильных предприятий. Заболевание у ослабленных лиц может возникнуть и как эндогенная инфекция, так как на слизистой оболочке зева здоровых людей иногда обнаруживаются аспергиллы. За последние годы актуальной проблемой стал аспергиллез у лиц с различными иммунодефицитами. В частности, у 20%таких больных развиваются микозы, а среди последних более 70% приходится на аспергиллез. Наблюдаются внутрибольничные заражения иммунодефицитных пациентов пылью, содержащей аспергиллы (воздушно-пылевая передача инфекции). Случаев заражения человека от больных людей не наблюдается.
Развитие болезни
Возбудитель аэрогенным путем попадает на слизистые оболочки верхних дыхательных путей. Может наступать инфицирование через кожу, обычно измененную каким-либо другим патологическим процессом. Ведущую роль в патогенезе аспергиллеза играет снижение иммунной защиты организма. Аспергиллез осложняет различные патологические процессы кожи, слизистых оболочек, внутренних органов. В частности, легочные формы аспергиллеза возникали на фоне бронхоэктатической болезни, абсцессов легкого, туберкулеза легких, рака легких, хронического бронхита и др.
У людей с иммунодефицитами
В последние годы аспергиллез стал особенно часто наблюдаться у лиц с иммунодефицитами (врожденные иммунодефициты, лица, получающие противоопухолевую химиотерапию, иммунодепрессанты, а также ВИЧ-инфицированные). Он встречается значительно чаще, чем другие глубокие микозы.
Легочные формы
У ослабленных лиц вначале поражаются грибом легкие, затем в процесс вовлекаются плевра, лимфатические узлы. Током крови аспергиллы могут заноситься в другие органы, образуя там специфические гранулемы, которые обычно абсцедируют. Из легочного аспергиллез превращается в генерализованный (септический) и нередко (свыше 50%) заканчивается гибелью больного. Спасти удается тех больных, у которых сохранились в какой-то мере функции иммунной системы. При массивной ингаляции спор аспергилл у лиц с нормальной иммунной системой может возникнуть острая диффузная пневмония, заканчивающаяся самовыздоровлением.
Симптомы аспергиллеза
Инкубационный период точно не установлен. Аспергиллы могут поражать любые органы и ткани. К клиническим проявлениям, симптомам аспергиллеза можно отнести следующие формы:
1) бронхолегочный аспергиллез;
2) генерализованный (септический)
аспергиллез;
3) аспергиллез ЛОР-органов;
4) аспергиллез глаза; 5)
аспергиллез кожи;
6) аспергиллез костей;
7) прочие формы аспергиллеза (поражение слизистых оболочек рта, гениталий, мико-токсикозы и пр.).
Бронхолегочный аспергиллез
Бронхолегочный аспергиллез может проявляться вначале как аспергиллезный бронхит или трахеобронхит. Вначале аспергиллы находятся в поверхностных слоях слизистой оболочки бронхов, затем процесс распространяется глубже, образуются поверхностные и более глубокие изъязвления. Заболевание протекает хронически, больного беспокоит общая слабость, кашель с выделением серого цвета мокроты, иногда с прожилками крови. В мокроте могут обнаруживаться комочки, в которых содержатся аспергиллы. Процесс
обычно прогрессирует, захватывает легкие, развивается аспергиллезная пневмония.
Аспергиллез легких
Легочная форма микоза может быть острой и хронической. При острых формах появляются такие симптомы, как повышенная температура тела, лихорадка обычно неправильного типа, нередко отмечаются повторные ознобы, появляется кашель с обильной вязкой слизисто-гнойной или кровянистой мокротой. У некоторых больных мокрота содержит зеленовато-серые комочки, в которых при микроскопии обнаруживаются скопления мицелия и спор гриба. Появляются одышка, боли в груди, ночные поты, нарастает слабость, похудание. При выслушивании отмечаются мелкопузырчатые влажные хрипы, иногда шум трения плевры. В крови лейкоцитоз (до 20х109 /л), эозинофилия, СОЭ увеличена. При рентгенологическом исследовании обнаруживается воспалительная инфильтрация в виде овальных или округлых инфильтратов, склонных к распаду. Вокруг образующихся полостей виден широкий инфильтративный вал.
Хроническая форма
Хронические формы легочного аспергиллеза обычно вторичны и наслаиваются на различные поражения легких (бронхоэктазы, каверны, абсцессы). Клиническая картина складывается из симптомов основного заболевания и поражений, обусловленных аспергиллезной инфекцией. Иногда больные отмечают запах плесени изо рта, в мокроте могут появиться зеленоватые комочки, состоящие из скоплений гриба. Рентгенологически характерным является заполнение полостей, возникающих в результате основного заболевания, своеобразной тенью в виде шара с воздушной прослойкой между тенью шара и стенками полости. Эта прослойка газа выявляется в виде своеобразной серповидной полости («ореола»). Летальность при легочном аспергиллезе колеблется от 20 до 37%.
Септические формы аспергиллеза
Септические (генерализованные) формы аспергиллеза развиваются на фоне резкого угнетения иммунитета (больные СПИДом и др.). Эта форма характеризуется гематогенным распространением аспергилл с образованием метастазов в различных органах и тканях. Могут наблюдаться поражения желудочно-кишечного тракта (симптомы: тошнота, рвота, запах плесени изо рта, жидкий пенистый стул, содержащий большое количество аспергилл), абсцессы головного мозга, специфические увеиты, множественные поражения кожи в виде своеобразных узлов. Наблюдаются и изменения органов дыхания, с которых обычно и начинается аспергиллезный сепсис. У больных СПИДом симптомы аспергиллеза сочетаются с проявлениями основного заболевания и оппортунистических инфекций (пневмоцистоз, саркома Капоши, криптоспороидоз, кандидоз, генерализованная герпетическая инфекция и др.). На этом фоне аспергиллезный сепсис, или генерализованный аспергиллез, приводит к летальному исходу.
Аспергиллез ЛОР-органов
Аспергиллез ЛОР-органов проявляется в виде наружного и среднего отита, после операций на внутреннем ухе, аспергиллеза с поражением слизистой оболочки носа и придаточных полостей, аспергиллеза гортани. Может быть аспергиллезное поражение кожи и ногтей. Профессиональный аспергиллез может развиваться у лиц, имеющих контакт со спорами различных видов аспергиллов (ткацкие фабрики, шпагатно-прядильные, производство солода и др.). Аспергиллез чаще протекает у них в виде хронического бронхита, иногда с симптомами бронхоспазма.
Течение аспергиллеза у больных СПИДом
Аспергиллез является самым частым микозом, развивающимся на фоне иммунодефицита. Он возникает или в конце предСПИДа, чаще уже при развернутой клинической симптоматике СПИДа. Инфицирование наступает экзогенно воздушно-пылевым путем, что может происходить и во время пребывания в лечебном отделении. Заболевание развивается быстро, вначале в виде легочного аспергиллеза, который затем переходит в септическую (генерализованную) форму и сопровождается поражением многих органов и систем. Протекает тяжело.
Диагноз и дифференциальный диагноз
При распознавании аспергиллеза учитываются эпидемиологические предпосылки (профессия, наличие болезней, ослабляющих иммунитет, и др.). Из поражений бронхов и легких диагностическое значение имеет длительное течение болезни, образование характерных инфильтратов с последующим распадом, характер мокроты, лейкоцитоз, эозинофилия. Подтверждением диагноза служит выделение возбудителя (из мокроты, материала, взятого из бронхов, биоптатов пораженных органов). Из крови аспергиллы выделяются очень редко даже при генерализованных формах аспергиллеза. Диагностическое значение имеет появление антител к возбудителю, выявляемых при помощи серологических реакций (РСК и др.). Кожные пробы со специфическим аспергиллезным антигеном можно использовать лишь при относительно доброкачественно протекающем микозе у лиц с нормальной иммунной системой. Следует учитывать, что у ВИЧ-инфицированных уже в стадии предСПИДа реакции гиперчувствительности замедленного типа становятся отрицательными. По клиническим и рентгенологическим данным аспергиллез необходимо дифференцировать с другими микозами (нокардиоз, гистоплазмоз, кандидоз), а также с туберкулезом легких, абсцессами легких, новообразованиями, хроническим бронхитом.
Лечение
Лечение легочного и генерализованного аспергиллеза представляет трудную задачу. Химиотерапия малоэффективна. Для терапии легочного аспергиллеза с ограниченным инфильтратом в последние годы успешно применяют хирургические методы (лобэктомию с резекцией пораженных участков легкого). У большинства больных операция протекает без осложнений и дает хорошие отдаленные результаты (рецидивов не наблюдается). При распространении процесса на многие органы хирургические методы используются в комплексе с консервативным лечением.
Назначают препараты йода внутрь в нарастающих дозах. Используют йодид калия (или натрия): вначале 3% раствор, затем 5 и 10% раствор по 1 столовой ложке 3-4 раза в день; 10% настойку йода в молоке от 3 до 30 капель 3 раза в день. Из противомикозных антибиотиков амфотерицин В. Препарат применяют внутривенно в 5% растворе глюкозы (50 000 ЕД амфотерицина В в 450 мл раствора глюкозы), вводят капельно в течение 4-6 часов. Суточную дозу назначают из расчета 250 ЕД/кг. Препарат вводят 2-3 раза в неделю. Длительность курса зависит от клинической формы аспергиллеза и колеблется от 4 до 8 нед (у ВИЧ-инфицированных дольше). При легочных формах аспергиллеза показаны ингаляции растворов йодида натрия, нистатин натриевой соли (10000 ЕД в 1 мл), 0,1% раствор бриллиантового зеленого (5 мл). При наслоении вторичной инфекции (обычно стафилококковой) можно применять оксациллин (по 1 г 4 раза в день) или эритромицин (по 0,25 г 4 раза в день). Антибиотики тетрациклиновой группы и левомицетин противопоказаны, так как они способствуют возникновению аспергиллезов.
Назначают витамины и общеукрепляющее лечение. При лечении аспергиллезных поражений кожи и слизистых оболочек используют местно противовоспалительные и противомикозные препараты.
Прогноз
При легочных формах летальность составляет 20-35% (у лиц с иммунодефицитами, не связанными с ВИЧ-инфекцией,-около 50%). При генерализованной (септической) форме прогноз неблагоприятный. При аспергиллезе кожи и слизистых оболочек прогноз благоприятный.
Литература
3. Лобзин Ю.В. «Руководство по инфекционным болезням», 2002 г.
4. Шлоссберг Д. «Дифференциальная диагностика инфекционных болезней», 2003 г.
Аспергиллез
Аспергиллез – это патологическое состояние, вызванное плесневыми грибами рода Aspergillus. Протекает в большинстве случаев с преимущественным поражением легких. Аспергиллы относят к классу сумчатых грибов, к гифомицетам, образуют протеолитический, цукролитичный, липолитичный ферменты, некоторые обладают эндотоксином. Борются с ними карболовая кислота и формалин.
Аспергиллез бывает нескольких видов:
Причины
Болезнь развивается в результате попадания в организм человека грибка Aspergillus. На его выростах мицелия появляются конидии, которые выбрасывают в воздух споры. Конидии попадают на открытую рану или проникают внутрь с некачественной пищей.
Aspergillus присутствуют в ванных комнатах, душевых кабинках, вентиляционных системах, кондиционерах, старых книгах или подушках, в горшках комнатных растений и даже на продуктах.
Симптомы
Повышается температура тела, кашель с вязкой обильной мокротой слизисто-гнойного или кровянистого характера, далее одышка, боль в груди, возможны ночные поты, у пациента снижается вес, нарастает слабость. При аускультации выслушиваются влажные мелкопузырчатые хрипы, шум трения плевры. При исследовании крови обнаруживается лейкоцитоз, эозинофилия, увеличение СОЭ. На рентгенограмме – воспалительная инфильтрация, имеющая склонность к распаду.
Хронический легочный аспергиллез, как правило, вторичный, наслаивается на другую патологию (абсцессы, бронхоэктазы, каверны). Иногда у пациентов возможен запах плесени изо рта, зеленоватые комочки из скоплений гриба в мокроте. Рентгенологическое исследование легких помогает обнаружить полости, которые заполненны своеобразной шарообразной тенью с воздушной прослойкой.
Септическая (генерализованная) форма возможна при резком угнетении иммунитета (например, у больных СПИДом), характерно гематогенное распространение аспергилл и образование метастазов в разных органах и тканях. Поражаются желудочно-кишечный тракт (запах изо рта плесени, тошнота, рвота, пенистый жидкий стул), головной мозг, кожа, глаза. Возникают патологические изменения в органах дыхания (чаще всего именно с них берет начало сепсис), возможен летальный исход.
При аспергиллезе ЛОР-органов возникает средний и наружный отиты, поражение гортани, слизистой носа, а также придаточных пазух.
Поражение кожи характеризуется образованием инфильтратов, узлов, язв и т.д. Что касается глаз, то появляются сильный зуд, слезотечение, отек конъюнктивы, покраснение, гнойные выделения.
Диагностика
Необходимо учитывать эпидемиологические предпосылки (наличие патологии, ослабляющей иммунитет, профессию и др.). В клиническом анализе крови обнаруживается повышение уровня лейкоцитов, эозинофилия. Подтверждает диагноз выделение возбудителя (из материала, взятого из бронхов, мокроты, биоптатов пораженных органов).
Лечение
Лечение аспергиллеза представляет собой довольно трудную задачу. Оно включает:
Профилактика
Профилактически нельзя полностью избежать контактов с плесенью, но в том случае, если по той или иной причине у вас ослаблен иммунитет, постарайтесь избегать таких очевидных источников плесени, как стройки, пещеры, зернохранилища, старые здания и т.п.
Так, при консультации отоларинголог предложит принимать профилактические препараты и носить защитную маску.
Синдром больной гробницы
Синдром больной гробницы
коллаж автора статьи (изображения из открытых источников)
Автор
Редактор
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Здания тоже болеют
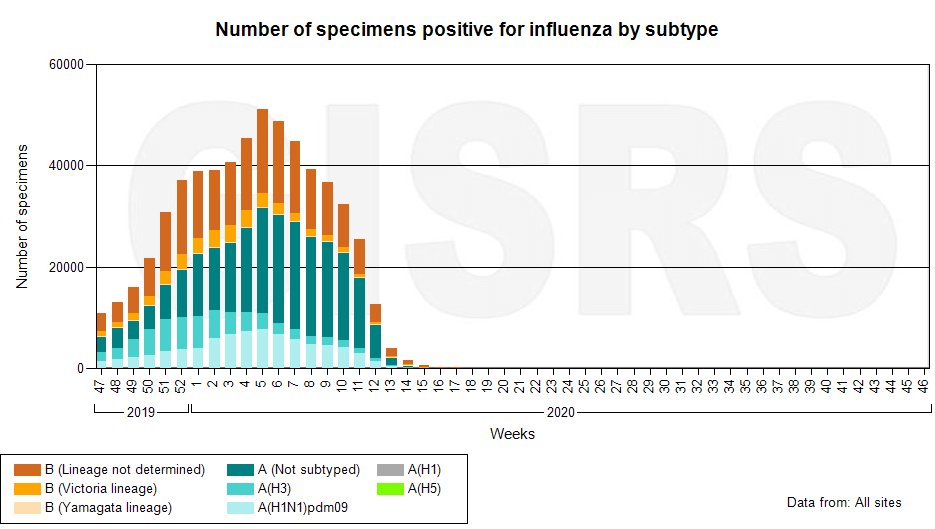
В современных непростых эпидемических реалиях каждый из нас видел в масс-медиа призывы, снабженные хэштегами «#домабезопаснее» и «#останьсядома». И, похоже, санитарно-гигиенические мероприятия действительно дали свои плоды: с 16-ой недели 2020 года, по данным FluNet, в мире практически перестали регистрироваться случаи гриппа (рис. 1). То есть меры, замысливавшиеся как антиковидные, оказались, в первую очередь, противогриппозными.
Рисунок 1. Число положительных проб на вирус гриппа (информация по циркуляции вируса гриппа в 69 странах)
Однако, длительное пребывание человека в закрытых помещениях само по себе может стать фактором, повышающим риск развития самых разных патологий. Со времен неолитической революции, ознаменовавшей переход от кочевого образа жизни к оседлости, люди начали всё больше времени проводить в тех или иных строениях. Постоянные переходы со стоянки на стоянку не позволяли накапливаться на одном месте фекальным массам и отходам хозяйственной деятельности, которые могли бы стать настоящим «банком», хранившим возбудителей инфекций с различными механизмами передачи. Появление стационарных жилищ оказалось для микроорганизмов настоящим подарком, максимально сократившим их «путь к телу» человека. История знает массу примеров чудовищных эпидемий, возникших и распространившихся именно из-за отсутствия бытовой санитарии в условиях скученного долговременного проживания людей на одном месте.
В 1983 году Всемирная организация здравоохранения (ВОЗ) опубликовала доклад, описывающий широкий спектр расстройств, возникающих при длительном пребывании в помещении. Головная боль, затруднение дыхания, насморк, раздражение глаз, носа и горла, усталость, аллергические проявления, головокружение и тошнота — все это было описано емким термином «синдром больного здания» (СБЗ). Эксперты ВОЗ отмечали, что примерно 30% зданий в США «больны» из-за некачественных строительных материалов, нерационально организованной вентиляции, а также герметизации, создающей идеальные условия для размножения и распространения микроорганизмов [1]. Проблема встала достаточно остро, ведь зачастую к врачам обращались люди с симптомами ОРВИ, возникавшими без всяких видимых причин. Диагностика была затруднена, так как эти чисто «простудные» симптомы к заболеваниям группы ОРВИ никакого отношения не имели. Несчастные пациенты были вынуждены думать, что они попросту «сочинили» свой недуг, и возвращались от врача без верного диагноза в губительные объятия своего «больного» дома.
К истории вопроса
Одно из самых ранних упоминаний о патогенной способности плесени сделал английский врач и писатель Джон Флойер. В 1698 году он опубликовал первое издание своего «Трактата об астме», ставшее первым пособием по этой болезни. В нем он отмечал среди факторов, провоцирующих астму, «сырые дома и болотистые страны». Флойер описывал случай с одним астматиком, «который впал в сильный припадок, войдя в винный погреб», предположительно из-за «дыма» в воздухе. В эпоху господства в медицине парацельсовой ятрохимии, объяснявшей возникновение болезней нарушением химического баланса в организме, это было достаточно смелым предположением [6].
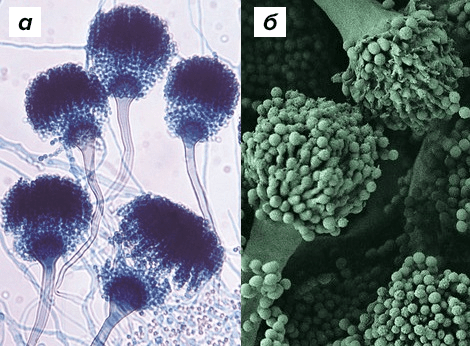
Как самостоятельную таксономическую единицу род Aspergillus (одну из наиболее часто встречающихся в окружающей среде групп патогенных микроскопических грибов, способных вызывать аспергиллёз — заболевание преимущественно дыхательной, а также нервной и пищеварительной систем) выделил итальянский биолог Пьер Антонио Микели в 1729 году. Мицелий гриба под микроскопом напомнил ему аспергилл — кропило для святой воды, — что и побудило ученого дать грибам такое родовое имя (рис. 2) [7].
Рисунок 2. Конидиальные головки Aspergillus fumigatus под микроскопом. а — световая микроскопия (окрашено PAS-методом); б — электронный сканирующий микроскоп.
Как самостоятельную патологию аспергиллез выделил Рудольф Вирхоф в середине XIX века — в период появления микробной теории возникновения инфекционных болезней.
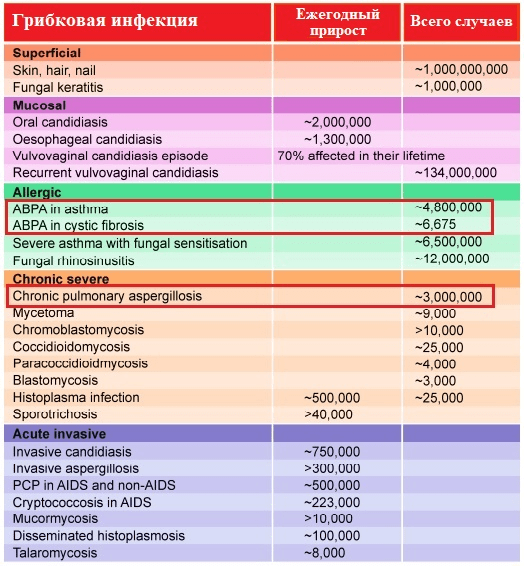
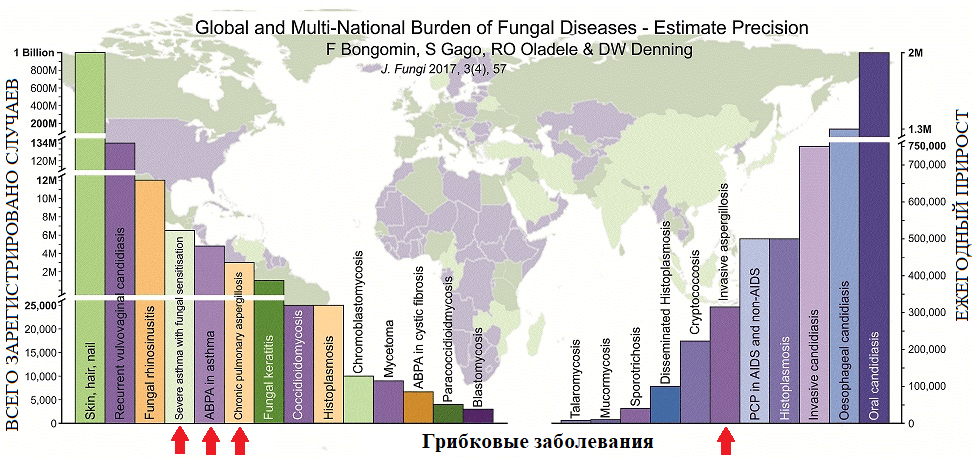
Современная систематика насчитывает уже более 350 видов в составе рода Aspergillus; патологические изменения дыхательной системы наиболее часто вызывает A. fumigatus, реже — A. flavus, A. niger, A. terreus, A. nidulans и A. clavatus [8]. Согласно проведенному в 2017 году обширному метаисследованию, наибольший вклад в структуру хронических легочных и аллергических заболеваний микотической природы принадлежит именно грибам рода Aspergillus — возбудителям различных форм аспергиллеза (рис. 3).
Рисунок 3. Зарегистрированные случаи микоинфекций (всемирное исследование, основанное на метаанализе информации о заболеваемости в 43 странах мира). ABPA — аллергический бронхолегочный аспергиллез и хронический легочный аспергиллез (на рисунке выделены красным маркером) — наиболее распространенные хронические и аллергические микозы.
Рисунок 4. Количество зарегистрированных в мире случаев микотических инфекций (по состоянию на 2017 год). Красные стрелки указывают на вклад аспергиллов в формирование общемировой картины микотической заболеваемости (слева направо: астматический, аллергический бронхиальный, хронический легочный, инвазивный аспергиллезы).
Fungi sexual revolution
На протяжении длительного периода времени ученые-микологи относили аспергиллы к дейтеромицетам — несовершенным грибам, не имеющим стадии полового размножения. Строение гриба исследователи представляли в виде достаточно сильного мицелия, разделенного перегородками (что характерно для высших грибов) и обладающего конидиеносцами — дифференцированными спороносцами, на которых в результате митотического деления созревают бесполые споры — конидии.
Споры сами по себе являются гаплоидными клетками (n), генетически идентичными родительским. При наличии благоприятных условий конидии способны прорастать и развиваться в новый организм. Такой механизм помогает грибам как в размножении, так и в расселении. С одной стороны, образование спор путем простого митоза занимает достаточно мало времени, но с другой — ставит перед размножающимся бесполым путем организмом серьезную эволюционную задачу: приспосабливаться к изменяющимся условиям окружающей среды только через процесс мутагенеза. А ведь подавляющее большинство мутаций случайны и не адаптивны! Таким образом, обладающий лишь бесполым способом размножения организм должен будет пройти сквозь длительную череду ненаправленных изменений в процессе естественного отбора, прежде чем выработает полезные приспособительные признаки.
У несовершенных грибов эта проблема частично решается наличием парасексуального цикла размножения, присутствующего также и у аспергиллов. При таком типе размножения происходит слияние гиф, что ведет к слиянию цитоплазмы и ядер двух клеток внутри одной. В процессе этого восстанавливается парность гомологичных хромосом и формируется диплоидный — двойной (2n) набор хромосом. Образовавшийся в итоге гетерокарион часто нестабилен и способен «терять» хромосомы путем митотического кроссинговера и гаплоидизации. Первый путь заключается в обмене генами между хромосомами, второй — в нерасхождении пар хромосом в процессе митоза, приводящем к случайному их распределению и образованию гаплоидных клеток. В отсутствии полового процесса парасексуальный цикл является единственным способом рекомбинации, способствующим поддержанию генетического разнообразия в популяции [11].
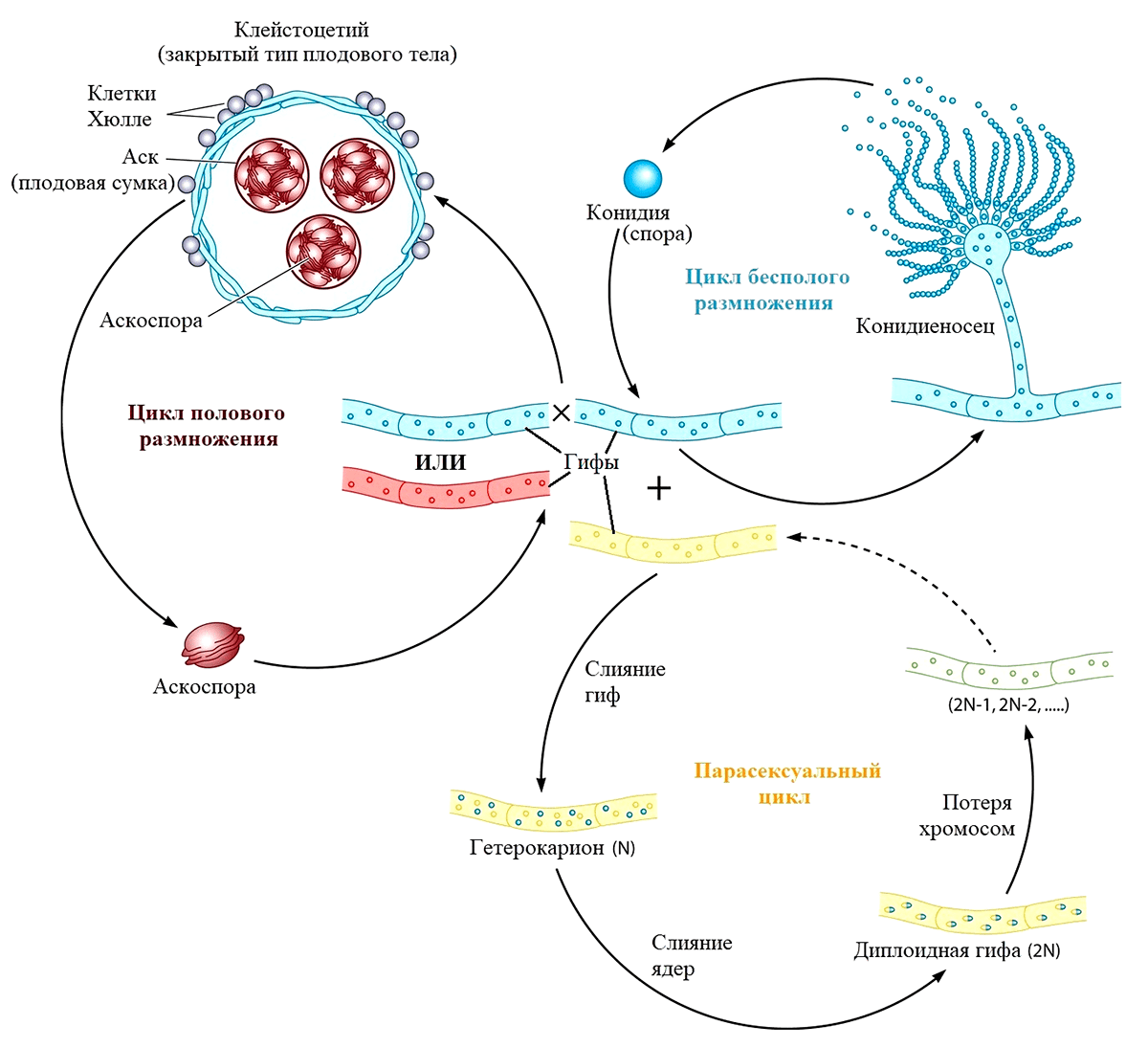
До конца первого десятилетия XXI века бесполый и парасексуальный циклы были единственными известными науке способами размножения грибов рода Aspergillus. В 2009 году Дэвиду Гейзеру удалось совершить настоящую «сексуальную революцию» в мире микологии. Он экспериментально доказал, что изолированные популяции A. fumigatus способны продуцировать как бесполые споры, так и половые — аскоспоры. Такой тип размножения характерен для аскомицетов, обладающих специальными органами полового спороношения — сумками (асками). Половой процесс у аспергилла протекает на среде, содержащей мало азота и много восстановителей. При этом формируются половые органы — спирально закрученные короткие гифы, при слиянии которых возникает двуядерная клетка, от которой отходят многочисленные аскогенные гифы. Это открытие позволило ученым кардинально пересмотреть систематическое положение аспергиллов и открыло новые перспективы их использования в качестве модельных организмов в генетических исследованиях [41]: для каждого их трех типов размножения (рис. 5) свойственно наследование характерного только для него фенотипа [12].
Рисунок 5. Половой, бесполый и парасексуальный циклы размножения Aspergillus fumigatus
Выяснилось, что при половом размножении они реализуют либо гомоталлическую (однополую и самооплодотворяющуюся), либо гетероталлическую (раздельнополую, аллогамическую) систему размножения.
В первом случае один организм обладает как мужскими, так и женскими репродуктивными структурами, а противоположные половые функции выполняются разными клетками одного мицелия. Таким образом, одна вегетативная спора способна произвести колонию, размножающуюся уже половым путем в условиях достаточно жесткой изоляции.
Во втором случае предполагается наличие у организма структур размножения, относящихся только к одному из полов, и требуется уже наличия второго партнера для образования споры.
Плодовое тело — репродуктивная часть организма гриба — представлено клейстоцетием, внутри сумок которого и созревают аскоспоры путем комбинации митоза и мейоза (рис. 5). Мейоз превращает ядро исходной диплоидной клетки (зиготы), образовавшейся в результате оплодотворения, в четыре гаплоидные. Перед мейозом ДНК обоих наборов хромосом зиготы удваивается, так что хромосомы двойного набора становятся двухроматидными. Ядро, содержащее уже два набора двухроматидных хромосом, делится в две стадии с образованием четырех новых ядер. Каждое из них обладает одинарным (гаплоидным) набором однохроматидных хромосом. На заключительной стадии каждое из этих ядер снова удваивает ДНК, и клетка делится митотически. В результате образуются аскосопоры, обладающие большим запасом питательных веществ и служащие грибам средством массового размножения, так как не требуют для прорастания периода покоя [13].
Современные исследования в области генетики пола аспергиллов показали, что их размножение регулируется генами, расположенными в MAT-локусах (matting type genes) и определяющими их половой тип (аналог пола у животных): MAT1-1 или MAT1-2. Глобальное исследование «сексуальности» аспергиллов, опубликованное в 2020 году [14], основывалось на анализе 131 географически изолированной популяции Aspergillus fumigatus из шести различных регионов. 111 из них были получены из окружающей среды, 20 — из клинических образцов (табл. 1).
| Регион | Число популяций | Половой тип | |
|---|---|---|---|
| MAT1-1 | MAT1-2 | ||
| Европа | 39 | 61,5% | 38,5% |
| Северная Америка | 29 | 48,3% | 51,7% |
| Южная Америка | 7 | 42,9% | 57,1% |
| Азия | 27 | 55,6% | 44,4% |
| Африка | 23 | 43,5% | 56,5% |
| Австралия | 3 | 33,3% | 66,7% |
Это исследование позволяет утверждать, что именно половой цикл «виновен» в нарастающей скорости распространения устойчивости аспергиллов к азольным фунгицидным средствам — одним из самых распространенных в современной клинической практике. Кроме того, половой цикл может серьезно снижать эффективность диагностических тестов, основанных на гипотезе о клональности большинства патогенных грибов — точном повторении дочерним организмом родительского в процессе бесполого размножения. Санитарный аспект значимости здесь тоже не остается в стороне: половые споры зачастую лучше переносят неблагоприятные условия окружающей среды, чем бесполые, и лучше выживают в жилых постройках [14].
Появление полового цикла было одним из наиболее значимых ароморфозов в эволюции всего живого на Земле. В плане медицинской микробиологии это может грозить нам появлением плесневых грибов с повышенной вирулентностью и устойчивостью к самым разным фунгицидным препаратам, достигнутым путем половой рекомбинации, приводящей к потоку генов между различными популяциями патогенов. В общем, половой процесс смотрится несравненно выигрышнее для аспергиллов по сравнению с бесполым из-за большего разнообразия комбинаций потенциально полезных признаков в условиях изменяющейся окружающей среды. В перспективе, подобные исследования в области генетики пола грибов могут сильно изменить логику разработки и назначения противомикозных средств, основанную на свидетельствах об очень ограниченной способности к половому размножению у других грибных патогенов, которые, по-видимому, размножаются преимущественно бесполым путем.
Невидимый враг
Заражение аспергиллами происходит преимущественно воздушно-пылевым путем, реже — при попадании спор на открытые раны. Осложнения, вплоть до летальных исходов, чаще всего возникают у больных с иммунодефицитами. То есть у пациентов, иммунная система которых не в состоянии бороться с инфекциями (например, из-за длительной терапии кортикостероидами, иммунодепрессантами, вследствие гематологических злокачественных новообразований, СПИДа). Если же аспергиллез развивается как внутрибольничная инфекция из-за сниженной устойчивости больных на фоне иных инфекционных болезней, микроскопический гриб может стать по-настоящему опасным для жизни [15]. Смертность от таких заболеваний в 1,6 раза превышает аналогичный показатель при туберкулезе и в 3 раза — при малярии [16].
Основная проблема своевременной терапии связана с трудностями ранней диагностики и отсутствием вакцин. Дело в том, что даже ставший широко известным сегодня ПЦР-анализ [40] дает до 25% ложноположительных реакций на присутствие в дыхательных путях аспергиллов. В развивающихся же странах аспергиллез вообще в 30% случаев ошибочно диагностируют как туберкулез легких [17]. Между появлением первых симптомов легочной недостаточности и моментом, когда на рентгенограмме можно будет однозначно определить поражение легких плесневыми грибами, может пройти до 10 лет. Часто однозначно поставить окончательный диагноз становится возможным лишь только после смерти пациента [18].
Современные методы диагностики, не обременительные для и без того ослабленного пациента, основываются на тестировании на галактоманнан — компонент клеточной стенки грибов рода Aspergillus. Кокрейновский обзор, посвященный этой методике, показал специфичность галактоманнанового теста к аспергиллу, достигающую 93% [19].
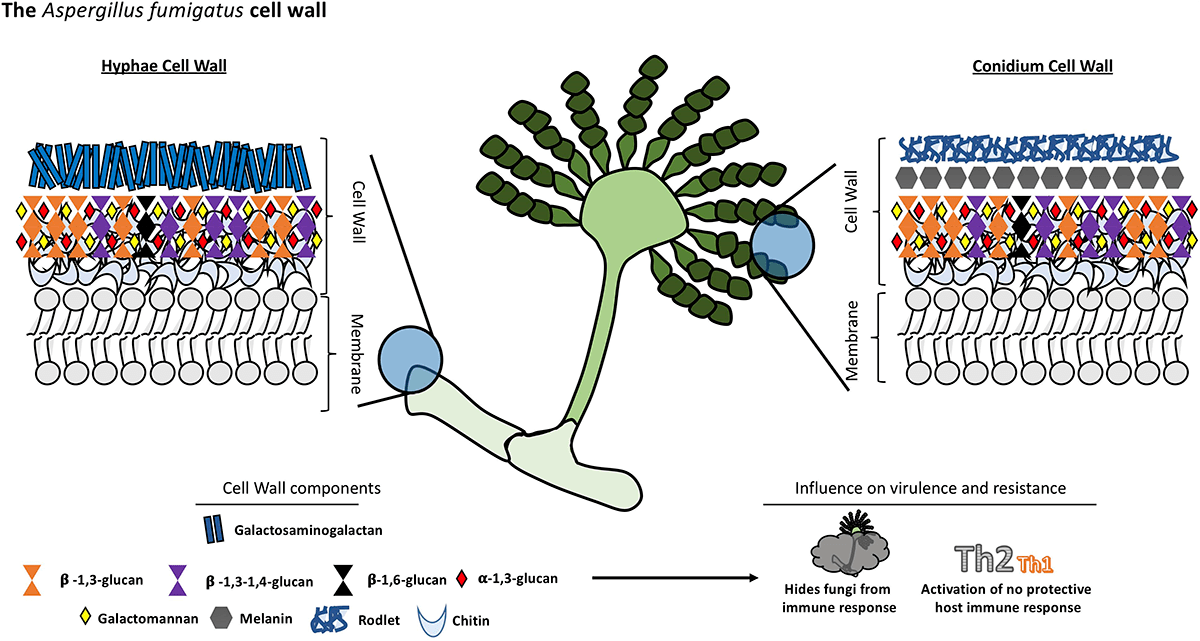
Наука XXI века действительно оставляет все меньше белых пятен на карте истории медицины, позволяя нам получать ответы на загадки, еще не так давно казавшиеся неразрешимыми. В самом конце 2020 года группой американских ученых в журнале Nature было опубликовано исследование, раскрывающее роль другого полисахарида, входящего в состав клеточной стенки аспергиллов — галактозааминогалактана (GAG) в формировании иммунитета к легочной форме аспергиллеза (рис. 6). Этот полисахарид способен активировать инфламмосому, вызывая иммунный ответ Th1- и Th2-типов. Искусственно же лишенный GAG мутантный грибок вовсе не вызывал активацию воспалительного ответа, основанного на секреции цитокинов, и, в результате, патоген проявлял более высокую вирулентность, чем его «оригинальный» собрат [20].
Рисунок 6. Структура клеточной стенки конидий и гиф Aspergillus fumigatus. Внизу указан перечень компонентов клеточной стенки. Гидрофобины RodA (Rodlet на рисунке), меланин, α-1,3-глюкан способны «маскировать» от Т-хелперов полисахариды, к которым у организма возникает устойчивый иммунный ответ. Примечательно, что во внешнем слое клеточной стенки отсутствуют β-1,3-глюкан и хитин (для их распознавания в организме млекопитающих есть специфические рецепторы), что свойственно только данному виду. Ученые считают, что именно это делает А. fumigatus самым инвазивным видом.
В свою очередь, шотландскому коллективу авторов из Абердинского университета удалось выяснить, что ассоциированные с лектинами полиморфные Mincle-рецепторы способны не только узнать конидии, но и усилить сопротивляемость инфицированного аспергиллами организма. Впрочем, особенности процесса формирования иммунитета еще не вполне ясны: выделенные у мышей лектины типа С действительно могут узнавать DHN-участки (дигидроксинафталиновые участки) меланина в спорах плесневых грибов, но механизм их действия еще не раскрыт. Меланин является важным фактором вирулентности для Aspergillus, поскольку он защищает конидии от макрофагов и фагоцитарной активности эпителиальных клеток. Но после поглощения споры альвеолярными макрофагами (видимо, за счет взаимодействия их лектинов с меланином спор) меланин разрушается, и «обнажившиеся» полисахариды вызывают мощный воспалительный ответ у имунностабильного человека [22].
Добытое шотландским коллективом авторов знание открыло новое поле для исследования инновационных способов борьбы с невидимым убийцей, притаившимся в «больных» зданиях. Естественные мутации генов, участвующих в синтезе различных компонентов стенки спор, уверенно приводили к потере вирулентности на модельных организмах и снижению периода выживаемости в открытой среде. В свете этих работ именно клеточная стенка микроскопических грибов видится наиболее привлекательной мишенью для разработки противомикозных препаратов следующего поколения, так как вещества, входящие в ее состав, отсутствуют в организме человека.
В конце 2016 года Европейское респираторное общество (ERS) и Европейское общество по клинической микробиологии и инфекционным болезням (ESCMID) издали первые рекомендации по диагностике и тактике ведения пациентов с различными формами легочных форм аспергиллеза. К сожалению, далеко не все представленные ERS/ESCMID методы могут быть использованы в развивающихся странах. Применяемые в широкой медицинской практике подходы основаны на длительном применении дорогостоящей комбинированной противомикотической терапии. Только для постановки диагноза наиболее опасной и быстропрогрессирующей формы аспергиллеза — инвазивной — требуется не менее 3-4 месяцев. Традиционные диагностические методы лабораторных посевов требуют сохранения микобактерий в легких на протяжении всего этого периода с целью исключения иных микробных заболеваний. Для больного с ослабленным иммунитетом такой период ожидания может оказаться попросту фатальным. В отдельных случаях заболевание может потребовать и хирургического вмешательства — анатомического удаления пораженной части легкого [23].
Часто и по сей день назначаемый антибиотик амфотерицин В (AT-B) ориентирован на эргостерол, содержащийся в клеточных мембранах грибов и простейших. AT-B способен связываться с эргостеролом, формировать ионные каналы, приводящие к потере грибной клеткой катионов К + и Н + и ее гибели. Такое направление терапии было предложено еще в 1957 году и в современных реалиях подвергается критике [24]. Дело в том, что эргостерол выполняет в клетках грибов примерно ту же функцию, что и холестерин в клетках животных — играет роль биослоя, придающего клеточной мембране жесткость, и стабилизирует ее текучесть. Амфотерицин В обладает достаточно низкой специфичностью к эргостеролу и также может связываться с холестерином, вызывая дисфункцию органов млекопитающих. Американское FDA (Food and Drug Administration) сообщает, что у 32% пациентов при длительном применении AT-B наблюдалось острое повреждение почек, зачастую необратимое [24].
Более перспективные триазольные препараты работают иначе. Мишенью для них является процесс биосинтеза эргостерола: триазолы ингибируют фермент ланостерол-14-альфа-деметилазу, ответственный за биохимический путь, преобразующий ланостерол в эргостерол. Нарушение адекватного функционирования мембраны приводит к гибели клетки гриба или ингибированию ее роста и процесса репликации ДНК. Второй механизм действия триазолов связан с подавлением активности цитохрома P450 (CYPs) — фермента, участвующего в цепи дыхания грибов. Преимущество таких препаратов заключается также в редкой встречаемости в природе резистентных к триазолам штаммов грибов рода Aspergillus. Однако открытие факта существования у некоторых видов аспергиллов полового размножения оставляет опасения на этот счет. Недавние лабораторные эксперименты по искусственному скрещиванию A. fumigatus выявили моногенное наследование устойчивости к триазолам [24].
В современной медицине все же остаются нерешенные вопросы в клинике аспергиллеза: ведение пациентов с формами заболевания, не поддающимися лечению; синтез антифунгальных препаратов, нацеленных исключительно на специфичные для таллома грибов химические соединения; разработка способов экспресс-диагностики и выявления основных групп риска (прежде всего профессиональных), в отношении которых наиболее успешной тактикой будет формирование профилактических мероприятий.
На фоне перспективных современных открытий и по сей день все еще остается одна историческая загадка, интересующая не только ученых, которые, как известно, «постоянно скрывают от нас правду», но и разного рода обладателей «истинного» знания — магов, экстрасенсов и альтернативных историков. Постараемся разобраться, какую роль в ней мог сыграть наш герой.
Это сказал фараон
В ноябре 1922 года произошло событие, всколыхнувшее мировую общественность. Археолог Говард Картер, работавший под патронажем Джорджа Герберта, пятого графа Карнарвона, обнаружил в Египте практически нетронутую расхитителями гробницу царя XVIII династии Нового царства — Тутанхамона (рис. 7).
Наконец-то сделали чудесное открытие в Долине Царей: великолепная гробница с неповрежденными печатями. Останется закрытой до вашего приезда. Поздравляю.
Телеграмма Г. Картера графу Карнарвону
Рисунок 7. Руководитель экспедиции — археолог Говард Картер открывает запечатанную погребальную камеру (фото колоризировано). Слева на коллаже — нетронутая печать на дверях зала с саркофагом.
К тому времени обнаружение значительного количества уникальных артефактов в долине Нила породило настоящую египтоманию в Европе, и потому журналисты и репортеры буквально осадили место раскопок Картера. Их любопытство подстегнуло опубликованное в The New York Times сообщение американского египтолога Джеймса Генри Брэстеда, одного из участников раскопок, о событии, случившемся вскоре после открытия гробницы. Ученый рассказал, что, когда Картер отправил одного из наемных египетских рабочих по поручению в свой дом в Луксоре, тот услышал «слабый, почти человеческий крик». Зайдя в дом, он увидел кобру в птичьей клетке, где жила канарейка Картера. Съеденная змеей, олицетворявшей в Древнем Египте царскую власть, птица послужила основанием для слухов о дурных последствиях, грозивших ученым, потревожившим вечный сон фараона.
Окончательно оформил «легенду о проклятии» еще один очевидец событий открытия гробницы — археолог Артур Вейгалл, представлявший на раскопках издание Daily Mail. Вейгалл регулярно подогревал интерес публики к череде мистических событий, сообщая, в частности, о случае, якобы произошедшем с неким польским путешественником, купившим мумии в Александрии и отправившимся с ними домой по морю. Рассказывали, что в пути его преследовали видения двух призраков, а море было неспокойно до тех пор, пока мумии не выбросили за борт.
Дальнейшие события лишь подстегнули истерию вокруг мистической кары, которая должна была постигнуть лиц, посмевших открыть погребальную камеру. 5 апреля 1923 года скоропостижно скончался лорд Карнарвон. Причем за две недели до его смерти оккультная писательница Мария Корелли опубликовала предупреждение о том, что «страшное наказание постигнет любого вторгнувшегося в запечатанную гробницу». Эта цитата из ее новой книги была с удовольствием подхвачена прессой и растиражирована по всему миру (рис. 8).
Рисунок 8. Заметка о смерти лорда Карнарвона в газете Springfield republican, 5 апреля 1923 года
За этим ожидаемо последовало настоящее безумие в средствах массовой информации, опубликовавших вал статей, авторы которых утверждали, что на могиле царя лежит проклятие. История имела настолько большой резонанс, что известный своей суеверностью Бенито Муссолини, когда-то принявший египетскую мумию в качестве подарка, приказал немедленно убрать ее из своей резиденции во дворце Палаццо Киджи.
Свою лепту в мистификацию внес и сэр Артур Конан Дойл, с 1910-х годов серьезно увлекавшийся спиритизмом. Известный писатель посчитал, что «смерть лорда Карнарвона была вызвана «элементалями» — духами, созданными жрецами для охраны царской гробницы». Утверждение сэра Артура еще больше подогрело интерес СМИ к «Проклятию фараонов».
Всего с «Проклятием» современники связали смерти 22 человек, умерших в период с 1923 по 1929 годы (13 из них непосредственно присутствовали при вскрытии гробницы). Ученые, отвергавшие всякие «мистические» объяснения ухода из жизни лиц, причастных к раскопкам, искали свой ответ на широко разрекламированную «загадку». Среди рациональных объяснений скоропостижной смерти графа Карнарвона они выдвигали версию о возможном развитии аспергиллеза, связанного с вдыханием спор микроскопического плесневого гриба рода Aspergillus. Понятие об аспергиллезе охватывает достаточно широкий спектр заболеваний, связанных с поражениями грибным мицелием верхних и нижних дыхательных путей. Болезнь, сопровождающаяся одышкой, кашлем, лихорадкой, болями в груди и кровохарканьем, может протекать как стремительно, так и бессимптомно.
В 2003 году в журнале The Lancet была опубликована статья, анализировавшая обстоятельства скоропостижной смерти графа [25]. Опираясь на документы, описывающие процесс раскопок, ее автор назвал причиной смерти пневмонию, развившуюся «как осложнение на фоне рожи». По мнению специалиста, воспаление легких явилось лишь одним из различных осложнений, возникших в результате прогрессирующей инвазивной инфекции, которая в конечном итоге и привела к полиорганной недостаточности.
И действительно, очевидцы событий утверждали, что незадолго до болезни Карнарвона укусил в щеку москит, и тот сам занес себе инфекцию, порезав место укуса во время бритья плохо стерилизованным лезвием. Такое предположение может выглядеть вполне убедительным, так как еще в 1903 году граф тяжело пострадал во время автомобильной катастрофы и после этого страдал частыми тяжелотекущими легочными заболеваниями. Ослабленную иммунную систему легко поразила рожа, и острый приступ бронхита вполне мог стать для него фатальным. 17 марта 1923 года египтологу поставили диагноз «рожистое воспаление и стрептококковое заражение крови». Карнарвон умер рано утром 5 апреля, страдая от высокой температуры, сильных головных болей, вызванных двусторонней пневмонией, что и привело, в конечном итоге, к сердечной и дыхательной недостаточности [25].
Сначала я ничего не видел, горячий воздух вырывался из помещения, в результате чего пламя свечи мерцало, но вскоре, как только мои глаза привыкли к свету, из тумана медленно появились детали комнаты, странные животные, статуи и золото — всюду блеск золота.
Из дневников Г. Картера
Картер описывал, как лорд Карнарвон с большим энтузиазмом исследовал каждый угол погребальной камеры, ползая по полу и вдыхая горячий воздух.
Воздействие спор действительно может вызвать различные формы пневмонии, к которой особенно чувствительны люди с ослабленным иммунитетом. И контакт Карнарвона с токсичной плесенью, безусловно, мог оказаться фатальным для уже больного человека, чрезвычайно чувствительного к легочным инфекциям. Споры аспергилла могут оставаться спящими в легких инфицированных людей в течение длительных периодов времени, и вполне возможно, что симптомы у лорда Карнарвона действительно не проявлялись в течение пяти месяцев после его первого проникновения в гробницу. 17 марта 1923 года Times напечатала сообщение о том, что лорд Карнарвон «страдал от боли, воспалительный процесс затронул носовые ходы и глаза». Такие симптомы могут соответствовать патологическим процессам, характерным для синусита, вызванного проникновением спор аспергиллов в дыхательные пути.
Примечательно, что такая вероятность подтверждается результатами современных исследований микоинфекций как профессиональных заболеваний археологов. Непривычные для человека микроклиматические условия — высокая температура и влажность, дополненные отсутствием ультрафиолета, — значительно повышают жизнеспособность и вирулентность плесневой микрофлоры. Так, микробиологическое исследование, проводившееся на раскопках древнегреческого города Лаодикея (на терр. совр. Турции), показало, что содержание микробных тел плесени в подземных помещениях древнего города в три раза превышало концентрации грибной микрофлоры, обнаруженной на поверхностях, расположенных на открытом воздухе. У 19,2% археологов отмечались симптомы бронхиальной астмы и аллергического синусита. А одним из преобладающих родов грибов оказался уже знакомый нам аспергилл [27]. У 50% профессиональных шахтеров, страдающих пневмокониозом, в анализах мокроты также обнаруживался A. fumigatus [28], [29].
«Прóклятые» микроорганизмы
Классическая эволюционная теория утверждает, что естественный отбор приводит к снижению вирулентности патогена, передаваемого напрямую от инфицированного организма к здоровому. Действительно, микроорганизмам совершенно невыгодно вызывать активный иммунный ответ у хозяина (а при высокой вирулентности такой непременно возникнет!) и уж тем более убивать его. Патогены, передаваемые через тот или иной компонент окружающей среды, с продолжительностью жизни инфекционных частиц, превышающей период активной болезни у хозяина, уже не будут ограничены этим эволюционным механизмом, и, следовательно, вполне могут позволить себе длительный период вирулентности. Это явление как раз и послужило появлению в микробиологии такого термина как «Проклятие фараонов», объясняющего значительные сроки выживаемости высоковирулентных микроорганизмов в благоприятных условиях окружающей среды (отсутствие ультрафиолета, стабильная температура, постоянная влажность) [32].
Споры грибов рода Aspergillus особенно хорошо прорастают на зерне, запасы которого были в изобилии обнаружены в гробнице Тутанхамона. Граф Карнарвон мог вдохнуть загрязненную зерновую пыль, когда запечатанная гробница была открыта, а спровоцированные автомобильной аварией многочисленные инфекции органов грудной клетки лишь повысили его восприимчивость к токсической плесени.
Микотическая инфекция особенно опасна для людей с ослабленным иммунитетом, крайне редко вызывая осложнения у иммунокомпетентных пациентов [33]. Согласно другому исследованию, опубликованному в The Lancet [34], этот феномен может быть объяснением того, что из 25 европейцев, посетивших гробницу, лишь граф скончался вскоре после ее открытия. Примечательно, что американский железнодорожный магнат Джей Гулд также умер от пневмонии вскоре после посещения усыпальницы Тутанхамона. Личный врач лорда Карнарвона, доктор Джонсон, мог легко принять легочный аспергиллез за двустороннюю пневмонию, поскольку симптомы были похожи: кашель, лихорадка, боль в груди, кровохарканье и одышка. Рентгенограмма грудной клетки также не показала бы диагностически значимых отличий. Безусловно, в 20-е годы XX века медицине были доступны лабораторные методы, необходимые для диагностики аспергиллеза, но доктор Джонсон не проанализировал мокроту своего пациента из-за отсутствия подозрений на возможное влияние микроскопических грибов на ухудшение состояния больного [34].
Можем ли мы однозначно полагать, что причиной череды смертей, начавшейся с Карнарвона и омрачивших великое археологическое открытие, мог быть незримый убийца-гриб, переживший восход и падение империй? Со времени описанных событий прошло без малого целое столетие, вряд ли мы узнаем, была ли гробница Тутанхамона «больна» тем самым синдромом больного здания. Результаты когортного исследования позволяют сомневаться на этот счет. Газеты, по-видимому, непроизвольно «убили» многих людей, участвовавших в открытии гробницы. Согласно одному из газетных списков, 26 человек, связанных с находкой, умерли в течение десяти лет после ее обнаружения. В действительности, только шестеро скончались в течение первого десятилетия, в то время как остальные дожили до достаточного преклонного возраста. Например, «Проклятие фараонов» должно было лежать на плечах самого Говарда Картера (проработавшего в гробнице около 10 лет), однако он прожил еще 17 лет, умерев незадолго до своего 65-летия. Другие участники экспедиции также жили вполне долго и плодотворно: у 26 человек, подвергшихся «проклятию», средний возраст смерти составил 70 лет, по сравнению с 75 годами у тех, кто не подвергался воздействию гробничной микрофлоры. Таким образом, после открытия гробницы Тутанхамона археологи прожили в среднем 20,8 и 28,9 лет соответственно [35].
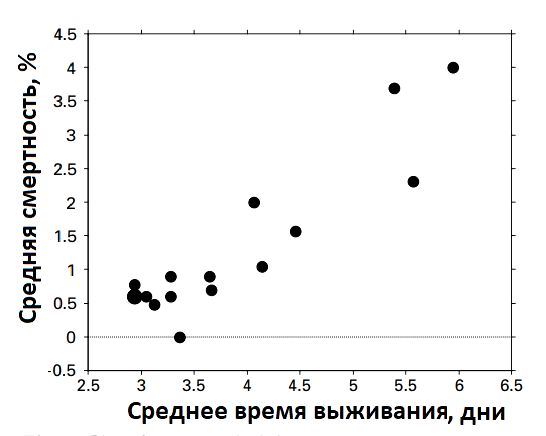
Сравнительные исследования показывают, что патогены, жизненный цикл которых включает стадию свободного существования, обычно вызывают более тяжелые симптомы у своих хозяев, чем патогены, передаваемые напрямую. Для объяснения этой закономерности ученые высказали предположение о том, что опосредованный путь передачи снижает зависимость от доступности хозяина. И патоген, преимущественно передаваемый через окружающую среду, может ждать, пока ему не «подвернется» кто-то подходящий. Такая стратегия существенно снижает энергетические затраты, связанные с постоянной приспособительной рекомбинацией в «поисках» штамма, способного ужиться с организмом-носителем, и эволюционно выглядит достаточно выигрышно [36]. На рисунке видно, что низколетальные инфекционные агенты имеют преимущественно более низкие сроки выживаемости в окружающей среде (рис. 9).
Рисунок 9. График зависимости среднего времени выживания инфекционных агентов от среднего процента смертности инфицированных лиц для 16 респираторных инфекций человека
Таким образом, недооцененный вклад передачи через окружающую среду может объяснить любопытное появление высокой вирулентности у инфекций, которые обычно являются умеренно патогенными при прямой передаче, например, у вируса птичьего гриппа, холерного вибриона, оспы, краснухи и многих других. Построенные математические модели свидетельствовали о том, что если в одном и том же эпидемическом очаге существуют два штамма одного и того же патогена, то в перспективе наиболее вирулентным окажется тот, что способен дольше свободно существовать в окружающей среде вне организма хозяина. Такой штамм показывал способность полностью вытеснять из популяции штаммы, передающиеся преимущественно напрямую: от больного человека к здоровому [37].
Подобных полумистических историй, связанных со «спящими» вековым сном болезнями, можно встретить немало. Например, уже в 70-х гг. ХХ в. 10 из 12 ученых, присутствовавших при вскрытии усыпальницы польского короля Казимира IV, умершего почти за 600 лет до этого, скончались в течение нескольких недель после проникновения в погребальную камеру. Микробиологические посевы c материала, полученного в усыпальнице, выявили наличие разнообразных микроскопических грибов, шесть веков изолированно существовавших в закрытом помещении [38]. Лабораторный анализ мумии Рамзеса II, привезенной в Париж в 1976 году, также обнаружил присутствие 89 различных видов грибов, в том числе аспергиллов [39].
Вместо послесловия
Чем же могут быть полезны нам сейчас эти события, происходившие без малого целое столетие назад? В современном мире существует масса научной и популярной литературы, посвященной истории развития и достижениям клинической медицины и фармакологии. Буквально каждый день появляются новости о будоражащих воображение открытиях и появлении новых, прогрессивных методов лечения. Успехи доказательной медицины помогают нам отличать лекарства от «пустышек», эффективные терапевтические алгоритмы от заблуждений и намеренных фальсификаций, разумно взвешивать пользу и риски того или иного средства для здоровья пациента. Нам повезло жить в век, когда «медицинский Атлант» уже «расправил плечи» и скинул с себя гнёт догматики и слепого следования безвозвратно устаревшим авторитетам. Но вместе с тем мы должны помнить и о том, какой ценой досталось нам создание таких незамысловатых, на наш просвещенный взгляд, санитарных правил и каким мучительным было их отсутствие.
К сожалению, профилактическая медицина зачастую остается в тени блистательных побед медицины клинической, особенно в современном информационном пространстве. Однако болезнь легче (да и дешевле, чего уж греха таить) предупредить, чем лечить, как завещал нам Гиппократ II Великий. Аспергиллез является ярким примером коварной инфекции, возникающей там, где человек забывает об ужасах эпидемий, вызванных отсутствием элементарных санитарных норм. Современная статистика только подтверждает эту тенденцию. Мы с грустью можем наблюдать, как возвращаются уже давно, казалось бы, побежденные инфекции. Человечество должно осознавать, что болезни никуда не делись и ждут на пороге, когда мы только потеряем бдительность и забудем о превентивных мерах. Ведь именно профилактические мероприятия, направленные, например, на поддержание неблагоприятных для размножения плесневых грибов условий, являются решающим фактором в борьбе с аспергиллезом, медленно, но безжалостно атакующим наиболее уязвимых.