Аспирационный синдром у новорожденных что это
Синдром аспирации мекония у новорожденных
Общая информация
Краткое описание
Российская ассоциация специалистов перинатальной медицины (РАСПМ)
Год утверждения: 2017 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Околоплодные воды могут быть окрашены меконием в 8-20% всех родов [1, 2, 8, 9]. Причем после полных 42 недель частота достигает 23-52% [10, 11]. От 2 до 9% новорожденных, у которых воды были окрашены меконием, в последствие отмечается клиническая картина САМ [2, 12, 13]. Около трети новорожденных с САМ требуют интубации трахеи и механической вентиляции легких [13]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может превышать 20%. Другие осложнения, включая СУВ, встречаются у 10-30% детей с САМ [14].
Диагностика
Диагностика
— курение, наркомания (особенно, кокаин) [2].
Комментарии: Необходимо проводить дифференциальный диагноз с врожденной пневмонией.
Дифференциальный диагноз
— Транзиторным тахипноэ новорождённых и другими состояниями, сопровождающимися развитием дыхательной недостаточности в раннем неонатальном периоде.
Лечение
Рекомендуется дифференцированный подход к оказанию помощи в родильном зале новорожденным с околоплодными водами, содержащими меконий [26]. Акушеры должны заранее предупредить врачей-неонатологов, если околоплодные воды окрашены меконием и имеются признаки дистресса плода. Санация ротоглотки после рождения головки плода не снижает вероятности развития респираторного дистресс-синдрома или клинически выраженного синдрома мекониальной аспирации, включая подгруппы, где имело место наличие густого мекония, отмечались признаки дистресса у плода или родоразрешение выполнялось абдоминальным путем [19].
Комментарии: В случае отсутствия лаважа желудка в родильном зале при наличии мекония в околоплодных водах не зарегистрировано вторичных осложнений, связанных с регургитацией и/или аспирацией мекониального желудочного содержимого [29]. В то же время лаваж желудка рассматривается как потенциально опасная манипуляция, поскольку введение рото- или назогастрального зонда в родильном зале нередко сопровождается развитием апноэ и/или брадикардией [30].
Синдром аспирации мекония у новорожденных. Клинические рекомендации.
Синдром аспирации мекония у новорожденных
Оглавление
Ключевые слова
синдром мекониальной аспирации
синдром аспирации мекония
персистирующая легочная гипертензия
синдром «утечки воздуха»
Список сокращений
ИВЛ – искусственная вентиляция легких
МАР – среднее давление в дыхательных путях
РКИ — рандомизированные контролируемые исследования
САМ – синдром аспирации мекония
СДР, РДС — синдром дыхательных расстройств
СРАР – continuous positive airway pressure / метод респираторной терапии – постоянное давление в дыхательных путях
УЗИ — ультразвуковое исследование
ЭТТ – эндотрахеальная трубка
f — частота аппаратных вдохов, в минуту
fO2 — содержание кислорода в воздушной смеси
Peep – пиковое давление в конце выдоха
Pip – пиковое давление на вдохе
раО2 – концентрация кислорода в крови
Термины и определения
Синдром аспирации мекония – тяжелое расстройство дыхания у новорожденных детей, вызванное попаданием мекония в нижние дыхательные пути.
Сурфактант (в переводе с английского – поверхностно-активное вещество) – смесь поверхностно-активных веществ, выстилающая альвеолы изнутри.
Синдром «утечки воздуха» – тяжелое состояние новорожденных, характеризующееся разрывом альвеол, выходом из них воздуха и его распространение по легким и в другие части организма.
Персистирующая легочная гипертензия – состояние, характеризующееся снижением кровотока в легких новорожденного и появление при этом право-левого сброса крови в результате возврата к констрикции артериол легких или персистирования.
Тахипноэ — учащённое поверхностное дыхание.
1. Краткая информация
1.1 Определение
Синдром аспирации мекония (САМ) – тяжелое расстройство дыхания у новорожденных детей, вызванное попаданием мекония в нижние дыхательные пути.
Синонимы САМ: синдром мекониальной аспирации новорожденных, неонатальная аспирация.
1.2 Этиология и патогенез
САМ чаще наблюдается у переношенных или доношенных новорожденных, которые подверглись внутриутробной антенатальной и/или интранатальной гипоксии и родились в асфиксии, приведшей к спазму сосудов брыжейки, усилению перистальтики кишечника, расслаблению анального сфинктера и пассажу мекония — выходу его в околоплодные воды. Обвитие пуповины вокруг шеи, сдавление ее стимулирует вагусную реакцию и пассаж мекония даже при отсутствии асфиксии.
1.3 Эпидемиология
1.4 Кодирование по МКБ 10
P24.0 – Неонатальная аспирация мекония
1.5 Классификация
Классификация САМ по вариантам течения
Первый вариант — с рождения имеется тяжелая дыхательная недостаточность, приступы вторичной асфиксии, одышки, притупления легочного тона, повышение ригидности грудной клетки, обильные разнокалиберные влажные хрипы в легких.
Классификация САМ по степени тяжести
В зависимости от количества, консистенции аспирированной жидкости, а также от сроков аспирации различают:
Легкая степень – отмечается тахипноэ, проходящее через 42-72 часа. Уровень рСО2 в артериальной крови в пределах нормы, рН крови без изменений. Редко отмечается незначительная гипоксимия, корригируемая ингаляцией кислорода.
Средняя степень – клиника схожа с легкой степенью, но нарастание дыхательной недостаточности происходит быстрее и пик приходится на 24 часа. В артериальной крови отмечается гипоксимия степень, которой не соответствует тяжести легочной патологии (сопоставление с Rg-граммой грудной клетки). Это может говорить о стойкой легочной гипертензии с шунтированием крови справа налево как на уровне открытого артериального протока так и на уровне предсердий (что подтверждается УЗИ сердца с Доплер-эффектом).
Тяжелая степень – дыхательная недостаточность отмечается сразу после рождения или в первые 24 часа жизни. В данном случае отмечается сочетание дыхательного и метаболического ацидоза, которые требуют немедленной коррекции.
При тяжелой степени достаточно часто развитие таких осложнений как напряженный пневмоторакс и практически всегда развитие стойкой легочной гипертензии. Стойкость легочной гипертензии связанна в первую очередь с утолщением стенок сосудов легочных артерий вследствие их чрезмерной гипертрофии и гиперплазии. Впервые о гипертрофии сообщили Siassi и соавт. в 1971 году. В частности, в их исследовании доказывалось, что хроническая гипоксия может вызывать утолщение стенок мелких легочных артерий вследствие гипертрофии гладкой мускулатуры, что в свою очередь приводит к стойкому сужению просвета сосуда. Помимо всего выше перечисленного сейчас установлено, что острая гипоксемия плода вызывает дальнейшее сужение легочных артерий, что в итоге приводит к стойкой легочной гипертензии.
2. Диагностика
2.1 Жалобы и анамнез
Анамнез заключается в выявлении факторов риска, таких как переношенность ребенка, эклампсия беременной, гипертензия беременной, сахарный диабет беременной.
2.2 Физикальное обследование
Рекомендовано на этапе постановки диагноза начать с оценки симптомов дыхательной недостаточности у новорожденного по шкале Даунса (Приложение Г) [1].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
Комментарии: Раннее (в течение 2 ч) наблюдается появление симптомов дыхательной недостаточности: тахипноэ, раздувание крыльев носа, втяжения уступчивых мест грудной клетки, цианоз. Увеличение передне-заднего размера грудной клетки.
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
Комментарии: При перкуссии выявляют участки притупления, чередующиеся с коробочным звуком. Выслушивается ослабленное или жёсткое дыхание с большим количеством проводных и крепитирующих хрипов. Удлинённый выдох. Тоны сердца приглушены, можно выслушать систолический шум. Из-за нарушения периферического кровотока кожные покровы приобретают мраморный цвет, могут появиться отёки.
2.3 Лабораторная диагностика
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: При САМ выявляют резко выраженную гипоксемию и смешанный ацидоз.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: Поскольку меконий может усилить рост бактерий и САМ трудно отличить от бактериальной пневмонии.
2.4 Инструментальная диагностика
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a)
Комментарии: На рентгенограмме легких отмечают сочетание участков апневматоза (крупные, неправильной формы затемнения), отходящих от корней легких, с вкраплениями эмфизематозных областей. Легкие вначале выглядят эмфизематозными, диафрагма уплощена, переднезадний размер грудной клетки увеличен. Для обильной аспирации характерны рентгеновский симптом «снежной бури» и кардиомегалия, развивающийся в первые сутки пневмоторакс.
2.5 Дифференциальная диагностика
При диагностике РДС характерными признаками на рентгеновском снимке являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма).
Диагностика раннего неонатального сепсиса, врожденной пневмонии. Характерны положительные маркеры воспаления, определяемые в динамике в первые 72 часа жизни. Рентгенологически при однородном процессе в легких ранний неонатальный сепсис/пневмония неотличимы от САМ. Однако, если процесс в легких очаговый (инфильтративные тени), то это признак характерен для инфекционного процесса и не характерен для САМ. При САМ на рентгенограмме органов грудной клетки инфильтративные тени перемежаются эмфизематозными изменениями, ателектазами, (возможны пневмомедиастинум и пневмоторакс).
Диагностика персистирующей легочной гипертензии новорожденных. На рентгеновском снимке органов грудной клетки отсутствуют характерные для САМ изменения. При эхокардиографическом исследовании выявляется право-левый сброс и признаки легочной гипертензии.
3. Лечение
3.1 Консервативное лечение
Сурфактантная терапия
При подтверждении САМ рекомендуется применение сурфактантной терапии [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: Способ сурфактант-терапии состоит в проведении лаважа трахеобронхиального дерева разведенным препаратом Порактант альфа**. Для этого препарат (75 мг во флаконе) разводят в 2,5 мл физиологического раствора, согласно инструкции фирмы производителя. Из этой эмульсии берут 0,5 мл и дополнительно разводят физиологическим раствором до 5,0 мл (осторожно перемешивая и не встряхивая) и проводят лаваж трахеобронхиального дерева дробно двумя-тремя порциями. Оставшиеся 2,0 мл (60 мг) эмульсии вводят попеременно по 1,0 мл в левый и в правый бронх болюсно через санационный катетер. Второй флакон препарата вводят микроструйно, так что общая доза составляла 50 мг / кг. Лечение синдрома аспирации мекония тяжелой степени путем проведения сурфактант-терапии в виде лаважа трахеобронхиального дерева разведенным Порактантом альфа** с последующим введением небольшой дозы препарата позволяет достоверно уменьшить время достижения нетоксической концентрации кислорода в подаваемой газовой смеси, время нахождения детей на искусственной вентиляции легких и в отделении реанимации и интенсивной терапии новорожденных. Известно, что меконий эффективно связывается с легочным сурфактантом за счет химических и физических механизмов взаимодействия и инактивирует его. При этом критерием инактивации является потеря сурфактантом свойства эффективно снижать поверхностное натяжение на границе раздела фаз воздух — вода. Меконий, сорбированный на частицах экзогенно введенного сурфактанта, удаляется при лаваже, а следующее за ним введение терапевтической дозы Порактанта альфа** 50 мг/кг выполняет роль заместительной терапии, приводя к повышению растяжимости легких, устранению ателектазов и улучшению вентиляционно-перфузионного отношения. Эффект терапии проявлялся улучшением аускультативной картины в легких и положительной динамикой на рентгенограммах грудной клетки.
Седация и миорелаксация
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2a)
Антибактериальная терапия
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
Комментарии: Антибактериальная терапия показана при аспирации мекония, так как он способствует росту бактерий. Начинают с цефалоспоринов и аминогликозидов. По результатам посевов из трахеи проводят смену антибактериальной терапии.
Респираторная терапия новорожденных с САМ
Помощь новорожденному с САМ в родильном зале
Уровень убедительности рекомендаций В (уровень достоверности доказательств–2b)
Комментарии: Широкое использование в предыдущие годы санации носо- и ротоглотки плода до рождения плечиков с профилактической целью не подтвердило своей эффективности, поэтому в настоящее время эта манипуляция не рекомендована для рутинного применения. Санация носо- и ротоглотки ребенка должна быть проведена после перемещения ребенка на реанимационный столик. При этом, несмотря на то, что околоплодные воды содержат меконий, если у ребенка сразу после рождения отмечается хороший мышечный тонус, активное самостоятельное дыхание или громкий крик, то санация трахеи не показана.
Если околоплодные воды содержат меконий и у ребенка отмечается сниженный мышечный тонус, неэффективное или ослабленное самостоятельное дыхание, сразу после рождения необходимо провести интубацию трахеи с последующей санацией через эндотрахеальную трубку. Следует обратить особое внимание на то, что санация проводится путем подключения шланга аспиратора через Т-образный коннектор или мекониальный аспиратор непосредственно к эндотрахеальной трубке. Санация производится до полной аспирации содержимого трахеи. Если эндотрахеальная трубка блокирована меконием, следует удалить эту трубку, повторно интубировать трахею ребенка и продолжить санацию. Использование с этой целью аспирационных катетеров, диаметр которых всегда меньше, чем диаметр эндотрахеальной трубки, не допускается. Если на фоне санации отмечается нарастание брадикардии менее 80уд/мин, санацию следует прекратить и начать искусственную вентиляцию легких (ИВЛ) до повышения частоты сердечных сокращений (ЧСС) более 100 уд/мин. Вопрос о необходимости повторной санации трахеи решается после восстановления сердечной деятельности ребенка в индивидуальном порядке.
Использование ИВЛ в условиях родильного зала
Рекомендуется начать ИВЛ сразу после извлечения ребенка из матери [2].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2a)
Комментарии: Использование саморасправляющегося мешка у новорожденных:
Следует использовать саморасправляющийся мешок объемом не более 240 мл. Такой размер более чем достаточен для проведения вентиляции легких у новорожденных. После сжатия мешок расправляется самостоятельно за счет своих эластических свойств, независимо от источника газовой смеси, что делает использование этого устройства удобным и простым. Однако, для проведения ИВЛ воздушно-кислородной смесью, необходимо подключить мешок к источнику кислорода и установить скорость потока 8 л/мин. Такая скорость позволяет добиться концентрации в дыхательной смеси около 40%. Для создания более высокой концентрации кислорода (80-90%) к саморасправляющемуся мешку требуется подключить дополнительно кислородный резервуар. Следует помнить, что при проведении ИВЛ с помощью саморасправляющегося мешка трудно поддерживать одинаковое пиковое давление от вдоха к вдоху. Поэтому целесообразно использовать манометр, подключенный к мешку. Максимальное пиковое давление ограничено клапаном сброса избыточного давления, который срабатывает при превышении около 40 смН2O. Для создания большего давления на вдохе следует заблокировать пальцем клапан сброса давления. Иногда это может потребоваться при неэффективности первых принудительных вдохов в процессе масочной ИВЛ у крупных доношенных новорожденных. При использовании саморасправляющегося мешка невозможно создать положительное давление в конце выдоха, не подключив дополнительно клапан, создающий давление в конце выдоха. Использование саморасправляющегося мешка не позволяет обеспечить раздувание легких длительностью более одной секунды.
Использование аппарата ИВЛ с Т-коннектором:
В аппаратах ИВЛ с Т-коннектором газовая смесь поступает в маску или интубационную трубку через контур, подключенный к смесителю сжатого воздуха и кислорода и к манометру. Вентиляция обеспечивается благодаря окклюзии пальцем выходной трубки Т-коннектора, осуществляемой с определенной периодичностью. Аппарат позволяет создавать и регулировать необходимое давление, как на вдохе, так и при помощи изменения диаметра отверстия выходной трубки на выдохе (СРАР, PEEP). Время вдоха регулируется путем изменения длительности окклюзии пальцем выходной трубки Т-коннектора. Для функционирования устройства требуется подключение его к источнику газовой смеси. Скорость потока устанавливается 8 л/мин. По сравнению с саморасправляющимся и поточнорасправляющимся мешками устройства с Т-коннектором являются наиболее удобными для проведения ИВЛ у новорожденных детей в родильном зале.
ИВЛ как метод респираторной терапии новорожденных с САМ
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1b)
Комментарии: Умеренную гипоксемию можно корригировать ингаляцией увлажненного кислорода через кислородную палатку. Эффект от применения СРАР у новорождённых с САМ непредсказуем и поэтому его не рекомендуют для рутинного использования.
Аспирационный синдром у новорожденных что это
О.А. Рогова, М.Д. Бакрадзе, Л.М. Кузенкова, Е.В. Увакина, К.А. Казакова
ФГБУ Научный центр здоровья детей МЗ РФ, Москва
Введение
Патология бронхов и легких, связанная с хронической аспирацией пищи, занимает значительное место у детей грудного и раннего возраста [1]. Как правило, развитие респираторных жалоб у детей грудного возраста связывают с гастроэзофагеальным рефлюксом (ГЭР) [2–3]. Однако в возникновении бронхолегочной патологии аспирационного генеза первостепенную роль играет дисфагия, а ГЭР имеет второстепенное значение, поскольку его распространенность наблюдалась практически с одинаковой частотой у детей с аспирационным синдромом и без него [4, 5]. В литературе наиболее часто эта проблема описывается у пациентов с сопутствующей патологией центральной нервной системы, а также с синдромом Сандифера [6–8]. Кроме того, по мнению некоторых авторов, с дисфагией связан угрожающий жизни эпизод [9–11]. Роли аспирации у детей без неврологической патологии посвящены отдельные работы [5, 12]. Средняя частота аспирационного синдрома (АС), по данным разных авторов, колеблется от 2 до 3% [13–15]. Однако истинная частота дисфагии и аспирации не известна, поскольку их клинические проявления бывают довольно стерты [1].
Акт глотания – сложный процесс, состоящий из 4 последовательных фаз, которые регулируются 5 парами черепных нервов и в котором участвуют 26 мышц. Губы, глотка, гортань, пищевод совершают координированную работу для его осуществления. Любые анатомические, неврологические или физиологические дефекты могут приводить к аспирации [16]. Перстнеглоточная дисфункция, дискоординация у новорожденных и преходящая дисфункция глоточных мышц достаточно хорошо описаны в педиатрической литературе [1]. Она включает спазм перстнеглоточной мускулатуры или ахалазию верхнего пищеводного сфинктера и встречается у детей, имеющих нормальный сосательный рефлекс, но некоординированный акт глотания. Такое возможно при вторичной задержке глотательного рефлекса или может быть ассоциировано с церебральным параличом [5].
В отечественной литературе недостаточно данных о частоте аспирационной пневмонии у детей раннего возраста. Некоторые зарубежные исследования показали, что 5–15% из 4,5 млн внебольничной пневмонии – аспирационного генеза [17]. По данным проведенного ретроспективного обзора, 30-дневная летальность от аспирационной пневмонии составляет 21% [18]. У пациентов с СА высок риск тяжелых респираторных последствий и, возможно, смерти. У пациентов с массивной аспирацией смертность составляет 25% [19]. В публикациях отечественных исследователей отсутствуют данные о частоте аспирационных процессов и дисфагии у детей, о различиях клинической картины у детей с патологией центральной нервной системы и без нее и о рациональных подходах к терапии.
Целью настоящего сравнительного наблюдательного исследования стало изучение частоты аспирационных процессов у детей с респираторными жалобами; сравнительное изучение клинической картины у детей с привычной аспирацией пищи с детьми, имеющими неврологическую симптоматику; оценка эффективности комплекса мер по борьбе с аспирацией.
В основную группу включали детей с острым поражением нижних дыхательных путей (острый бронхит, бронхиолит, пневмония) в возрасте до 3 лет, у которых не было выявлено неврологической патологии, кроме дисфагии вследствие морфофункциональной незрелости. В группу сравнения включены дети с аспирацией, госпитализированные с органическим поражением центральной нервной системы, имеющие бульбарный или псевдобульбарный синдром. Всем детям проведен физикальный осмотр, забор капиллярной или венозной крови, выполнена проба с кормлением жидкой пищей и аускультацией до и после кормления, осуществлены рентгенограммы органов грудной клетки, по показаниям проведены компьютерная томография органов грудной клетки, эзофагогастродуоденоскопия, рентгенконтрастное исследование пищевода, водно-сифонная проба. Комплекс лечебных мероприятий у детей с дисфагией включал соблюдение диеты, режимные мероприятия и медикаментозную терапию.
Материал и методы
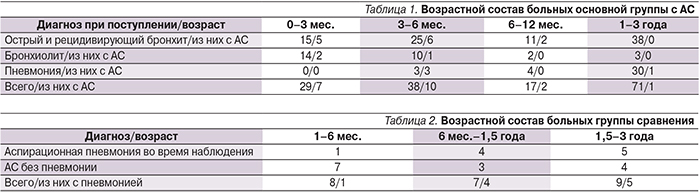
За 2013–2015 гг. в Центр здоровья детей были госпитализированы 162 ребенка в возрасте от 0 до 3 лет с респираторными заболеваниями (пневмония, острый бронхит, бронхиолит). Из этого числа у 27 детей был выявлен АС в отсутствие какой бы то ни было другой неврологической патологии, кроме дисфагии. Эти дети составили основную группу исследования. Возраст и диагнозы детей, госпитализиро-ванных с респираторными жалобами по возрасту и нозологии, представлены в табл. 1.
В группу сравнения были включены 24 ребенка с АС на фоне органического поражения центральной нервной системы из отделений психоневрологии и патологии детей раннего возраста.
Возраст и форма неврологических нарушений приведены в табл. 2.
Наиболее часто аспирация пищи встречалась у детей в возрасте до 6 месяцев (32%).
Аспирационный бронхит выявлен у 13 (14,6%) из 89 детей с бронхитом.
В первом полугодии жизни из 40 детей с бронхитом аспирация была у 11 (27,5%) детей. У детей старше 6 месяцев аспирация выявлена всего в 2 (4%) случаях из 49. Аспирация у детей с бронхиолитом имела место в первом полугодии жизни, частота АС достигала 12,5%. Из 7 детей в возрасте до 12 месяцев, госпитализированных с пневмонией, аспирационный генез выявлен у 3. Из 30 детей с пневмонией в возрасте от года до 3 лет аспирационная пневмония была диагностирована у 1 ребенка с дисфагией на фоне аномалии развития твердого неба. У детей из основной группы в возрасте до года все выявленные пневмонии имели аспирационный генез. Из 24 детей группы сравнения псевдобульбарный синдром был у 20 детей, 2 ребенка имели бульбарные нарушения. В течение госпитализации острая пневмония развилась у 10 детей. У 3 детей при обследовании были выявлены изменения, свидетельствующие о ранее перенесенной пневмонии. В отличие от основной группы пневмония была выявлена у детей в возрасте старше 6 месяцев. Развитие аспирационной пневмонии достоверно чаще наблюдалось в группе сравнения (14,8 и 41,6% соответственно, р=0,05%). Число повторно рожавших матерей (вторые роды и более) было достоверно выше в группе сравнения (29,6 и 58% соответственно, р=0,05%).
Указания на симптомы, которые позволили бы предположить наличие дисфагии, были у 9 из 11 детей с аспирационным бронхитом в возрасте до 6 месяцев. Поводом для госпитализации таких пациентов послужили длительно сохраняющиеся респираторные проявления. Это указывало на то, что у таких детей последний бронхит был не столько инфекционной природы, сколько аспирационной. У части детей наличие привычной аспирации пищи проявлялось тем, что они поступали в клинику в поздние сроки заболевания – после 3–5–8 дней отсутствия эффекта от лечения. Из 27 детей основной группы 12 поступили после стационарного лечения в другом медицинском учреждении, 8 детям назначался бронхолитик, 6 – будесонид. Еще 2 детей поступили с клиникой острого респираторного заболевания, в структуре которого развился бронхит.
У этих детей не было лихорадки, воспалительной реакции крови, наличие аспирации ухудшало респираторную функцию. У детей с бронхиолитом аспирации в анамнезе не было, она имела место лишь во время острого заболевания, что в отличие от детей с бронхитами позволяет считать инфекцию триггером аспирации. У детей с пневмонией в анамнезе также не было аспирации, они не имели длительного кашля, эпизодов бронхообструкции, признаков дисфагии. Аспирация пищи возникла на фоне острого респираторного заболевания. В группе сравнения АС имел место с первого полугодия жизни детей. В клинической картине преобладали бульбарные и псевдобульбарные нарушения, судорожный синдром, отставание в развитии, гипотрофия. Из 24 детей 17 после рождения потребовалась искусственная вентиляция легких.
Дети с аспирационным бронхитом поступали с жалобами на длительный, плохо поддающийся терапии кашель, эпизоды свистящего дыхания, наличие дистанционных хрипов, присутствовала одышка, обилие густой вязкой мокроты, наличие хрипов, усиливающихся после кормления. При этом отсутствовали лихорадка, изменения гематологических показателей. Наличие аспирации пищи у детей с бронхиолитом утяжеляло их клиническую картину, способствуя более длительному и стойкому сохранению дыхательной недостаточности, гиперпродукции густой вязкой мокроты. В отличие от детей с бронхитами эти дети начали поперхиваться и закашливаться при кормлении лишь во время острого эпизода заболевания; кроме того, имели место десатурация и изменения гематологических показателей. В случае аспирационной пневмонии клиническая картина заметно отличалась от таковой при бронхите или бронхиолите: присутствовали выраженные признаки тяжести, высокая лихорадка, асимметрия хрипов при аускультации легких. Уровень лейкоцитов периферической крови у 3 детей оставался нормальным. В группе сравнения из 24 детей в возрасте до 3 лет, госпитализированных в плановом порядке, у 10 пневмония аспирационного генеза возникла во время пребывания в стационаре. Длительность острого заболевания в контрольной группе была выше, чем в основной, в среднем на 3 дня. Сопоставляя особенности респираторных проявлений аспирации, мы не выявили достоверных различий ни в частоте бронхообструктивного синдрома (50 и 74% соответственно), ни в частоте ГЭР (50 и 74% соответственно). Эти данные показывают, что ни обструкция, ни ГЭР не были основной причиной респираторного синдрома.
На рентгенограмме грудной клетки у детей с аспирационным бронхитом и бронхиолитом отмечались косвенные признаки микроаспирации (неоднородность легочных полей в области верхушек легких, преимущественно справа). Аспирационная пневмония у детей основной группы проявлялась характерным появлением инфильтрата в верхней доле правого легкого. Из 10 детей группы сравнения с аспирационной пневмонией, развившейся в клинике, рентгенологическое исследование проведено 8 раз, компьютерная томография органов грудной клетки – 7 раз (6 детям проведено и то и другое). По результатам компьютерной томографии в 7 случаях выявлены изменения в верхней доле правого легкого, в 1 – в нижней доле левого легкого. У 3 детей, по данным КТ, выявлены изменения в верхней доле правого легкого, что позволяет думать о ранее перенесенных аспирационных пневмониях. Еще 2 ребенка имели некоторое усиление легочного рисунка, множество мелких очаговых теней – преимущественно в верхних долях легких. От остальных детей не получено рентгенологических признаков поражения легочной ткани, несмотря на наличие у них псевдобульбарных расстройств, ГЭР. У 2 детей на рентгенограмме и компьютерной томограмме были выявлены признаки пневмофиброза. У 10 детей с дисфагией на фоне псевдобульбарного синдрома выявлены инфильтративные изменения, характерные для острой пневмонии. У 1 ребенка выраженные бронхитические изменения, у 8 детей – норма, остальным 5 детям компьютерную томографию органов грудной клетки не проводили ввиду отсутствия показаний. Наличие изменений на рентгенограмме органов грудной клетки в виде «заплеванности», сгущения рисунка в верхушках легких достоверно чаще встречалась в группе сравнения (16,7 и 66,7% соответственно, р=0,01%).
Наличие инфильтративных изменений в верхней доле правого легкого по результатам рентгенограммы органов грудной клетки достоверно чаще встречалось в группе сравнения (11,1 и 41,7% соответственно; р=0,05%).
Комплекс лечебных мероприятий у детей с дисфагией включал изменения диеты (введение в рацион загустителя или антирефлюксной смеси, безмолочной рисовой каши – 15 мл после каждого кормления; подбор соски с подходящим размером отверстия; переход на кормление с ложки; увеличение кратности и уменьшение объема разового кормления; исключение кислых и сладких продуктов) и противоаспи-рационный режим (подбор позиции для кормления, в которой аспирация наименее выражена; приподнятое положение головного конца кровати до 30–45°; проведение последнего кормления за 2–3 часа до сна). Всем детям проведены дренажный массаж грудной клетки и санация верхних дыхательных путей электроаспиратором. Введение всех этих мер потребовало настойчивой работы с роди-телями.
Наряду с диетической коррекцией и противоаспирационными мероприятиями вводились прокинетикики (домперидон 0,5–1,5 мг/кг/сут перед едой) 10 детям. Как правило, всего вышеперечисленного было достаточно для уменьшения проявлений микроаспирации, лишь 3 детям с инструментально подтвержденным ГЭР потребовалось назначение ингибитора протонной помпы (эзомепразол по 5 мг/сут 1 раз на ночь) и антацида (алюминия фосфат 4 г перед кормлением до 6 раз в сутки). Детям с бронхообструктивным синдромом назначалась ингаляционная терапия бронхолитиком (ипратропия бромид+фенотерол 0,1 мл на кг массы тела), но в половине случаев выраженного эффекта в виде повышения оксигенации не наблюдалось. Антибактериальную терапию получили 16 детей с аспирационной пневмонией.
В ходе катамнестического наблюдения было установлено, что у детей без органических неврологических заболеваний (n=20) на фоне рекомендованного лечения респираторные проявления уменьшились и через 2–3 месяцев полностью сгладились. В то же время у 10 детей аспирация прослеживалась до 1,0–1,5 лет. Дети, у которых аспирация проявилась во время бронхиолита, восстанавливались быстрее, чем дети с бронхитом. В отличие от этого у детей группы сравнения сохранялись стойкие глотательные нарушения и респираторная симптоматика в том возрасте, когда дети без неврологической симптоматики уже выздоравливали. При соблюдении всех рекомендованных противоаспирационных мероприятий в основной группе все дети были выписаны с улучшением или полным выздоровлением, в контрольной группе происходило стихание острого процесса, однако сохранялись стойкие явления дисфагии, длительно сохранялся кашель, гиперпродукция слизи в верхних дыхательных путях. Кроме того, на фоне фебрильного заболевания происходило усиление судорожного синдрома, связанного с основным заболеванием, что утяжеляло состояние ребенка.
Отдельного внимания заслуживают 7 детей, не указанных в табл. 1, которые были госпитализированы без катарального синдрома. Причиной обращения за помощью со стороны 4 детей было наличие в анамнезе эпизода т.н. аффективно-респираторного пароксизма, который в последнее время принято именовать угрожающим жизни эпизодом. У них не было респираторных проявлений, дисфагия носила эпизодический характер и не было никаких изменений на рентгенограмме органов грудной клетки. У 3 детей имел место синдром Сандифера: у 1 ребенка – его развернутая форма; у 2 детей имел место неполный симптомокомплекс: акт глотания происходил с задержкой молока в полости рта на фоне резкого поворота головы в сторону и сопровождался слабовыраженным тоническим напряжением мышц шеи и конечностей, плачем. Аускультативная картина у этих детей была в норме, изредка выслушивались единичные влажные хрипы в верхних отделах легких, исчезающие после откашливания, что заставило думать о значительной компенсации дисфагии за счет поворота головы во время глотания. При помощи рентгенконтрастного исследования верхних отделов желудочно-кишечного тракта и эзофагогастродуоденоскопии был подтвержден ГЭР.
Обсуждение
Основной причиной аспирации у детей грудного возраста считается патология центральной нервной системы [16]. Однако наши данные показывают, что аспирация часто встречается у здоровых детей, обусловливая значительный процент госпитализации по поводу бронхиолита и затяжного кашля или рецидивирующего бронхита. Выявление привычной аспирации пищи у детей раннего возраста, особенно первого полугодия жизни, остается важной задачей клинициста, поскольку достаточно простыми мерами и мягким медикаментозным воздействием можно существенно уменьшить аспирацию и частоту респираторных заболеваний.
Причиной возникновения дисфагии у детей первых месяцев жизни чаще всего считаются патология центральной нервной системы и нейромышечная патология, парез мягкого неба, аномалии челюстно-лицевого скелета, стридор, сдавление пищевода аномальным сосудом, семейная дизаутономия Райли-Дея. Анатомические нарушения, такие как расщелина твердого и мягкого неба, трахеопищеводный свищ, дуоденальная обструкция или мальротация, а также макроглоссия и микрогнатия могут усиливать риск и предрасполагать к аспирации [1].
У значительного числа больных дисфагия является единственным симптомом. Аспирация зачастую протекает стерто и впервые выявляется при острых и особенно рецидивирующих респираторных синдромах, нередко является причиной аспирационной пневмонии [2, 20]. Наши данные показали, что у детей, госпитализированных с респираторной патологией в возрасте до 6 месяцев, АС встречался у каждого 3-го (32%) ребенка, более того, из всех 37 детей в возрасте до 3 лет аспирационная пневмония составила 10,8%.
У детей в возрасте до года, особенно первого полугодия жизни, поступивших с респираторными жалобами, аспирация выявлена у 17 (27,5%) из 67. Кроме того, наши данные позволяют считать, что у 14 из 67 детей именно аспирация, а не инфекция стала причиной рецидивирующих респираторных жалоб или пневмонии. И лишь у 3 детей аспирация возникла на фоне бронхиолита, ставшего, по-видимому, триггером. Хотя число клинических наблюдений невелико, мы не можем не отметить, что из всех 3 детей первых 6 месяцев, госпитализированных в наше отделение с пневмонией, во всех случаях ее причиной была аспирация.
У детей без неврологических нарушений применение простых мер давало хороший эффект с постепенным уменьшением дисфагии и особенно кашля и бронхообструктивных проявлений. Применение домперидона на этом фоне не оказало значительного влияния на детей с ГЭР. Тот же комплекс оказался эффективным в отношении детей с синдромом Сандифера. Он позволил практически ликвидировать характерные для него признаки в течение месяца. Тот же комплекс у детей
с псевдобульбарным синдромом дал далеко не полный эффект. В отличие от детей основной группы у детей группы сравнения пневмония, развившаяся в отделении и имевшая место ранее, наблюдалась существенно чаще (10 из 24 детей) и не только в первом полугодии, но и на 1–3-м году жизни. Это можно объяснить наличием у них псевдобульбарного и бульбарного синдромов и прогрессированием неврологической симптоматики.
В ходе нашего исследования ГЭР был диагностирован у 4 детей основной группы и у двух детей группы сравнения, что составило 14,8 и 8,3% соответственно и не превышало частоту ГЭР у здоровых детей. Гастроэзофагеальная рефлюксная болезнь у детей с неврологической патологией нередко требует хирургического лечения, поскольку именно у этих пациентов значительно чаще возникают осложнения со стороны дыхательной системы, в т.ч. с летальным исходом [21]. Двум из 24 детей контрольной группы в связи с неуклонным прогрессированием неврологической симптоматики, наличием псевдобульбарных расстройств, эпизодов апноэ и АС, белково-энергетической недостаточности была установлена пункционная низкопрофильная гастростома. Детей с тяжелыми необратимыми поражениями центральной нервной системы при невозможности хирургического лечения целесообразно кормить через зонд или гастростому. H. Williams, P. Phelan, однако, не рекомендуют этого – даже при выраженной аспирации и согласии родителей [22].
Заключение
Приведенные данные показывают, что аспирация пищи служит достаточно частой причиной респираторного синдрома, особенно у детей первого полугодия жизни. Наличие аспирации пищи связано не с ГЭР, а с дисфагией. Частота срыгиваний и инструментально установленный ГЭР у детей с аспирацией в целом не отличаются от частоты ГЭР у здоровых детей. Респираторный синдром у детей с привычной аспирацией пищи характеризуется повторными эпизодами кашля, обструкции с тенденцией к затяжному течению за счет продолжающейся аспирации и требует строгого соблюдения комплекса мер, направленных на ее уменьшение.