Атаканд или лориста что лучше
Обзор таблеток от повышенного давления нового поколения
Частое повышение показателей артериального давления (АД) – причина развития серьезных заболеваний (инсульт, инфаркт миокарда и пр.). Гипертоническая болезнь в России диагностируется у каждого третьего человека преклонного возраста. Для борьбы с гипертонией многим пациентам приходится принимать препараты на протяжении всей жизни, чтобы исключить осложнения.
Современные фармакологические компании предлагают большой выбор лекарственных средств, эффективных при гипертонии. Если не знаете, как выбрать таблетки от повышенного давления, ознакомьтесь с рейтингом, представленным ниже. В ТОП вошли лучшие медикаменты с учетом эффективности, стоимости и отзывов.
Классификация препаратов от повышенного давления
Причины гипертонии
Когда нужно вызвать врача на дом при повышении давления?
Общепринятые показатели АД – 120/80. Параметры могут незначительно варьировать в зависимости от времени суток, физической активности и возраста человека.
Таблица – Показатели артериального давления и рекомендации
Средства, блокирующие ангиотензинные АТ1–рецепторы
В нашем организме ренин–ангиотензин–альдостероновая система (РААС) представляет собой сложный ферментативно–гормональный биологический процесс. Данная система принимает активное участие в поддержании нормальных показателей артериального давления, обеспечивает водно–солевое равновесие в организме и поддерживает кислотно–щелочной баланс крови.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
В нашем организме ренин–ангиотензин–альдостероновая система (РААС) представляет собой сложный ферментативно–гормональный биологический процесс. Данная система принимает активное участие в поддержании нормальных показателей артериального давления, обеспечивает водно-солевое равновесие в организме и поддерживает кислотно–щелочной баланс крови. Именно этой системе отводится важнейшая роль не только в патогенезе артериальной гипертензии, но и других ССЗ.
Главная эффекторная задача в РААС отдана ангиотензину II (АТII). АТII (октапептид) образуется в результате нескольких последовательных биохимических реакций. В секреторных гранулах юкстагломерулярного аппарата почек вырабатывается протеолитический фермент ренин, высвобождающийся в кровь. В кровяном русле из неактивного белка ангиотензиногена (полипептида, альфа2–глобулиновой фракции сыворотки) под действием ренина образуется неактивный декапептид АТI. Ренин разрывает в молекуле ангиотензиногена пептидную связь, образованную двумя остатками лейцина с образованием АТI. Под действием ангиотензин–превращающего фермента (АПФ), также присутствующего в плазме крови, происходит конверсия АТI в АТII. АПФ отщепляет от биологически неактивного АТI две молекулы аминокислоты, превращая его в высокоактивный АТII, с периодом полураспада 12 мин. АПФ — это цинксодержащая дипептидиловая карбоксипептидаза (кининаза–II), которая локализуется на эндотелиальных клетках, капиллярах легких, в паренхиме почек, сердца и надпочечниках. Фермент АПФ не обладает избирательностью действия и параллельно осуществляет инактивацию физиологического вазодилататора брадикинина, расширяющего периферические артериолы.
АТII считается основным высокоактивным пептидом, циркулирующим в РААС. Это наиболее сильный вазоконстриктор прямого действия, способный суживать артерии и вены, провоцировать сокращение периферических кровеносных сосудов, что приводит к скачку вверх кровяного давления. АТII стимулирует выработку катехоламинов из мозгового слоя надпочечников, повышая симпатический тонус. Из коры надпочечников в кровь он усиливает секрецию минералокортикоидного гормона — альдостерона, вызывающего задержку натрия и потерю калия в организме, сужает сосуды в почках, поднимает давление в почках и увеличивает общий объем циркулирующей крови. АТII оказывает влияние на ЦНС, при этом нарастает выработка антидиуретического гормона — вазопрессина, последний повышает реабсорбцию воды и возникает чувство жажды, что, в свою очередь, приводит к обилию жидкости в организме и возникновению отеков.
При длительном процессе концентрации АТII в крови и тканях усиливается образование коллагеновых волокон и развивается гипертрофия гладкомышечных клеток кровеносных сосудов. В результате стенки кровеносных сосудов утолщаются, уменьшается их внутренний диаметр, что приводит к поднятию артериального давления. Помимо этого, происходит истощение и дистрофия клеток сердечной мышцы с их последующей гибелью и замещением на соединительную ткань, что является причиной развития сердечной недостаточности. Вот почему необходимо подавлять чрезмерную активность АТII в кровяном русле и тканях больных не только гипертонией, но и ряда других заболеваний.
Было установлено, что ЛС группы «Ингибиторы АПФ» (ИАПФ) полностью не устраняют влияние АТII, остаются альтернативные пути его образования, влияющих на АД. В тканях превращение АТI в АТII катализируют другие ферменты. В стенке артерий под действием АПФ образуется только 30% АТII, тогда как в тканях под действием химазы и катепсина G — около 70%. Поэтому терапевтическая эффективность при применении ИАПФ у пациентов с артериальной гипертензией (АГ) и сердечной недостаточностью часто бывает ограничена. При лечении ИАПФ образование АТII уменьшается, а содержание в крови и тканях БАВ, таких как брадикинин, гистамин, нейропептид Y, субстанция Р, простагландин Е2, — повышается, что связано с развитием побочных результатов.
Почти все эффекты активации РААС в крови и тканях объясняются действием АТII на специфические ангиотензиновые рецепторы (АТR). Наибольшее сродство АТII имеет к АТ1–рецепторам (I типа), которые локализуются преимущественно в гладкой мускулатуре кровеносных сосудов, сердце, отдельных областях мозга, печени, почках, коре надпочечников. Поэтому в 1990–х гг. были предложены блокаторы АТ1– рецепторов, и первый в этой группе был Лозартан (Козаар) — препарат, с которого началась эра «сартанов», на основе которых сегодня созданы уже несколько поколений ЛП.
Сартаны
Еще недавно у данной группы ЛС в рекомендациях ВОЗ/МОГ было единственное показание — развитие кашля на прием ИАПФ. В настоящее время «сартаны» стали наиболее применяемой группой для коррекции многих патологических состояний.
Группу «Сартаны» (далее — сартаны) также называют блокаторами АТ1–рецепторов (БРА) или антагонистами (ингибиторами) АТII. По химической структуре сартаны делятся на 3 основные подгруппы:
В зависимости от наличия активного метаболита среди сартанов выделяют пролекарства и активные ЛС. К пролекарствам относятся: Лозартан и его фармакологически активный метаболит (Е 3174), Кандесартан и его активный метаболит (CV-11974), Азилсартана медоксомил превращается в активную молекулу азилсартана, Олмесартан медоксомил и его активный метаболит (CS-866).
Активными ЛС являются Валсартан, Ирбесартан, Телмисартан, Эпросартан, Фимасартан.
В зависимости от типа антагонизма с АТII их делят на селективные конкурентные антагонисты — лозартан, эпросартан, олмесартан, азилсартан и неконкурентные — вальсартан, ирбесартан, кандесартан, телмисартан.
В основе механизма действия сартанов лежит воздействие на РААС, с уменьшением ее активности. Данные ЛС блокируют АТ1–рецепторы, ослабляют эффекты АТII и опосредованно повышают активность АТ2–рецепторов (II типа). Среди эффектов, которые опосредуются через рецепторы II типа, возникает: вазодилатация, высвобождение оксида азота, стимуляция апоптоза, антипролиферативное действие и др.
Блокаторы АТ1–рецепторов имеют ряд преимуществ перед ИАПФ. ЛП более специфично и значительно подавляют сердечно–сосудистые эффекты активации РААС, блокируют негативные действия АТII, стимулируют при этом защитные эффекты, нарушают деградацию брадикинина, способствуя синтезу простациклина и оксида азота.
Сартаны устраняют действие АТII на сосуды, которые «отказываются» сокращаться, отчего нет артериальной вазоконстрикции и повышения АД. Оттого не происходит задержки натрия и воды. Кроме того, антагонисты АТII взаимодействуют с пресинаптическими рецепторами норадренергических нейронов, что приводит к значительному уменьшению высвобождения норадреналина в синаптическую щель и предотвращению симпатической вазоконстрикции.
Применение сартанов вызывает ремоделирование сосудистой стенки и миокарда, улучшается внутрисердечная гемодинамика, возникает уменьшение полости сердца и регрессия гипертрофии левого желудочка. Препараты снижают симпатическое влияние, повышенную эктопическую активность миокарда и оказывают стабилизирующее воздействие на кардиомиоциты. Отмечается и наличие антиаритмических свойств. Таким образом, ингибирование активности РААС сводит к минимуму сосудистое воспаление, способствует замедлению развития атеросклероза и исключают возможность накопления БАВ и связанных с ними нежелательных реакций.
Степень специфического сродства — аффиннитет (лат. affinitas — родственность) средства с АТ1–рецепторами обеспечивает прочность биомолекулярного комплекса со специфическими рецепторами и скорость диссоциации этой связи, что коррелирует с длительностью действия ЛС. По степени аффинности к рецепторам препараты располагаются в убывающей последовательности: кандесартан > олмесартан > телмисартан > валсартан > ирбесартан > лозартан.
Сартаны помимо гипотензивного действия положительно влияют на работу внутренних органов, проявляют кардиопротективный, ренопротективный, вазопротективный церебропротективными эффекты.
Сартаны имеют малую роль в концентрации глюкозы, показателях холестерина и пуринов в крови, но повышают чувствительность ткани к инсулину, за счет чего уменьшается инсулинорезистентность.
В ходе КИ, у пациентов, принимающих сартаны, редко возникали отеки, эректильная дисфункция и андрогенный дефицит. Практически не наблюдается частота развития острых аллергических реакций, таких как анафилактический шок или приступы сухого кашля.
ЛП редко вызывают гипотензию и коллаптоидные реакции, крайне редко — гиперкалиемию и гипонатриемию. Наиболее часто возникали головная боль и головокружения, боль в спине и миалгии, нарушения функции почек. В целом при применении данной группы ЛП не было отмечено клинически значимых изменений лабораторных показателей.
Лозартан, табл. 12,5 мг, 25 мг, 50 мг, 100 мг (ТН «Козаар», «Лозап», «Вазортенз», «Презартан», «Лориста») — первый непептидный блокатор АТ1–рецепторов, основные фармакологические эффекты которого обусловлены его активным метаболитом, который в 10–40 раз сильнее исходного препарата лозартан. Антигипертензивный эффект при назначении его в суточной дозе 50 мг и 100 мг один раз в день сохраняется 24 часа. По антигипертензивной эффективности лозартан не уступает бета–блокаторам, антагонистам кальция и ИАПФ, но лучше переносится больными и меньше вызывает побочных явлений. В отличие от других сартанов ЛП обладает урикозурическим действием, уникальной способностью увеличивать почечную экскрецию мочевой кислоты; также тормозит транспорт уратов в проксимальных почечных канальцах. К благоприятным эффектам Лозартана можно отнести торможение активации тромбоцитов.
Кандесартан (ТН «Атаканд», «Кандекор», «Ангиаканд», «Ордисс», «Гипокарт», «Ксартен») — для ЛП характерна высокая селективность, сродство к АТ1–рецепторам, прочность связи в 80 раз выше, чем у лозартана. ЛП обладает высокой липофильностью, оказывает длительное дозозависимое снижение АД: одноразовый прием вне зависимости от приема пищи обеспечивает снижение АД на сутки. Нефропротективный эффект после приема связан с увеличением почечного кровотока и скорости клубочковой фильтрации, снижением почечного сосудистого сопротивления и фильтрационной фракции. Ни ингибиторы, ни индукторы микросомальных цитохромных ферментов не оказывают существенного влияния на фармакокинетику этого ЛП.
Ирбесартан, табл. 150 мг, 300 мг (ТН «Апровель», «Ирсар», «Ирбис») — высокоселективный неконкурентный блокатор АТ1–рецепторов, который в 10 раз сильнее связывается с рецепторами, чем лозартан. ЛП снижает концентрацию альдостерона в плазме крови и не подавляет фермент АПФ, уменьшает постнагрузку, системное артериальное давление и давление в «малом» круге кровообращения. Обладает высокой липофильностью и более длительным дозозависимым действием. Гипотензивное действие развивается в течение 1–2 недель и достигает максимума эффективности через 4–6 недель после начала терапии.
Важно! Противопоказан в период беременности и лактации.
Валсартан, табл. 40 мг, 80 мг, 160 мг (ТН «Диован») — относится к специфическим антагонистам АТII, избирательно блокирует АТ1–рецепторы. Сродство валсартана АТ1–рецепторам в тысячи раз выше, чем к рецепторам подтипа АТ2. После однократного приема ЛП гипотензивный эффект поддерживается в течение суток. В контролируемых КИ у пациентов с АГ частота нежелательных явлений была сравнима с плацебо. Отмена в терапии не вызывает развития рикошетной гипертензии, также отсутствует гипотония первой дозы. ЛП не вызывает повышение уровня гликемии (не изменяет липидный профиль), триглицеридов и мочевой кислоты.
Телмисартан, табл. 40 мг, 80 мг (ТН «Микардис», «Телзап», «Телмиста», «Телсартан») — считается самым мощным из сартанов, т.к. помимо блокады рецепторов AT1, значительно активирует противовоспалительные ядерные рецепторы PPARγ, уменьшает воспаление и метаболические изменения и играет важную роль в нейропротекции (подробнее о применении см. в инструкции).
Начало гипотензивного действия после первого приема 80 мг отмечается в течение 3 часов и может пролонгироваться до 48 час.
Эпросартан, табл. 600 мг (ТН «Теветен») — связывается с АТ1–рецепторами сосудов сердца, почек и коры надпочечников, образуя с ними прочную связь. ЛП оказывает вазодилатирующее, гипотензивное и опосредованно диуретическое действие; не оказывает отрицательного влияния на концентрацию в крови глюкозы, общего холестерина, триглицеридов, липопротеидов низкой плотности. Нефропротективное действие связано с увеличением почечного кровотока, скорости клубочковой фильтрации, уменьшением выведения альбуминов. Внезапное прекращение приема эпросартана после его применения в течение длительного периода не сопровождается синдромом отмены.
Олмесартана медоксомил, табл. 10 мг, 20 мг и 40 мг (ТН «Кардосал») — отличается наличием прочного продолжительного связывания с АТ1–рецепторами, что обеспечивает наибольшую его эффективность при наблюдении АД. Препарат практически не связывается с АТ2–рецепторами. При АГ вызывает дозозависимое продолжительное снижение АД и значительно снижает риск осложнений ССЗ. Гипотензивное действие ЛП зависит от дозы, развивается в течение первых 2 недель, максимальный эффект — приблизительно через 4–8 недель после начала терапии.
Азилсартана медоксомил, табл. 20 мг, 40 мг, 80 мг (ТН «Эдарби») — допущен к использованию в США в 2011 г. для лечения больных с АГ и показал благоприятные результаты в снижении и контроле за АД. В 2012 году данный лекарственный препарат был одобрен для лечения АГ и в Японии. Азилсартана медоксомил является более эффективным, чем кандесартан в способности уменьшать плазменные концентрации глюкозы и жирных кислот. Также было доказано, что это азилсартан медоксомил уменьшает инсулинорезистентность, независимо от характера питания, увеличения массы тела или активации жировой PPAR–γ (Peroxisome proliferatorт– activated receptor gamma) — главного регулятора адипогенеза и вовлеченного в патологию множества заболеваний, включая ожирение, диабет, атеросклероз. Азилсартан может с достаточной эффективностью использоваться у больных с АГ в сочетании с инсулинорезистентностью, метаболическим синдромом и внести потенциальный вклад в дело уменьшения риска сердечно-сосудистых осложнений у лиц с высоким коронарным риском. Он модулирует многие метаболические функции участвующие в развитии и прогрессировании атеросклеротического процесса.
Фимасартан калия тригидрат, табл. 60 мг, 120 мг (ТН «Канарб») — мощный блокатор АТ1–рецепторов, изученный в широком спектре доклинических и КИ в Республике Корея. Многоцентровые, рандомизированные КИ завершились в 2016 году. После однократного перорального приема фимасартана в дозе от 20 до 480 мг максимум терапевт. Воздействия достигается спустя 6-8 час. и в полной мере может пролонгироваться до 48 часов. Для пациентов с легкой степенью хронической почечной и печеночной недостаточности начальной коррекции дозы ЛП не требуется.
При средней и тяжелой печеночной недостаточности — не рекомендован.
Важно! Применение ЛП у беременных женщин, и только еще планирующих беременность, противопоказано.
Артериальная гипертензия является одним из наиболее значимых факторов риска возникновения ССЗ. Применение сартанов для снижения АД до рекомендованного нормального уровня взаимосвязано с максимальным снижением риска неблагоприятных сердечно–сосудистых осложнений, повышением качества и увеличением продолжительности жизни больных.
Комбинированная терапия больных ишемической болезнью сердца и артериальной гипертензией
Продолжение. Начало см.: «Лечащий Врач», № 1, 2007 г. Ингибиторы ангиотензинпревращающего фермента (АПФ). Ингибиторы АПФ являются эффективными и безопасными средствами. Помимо снижения АД, препараты оказывают благоприятные эффекты, препятствуя появл
Продолжение. Начало см.: «Лечащий Врач», № 1, 2007 г.
Ингибиторы ангиотензинпревращающего фермента (АПФ). Ингибиторы АПФ являются эффективными и безопасными средствами. Помимо снижения АД, препараты оказывают благоприятные эффекты, препятствуя появлению и прогрессированию сердечно-сосудистых осложнений, эффективно снижают смертность больных сердечной недостаточностью. Их рекомендуется назначать при левожелудочковой дисфункции, перенесенном инфаркте миокарда, диабетической нефропатии.
В таблице 1 представлены основные ингибиторы АПФ, их средние дозы и кратность приема.
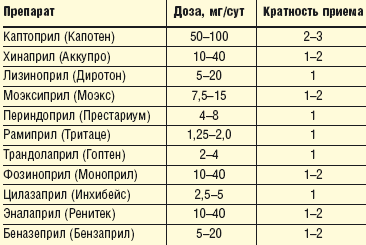 |
| Таблица 1. Ингибиторы АПФ, применяющиеся у больных ИБС с артериальной гипертензией |
Дозу ингибитора АПФ и кратность его приема в течение суток подбирают таким образом, чтобы обеспечить 24-часовой контроль за уровнем артериального давления (АД) и в то же время не допустить чрезмерного снижения АД при максимальном действии препарата. Для этого необходимо измерять АД на максимуме действия данного препарата и в конце междозового интервала (обычно через 24 ч после приема ингибитора АПФ длительного действия).
Имеются данные о дополнительных кардиопротекторных свойствах ингибиторов АПФ у группы больных ишемической болезнью сердца (ИБС) с артериальной гипертензией (АГ), которые нельзя объяснить только снижением АД. Было показано, что ингибиторы АПФ влияют на основные патологические процессы, лежащие в основе коронарной болезни сердца — вазоконстрикцию, структурные изменения в сосудистой стенке, ремоделирование левого желудочка (ЛЖ), формирование тромба. Протекторное влияние ингибиторов АПФ в отношении развития атеросклероза, по-видимому, обусловлено сложным механизмом их действия: снижением уровня ангиотензина II и повышением продукции оксида азота, а также улучшением функции эндотелия сосудов. Одним из механизмов антиишемического действия ингибиторов АПФ является и артериовенозная периферическая вазодилатация, устраняющая гемодинамическую перегрузку сердца (как заполнением, так и сопротивлением) и снижение давления в желудочках [6, 20]. Кроме того, препараты оказывают прямое положительное действие на коронарный кровоток, уменьшая вазопрессорные симпатико-адреналовые эффекты, потенцируя эффекты нитратов (часто назначаемые больным стенокардией) и устраняя толерантность к ним, а также оказывая непосредственное вазодилатирующее действие на коронарные сосуды.
Некоторые препараты ингибиторов АПФ (Моноприл) оказывают благоприятное влияние на суточный профиль АД, обеспечивая стабильный на протяжении суток уровень гемодинамики, снижение постнагрузки на ЛЖ. Возможно, именно эта особенность антигипертензивного эффекта и определяет способность моноприла избирательно устранять эпизоды ночной ишемии миокарда [16].
В. П. Лупанов, доктор медицинских наук, профессор
НИИ клинической кардиологии им. А. Л. Мясникова, Москва
Сравнительный мета–анализ эффективности сартанов при лечении артериальной гипертензии
Опубликовано в журнале:
РМЖ КАРДИОЛОГИЯ ТОМ 18, No 22, 2010
Д.м.н. Г.А. Барышникова
ФГУ Учебно–научный медицинский центр управления делами Президента РФ, Москва
В настоящее время в мире артериальной гипертензией (АГ) страдает один миллиард человек. АГ является важным фактором риска развития сердечно–сосудистых осложнений (ССО), а из–за широкого распространения вносит существенный вклад (от 35 до 45%) в сердечно–сосудистую заболеваемость и смертность [1]. По мере старения населения и увеличения роли таких способствующих факторов, как ожирение, малоподвижный образ жизни и курение, к 2025 г. ожидается увеличение доли сердечно–сосудистых заболеваний в структуре смертности населения до 60% (до 1,56 млрд человек) [1,2]. Заболеваемость и смертность, связанные с неконтролируемой АГ, являются причиной существенного экономического бремени в виде расходов на лекарства, госпитализацию, хирургическое вмешательство и прочие ресурсы здравоохранения. Несмотря на широкую осведомленность о последствиях АГ и доступность эффективных методов лечения, до 32% пациентов, страдающих АГ, не получают эффективных противогипертензивных препаратов [3].
Ренин–ангиотензин–альдостероновая система (РААС) играет ключевую роль в патофизиологии АГ, выступая первичным регулятором объема жидкости, водно–солевого баланса и объема крови. При повышении активности РААС ангиотензин–II вызывает вазоконстрикцию, повышение секреции альдостерона и активности симпатической нервной системы, что в совокупности способствует становлению и прогрессированию АГ. Блокаторы рецепторов ангиотензина–II (БРА) регулируют работу РААС, блокируя активацию рецепторов ангиотензина–II подтипа АТ1, что сопровождается вазодилатацией, уменьшением секреции вазопрессина, выработки и секреции альдостерона.
На протяжении ряда лет важную роль в лечении АГ играют БРА II, входящие в список основных антигипертензивных препаратов, которые практически сразу заявили о себе не только как о средствах для лечения АГ, но и о перспективных препаратах для предотвращения ряда ССО, лечения хронической сердечной недостаточности и заболеваний почек. Основания для их назначения при АГ значительно расширены (рис. 1), и сегодня совсем не обязательно иметь предшествующий печальный опыт применения ингибиторов АПФ в виде мучительного сухого кашля или ангионевротического отека для выбора сартанов как противогипертензивных препаратов, т.е. БРА II обрели самостоятельную ценность. Наработана серьезная доказательная база по применению этих препаратов, и, разумеется, появилась потребность провести сравнительную оценку эффективности и безопасности отдельных представителей класса сартанов. Этой цели служит мета–анализ Nixon R.M. с соавт. [4], посвященный оценке сравнительной эффективности валсартана в лечении АГ в ряду прочих БРА II. В настоящее время в России широко используются лозартан, валсартан, реже – эпросартан, ирбесартан, телмисартан, кандесартан. За каждым из этих препаратов значительная доказательная база, например лозартан доказал свои преимущества перед атенололом в лечении АГ с сопутствующей гипертрофией левого желудочка (исследование LIFE), ирбесартан доказал наличие у него мощного нефропротективного потенциала (исследования IDNT и IRMA–2), эпросартан эффективно предупреждал развитие повторного инсульта в исследовании MOSES. Что касается сравнения противогипертензивной активности различных сартанов, то в большинстве посвященных этому вопросу мета–анализов сообщалось о сопоставимой активности различных БРА [5], однако при этом либо не рассматривалась эффективность валсартана, либо он применялся в низкой дозе (до недавнего времени валсартан применялся в основном в дозе 80 мг/сут., в то время как с 2001 г. рекомендуемая стартовая доза валсартана для лечения АГ 160 мг/сут., максимальная – 320 мг/сут.).
| Рис. 1. Клинические ситуации в пользу применения БРА II в рекомендациях ВНОК |
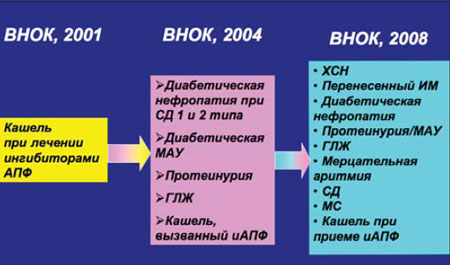 |
Валсартан поистине «препарат–многостаночник», доказавший свою эффективность при АГ (исследование VALUE), при хронической сердечной недостаточности (исследование Val–HeFT), при остром инфаркте миокарда (исследование VALIANT). Общее число включенных в эти исследования пациентов превысило 34 тыс. человек. Валсартан стал первым препаратом из класса БРА II, который был зарегистрирован для лечения больных ХСН. В исследовании Val–HeFT [7] в течение 2 лет наблюдали 5010 больных ХСН со II– IV ФК NYHA, которые получали рекомендуемую терапию, в составе которой могли назначать иАПФ, бета–блокаторы, диуретики и дигоксин. К проводимой терапии был добавлен либо валсартан в стартовой дозе 40–80 мг с последующим увеличением до 160 мг 2 раза/сут., либо плацебо. Добавление валсартана к проводимой терапии, включая иАПФ в 93% случаев, привело к снижению риска развития смертности и сердечно–сосудистой заболеваемости на 13,2% (р=0,009) в основном за счет снижения количества госпитализаций вследствие ХСН. В подгруппе пациентов, не получавших иАПФ, применение валсартана снижало риск общей смертности на 33,1 % (р = 0,017), а риск развития комбинированной точки (общая смертность + сердечно–сосудистые события) – на 44 % (р = 0,0002). В исследовании Val–HeFT было показано, что при лечении валсартаном наблюдается достоверное по сравнению с плацебо, снижение активности мозгового натрийуретического пептида, считающегося одним из важных маркеров прогрессирования сердечной недостаточности. При лечении валсартаном отмечалось и меньшее, по сравнению с группой плацебо, нарастание активности норадреналина – еще одного неблагоприятного прогностического маркера. В результате дополнительного анализа результатов исследования Val–HeFT была обнаружена способность этого препарата предупреждать развитие мерцательной аритмии. В исследовании VALIANT [8] изучалось применение валсартана у пациентов с острым инфарктом миокарда, осложненным сердечной недостаточностью и/или дисфункцией левого желудочка, с использованием БРА в сравнении с иАПФ на течение острого ИМ. В исследование включались больные в течение 0,5–10 дней после развития ИМ. По данным этого исследования, монотерапия валсартаном в дозе 160 мг 2 раза/сут оказалась такой же эффективной в лечении постинфарктных больных с дисфункцией левого желудочка и/или сердечной недостаточностью, как и монотерапия каптоприлом в дозе 50 мг 3 раза/сут., ценность применения которого в подобной ситуации была доказана ранее. Следует отметить лучшую переносимость валсартана. Вместе с тем комбинированная терапия ингибитором АПФ и БРА не давала дополнительного улучшения прогноза у больных после ИМ по сравнению с монотерапией иАПФ. По итогам VALIANT оба препарата можно в равной степени применять при остром инфаркте миокарда у пациентов с высоким риском сердечно–сосудистых осложнений. Выбор будет, очевидно, определяться переносимостью и стоимостью этих препаратов. В исследовании KYOTO HEART [9] оценивали у 3031 пациента эффективность валсартана, присоединенного к проводимой антигипертензивной терапии у больных с неконтролируемой АГ и высоким риском осложнений. Пациенты были рандомизированы в группу получающих дополнительно валсартан в дозе до 320 мг/сут. и группу получающих другие препараты за исключением БРА. В качестве первичной конечной точки была сумма всех фатальных и нефатальных сердечно–сосудистых событий. В среднем период наблюдения составил 3,3 года. В обеих группах был достигнут одинаковый контроль за уровнем АД: давление снизилось со 157/88 до 133/76 мм рт.ст. У больных группы валсартана по сравнению с другой группой достоверно снизился риск развития событий первичной конечной точки на 45%. Таким образом, присоединение валсартана к лечению недостаточно контролируемых больных АГ не только позволило добиться целевого уровня, но и значительно улучшило прогноз.
В исследовании VALUE (2004) также осуществлялось увеличение дозы валсартана с 80 мг до 160 мг/сут. [10], поскольку в этих исследованиях была продемонстрирована высокая эффективность валсартана, целесообразно сравнить эффект валсартана и других сартанов в сопоставимых дозах. Nixon R.M. с соавт. [4] при проведении в 2009 г. крупного мета–анализа (13 тыс. пациентов) учел недостатки проведенных ранее мета–анализов, отобрав для анализа исследования, в которых различные сартаны назначались в сопоставимых дозах, в том числе исследования с валсартаном, используемым в более высоких дозах (160–320 мг/сут.). Как уже сообщалось ранее, целью мета–анализа было изучение сравнительной эффективности разных сартанов в снижении систолического (САД) и диастолического (ДАД) АД у больных с эссенциальной АГ. Были проанализированы результаты краткосрочных проспективных рандомизированных двойных слепых контролируемых исследований, проведенных за период с октября 1997 г. по май 2008 г. (более 10 лет), в которых у больных АГ (лица старше 18 лет с 1 –2 степенью повышения АД, ДАД – 90–115 мм рт. ст.) применялся хотя бы один сартан. Были использованы англо– и германоязычные базы данных MEDLINE, EMBASE, EMBASE Alert, а также базы данных Кокрановских систематических обзоров и клинических исследований и научного цитирования (SciSearch). Всего в мета–анализ было включено 31 исследование (13110 больных), распределение по количеству исследований с применением различных сартанов приведено на рисунке 2. Авторы мета–анализа включали только те исследования, в которых титрование доз препаратов либо не проводилось, либо проводилось форсированно. При этом дозировки сартанов классифицировались как «низкие», «средние» и «высокие» (рис. 3).
| Препарат | Количество исследований |
| Лозартан | 13 |
| Валсартан | 12 |
| Кандесартан | 6 |
| Ирбесартан | 6 |
| Телмисартан | 5 |
| Олмесартан | 2 |
| Препараты | Низкие дозы, мг | Средние дозы, мг | Высокие дозы, мг |
| Лозартан | 50 | 100 | — |
| Валсартан | 80 | 160 | 320 |
| Кандесартан | 8 | 16 | 32 |
| Ирбесартан | — | 150 | 300 |
| Телмисартан | — | 40 | 80 |
| Олмесартан | 10 | 160 | 320 |
При оценке результатов мета–анализа авторы прежде всего отметили связь эффекта всех БРА с используемой дозой препаратов. На рисунке 4 приведены данные по снижению САД и ДАД при использовании различных доз валсартана. Причем валсартан в дозе 160 мг оказался эффективнее лозартана в дозе 100 мг и ирбесартана в дозе 150 мг/сут. Таким образом, валсартан снижал САД достоверно лучше, чем лозартан (на 3,31 мм рт.ст.) и ирбесартан (на 3,56 мм рт.ст.), и ДАД – лучше, чем лозартан (на 1,95 мм рт. ст.), ирбесартан (на 2,06 мм рт.ст.) и кандесартан (на 1,85 мм рт.ст. Других статистически достоверных различий в эффективности различных сартанов, при использовании их в эквивалентных дозах обнаружено не было.
Для уточнения этих данных авторы мета–анализа рекомендуют провести специально спланированные рандомизированные клинические исследования с прямым сравнением разных препаратов друг с другом.
В настоящее время на российском рынке появился препарат Валз (фармацевтическая компания Актавис). Отличительной особенностью Валза является наличие всех трех зарегистрированных показаний, как и у оригинального валсартана: АГ, ХСН и повышение выживаемости пациентов с острым инфарктом миокарда. Это может быть важно для практического врача при выборе назначаемого препарата. Следует отметить и наличие комбинированного препарата валсартан+гидрохлоротиазид Валз Н, более выраженно снижающего АД по сравнению с валсартаном. По результатам исследования на биоэквивалентность доказано, что Валз эквивалентен оригинальному валсартану. Валз сочетает высокую эффективность и сравнительно невысокую стоимость, что делает препарат доступным для большинства пациентов.


