Атипичный гемолитико уремический синдром что это
Гемолитико-уремический синдром у детей
Общая информация
Краткое описание
Союз педиатров России
МКБ 10: D59.3
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
ГУС представляет собой серьезную терапевтическую проблему в педиатрии и детской нефрологии, являясь одной из ведущих причин ОПН с потенциальной трансформацией в терминальную хроническую почечную недостаточность (тХПН) в различные сроки от начала заболевания. Несмотря на то, что наиболее распространена STEC-ассоциированная форма ГУС с типичным диарейным продромом, требуется тщательное подтверждение инфекционной этиологии для того, чтобы своевременно исключить атипичный ГУС и ГУС, связанный с пневмококковой инфекцией.
Эпидемиология
Диагностика
Крайне необходимо своевременное подтверждение факта STEC-инфекции и определение основных признаков ТМА, показателей азотемии, электролитов и основных витальных параметров.
(Сила рекомендации 1; уровень достоверности доказательств C)
(Сила рекомендации 1; уровень достоверности доказательств B).
Дифференциальный диагноз
— Острый тубулоинтерстициальный нефрит.
Осложнения
Введение плазмы и не отмытых эритроцитов противопоказано, поскольку они содержат анти-Т IgM антитела, которые могут спровоцировать рецидив ГУС. Отдельные работы свидетельствуют об эффективности заменного переливания плазмы (ЗПП) с последующим замещением альбумином.
Лечение
Консервативное лечение
Комментарий: нет доказанного варианта терапии, способного повлиять на течение Д+ГУС. Гепарин, тромболитики и антиагреганты, стероиды и СЗП не имеют существенного эффекта.
80 %), CFI и С3 (> 50 %). Трансплантация проведена всего 3 пациентам с мутацией CFB, все потеряли почки в результате возвратного аГУС. Поскольку трансплантированная почка не содержит мутированного MCP белка, вероятность возврата аГУС при этих мутациях очень мала. Большинство больных при возврате аГУС теряют почки менее, чем через 1 год. Другой причиной потери почки у детей является тромбоз.
Прогноз
Профилактика
Комментарий: у отдельных больных рецидивы отмечены после вакцинаций. Тем не менее, польза последних существенно превалирует над риском.
Атипичный гемолитико-уремический синдром (аГУС)
Атипичный гемолитико-уремический синдром (аГУС)
Атипичный гемолитико-уремический синдром (аГУС) – это чрезвычайно редкое (орфанное) заболевание, связанное с недостаточностью альтернативного пути активации комплемента. По системе МКБ-10 кодируется, как D 59.3
Атипичный гемолитико-уремический синдром (аГУС). Прогноз. Причины.
К сожалению, прогноз заболевания, чаще всего, неблагоприятный. Атипичный гемолитико-уремический синдром (аГУС) – это угрожающая жизни хроническая болезнь, характеризующаяся мультисистемным поражением органов и тканей. Заболевание примерно одинаково встречается как у детей, так и у взрослых. В основе заболевания лежит тромботическая микроангиопатия (TMA), при которой в маленьких кровеносных сосудах возникают тромбы. Из-за этого нарушается кровоснабжение, и органы страдают.
Чем дольше длится токсическое агрессивное воздействие на организм, тем более пагубными становятся последствия: отказывают почки, развивается инсульт или инфаркт.
Соответственно, при ранней диагностике, при выявлении заболевания на начальных стадиях, можно снизить пагубное воздействие атипичного гемолитико-уремического синдрома (аГУС), и тем самым дать шанс человеку на нормальную полноценную жизнь.
Атипичный гемолитико-уремический синдром (аГУС). Наследование.
Атипичный гемолитико-уремический синдром (аГУС) считается наследственным заболеванием только в 20% случаев, с аутосомно-рецессивным или доминантным типом передачи. Примерно в половине случаев выявить генетическую мутацию не получается. Поэтому ДНК – анализ при атипичном гемолитико-уремическом синдроме (аГУС) не является важнейшим диагностическим методом, на его основании не может даваться заключение о начале или отмене терапии.
Атипичный гемолитико-уремический синдром (аГУС) одинаково распространен по всей планете, не выявлено зависимости от пола или расы пациентов. Из-за редкости заболевания сложно говорить о точном количестве пациентов, есть предположения о том, что болезнь встречается примерно от 1 до 9 случаев на миллион человек.
Атипичный гемолитико-уремический синдром (аГУС). Клинические проявления.
Симптомы атипичного гемолитико-уремического синдрома (аГУС) встречаются как все вместе, так и по отдельности. Насторожить должно любое из клинических проявлений болезни.
Итак, симптомами атипичного гемолитико-уремического синдрома (аГУС) являются:
Вызывать проявления атипичного гемолитико-уремического синдрома (аГУС) могут несколько причин, зачастую они становятся спусковым крючком для начала заболевания. Вот они:
Все они усиливают нарушение в системе комплемента. Иногда для манифестации заболевания бывает достаточно одного фактора, но они могут действовать и в совокупности.
Атипичный гемолитико-уремический синдром (аГУС). Диагностика.
Во-первых, атипичный гемолитико-уремический синдром (аГУС) не имеет в самом начале возникновения заболевания проявлений гемоколита, во-вторых диарея может сама по себе вызвать заболевание, а не быть его симптомом. На этом этапе нужно исключить STEC и Streptococcus pneumoniae – инфекции.
Дальше методом исключения проверяем пациента на системную красную волчанку, СПИД, злокачественную гипертонию, тромботическую тромбоцитопеническую пурпуру, HELLP – синдром у рожающих женщин и ряд других заболеваний.
Напоминаем, что генетический анализ не имеет 100% достоверности, у части пациентов с подтвержденным атипичным гемолитико-уремическим синдромом (аГУС), нарушения в соответствующем гене не выявлены.
Атипичный гемолитико-уремический синдром (аГУС). Лечение.
Лечение инфузиями плазмы, пламообменом. В настоящий момент метод считается недостаточно эффективным, у одних пациентов он вызывает незначительное улучшение показателей, а у других оказывается практически бесполезным.
Гемодиализ. Процедура искусственной очистки организма лишь устраняет последствия сбоя в системе комплемента, но при этом никак не влияет на процесс избыточного образования белка. Она способна на несколько лет увеличить продолжительность жизни пациента. Сохраняется возможность развития внепочечной тромботической микроангиопатии.
Трансплантация. Почка, потерявшая свою функцию, может быть заменена на новую, но прогрессирующее заболевание может вновь начать разрушать органы и ткани. 90% пациентов опять чувствуют симптомы атипичного гемолитико-уремического синдрома (аГУС). Есть большой риск рецидива после трансплантации. Иногда можно осуществить двойную трансплантацию, и печени, и почки, но при этом возникает огромная сложность в поиске идеально подходящих двух донорских органов. Кроме того, и такая сложнейшая манипуляция может не дать гарантированного положительного результата. Тромботическая микроангиопатия развивается и в других органах.
Норильская межрайонная детская больница
Краевое государственное бюджетное учреждение здравоохранения
Современные представления об атипичном гемолитико-уремическом синдроме
А.В. Попа, В.И. Лифшиц, ХМ. Эмирова, Т.Ю. Абасеева, Д.В. Зверев, Т.Е. Панкратенко
В настоящее время гемолитико-уремический синдром (ГУС) является основной причиной острой почечной недостаточности (ОПН) у детей в возрасте младше 5 лет. Несмотря на то, что с момента описания ГУС Гассером прошло более 50 лет, вопросы этиологии, патогенеза, диагностики и лечения ГУС остаются до настоящего времени недостаточно изученными и практически важными для клинической педиатрии. Исследования последнего десятилетия доказывают, что в основе механизма повреждения клеток эндотелия сосудов лежит чаще всего генетически обусловленная разбалан-сировка системы комплемента, что приводит к ее резкой активизации. Лечение атипичного ГУС остается малоэффективным. Прогноз, по-прежнему, неблагоприятен.
В настоящее время гемолитико-уремический синдром (ГУС) является основной причиной острой почечной недостаточности (ОПН) у детей в возрасте младше 5 лет. До настоящего времени вопросы этиологии, патогенеза, диагностики и лечения ГУС остаются недостаточно изученными и важными для клинической педиатрии.
Выделяют типичный или постдиарейный ГУС (Stx-HUS) и атипичный ГУС (аГУС; Non-Stx-HUS). Если результаты лечения типичного ГУС успешны, то последствия атипичного ГУС остаются весьма неблагоприятными [1].
Non-Stx-HUS (аГУС) относится к группе тромботических микроангиопатий (ТМА), при которой почки являются основной мишенью в результате массивного повреждения эндотелия сосудов. Заболевание характеризуется микроангиопатической гемолитической анемией (МАГА) с тромбоцитопенией и почечной недостаточностью и отличается от Stx-HUS возрастом пациентов ( 5 лет). Дебют аГУС может напоминать классическую тромботическую тромбоцитопеническую пурпуру (ТТП) — заболевание, при котором комбинация ТМА с тромбоцитопенией нередко сочетается с неврологическими симптомами, но обычно менее тяжелым поражением почек.
Развитие ТТП связывают с дефицитом протеазы фактора фон Виллебранда (ADAMTS 13), чаще в результате наличия антител, реже врожденной недостаточности энзима. Атипичный ГУС встречается в 5-10% от всех случаев ГУС, относится к тяжелым состояниям, склонным к рецидивам, с высокой летальностью и реальным риском развития терминальной стадии хронической почечной недостаточности (тХПН) [2, 3].
Несмотря на многообразие классификаций ГУС, в последнее время широко используется вариант, учитывающий отношение к шига-токсину (табл. 1) [1].

Симптомокомплекс аГУС имеет мультифакториальную природу, включая различные возбудители, не продуцирующие шигатоксин, а также вирусы, лекарственные препараты, злокачественные новообразования, трансплантацию, беременность, склеродермию, волчанку, антифосфолипидный синдром. Диарея у этих пациентов встречается редко. Результаты лечения этих форм неудовлетворительны. По разным данным, аГУС в 25% случаев заканчивается летально, в 50% — развивается тХПН или необратимое поражение ЦНС 4.
Спорадическая форма аГУС, развившаяся на фоне инфекции Streptococcus pneumonia, составляет около 40% случаев non-Stx-HUS и 4,7% всех случаев ГУС у детей в США [6]. Фермент нейраминидаза, продуцируемый S. pneumonia, удаляет сиаловые кислоты с клеточных мембран и обнажает антиген Thomsen-Friedenreich, тем самым, обеспечивая воздействие на него циркулирующих IgM, что приводит к агрегации тромбоцитов и повреждению эндотелия [8, 9]. Это тяжелое заболевание, сопровождающееся респираторным дистресс-синдромом, тяжелыми неврологическими расстройствами, при котором летальность достигает 50% [9].
Описано развитие non-Stx-HUS, вызванное противоопухолевыми (митомицин, цисплатин, блеомицин, гемцитабин), иммуносупрессивными (циклоспорин А, такролимус, ОКТЗ, хинидин) и антитромбоцитарными (тиклопидин, клопидогель) препаратами [10].
В литературе имеются сообщения о двух видах посттрансплантационного ГУС [2, 11]. Один из них возникает у пациентов впервые (de novo), другой — с тХПН, развившейся в результате перенесенного ГУС. Причинами развития посттрансплантационного ГУС, возникшего de novo, может служить применение ингибиторов кальцинейрина или отторжение по гуморальному типу (С4Ь-поло-жительное). Эта форма ГУС после трансплантации почки возникает у 5-15% пациентов, получающих циклоспорин А, и у 1% пациентов, получающих такролимус [12].
На фоне беременности при преэклапсии как осложнение могут развиться ГУС и поражение печени (HELLP-синдром), что служит показанием к экстренному родоразрешению, после которого наступает полная ремиссия [13]. Послеродовый ГУС, как правило, развивается в первые 3 месяца после родов. Летальность при этой форме составляет 50-60% [14].
Исследованиями последнего времени документально подтверждено, что аГУС связан с генетическими нарушениями системы комплемента [5] (табл. 2).

Первые сообщения в мировой литературе о роли в патогенезе аГУС третьего компонента комплемента (СЗ) при семейной и спорадической формах появились еще в 1974 г. [16, 17]. Низкий уровень СЗ отражает его повышенное потребление в микроциркуляторном русле, что подтверждается обнаружением гранулярных отложений СЗ в клубочках и артериолах [18, 19]. Четвертая фракция комплемента (С4) находится в пределах нормы [16]. Описано снижение СЗ у здоровых родственников пациентов, страдающих семейным аГУС, что свидетельствует о наличии врожденного дефекта, приводящего к повышенной активации комплемента [16].
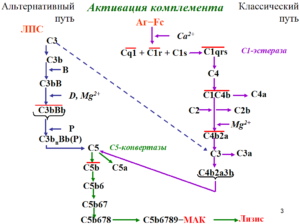
Выделяют три пути активации комплемента: классический, лектиновый и альтернативный (см. рисунок) [20, 21].
Поверхностные молекулы микроорганизмов активируют эти механизмы с образованием комплексов протеаз и СЗ конвертаз, расщепляющих СЗ до СЗЬ. Классическая и лектиновая конвертазы образуются из фрагментов С2 и С4, а конвертаза альтернативного пути требует СЗ. В случаях с низким уровнем СЗ и нормальным уровнем С4, которые чаще всего встречаются у пациентов с аГУС, можно сделать вывод об альтернативном пути активации комплемента у этих больных [16].
Альтернативный путь требует непрерывного контроля активности, так как находится в состоянии постоянной аутоактивации. Последовательность протеолитических шагов, вовлекающих СЗ, факторы В и D, усиливает активацию комплемента. Активация С5 приводит к образованию мембраноатакующего комплекса и лизису клетки. Активация контролируется ингибиторными белками, фактором Н и мембрано-связанным кофакторным протеином (МСР, известного как CD46). Фактор I является сериновой протеазой, которая инактивирует СЗЬ и С4Ь с кофакторами фактором Н и С4Ь-связывающим протеином. Нарушения были описаны в генах для большинства компонентов (фактор Н — у 30% больных, CD46 — у 10-15%, фактор I — в 10% случаев, фактор В, СЗ, фактор Н-связанные белки 1-5, тромбомодулин).
В 1998 г. P.Warwicker и соавт. [22] опубликовали результаты развития аГУС в трех семьях из-за связи с кластером генов на хромосоме Iq32, кодирующих ряд регуляторных белков комплемента. Первым изученным геном этого участка хромосомы стал фактор Н (HFI) [23, 24]. Фактор Н является мультифункциональным одноцепочечным гликопротеином плазмы крови с молекулярной массой 150 кДа, играет важную роль в регуляции альтернативного пути активации комплемента. HFI служит кофактором для фактора I (FI), регулирующего деградацию вновь образованных молекул СЗЬ, и контролирует разрушение, образование и стабильность СЗЬ-конвертазы (СЗЬВЬ).
В результате вирусной или бактериальной инфекции повреждается эндотелий сосудов с активацией комплемента и образованием СЗЬ. В случае отсутствия мутации HFI превращает СЗЬ в неактивную форму iC3b. В субэндотелиальном матриксе отсутствуют регуляторы комплемента, поэтому контроль за активацией комплемента в этой структуре полностью зависит от HFI. В инактивации СЗЬ участвует и МСР, расщепляя его до iC3b под действием FI [25, 26].
Мутантный HFI обладает нормальной кофакторной активностью в жидкой фазе. Однако мутация затрагивает участок взаимодействия с полианионами на С-конце HFI, что приводит к снижению способности данного фактора к связыванию с протеогликанами на поверхности эндотелиальных клеток и в субэндотелиальном матриксе. Тем самым увеличивается количество СЗЬ, получающего доступ к поверхности эндотелиальных клеток, так что концентрация МСР становится недостаточной для адекватного контроля активности комплемента на клеточной мембране. Кроме того, СЗЬ, откладываемый на обнаженном внеклеточном матриксе, не разрушается и образует СЗ-конвертазу альтернативного пути активации комплемента, усиливающую расщепление СЗ с образованием СЗЬ [25, 26].
Тогда как большинство мутаций приводят к дефектной функции регуляторных белков, мутации с усилением функции приводят к сверхактивации этого пути (суперфактор В). Мутантный фактор В приобретает способность связываться с инактивированным СЗЬ, что дает совершенно новый функциональный iC3Bb (СЗ конвертаза). Таким образом, даже если клеткам хозяина удалось заполучить фактор I для инактивации по¬верхностных отложений СЗЬ, мутантный фактор В будет использовать инактивированный СЗЬ для дальнейшей активации комплемента, приводя к клеточному повреждению [26].
В детском возрасте встречается и так называемый DEAP-HUS (Дефицит фактор Н-связанных плазменных белков и аутоантитело позитивная форма гемолитико-уремического синдрома), ключевыми признаками которого является наличие аутоантител к фактору Н и отсутствие фактор Н-связанных белков 1 и 3, обусловленное делецией 84-kbp фрагмента хромосомы 1. Лечение этого вида ГУС основывается на снижении титра антител с использованием плазматерапии, стероидов и иммуносупрессии.
Дефицит МСР также предрасполагает к развитию аГУС. Мутации МСР приводят к снижению поверхностной экспрессии или способности связывать СЗЬ. В обоих случаях мембраносвязанный СЗЬ инактивируется малоэффективно, что вызывает недостаточное усиление образования СЗЬ и отложение его на поврежденные эндотелиальные клетки посредством образования СЗ-конвертазы [25, 26].
В последнее время описывают еще один механизм регуляции активации комплемента — это мутации гена МСР, кодирующего мембранный кофакторный белок — связанный с клеткой регулятор комплемента [27, 28]. МСР является широко распространенным трансмембранным гликопротеином, выполняющим функцию кофактора для FI, расщепляющего СЗЬ и С4Ь на поверхности клеток хозяина 29. В почках отмечается высокий уровень МСР, который обнаруживается на поверхности эндотелиальных клеток почечных клубочков 33. По-видимому, МСР играет основную роль в защите гломерулярного эндотелия от активации СЗ. В настоящее время при аГУС изучается роль тромбомодулина-эндотелиального гликопротеина, обладающего антикоагулянтной, противовоспалительной и цитопротективной активностью.
In vitro тромбомодулин связывает СЗЬ и HFI, ингибируя активность комплемента и усиливая FI-обусловленную инактивацию СЗЬ в присутствии кофакторов — HFI и С4Ь-связывающего белка. Способствуя активации плазменной прокарбокси-пептидазы В, тромбомодулин усиливает инактивацию анафилатоксинов СЗЬ и С5а. Мутантный тромбомодулин обладает сниженной активностью к инактивации СЗЬ и в меньшей степени защищает от безудержной активации комплемента. По полученным данным, нарушение функции тромбомодулина встречается у 5% больных с аГУС [36].
ГУС клинически проявляется неиммунной МАГА, тромбоцитопенией и ОПН. Stx-HUS, как правило, развивается на исходе инфекционного гастроэнтероколита [2]. Средний промежуток времени между проникновением в организм инфекционного агента и развитием инфекционного процесса составляет от 1 до 8 суток [1, 37]. Кишечная инфекция манифестирует болями в животе, жидким водянистым стулом, часто со слизью и зеленью, в 70% случаев через 1-2 суток развивается гемоколит, более чем в 50% — повторная рвота [1, 37]. Фебрильная лихорадка встречается в 30-80% случаев.
Начало Stx-ГУС чаще всего наблюдается на фоне уменьшения степени выраженности диареи и проявляется резкой бледностью кожного покрова, петехиями, наличием пастозности, снижением объема мочи или ее полным отсутствием. Ребенок становится вялым, сонливым, резко снижается аппетит. В 25% случаев энцефалопатия проявляется клонико-тоническими судорогами, сопором, комой [1, 38, 39]. В патогенезе энцефалопатии играют важную роль одновременно несколько факторов: отек мозга, гипоксия, геморрагии.
Массивное внутрисосудистое потребление тромбоцитов может спровоцировать развитие коагулопа-тии потребления и развернутого ДВС-синдрома: гипер- или гипокоагуляция, гипопротромбинемия, гипофибриногенемия, повышение уровня продуктов деградации фибрина, Д-димера, замедленный фибринолиз, нарушение агрегации тромбоцитов.
В лабораторных показателях практически всегда обнаруживается анемия (Нв 40-90 г/л), тром-боцитопения ( 8 ммоль/л, креатинин >110 мкмоль/л), повышение уровня лактатдегидрогеназы; в мазке периферической крови: лейкоцитоз, фрагменти-рованные эритроциты (шизоциты), анизоцитоз, пойкилоцитоз, умеренно выраженный ретикулоцитоз. Для подтверждения неиммунного характе¬ра анемии выполняется реакция Кумбса, являющаяся отрицательной при ГУС [1, 40].
Учитывая, что патоморфологической основой ГУС является ТМА, в клинической картине могут присутствовать симптомы полиорганной недостаточности: поражение поджелудочной
железы, желудочно-кишечного тракта, легких, миокарда.
Атипичный ГУС манифестирует в раннем возрасте: при мутации FI — в возрасте 2 месяцев, HFI — 6 месяцев, МСР — старше года. Провоцирующим фактором к дебюту аГУС являются инфекционные агенты, в дальнейшем рецидивы возникают у 2/з больных независимо от генетического варианта. Причем промежуток между рецидивами может колебаться от нескольких недель до нескольких лет. Экстраренальные проявления при аГУС — чаще поражение ЦНС — выявляются в 20% случаев. Клинические проявления аналогичны таковым при Stx-HUS, но исход и прогноз значительно хуже и зависят от варианта мутации.
Диагностика
Установление диагноза аГУС обычно вызывает определенные затруднения в связи с тем, что не существует достоверных клинических отличий его от типичного ГУС и ТТП. Таким образом, для проведения дифференциальной диагностики пациенты с ГУС при поступлении в лечебное учреждение нуждаются в определении концентрации СЗ и фактора ADAMTS 13. В случае обнаружения дефицита фактора ADAMTS 13 в первую очередь нужно думать о ТТП. Однако нормальный уровень СЗ не исключает дисфункцию комплемента. Более чувствительным тестом является определение повышенного показателя отношения C3d/C3 в плазме крови и наличие отложения СЗ в биоптате почек [18, 19].
Для достоверной диагностики аГУС необходимо определение уровней факторов Н, I, В, D. Измерение уровня HFI в сыворотке крови позволяет выявить тех немногочисленных пациентов с мутациями HFI, вызывающими снижение уровня HFI. Снижение показателя СН50 и концентрации фактора В можно найти у некоторых, но не у всех пациентов с мутациями HFI или МСР. Второй этап состоит в поиске мутаций по генам HFI и МСР. Поиск мутаций фактора I следует проводить у пациентов с пониженным уровнем его в сыворотке крови [25, 26].
Лечение
Специфической терапии ГУС не существует. Лечение пациентов с Stx-HUS заключается в проведении заместительной почечной терапии (ЗПТ) в тех случаях, когда она показана с целью поддержания гомеостаза и обеспечения жизненно важных функций. Параллельно проводится посиндромная терапия, включающая регуляцию водно-электролитного баланса, коррекцию коагулопатии (трансфузии свежезамороженной плазмы — СЗП, антикоагулянты), коррекцию анемии (трансфузии эритроцитов). Причем применение СЗП также не является доказанно необходимым [21].
Зато применение тромбоцитной массы с заместительной целью во всех публикациях считается
неоправданным. Доказано, что трансфузии тромбоцитов способствуют и без того высокой склонности к образованию микротромбов и усилению ишемии тканей. Особенно значительно сказывается мик-ротромбообразование на состоянии ЦНС, усиливая неврологическую симптоматику. Трансфузии тромбоцитной массы считаются оправданными только в случае сочетания выраженной тромбоци-топении с профузным кровотечением.
По поводу антибактериальной терапии в литературе существует определенная дискуссия. Одни авторы [41] сообщают об увеличении риска развития ГУС в случае применения антибиотиков для лечения инфекции, вызванной Stx-E. coli, другие [42] публикуют результаты исследований, которые подобные факты не подтверждают. Представляется рациональным внутривенное введение антибактериальных препаратов широкого спектра действия для профилактики бактериальной инфекции при катетеризации центральных вен, имплантации перитонеального катетера и других оперативных вмешательствах, а также при наличии явного очага инфекции.
Неэффективным также признано внутривенное введение фибринолитиков, иммуноглобулинов, кортикостероидов, антиоксидантов и антитромбоцитарных препаратов [39] в острой фазе заболевания.
Были попытки использовать пероральный препарат SYNSORB, механизм действия которого основан на связывании шига-токсина [43]. Но проведенные клинические исследования не подтвердили достоверную эффективность этого препарата. В то же время многие авторы [44, 45] сообщают о снижении частоты развития тХПН после ГУС у детей, получавших малобелковую диету и ингибиторы ангиотензинпревращающего фермента (иАПФ). У этих детей отмечены уменьшение протеинурии, нормализация артериального давления и оптимизация скорости клубочковой фильтрации. В случае развития тХПН выполняется трансплантация почки. Риск развития повторного ГУС в этом случае составляет не более 10% [46].
Лечение пациентов с non-Stx-HUS отличается от лечения пациентов с типичным ГУС. Практически все источники сообщают об эффективности использования СЗП [47, 48]. Ежедневная доза СЗП колеблется от 20 до 40 мл/кг, трансфузии производятся до достижения ремиссии [2, 49]. В последнее время все большее распространение получает точка зрения об эффективности заменного плазмафереза. Многие авторы доказывают необходимость ежедневного плазмафереза длительное время [50].
В случае развития non-Stx-HUS, вызванного Streptococcus pneumonia, трансфузии СЗП противопоказаны из-за наличия в плазме взрослого человека антител против антигена Tromsen-
Friedenreich, которые утяжеляют течение процесса[1]. Если ГУС развивается на фоне приема циклоспорина или такролимуса необходимо отменить препарат.
Трансплантация почки в случае non-Stx-HUS малоэффективна. У 50% пациентов после трансплантации развивается ГУС в трансплантате [46]. В случае развития рецидива ГУС в трансплантате повторная трансплантация не производится.
Перспективные направления терапии
В настоящее время есть несколько направлений борьбы с ГУС. Одно из направлений — это создание препаратов, предупреждающих воздействие шига-токсина на организм. Есть сообщения об использовании в эксперименте на животных (мыши) рекомбинантных бактерий, на поверхности которых расположен рецептор к шига-токсину, связывающий токсин в кишечнике [51].
Другим перспективным направлением борьбы с ГУС является путь воздействия на систему комплемента, играющую важную роль в патогенезе ТМА. В настоящее время разрабатываются моноклональные антитела против фактора С5.
Пекселизумаб и Экулизумаб блокируют активацию компонентов комплемента. Проводятся клинические испытания растворимых форм ингибитора СЗ/С5-конвертазы, рецептора комплемента I (CRI) [52].
Для варианта с дефицитом HFI разрабатывается рекомбинантный HFI, а также возможность использования донорской плазмы, богатой HFI [25].Некоторые молодые больные (около 10%) имеют аутоантитела против фактора Н, особенно при наличии предрасполагающих мутаций в других компонентах комплемента. Некоторые больные с аГУС имеют дефицит ADAMTS 13. Эти результаты привели к разработке новых рекомендаций для диагностики и лечения с использованием ингибиторов альтернативного пути активации комплемента.
В настоящее время открыты новые горизонты терапии. Моноклональные антитела против С5, экулизумаб, показали свою эффективность в некоторых случаях ГУС (Gruppo RA). Другие терапевтические стратегии, которые исследуются в настоящее время, включают концентрат фактора Н, синтетический регулятор комплемента.
Действительно, одной из важных клинических проблем является определение критериев прогноза заболевания. Так как около 50% выживших после острого периода в дальнейшем нуждаются в ЗПТ и трансплантации почки, то и прогноз в значительной степени определяется риском возврата аГУС после трансплантации. Такой риск чрезвычайно высок у пациентов с мутациями CFH (-80%), CFI и СЗ (>50%). Описаны результаты 3 трансплантаций у пациентов с мутацией CFB — у всех отмечена гибель трансплантата в результате возвратного аГУС [53]. В случае мутации МСР подобного осложнения не происходит из-за отсутствия мутированного белка в трансплантате. Поскольку CFH, CFI, CFB и СЗ синтезируются в печени, рекомендуют осуществлять комбинированную трансплантацию печени и почки или изолированную трансплантацию печени в случае отсутствия почечной недостаточности.
Атипичный ГУС — тяжелое состояние с очень высокой смертностью и большим риском развития ХПН. Наиболее эффективным методом терапии признано проведение заменного плазмафереза в начале острого периода. Некоторое улучшение результатов лечения пациентов с аГУС обусловлено активным изучением патогенеза этого тяжелого заболевания в последние годы.





