Атомам этих элементов легче отдать электроны чем принять
Атомам этих элементов легче отдать электроны чем принять
ПОЧЕМУ «ДВЕ БОЛЬШИЕ РАЗНИЦЫ»?
Некий шутник как-то заметил, что людей отличают от животных прежде всего два замечательных качества: чувство юмора и чувство исторического опыта. Человек может посмеяться над собственной неудачей и не попадет впросак там, где уже попал однажды. Мы бы упомянули еще одно качество: задавать себе вопрос «почему» и пытаться дать на него ответ.
И этим самым словечком «почему» мы сейчас воспользуемся.
Так вот в этом важнейшем законе химии и кроется различие между металлами и неметаллами.
Вот основная разница между металлами и неметаллами.
Впрочем, дотошные химики и в этом строжайшем правиле отыскали исключения. Есть и в обществе металлов непостоянные характеры. Два (пока!), всего два металла обнаружили «неметаллическую» особенность. Астат и рений (они обитают в 85-й и 75-й клетках таблицы Менделеева) известны в виде отрицательно одновалентных ионов. Этот факт словно бросает маленькую тень на удивительно целеустремленную семью металлов.
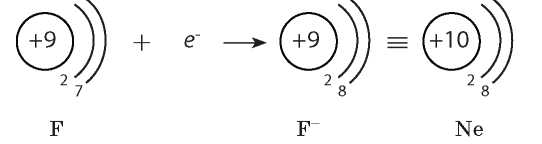
В царстве неметаллов наиболее яростен фтор. У него во «внешних сферах» семь электронов. Восьмого как раз не хватает для идиллии. И он с жадностью отнимает его почти у любого элемента периодической системы, ничто не может устоять перед бешеным натиском фтора.
Другие неметаллы принимают электроны кто легче, кто труднее. И понятно теперь, почему группируются они главным образом в верхнем правом углу таблицы: ведь у них снаружи много электронов, а такая картина может быть только у атомов, стоящих ближе к концу периодов.
Атомам этих элементов легче отдать электроны чем принять
• металлические элементы образуют простые вещества металлы и вещества преимущественно с основными свойствами;
• неметаллические элементы образуют неметаллы и вещества преимущественно с кислотными свойствами; металлы активно реагируют с неметаллами.
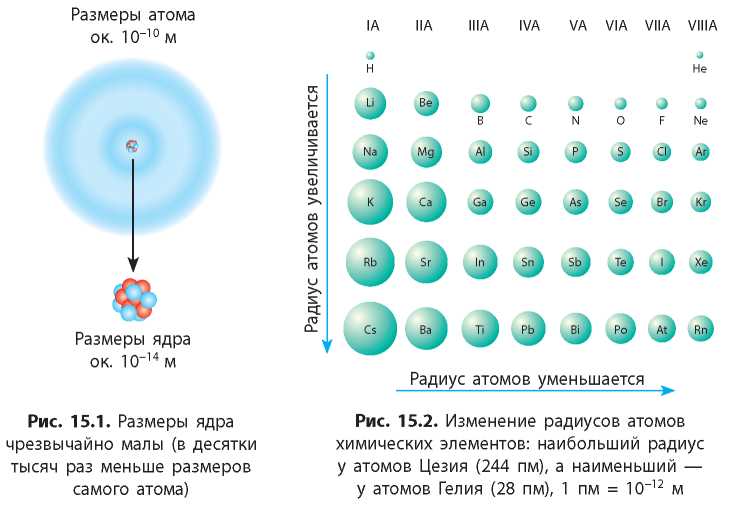
У электронной оболочки нет четких границ, поэтому радиус атомов определяют по расстоянию между ядрами соединенных атомов. Размер ядра атома по сравнению с размером атома мизерный, поэтому размер атомного ядра никоим образом не влияет на размер атомов (рис. 15.1). Радиус атомов полностью обусловлен числом электронных слоев (энергетических уровней).
В главных подгруппах с увеличением порядкового номера элемента (сверху вниз) увеличивается число занятых энергетических уровней. Поэтому радиус атомов химических элементов одной группы увеличивается (рис. 15.2).
У атомов химических элементов одного периода число заполняемых электронных слоев одинаково. Это означает, что и радиус их атомов должен быть одинаковым. Но в периоде с увеличением порядкового номера химического элемента заряд ядра постепенно возрастает. Электроны с увеличением заряда ядра притягиваются к нему сильнее, и потому в периоде радиус атомов постепенно уменьшается (рис. 15.2, с. 77).
Причина инертности инертных элементов
Зная электронное строение атома, можно предсказать характер химических элементов и свойства их соединений. Эти свойства обусловлены электронами, которые находятся на внешних энергетических уровнях. Такие электроны называют валентными. Рассмотрим влияние строения внешнего электронного уровня на характер элементов.
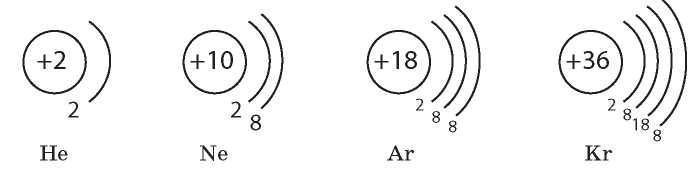
Среди химических элементов особую группу составляют инертные элементы. Их особенность заключается в том, что они не «стремятся» образовывать соединения. У атомов инертных элементов чрезвычайно устойчивая электронная оболочка, которая обусловливает их химическую инертность. В чем заключается причина ее устойчивости? Проанализируем строение внешнего электронного уровня инертных элементов:
У атомов Гелия на внешнем уровне находится два электрона. Это максимальная вместимость первого энергетического уровня, т. е. у атомов Гелия электронная оболочка полностью заполнена. У атомов Неона электронная оболочка также содержит максимальное число электронов — восемь. Атомы других инертных элементов (Аргон, Криптон и др.) на внешнем уровне содержат по 8 электронов. Их внешний энергетический уровень хоть и не заполнен полностью, но это соответствует заполненным s- и ^-орбиталям на внешнем уровне. Именно этим и объясняется химическая инертность данных элементов: они вообще не вступают в химические реакции.
Таким образом, атомы с завершенными энергетическими уровнями или на внешнем уровне которых содержится восемь электронов, обладают повышенной химической устойчивостью.
Металлический и неметаллический характер химических элементов
Атомы всех других химических элементов стремятся иметь такую же электронную оболочку, как у инертных элементов. Для этого они отдают или присоединяют электроны, чтобы их электронная оболочка стала такой же, как у атомов ближайшего инертного элемента.
Отдавая или присоединяя электроны, атом превращается в заряженную частицу, которую называют ионом. Различают катионы — ионы с положительным зарядом и анионы — отрицательно заряженные ионы.
Если электронов на внешнем энергетическом уровне мало, то их легче отдать, что характерно для металлических элементов. А если электронов на внешнем уровне много, то такие атомы присоединяют электроны, что характерно для неметаллических элементов.
Атомы большинства неметаллических элементов могут также и отдавать электроны, но главное отличие заключается в том, что атомы металлических элементов способны только отдавать электроны, а неметаллических — и отдавать, и принимать.
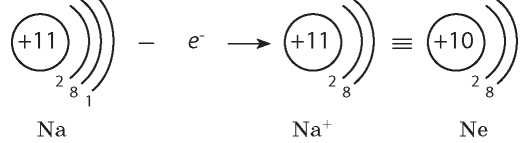
Рассмотрим щелочной элемент Натрий — элемент главной подгруппы I группы. Простое вещество, образованное Натрием,— активный металл. Высокая химическая активность натрия объясняется наличием в его атомах единственного валентного электрона, который он легко отдает в химических реакциях. Теряя этот электрон, атом Натрия превращается в положительно заряженный ион Na+ с электронной формулой инертного элемента Неона:
Ионы Na+ входят в состав всех соединений Натрия, например соды и поваренной соли. В отличие от атомов Натрия, ионы Натрия химически инертны и почти безвредны для организма (рис. 15.3, с. 80). Весь Натрий, который содержится в организме человека (около 90 г), находится именно в виде ионов.
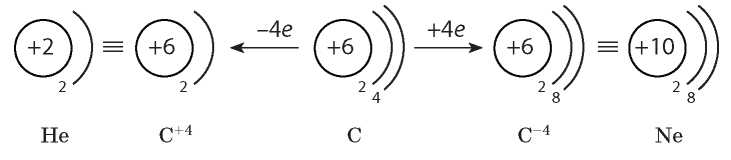
Рассмотрим Карбон — элемент главной подгруппы IV группы. Его атомы на внешнем уровне содержат по четыре электрона. Они могут принять электронную конфигурацию Гелия, отдав четыре электрона, или электронную конфигурацию Неона, присоединив четыре электрона:
Таким образом, Карбон может проявлять как металлические, так и неметаллические свойства. Но Карбон относят к неметаллическим элементам, так как главная особенность неметаллических элементов — способность присоединять электроны, и она преобладает над способностью их отдавать.
В атомах переходных элементов (d-элементов) на внешнем уровне, как правило, находится два электрона. Благодаря этому все переходные элементы являются металлическими. Все /-элементы (лантаноиды и актиноиды) также являются металлическими.
Электронные формулы ионов можно определить по формулам атомов, прибавив к ним или отняв от них нужное число электронов.
Изменение металлических и неметаллических свойств
У различных химических элементов — металлических или неметаллических — разная химическая активность. Это так же обусловлено числом валентных электронов на внешнем электронном уровне их атомов.
Элементам І группы нужно отдать один электрон, а ІІ группы — два электрона. Один электрон отдать легче, чем два. Следовательно, чем больше электронов на внешнем электронном уровне, тем атомам сложнее их отдавать, поэтому с увеличением числа электронов на внешнем уровне (в периодах) металлические свойства элементов ослабевают.
Чем больше электронов не хватает до завершения электронного уровня, тем тяжелее их присоединять, поэтому, чем меньше электронов на внешнем уровне, тем слабее проявляются неметаллические свойства элементов.
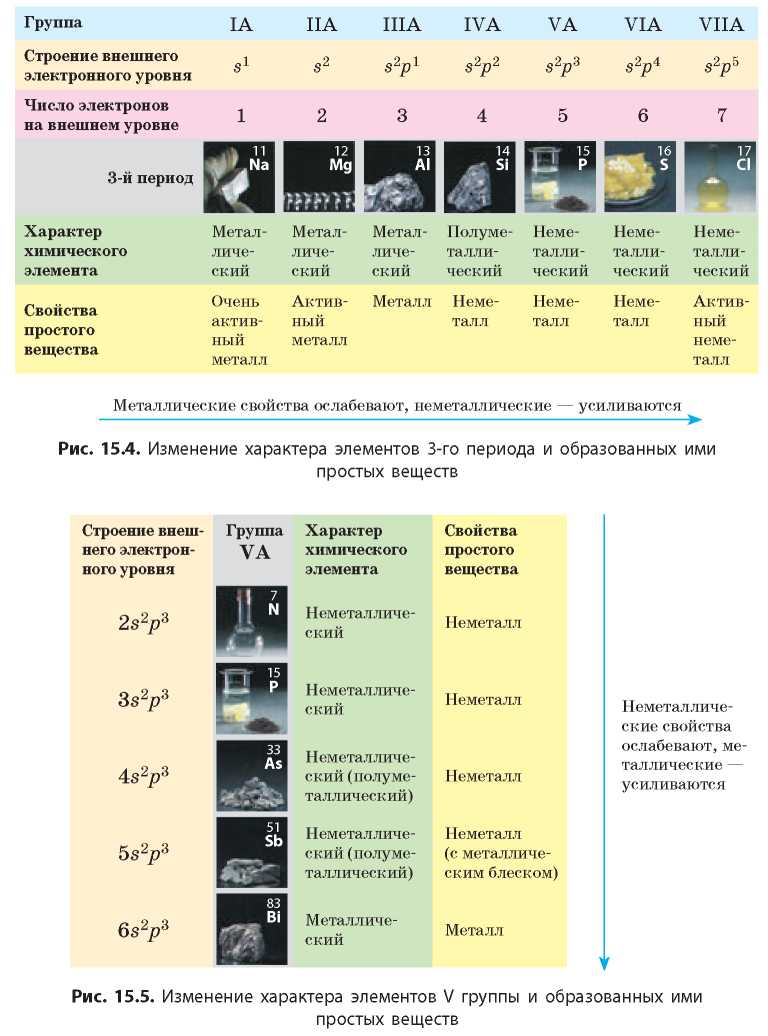
В периоде с увеличением порядкового номера металлические свойства элементов и образованных ими простых веществ ослабляются, а неметаллические — усиливаются (рис. 15.4, с. 82).
У элементов одной группы на внешнем уровне находится одинаковое число электронов. Например, у атомов щелочных элементов по одному электрону, но они расположены на разных уровнях: у атомов Лития — на втором, Натрия — на третьем и т. д. Чем дальше от ядра расположены валентные электроны, тем слабее они притягиваются к ядру. Поэтому атомы Натрия отдают электроны легче, чем атомы Лития.
С увеличением радиуса атомов внешние электроны легче терять, поэтому металлические свойства в группах усиливаются. Вместе с тем неметаллические свойства элементов в группах с увеличением радиуса атомов ослабевают. Металлические свойства элементов одной подгруппы сильнее всего выражены у элементов с наибольшим радиусом (наибольшим порядковым номером), а неметаллические — у элементов с наименьшим радиусом (наименьшим порядковым номером) (рис. 15.5).
С увеличением порядкового номера:
• в периодах металлические свойства ослабевают, а неметаллические — усиливаются
• в главных подгруппах металлические свойства усиливаются, а неметаллические — ослабевают
Среди всех химических элементов наиболее активным металлическим элементом является Франций (поскольку Франций в природе не встречается, а получен искусственно, то среди существующих элементов наиболее активным является металлический элемент — Цезий).
А наиболее активный неметаллический элемент — Флуор.
Как вы смогли заметить, свойства элементов и их соединений обусловлены строением электронных оболочек их атомов. А значит, и периодичность изменения этих свойств связана с периодичностью повторений электронной конфигурации атомов.
1. Радиус атомов определяется размером электронной оболочки. В периодах радиус атомов уменьшается, а в группах — увеличивается.
2. Свойства элементов и их соединений обусловлены строением электронных оболочек атомов. Металлические свойства проявляют главным образом элементы, у атомов которых на внешних уровнях находится не больше четырех электронов. Атомы неметаллических элементов содержат на внешнем уровне четыре и больше электронов.
3. В периодах металлические свойства элементов с увеличением порядкового номера ослабевают, а в группах — усиливаются. Неметаллические свойства, наоборот, в периодах усиливаются, а в группах — ослабевают.
1. Чем обусловлены металлические и неметаллические свойства элементов?
2. Как определить число валентных электронов в электронных оболочках атомов химических элементов главных подгрупп?
3. Почему атомы принимают (отдают) электроны в химических реакциях?
4. Почему инертные элементы не вступают в химические реакции?
5. Какие частицы называют ионами?
6. Как изменяется сила притяжения валентных электронов к ядру в периоде и в подгруппе?
7. Как изменяются металлические и неметаллические свойства элементов в группах и периодах Периодической системы с увеличением порядкового номера? Чем объясняются такие изменения?
8. Что определяет радиус атомов? Как он изменяется в периодах и группах?
Задания для усвоения материала
1. Выпишите из данного перечня отдельно символы: а) атомов; б) катионов; в) анионов; г) молекул.
4. Атом какого элемента содержит столько же электронов, сколько их в ионе Na+?
6. Сколько электронов не хватает до завершения внешнего энергетического уровня атомам: а) Оксигена; б) Хлора; в) Фосфора?
7. У иона некоторого элемента E+ 2 такое же электронное строение, как и у атома Аргона. Определите этот элемент.
8. По Периодической системе определите число электронов, которое максимально может отдавать и присоединять атом Фосфора.
9. Почему существенно отличаются свойства элементов главных подгрупп I и VII групп? Поясните ответ с точки зрения строения их электронных оболочек.
10. В чем заключается отличие электронной оболочки иона Натрия от электронных оболочек: а) атома Натрия; б) атома Неона; в) иона K+?
11. Почему элементы Флуор и Хлор обладают сходными свойствами?
Атомам этих элементов легче отдать электроны чем принять
В с п о м н и т е, что такое атом, из чего состоит атом, изменяется ли атом в химических реакциях.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного атома, а также свойства простых и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение электронов вокруг ядра, несложно определить по положению элемента в периодической системе.
В периодической системе Д.И.Менделеева химические элементы располагаются в определенной последовательности. Эта последовательность тесно связана со строением атомов этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать номер периода, номер группы, вид подгруппы.
Зная точный «адрес» химического элемента – группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период – это горизонтальный ряд химических элементов. В современной периодической системе семь периодов. Первые три периода – малые, т.к. они содержат 2 или 8 элементов:
2-й период – Li … Nе – 8 элементов;
Остальные периоды – большие. Каждый из них содержит 2–3 ряда элементов:
Группа – вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы. Например:
Главную подгруппу образуют химические элементы малых периодов (например, N, P) и больших периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко. Главная подгруппа «высокая», она начинается с 1-го или 2-го периода. Побочная подгруппа – «низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической системы имеет свой адрес: период, группу, подгруппу, порядковый номер.
Например, ванадий V – это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о положении элемента в периодической системе со строением его атома?
Атом состоит из ядра (оно имеет положительный заряд) и электронов (они имеют отрицательный заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре сосредоточена почти вся масса атома. Поскольку химический элемент – совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают следующие его координаты:
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1. Нейтрон n заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Заряд ядра определяют протоны. Причем число протонов равно (по величине) заряду ядра атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности между величинами: «масса ядра» А и «порядковый номер» Z. Так, для атома алюминия:
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Как известно, ядро атома в химических процессах не изменяется. А что изменяется? Переменным оказывается общее число электронов в атоме и распределение электронов. Общее число электронов в нейтральном атоме определить несложно – оно равно порядковому номеру, т.е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются друг от друга и находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, находятся на приблизительно равном расстоянии от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (например, для Al):
Задание 3.4. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати электронов.
Эти числа показывают, что, например, на втором энергетическом уровне может находиться 2, 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера энергетического уровня на внешнем уровне (последнем) не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершенным. Такие энергетические уровни имеются у самых неактивных элементов – благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило: число внешних электронов равно:
• для элементов главных подгрупп – номеру группы;
• для элементов побочных подгрупп оно не может быть больше двух.














 p
p