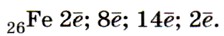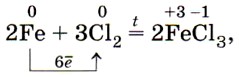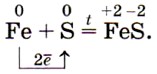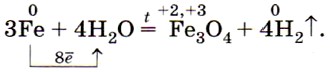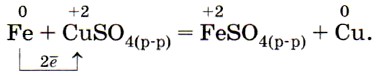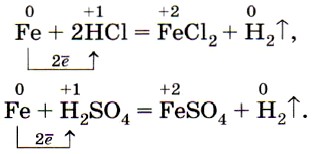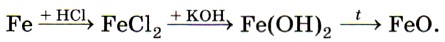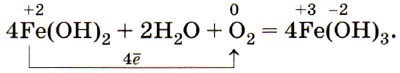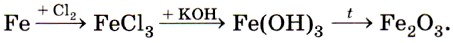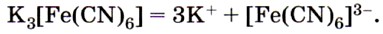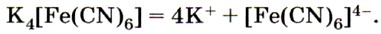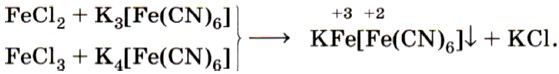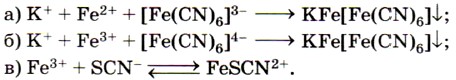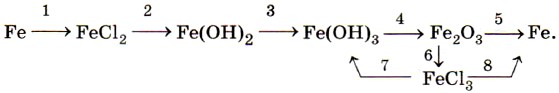Атомы азота и железа отличаются чем
Виды простых и сложных веществ
Простые и сложные вещества в химии
В неорганической химии вещества по составу делятся на простые и сложные.
Сложные вещества — соединения:
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
Li+1 и O-2→ Li2O; Al+3 и O-2→ Al2O3; N+5 и O-2→ N2O5.
Название оксида: слово «оксид» в именительном падеже + название элемента Э в родительном падеже: оксид лития Li2O, оксид алюминия Al2O3.
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид SO3, азотный ангидрид N2O5 и др.
K+1 и OH- → KOH, Mg+2 и OH- → Mg(OH)2.
Название: слово «гидроксид» в именительном падеже + название элемента в родительном падеже: гидроксид калия, гидроксид магния.
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Fe(OH)2 — гидроксид железа (II), Cr(OH)3 — гидроксид хрома (III).
Названия бескислородных кислот: корень русского названия элемента, образующего кислоту + суффикс «о» + «-водородная кислота», например: HBr — бромоводородная кислота, HCl — хлороводородная кислота, H2S — сероводородная кислота.
Названия кислородсодержащих кислот: русское название образующего элемента + «кислота», с учетом правил:
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| HAlO2 метаалюминиевая | метаалюминат |
| H3AlO3 ортоалюминиевая | ортоалюминат |
| HAsO3 метамышьяковая | метаарсенат |
| H3AsO4 ортомышьяковая | ортоарсенат |
| H3BO3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| HBrO3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H2CO3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| HClO2 хлористая | хлорит |
| HClO3 хлорноватая | хлорат |
| HClO4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| HMnO4 марганцовая | перманганат |
| HNO2 азотистая | нитрит |
| HNO3 азотная | нитрат |
| HPO3 метафосфорная | метафосфат |
| H3PO4 ортофосфорная | ортофосфат |
| H2S сероводородная | сульфид |
| H2SO3 сернистая | сульфит |
| H2SO4 серная | сульфат |
| H2SiO3 метакремниевая | метасиликат |
| H3SiO4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Для некоторых есть тривиальные названия: NH3 — аммиак, SiН4 — силан, PH3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
Химические свойства благородных газов
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
ZnO + H2SO4 → ZnSO4 + H2О,
ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
Все основания реагируют с кислотами (реакция нейтрализации):
1. Щелочи взаимодействуют с:
2. Нерастворимые основания разлагаются при нагревании: Cu(OH)2 → CuO + H2O.
Также о химических свойствах неорганических соединений можно почитать в статье «Классы неорганических соединений».
Простые и сложные вещества
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения. В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз. В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи. Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ. Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток. Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
Сложные вещества необходимо отличать от смесей, которые тоже состоят из разных элементов. Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет. Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ.
И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности. Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS, не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Выводы из статьи по теме Простые и сложные вещества
§ 17. Железо
Строение и свойства атомов. Железо Fe — элемент побочной подгруппы VIII группы (УIIIБ группы) 4-го периода Периодической системы Д. И. Менделеева.
Строение электронной оболочки атомов железа несколько отличается от строения электронных оболочек атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково:
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но часто и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
Железо — простое вещество. Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куётся, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твёрдость методами термического и механического воздействия, например с помощью закалки и прокатки.
Различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, оно содержит 0,02—0,04% углерода, а кислорода, серы, азота и фосфора — ещё меньше.
Химически чистое железо содержит менее 0,01% примесей.
Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии. Очевидно, знаменитая Делийская колонна сделана из чистого железа (рис. 68).
Первые образцы железа, попавшего в руки человека, по-видимому, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа.
Алхимики обозначали железо в виде копья и щита — характерных атрибутов бога войны Марса.
В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа.
Переходя к описанию химических свойств железа, повторим, что оно может проявлять степени окисления +2 и +3, соответственно железо даёт два ряда соединений. Число электронов, которое атом железа отдаёт при химических взаимодействиях, зависит от окислительной способности реагирующих с ним веществ. Например, с галогенами (кроме иода) железо образует галогениды, в которых оно имеет степень окисления +3:
а с серой — сульфид железа (II):
При высокой температуре (700—900 °С) железо взаимодействует с парами воды:
В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей, например:
В разбавленных соляной и серной кислотах железо растворяется, окисляясь ионами водорода, при этом образуются соли железа (II) и водород:
Растворяется железо и в разбавленной азотной кислоте, при этом образуются нитрат железа (III), вода и продукт восстановления азотной кислоты — азот N2, оксид азота (II) NO или аммиак NH3 (нитрат аммония NH4NO3) в зависимости от концентрации кислоты.
Концентрированные серная и азотная кислоты пассивируют железо, образуя на поверхности металла плотную, прочную оксидную плёнку.
Соединения железа. По распространённости в земной коре железо занимает четвёртое место среди всех элементов (после кислорода, кремния и алюминия).
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 • ЗН2O. Все они используются в чёрной металлургии для производства чугуна и стали.
Ещё одно природное соединение железа — железный, или серный, колчедан (пирит) FeS2 — не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Как уже было сказано выше, для железа характерны два ряда соединений: соединения железа (II) и железа (III).
Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 получают косвенно, в частности по следующей цепочке превращений:
Оксид и гидроксид железа (II) имеют ярко выраженные основные свойства.
Оксид железа (III) Fe2O3 и соответствующий ему гидроксид железа (III) Fe(OH)3 также получают косвенно, например по цепочке:
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа (II) FeSO4 • 7Н2O, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины и в других целях.
Хлорид железа (III) FeCl3 используют при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа (III) Fe2(SO4)3 • 9Н2O применяют при очистке воды, в качестве растворителя в гидрометаллургии и в других целях.
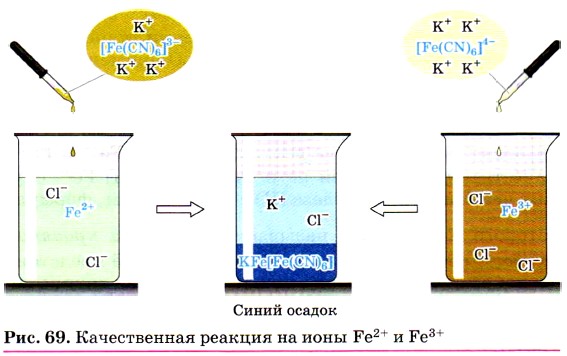
Реактивом на ионы железа (III) Fe 3+ является другое комплексное соединение — жёлтая кровяная соль — 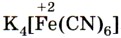
Для обнаружения ионов Fe 3+ также используют взаимодействие солей железа (III) с роданидом калия KSCN или роданидом аммония NH4SCN.
Роль химического элемента железа в жизнедеятельности живых организмов очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и тканям.
Соединения железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Для человека и животных источником железа служит пища. В зелёных овощах, таких как шпинат, салат, капуста, много железа. Розовая черешня содержит наполовину меньше железа, чем чёрная. Светло-зелёный капустный лист в шесть раз беднее железом, чем зелёный. В говядине железа больше, чем в телятине.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
2. Напишите по два молекулярных уравнения, соответствующих следующим сокращённым ионным уравнениям:
4. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
Рассмотрите два превращения (по выбору) с позиций окисления-восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах.
5. Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно N2, NO, NH4NO3. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях.
6. Вычислите объём оксида углерода (II) (н. у.), который потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы. Вычислите количество вещества железа, которое при этом получится, если выход его составляет 80% от теоретически возможного.