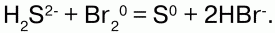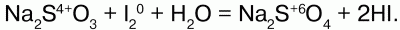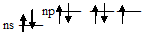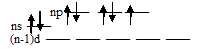Атомы брома и йода чем похожи
Бром. Йод
Бром

Бром добывают из морской воды, где он содержится в виде бромидов – солей бромоводородной кислоты HBr. Для этого морскую воду обрабатывают хлором, а выделившийся бром отгоняют, продувая воздух.
Соединения брома применяются в фотографии (бромид серебра AgBr является светочувствительным веществом: на свету он разлагается на серебро и бром), при производстве лекарств, в медицине. Многие производные брома (бромид калия, бромкамфора) обладают успокоительным действием.
Йод
Йод (tпл = 114 о С, tкип = 185 о С) – твёрдое вещество в виде серых кристаллов с металлическим блеском, хорошо растворимых в органических растворителях. При небольшом нагревании кристаллический йод возгоняется, образуя пары фиолетового цвета. Когда пары охлаждаются, на стенках сосуда вновь конденсируется йод в виде кристаллов.
Молекулы йода обладают уникальной способностью проникать в организм даже через неповрежденную кожу. Поэтому настойку йода применяют и для лечения внутрикожных воспалений.
Для извлечения йода буровые воды или золу морских водорослей обрабатывают хлором, а выделившийся йод адсорбируют углем или отгоняют с водяным паром.

В организме человека содержится от 12 до 20 мг йода, причем большая его часть сконцентрирована в щитовидной железе в составе белка тиреоглобулина, ответственного за синтез некоторых гормонов. При недостатке йода у детей и взрослых развиваются тяжелые заболевания, например базедова болезнь. Во избежание этого в местностях с пониженным содержанием йода в почве и воздухе в продажу поступает йодированная поваренная соль, содержащая добавки йодида или йодата калия.
Скачать:
Скачать бесплатно реферат на тему: «Бром» БРОМ.docx (222 Загрузки)
Скачать бесплатно реферат на тему: «Йод» ИОД.docx (218 Загрузок)
Скачать рефераты по другим темам можно здесь
1. Обнаружение в растворах восстановителей
Газообразные и растворенные в воде SO2 и H2S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
2. Обнаружение кратных углерод-углеродных связей
3. Обнаружение фенола и анилина в органических растворах
Фенол и анилин легко взаимодействуют с бромной водой, причем продукты реакций не растворяются в органических растворителях, поэтому образуют осадки:
Йод-крахмальная реакция в качественном анализе
Обнаружить выделяющийся I2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I2. Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Реакции с участием I2 в качестве восстановителя
Атомы иода имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением энергии ионизации, благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
Бромоводород и йодоводород
НВr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Термическая неустойчивость НВr и HI
Молекулы НВr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
HCI получают действием конц. H2SO4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H2SO4 до свободных галогенов:
Получение НВг и HI:
1) из бромидов и йодидов
Необходимо вытеснять НВr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой
2) гидролиз галогенидов неметаллов
3) восстановление свободных галогенов в водных растворах
Бром и йод
Бром — красновато-бурая жидкость (плавится при температуре 7,25°С), в застывшем состоянии — красно-коричневые игольчатые кристаллы со слабым металлическим блеском. Пары брома обладают резким неприятным запахом (по-гречески «бромос» — зловонный). Бром открыт в 1826 г.
Из-за высокой химической активности в свободном виде бром не встречается. Он находится в виде бромидов в морской воде, в водах соляных озер и нефтяных буровых скважин, в верхних горизонтах залежей поваренной соли. Бром соединяется с водородом, металлами и неметаллами, растворяется в воде и органических растворителях. Важнейшие соединения брома: бромистый калий, бромистый натрий, бромистый аммоний, бромистое железо, бромистый этил, бромистый метилен, бромоформ. Известен единственный природный минерал брома (природный бромид) — бромаргерит (AgBr).
Йод представляет собой серовато-черные пластинчатые кристаллы с металлическим блеском, температурой плавления 113,6°С и кипения 184,4°С. При нагревании переходит в пар коричневого цвета. В воде плохо растворяется, хорошо растворяется в спирте, эфире и других органических растворителях. Важнейшие соединения йода: йодистый калий, йодистый натрий, йодистый аммоний, йодистый метил, йодистый этил, йодоформ.
В 1811 г., получая селитру, французский химик Б. Куртуа обратил внимание на то, что медный котел, в котором происходило выпаривание зольного раствора, быстро разъедается. Под действием концентрированной серной кислоты из раствора выделялись тяжелые фиолетовые пары. В 1813 г. Ж. Гей-Люссак детально исследовал фиолетовое вещество, установил его элементарную природу и назвал йодом (от греческого «иоэйдес» — фиолетовый).
Примерно 90 % мировой добычи брома идет на изготовление антидетонаторов для моторного топлива. Кроме того соединения брома используются в медицине, при изготовлении фототоваров, в сельском хозяйстве (для борьбы с вредителями); йод применяется в основном в медицине и фармакологии, в сельском хозяйстве (добавка к удобрениям), в реактивной технике и т. д. Йод, как и фосфор, является необходимым элементом всех живых организмов. Особенно много йода накапливается в морских водорослях, губках и кораллах. В качестве источника йода используются подземные воды, морские водоросли, отходы производства селитры.
Бром добывается из морской воды, рассолов соляных озер, щелока калийных производств, подземных вод нефтяных месторождений. В СССР производство йода начато в 1932 г. из буровых вод одновременно тремя заводами: Бакинским йодным (Апшеронский полуостров), Челекенским химическим (Туркменская ССР) и Лапоминским опытным йодным заводом (у г. Архангельска). Бром добывается из озерной рапы в Крыму.
Переоценка запасов брома и йода показала, что наиболее богатые по концентрации йода месторождения приурочены к артезианским бассейнам Северного Кавказа (Азово-Кубанский, Терско-Прикаспийский), и к восточной части Рионо-Куринского бассейна, в районах Днепровско-Донецкого и Предкарпатского бассейнов, Предуральского прогиба и Северо-Двинского бассейна. Йодные месторождения известны в Западной Туркмении (Каракумский и Восточно-прикаспийский артезианские бассейны), в Западной Сибири (Среднее Предуралье, Среднее Приобье), на Дальнем Востоке (артезианские воды о-ва Сахалин). Бромные воды особенно широко распространены в районах Волго-Камского, Ангаро-Леиского, Западно-Туркменского и Амударьинского артезианских бассейнов. В Крыму, северо-восточнее Джанкоя, открыто Северо-сивашское месторождение йодных вод. Сырьевой базой брома служат оз. Сасык-Сиваш у Евпатории и Сивашский залив (запасы брома в этих водоемах все время восполняются за счет вод Черного и Азовского морей). Источником брома и йода служат и нефтяные воды различных месторождений.
Мировое производство брома более 320 тыс. т; наиболее крупные производители (в тыс. т): США (почти 200), Великобритания (30), Израиль (21), Франция (16), Япония (12).
Источник: В.Д. Войлошников, Н.А. Войлошникова. Книга о полезных ископаемых. Издательство «Недра». Москва. 1991
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Атомы брома и йода чем похожи
21. Краткие сведения о фторе, броме и йоде
Фтор (F); бром (Br); йод (I) относятся к группе галогенов. Стоят в 7-й группе главной подгруппы периодической системы. Общая электронная формула: ns2np6.
Физические свойства: F2 – бесцветный, трудно сжижающийся газ; Br2 – жидкость красно-бурого цвета, легко испаряется, образуя красно-бурые пары; I2 – кристаллическое вещество фиолетового цвета со слабым металлическим блеском, при постепенном нагревании йод сублимируется, превращаясь в пар, минуя жидкое состояние. Бром и йод малорастворимы в воде, хорошо растворяются в органических растворителях – в бензине, бензоле, спирте. Химические свойства: галогены – ярко выраженные неметаллы. Фтор F2 – связь ковалентная неполярная обладает высокой химической активностью, за счет маленького радиуса атома, является сильнейшим окислителем. Фтор реагирует практически со всеми простыми и сложными веществами. Окисляет кислород, образуя фториды кислорода: ОF2 и О2F2. Вступает во взаимодействие даже с некоторыми инертными газами: 2F2 + Хе = ХеF4.
Не реагирует фтор только с гелием, неоном и аргоном. Водородное соединение фтора – НF (фтороводород) при растворении в воде образует плавиковую кислоту. Бром и йод тоже вступают в реакции со многими соединениями, особенно с металлами, которые сгорают в них и образуются соответствующие соли. Металлы при этом отдают электроны, а галогены их принимают, являясь окислителями. При растворении в воде дает бромную воду. Молекулы их также двухатомные, ковалентные неполярные, но они менее активны, чем фтор, что объясняется большим радиусом атома у брома и йода, чем у фтора. Все галогены – активные окислители, что проявляется при взаимодействии их с различными сложными веществами – смешивание сероводородной воды с раствором брома:
Галогены нашли широкое применение в химической промышленности: фтор используют в синтезе полимеров – фторопластов, пластмассы, стойкой к химическим воздействиям (тефлон), смазочных веществ, жидкостей для холодильников (фреоны). Бром используется в изготовлении лекарственных препаратов, некоторых красителей; йод широко используется в медицине – 10 %-ный раствор йода в спирте – как антисептическое, дезинфицирующее средство, йод входит в состав некоторых фармацевтических препаратов. Также бром и йод используются при различных синтезах и анализах веществ.
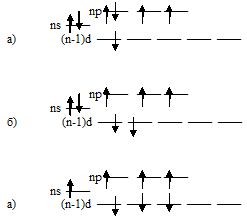
Сравнительная характеристика строения атомов галогенов
Валентные состояния атомов галогенов
Нормальное состояние атома фтора:
Нормальное состояние атома галогена (хлора, брома и йода):
Состояние атомов галогенов (хлора, брома и йода) при возбуждении:
За исключением некоторых оксидов (ClO2, Cl2O6) галогены кроме фтора (-1), проявляют нечётные степени окисления в своих соединениях.
Сравнительная характеристика атомов галогенов
Задача 809.
Дать сравнительную характеристику атомов галогенов, указав: а) характер изменения первых потенциалов ионизации; 6) характер энергии сродства к электрону.
Решение:
а) Первые потенциалы ионизации у атомов галогенов закономерно уменьшаются с увеличением порядкового номера элемента, что свидетельствует об усилении металлических свойств. Так у фтора потенциал ионизации I равен 17,42 эВ, у хлора – 12,97 эВ, у брома – 11,48 эВ, у йода – 10,45 эВ. Эта закономерность связана с возрастанием радиусов атомов, так как с увеличение порядкового номера элемента появляются новые электронные слои. Увеличение числа промежуточных электронных слоёв, расположенных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т. е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и удаление его эффективного заряда) приводят к ослаблению связи внешних электронов с ядром и, следовательно, к уменьшению потенциала ионизации.
б) Энергия сродства к электрону – это энергия, выделяющаяся при присоединении к свободному атому. У атомов галогенов с ростом порядкового номера элемента сродство к электрону закономерно уменьшается в ряду: F, Cl, Br, I. У атома хлора сродство к электрону больше, чем фтора, потому что у хлора появляется на внешнем энергетическом уровне d-подуровень. Уменьшение энергии сродства к электрону с ростом заряда ядра атома объясняется ростом радиуса атома элемента и, следовательно, уменьшением при этом эффективного заряда ядра.
Сравнительная характеристика свойств галогенов
Задача 810.
Дать сравнительную характеристику свойств образуемых галогенами простых веществ, указав характер изменения: а) стандартных энтальпий диссоциации молекул Г2; б) агрегатного состояния простых веществ при обычной температуре и давлении; в) окислительно-восстановительных свойств. Назвать причины, вызывающие эти изменения.
Решение:
а) В ряду Cl2 — Br2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Г2 на атомы. Причины этого можно объяснить тем, что с увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается всё дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов галогенов к области перекрывания электронных облаков уменьшается. Кроме того, в ряду: Cl — Br — I возрастает число промежуточных электронных слоёв, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания электронных облаков. Однако из этих данных выпадает фтор: прочность связи между атомами фтора в молекуле F2 меньше, чем у хлора. Это можно объяснить отсутствием d-подуровня во внешнем электронном слое атома фтора. В молекулах других галогенов есть свободные d-орбитали и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь между атомами.
б) В обычных условиях фтор и хлор, газообразные вещества, бром – жидкость, а йод – кристаллическое вещество. Температуры плавления и кипения галогенов закономерно увеличиваются в ряду F — Cl — Br — I. Объясняется это тем, что с увеличением радиуса атомов возрастает Поляризуемость молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обуславливает возрастание температур плавления и кипения простых веществ галогенов.
в) Окислительно-восстановительные свойства галогенов закономерно изменяются в ряду F2 — Cl2 — Br2 — I2. Окислительные свойства уменьшаются в ряду галогенов от фтора к йоду, самый слабый окислитель – йод. Восстановительные свойства в ряду галогенов увеличиваются, самый слабый восстановитель – фтор. Происходит так, потому что в группе с увеличением порядкового номера элемента последовательно возрастают радиусы атомов и анионов Г- и уменьшается сродство к электрону и электроотрицательность элементов. Поэтому способность отдавать электроны увеличивается, а принимать – уменьшается в ряду
F2 — Cl2 — Br2 — I2.
Энергия диссоциации молекул галогенов
Задача 811.
Энергия диссоциации молекул галогенов по схеме Г2 ↔ 2Г составляет для фтора, хлора, брома и йода соответственно 155, 243, 190, 149 кДж/моль. Объяснить наибольшую прочность молекул хлора.
Решение:
В ряду Cl2 — Br2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Г2 на атомы. Причины этого можно объяснить тем, что с увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается всё дальше от атомных ядер. Поэтому при переходе от хлора к брому и йоду притяжение ядер атомов галогенов к области перекрывания электронных облаков уменьшается. Кроме того, в ряду: Cl — Br — I возрастает число промежуточных электронных слоёв, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания электронных облаков. Однако из этих данных выпадает фтор: прочность связи между атомами фтора в молекуле F2 меньше, чем у хлора. Это можно объяснить отсутствием d-подуровня во внешнем электронном слое атома фтора. В молекулах других галогенов есть свободные d-орбитали и поэтому между атомами имеет место дополнительное донорно-акцепторное взаимодействие, упрочняющее связь между атомами. К тому же у хлора радиус атома ещё сравнительно мал, только чуть больше, чем у фтора, но значительно меньше, чем у брома и йода. Поэтому энергия связи в молекуле Cl2 значительно больше, чем у F2. Дополнительные донорно-акцепторные связи называют дативные.
Схема образования связей в молекулах F2 и Cl2: