Атрезия яичника что такое
Атрезия фолликулов
В основе изменений в яичниках женщины в процессе овариально-менструального цикла лежит рост и созревание фолликулов. Из одного из них (из доминантного фолликула) выходит зрелая яйцеклетка (происходит овуляция), а другие претерпевают атретические изменения. Однако, есть и состояние, при котором происходит атрезия доминантного фолликула.
Стаж работы более 22 года.
Что такое атрезия фолликула
Атрезия доминантного фолликула — это процесс, суть которого состоит в обратном развитии фолликула вместо того, чтобы совершился процесс овуляции (выход зрелого ооцита). При таком патологическом процессе невозможна беременность, так как яйцеклетка не вышла.

Стадии развития фолликул
Закладка фолликулов происходит еще на этапе внутриутробного развития девочки.
Внутри фолликула находится яйцеклетка, которая окружена защитным эпителием, окруженным соединительной тканью. Кроме хранения в себе женских половых клеток фолликулы также выполняют важную функцию – продукцию женских половых гормонов (эстрогенов, прогестерона).
Все стадии развития, которые проходит фолликул, называются фолликулогенезом.
Различают несколько стадий развития фолликулов:
Однако в силу влияния определенных провоцирующих факторов доминантный фолликул может не овулировать, а претерпевать атрезию.

Причины атрезии доминантного фолликула
Причины такого состояния, как атрезия фолликулов:
Симптомы
Лечение атрезии фолликулов
При наличии дисфункциональных маточных кровотечений цель терапии состоит в выполнении гесмостаза (остановке кровотечения) и нормализации гормонального фона.
При наличии нарушений овариально-менструального цикла не стоит медлить с обращением за медицинской помощью. Специалисты нашего центра готовы оказать весь необходимый объем как диагностических, так и лечебных мероприятий, способствуя сохранению вашего здоровья.
Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
Лечение пороков развития яичников
Заболевания женской половой системы многообразны, но отдельное место среди них занимают различные аномалии развития половых органов – яичников, матки, влагалища, маточных труб. Аномалии развития яичников – это нарушение роста, расположения и строения яичников, возникающее, как правило, еще во время внутриутробного развития. Чаще всего встречаются следующие виды пороков развития половых органов:
К счастью, пороки развития яичников встречаются в практике довольно редко, однако данные медицинской статистики подтверждают, что за последние несколько десятилетий частота таких патологий возросла до 2 %. Клиника Современной Медицины – один из лучших медицинских центров Москвы, специализирующийся на гинекологических заболеваниях, включая патологии развития яичников и других женских половых органов.
Передовая диагностическая база и уникальный опыт лечения патологий такого типа позволяют нам быстро выявить характер нарушения и провести эффективную терапию, подобранную с учетом формы заболевания, тяжести клинических проявлений, возраста пациентки и других факторов.
Причины аномалий развития яичников
В современной гинекологии выделяют три основные группы причин, провоцирующих пороки развития яичников:
Как правило, аномалии развития яичников обусловлены хромосомными нарушениями и зачастую сопровождаются патологическими изменениями всех репродуктивных органов, а нередко и других систем организма.
Аномальное развитие яичников возникает вследствие нарушения внутриутробного развития, на стадии закладки и дифференцирования тканей половых органов девочки. Главными причинами развития патологии являются:
Аномалии развития яичников сопряжены с врожденным дефектом развития половых желез или их полным отсутствием в генотипе (так называемая дисгенезия гонад в генотипе). Данные патологии проявляются в четырех вариантах: чистая, типичная (синдром Шерешевского-Тернера), смешанная и стертая. Размеры половых желез значительно отстают от возрастной нормы, а их морфологическая структура, генеративная и эндокринная функции неполноценны (яйцеклетки дегенерируют, фолликулы не достигают зрелости и т. д.).
Симптомы патологий развития яичников
Яичники (ovaria) – это парная половая железа, расположенная в малом тазу женщины. Именно в яичнике созревают яйцеклетки, принимающие участие в зачатии, и синтезируются женские половые гормоны, поступающие затем непосредственно в кровеносную систему.
В норме яичники взрослой здоровой женщины имеют овальную форму, толщину 1-1,5 см, длину 2,5-3,5 см, ширину 1,5-2,5 см и массу 5-8 г. При этом правый яичник имеет чуть большие размеры, чем левый. Первичные половые железы у зародыша закладываются уже на 3-й неделе внутриутробного развития и включительно до 6-7 недели не имеют никаких половых различий. Только с 7-8 недели беременности гонады начинают дифференцироваться в яичники (у зародышей с женским набором хромосом) и к 25 неделе формирование морфологических структур яичников заканчивается.
Симптомы аномалий развития яичников зависят от формы болезни. Как правило, для таких патологий характерно:
Для смешанной формы характерно увеличение клитора и присутствие рудиментарной матки.
Какие бывают пороки развития яичников
Аномалии развития яичников довольно разнообразны. Реже всего встречается полное отсутствие одного или обоих яичников. Более часто у женщин диагностируется наличие дополнительной половой железы, состоящей из островков яичниковой ткани, прилегающих или прикрепленных непосредственно к яичнику. Также нередко встречаются гипертрофированные яичники, значительно превышающие размерами норму. Такие изменения происходят из-за увеличения фолликулярного слоя и практически не оказывают влияния на нормальную функциональную деятельность половой железы.
Очень редкой патологией являются раздвоенные яичники разного или одинакового размера, расположенные один за другим. Возникает такая патология вследствие редупликации первичных гонад. Также к порокам развития яичников относится опущение яичника с образованием грыж, из-за которых орган смещается в тот или иной грыжевой мешок.
Аномалии развития яичников и пороки половых путей взаимно не обусловлены и могут не комбинироваться, поскольку половые протоки и половые железы формируются не синхронно и из разных эмбриональных зачатков. Аномальные яичники зачастую располагаются в несвойственных для них местах, к примеру, в паховом канале. Пороки развития яичников нуждаются в обязательном лечении и максимально пристальном внимании, поскольку в тканях таких половых желез довольно нередко образуются очаги бластоматозного роста, что угрожает не только здоровью, но и жизни женщины.
Диагностика
Диагностическое исследование пороков развития яичников включает:
Необходимы консультации генетика и онколога. После проведения дифференциальной диагностики ставится диагноз и определяется тип патологии. В Клинике Современной Медицины работают лучшие акушеры-гинекологи, эндокринологи, онкологи и генетики Москвы, имеющие уникальный опыт работы в диагностике и лечении пороков развития органов репродуктивной системы, что дает возможность быстро установить характер нарушения кариотипа, досконально исследовать яичники с минимумом дискомфорта.
Лечение аномалий развития яичников
Лечение пороков развития яичников может быть как консервативным, так и оперативным. Метод терапии врач подбирает индивидуально, на основании полученных при обследовании данных. Объем и способ лечения напрямую зависит от характера патологии, формы дисгенезии гонад, выраженности клинических проявлений и других факторов.
Полное излечение аномалий развития яичников невозможно. Симптоматическое лечение заключается в назначении заместительной гормонотерапии с целью предотвращения метаболических нарушений. Нередко патология требует оперативного лечения, которое заключается в удалении аномальной половой железы.
Клиника Современной Медицины обладает передовой лечебно-диагностической базой для определения типа дисгенезии гонад и оснащена прогрессивным оборудованием для выполнения сложных микрохирургических операций. Большой опыт работы в данной области позволяет нашим специалистам быстро определить характер патологии, провести тщательное, всестороннее обследование яичников с минимальным стрессом для пациентки и назначить грамотное и результативное лечение.
Наш медицинский центр оказывает самый широкий спектр услуг. Вы всегда можете обратится к нам по вопросам лечения гинекологических заболеваний. Мы готовы оказать вам услуги лечения сальпингита и лечения сальпингоофорита.
Атрезия яичника что такое
Адрес: г.Москва, улица Советской армии, 7 (м. Достоевская)
Женский организм обладает многими уникальными особенностями, к которым можно отнести и механизм функционирования половой системы.
Еще в материнской утробе в организме девочки закладывается определенное количество фолликулов, которое приблизительно составляет пятьсот тысяч. К достижению половой зрелости в яичниках остается всего около сорока тысяч фолликулов, но не каждому из них суждено созреть и выпустить яйцеклетку в момент овуляции. В процессе всей жизни женщины полностью созревают порядка пятисот фолликулов, остальные же подвергаются процессу атрезии (угасают в развитии).
Особенности процесса созревания фолликулов
Процесс созревания фолликула является очень сложным с биологической точки зрения. Повлиять на него может целое множество факторов. Начало этого процесса происходит в первой фазе вашего менструального цикла под воздействием особых гормонов. Одновременному созреванию подвергается порядка десяти фолликулов, но в дальнейшем выделяется лишь один, который называется доминантным. Именно из него в момент овуляции выйдет созревшая яйцеклетка.
Если ваш менструальный цикл является регулярным, вы сами можете отследить процесс созревания фолликула. Примерно на седьмой день цикла с помощью ультразвукового исследования можно визуализировать фолликулы, размер которых будет составлять несколько миллиметров. Если и дальше проводить регулярный мониторинг, можно четко отследить тенденцию роста фолликулов я выявить тот из них, что является доминантным.
Фолликул увеличивается на 2 мм в день и достигая 20 мм лопается и происходит высвобождение яйцеклетки (происходит овуляция ).
При достижении полного созревания фолликул имеет размер около двадцати одного миллиметра. Это говорит о том, что в скором времени должна произойти овуляция, при которой фолликул лопнет, а из него выйдет созревшая, готовая к оплодотворению яйцеклетка. При нормальном менструальном цикле овуляция приходится примерно на тринадцатый-пятнадцатый день.
Вы также можете попробовать отследить процесс созревания фолликула по характерным признакам овуляции:
Сколько фолликулов должно созревать
Почему фолликулы не созревают
Если у вас наблюдается одно или несколько из вышеперечисленных нарушений, следствием этого может стать полное отсутствие фолликулов в яичниках, нарушение их развития, при котором фолликул останавливается на одной из стадий своего развития или начинает регрессировать. Также фолликул может не достигнуть необходимых размеров или просто не разорваться, не давая яйцеклетке выйти наружу.
Стоит отметить, что отклонением от нормы считается не только не созревание фолликула, но и его преждевременное или запоздалое созревание. Во всех этих случаях мы рекомендуем вам пройти комплексное обследование у квалифицированных специалистов нашей клиники, чтобы выявить причины этой проблемы и найти оптимальные пути для ее решения.
Каждая женщина, планирующая самостоятельную беременность, может пройти ультразвуковой мониторинг роста фолликула, стимуляцию овуляции.
При стимуляции овуляции врач назначает вам гормональные препараты, которые способны вызвать рост нескольких фолликулов за один менструальный цикл.
Зная, как растет фолликул, врач рассчитывает вам даты овуляции.
Мультифолликулярные яичники и бесплодие
Мультифолликулярные яичники (МФЯ) – это состояние, которое характеризуется одновременным наличием в яичниках более 8-10 фолликулов (то есть мешочков, в которых зреет яйцеклетка).
В норме наблюдается развитие примерно 3-7 фолликулов, но полного созревания достигает всего 1-2. При мультифолликулярных яичниках количество созревающих фолликулов увеличено, что свидетельствует о неблагоприятных процессах в организме. Чаще всего МФЯ обнаруживаются во время УЗИ органов малого таза, в этом случае требуется полное обследование пациентки, направленное на выявление причин синдрома и сопутствующих заболеваний.
Прием врача акушера-гинеколога, первичный от 2 500 руб.
Прием врача акушера-гинеколога, повторный от 2 500 руб.
Вы в любое время можете обратиться за профессиональной помощью в нашу Международную клинику Гемостаза в Москве. У нас работают опытные врачи-гинекологи, кандидаты и доктора медицинских наук, которые помогут назначить грамотное лечение. Мы располагаем всем необходимым, чтобы выявить синдром мультифолликулярных яичников и другие патологические процессы репродуктивной системы.
Причины состояния
Спровоцировать развитие увеличенного количества фолликулов могут следующие факторы:
Эти состояния провоцируют недостаточное количество лютеинизирующего гормона (ЛГ), а ФСГ начинает усиленную стимуляцию созревания фолликулов. Стоит отметить, что мультифолликулярные яичники – это не отдельное заболевание, а лишь один из симптомов, который может свидетельствовать о целом ряде патологий.
Влияние на зачатие
Многих пациенток волнует, возможно ли забеременеть с МФЯ. Такой синдром напрямую не влияет на способность к зачатию, а значить, забеременеть женщина может. Однако чаще всего мультифолликулярные яичники сопровождаются гормональными изменениями в организме, что может стать причиной бесплодия.
Иногда при диагнозе МФЯ наблюдаются проблемы с вынашиванием ребенка: очень часто происходят выкидыши или замирание развития плода. Именно по этой причине при обнаружении множества фолликулов требуется постоянное наблюдение у врача-гинеколога, а также консультация у специалистов смежных направлений.
Симптомы мультифолликулярных яичников
В подавляющем большинстве случаев синдром обнаруживается случайно, выраженной симптоматики он не имеет. В отдельных случаях женщину может беспокоить следующее:
Наиболее действенными способами диагностики мультифолликулярных яичников являются следующие процедуры:
Лечение мультифолликулярных яичников
В большинстве случаев такой синдром не требует терапии, однако может потребоваться лечение сопутствующих патологий. Например, это требуется при бесплодии или нарушениях гормонального фона. Чаще всего достаточно витаминотерапии, коррекции уровня гормонов, что обеспечивается за счет приема определенных препаратов.
В том случае, если гормональная терапия не приносит выраженного результата и зачатие естественным путем невозможно, применяются вспомогательные репродуктивные технологии. Чаще всего используется ЭКО (экстракорпоральное оплодотворение), предполагающее искусственное оплодотворение яйцеклетки и последующее введение эмбриона в полость матки. Такая процедура – один из наиболее действенных способов лечения бесплодия.
В ряде случаев дополнительно проводится стимуляция яичников. Этот процесс заключается в приеме специальных препаратов, которые ускоряют процесс развития и созревания яйцеклетки.
Для того чтобы вовремя выявить наличие мультифолликулярных яичников и исключить риски бесплодия, советуем регулярно проходить профилактический осмотр у врача-гинеколога. Вы всегда можете обратиться в Международную клинику Гемостаза в Москве – цена консультации и осмотра у опытного специалиста у нас составляет от 2000 руб.
Будем ждать вас по адресу: м. Арбатская / Кропоткинская, Б. Афанасьевский пер., д. 22. Записывайтесь при помощи онлайн-формы на сайте или по телефону: +7 (495) 106-91-83!
Фолликулогенез и современная овариальная стимуляция (обзор литературы).
| Несмотря на то, что со времени публикации последнего нашего обзора прошло только пять лет, в научной литературе, посвященной фолликулогенезу и овариальной стимуляции, накопилось достаточно материала для того, чтобы поделиться им с заинтересованным читателем [35]. |
Миграция первичных половых клеток из эндодермы желточного мешка в гонады начинается с 7—8-й нед беременности, и к 16 нед в яичниках девочки определяются ооциты. К 5-му месяцу беременности число половых клеток достигает максимума (около 7 млн), после чего происходит массивная атрезия фолликулов, и ко времени родов их остается около 1 млн. К менархе в яичниках остается от 270 до 500 000 фолликулов [36]. В яичнике женщины определяются фолликулы на различных стадиях развития [1]:
Примордиальный (I стадия) [6] — ооцит частично или полностью окружен уплощенными клетками гранулезы, размер фолликула около 30—40 мкм.
Первичный (II стадия) [6] — ооцит окружен одиночным слоем кубических клеток гранулезы.
Ранний вторичный — неполный второй слой кубических клеток гранулезы.
Вторичный (III стадия) [6] — два полных слоя клеток гранулезы, размер фолликула около 50 мкм.
Преантральный (1-й класс) [6] — ооцит увеличен в объеме и окружен более чем двумя слоями гранулезы без образования полости, размер фолликула около 100 мкм.
Антральный (2—8-й класс) [6] — ооцит увеличен в объеме и окружен несколькими слоями клеток гранулезы с образованием полости. Размер фолликула более 0,2 мм в диаметре.
Рост фолликулов от примордиальной стадии до овуляции доминантного фолликула остается наиболее важной частью исследований в репродукции человека. За жизнь у женщины в норме овулируют около 400 фолликулов, остальные подвергаются атрезии на различных стадиях. Фолликулогенез можно разделить на следующие стадии: 1) формирование пула растущих фолликулов; 2) базальный рост (рост до стадии антрального фолликула 4-го класса); 3) селекция и созревание доминантного фолликула. Зависимость первых двух этапов от гипофизарных гонадотропинов, преимущественно от ФСГ, является непрямой и скорее опосредована внутрияичниковыми факторами, и лишь последний этап напрямую регулируется гипофизом.
Точное время роста фолликулов от примордиаль ной стадии до овуляции трудно установить, что в первую очередь связано со сложностью определения начала роста и дифференцировки фолликулов, а также достаточной продолжительностью начальных этапов роста фолликула. По различным данным, гормональ но-независимый этап роста фолликулов длится от 180 до 300 сут и гормонально-зависимый до 50 сут [5].
1. Формирование пула растущих фолликулов (продолжается более 120 сут)
Особый интерес вызывает механизм выхода фолликулов из состояния покоя (рис. 1). Факторы, определяющие начало роста и дифференцировки примордиальных фолликулов, до сих пор не определены, однако ряд авторов высказывают предположение о том, что это некий внутрияичниковый гормонально-неза висимый фактор, связанный с образованием межклеточных контактов и поддерживающий фолликулы в состоянии покоя. Культивирование отделенных друг от друга фолликулов в среде ведет к их росту и дифференцировке. Эти данные позволяют предположить, что потеря межклеточных контактов может быть пусковым фактором начала дифференцировки. Данная теория получила название теории латеральной спецификации (lateral specification) [2]. Согласно данной гипотезе, в рост идут те фолликулы, которые потеряли боковой контакт с соседними фолликулами, и обычно рост фолликулов происходит по краю яичника, а также в районе недавно образовавшегося желтого тела. Эта гипотеза объясняет наблюдения, что при делеции фолликулов при старении увеличивается относительное число растущих фолликулов. Как один из кандидатов на роль этого фактора, отвечающего за потерю межклеточных контактов и начала дифференцировки, был предложен продукт экспрессии гена Notch, один из вариантов которого был выделен из яичника мыши [2]. О гормонально-независимом характере начала роста фолликулов также говорит тот факт, что он происходит в аваскулярной зоне.
Процесс выхода примордиальных фолликулов из состояния покоя происходит постоянно и зависит от возраста женщины. Так, в возрасте 24—25 лет ежедневно уходят в рост около 50 примордиальных фолликулов, в 34—35 лет — около 17 фолликулов, в 44—45 лет — только около 3 фолликулов [6]. При исчезновении последних фолликулов в яичнике женщины наступает менопауза.
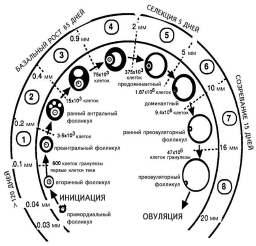 |
| Рис. 1. Стадии развития фолликулов. |
Также указаны размеры фолликулов и количество клеток гранулезы. Рисунок воспроизведен из работы A. Gougeon [16].
Большинство фолликулов подвергается атрезии на стадии малых антральных фолликулов [7]. Следует отметить, что в 37—38 лет к данному механизму атрезии прибавляется выраженная атрезия собственно примордиальных фолликулов, что значительно убыстряет процесс исчезновения фолликулов из яичника [6].
Также в ооците продуцируются морфогенетический протеин кости 15 и 6, фактор роста фибробластов 8, ТФР-b2. Роль этих факторов в фолликулогенезе еще недостаточно определена и ждет дальнейших исследований [4, 5].
2. Базальный рост (рост до стадии антрального фолликула 4-го класса)
Эта стадия, несмотря на то что продолжается около двух менструальных циклов (около 65 дней), является также малоизученной, и лишь немного известно о факторах, определяющих рост фолликулов на данной стадии. По данным гистологического исследования, в начале этой фазы преантральные фолликулы, размером 0,1—0,2 мм и содержащие около 3,5 тыс. клеток гранулезы, начинают активно расти. Происходит процесс дифференцировки гранулезы на клетки предшественники пристеночного слоя и кумулюса, постепенно образуются лакуны, которые затем объединяются и образуют антральную полость (см. рис. 1, рис. 2).
Большой интерес в современной литературе уделяется антимюллеровому гормону (antimulleran hormone, mullerian-inhibiting substance), который играет важнейшую роль в эмбриогенезе мужской особи млекопитающих и продуцируется клетками Сертоли, что вызывает регрессию органов мюллерова протока (маточных труб, матки и верхней части влагалища). Однако роль данного гормона не ограничивается эмбриогенезом. Выяснилось, что антимюллеровый гормон играет роль в фолликулогенезе и определяется в яичниках девочки с 32-й недели беременности и во взрослом состоянии продуцируется клетками гранулезы фолликулов [9]. Показано, что концентрация этого гормона с молекулярной массой около 72 кДа мало зависит от фазы цикла и, возможно, отражает число фолликулов, находящихся в базальной фазе роста. Это делает данный гормон уникальным маркером старения яичников и овариального резерва, а также позволяет говорить о его ценности в диагностике синдрома поликистозных яичников [10—12].
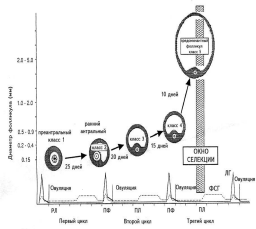 |
| Рис. 2. Динамика развития фолликулов в стадии базального роста. |
ПФ — поздняя фолликулярная фаза цикла, РЛ — ранняя лютеиновая фаза, ПЛ — поздняя лютеиновая фаза цикла. Рисунок воспроизведен из работы A. Gougeon [16].
3. Селекция и созревание доминантного фолликула
Данный этап фолликулогенеза можно разделить на следующие этапы: формирование пула малых антральных фолликулов и их рост, селекция доминантного фолликула и собственно овуляция.
Гормонально-зависимая стадия фолликулярного роста начинается в конце лютеиновой фазы цикла, когда снижение уровня эстрадиола, прогестерона и ингибинов А и В вызывает повышение уровня ФСГ. Под воздействием этого подъема фолликулы 5-го класса, размером около 2—5 мм в диаметре начинают интенсивно расти (см. рис. 1).
В последние годы сложное взаимодействие различных факторов роста и цитокинов на этапе созревания доминантного фолликула было изучено подробно.
Эпидермальный фактор роста (ЭФР) и ТФР-a играют важную роль в пролиферации клеток гранулезы антральных фолликулов, размером от 1 до 5 мм, и в то же время защищают фолликулы от воздействия на их гранулезу ФСГ. Этот механизм позволяет фолликулам достаточно долго находиться на данной стадии, например при беременности и при длительном воздействии агонистов люлиберина (при лечении эндометриоза и миомы матки), а также способствует формированию пула данных фолликулов. Снижение концентрации ЭФР и ТФР-a в фолликулах более 4—5 мм в диаметре позволяет ФСГ воздействовать на гранулезу этих фолликулов [17, 18]. В то же время концентрация ТФР-b с увеличением диаметра фолликула от 2 до 20 мм возрастает, что позволяет говорить об антагонизме между воздействием на гранулезу фолликулов ЭФР и ТФР-a, с одной стороны, и ТФР-b, с другой [16].
Крайне важной представляется роль ИПФР I и II в фолликулогенезе, селекции доминантного фолликула и атрезии фолликулов. В исследованиях последних лет выяснилось, что высокие концентрации ИПФР I и II способствуют воздействию ФСГ на клетки гранулезы. В атретических фолликулах наблюдается повышенная концентрация протеинов, связывающих инсулиноподобные факторы роста (ИПФРСП), и в первую очередь ИПФРСП-4. Однако действие этого фактора в яичниках может быть заблокировано специфиче ской протеазой, которая недавно выделена из клеток гранулезы фолликулов и желтого тела человека. Специфической протеазой к ИПФРСП-4 оказался протеин, ранее известный как ассоциированный с беременностью сывороточный белок А (pregnancy-associated plasma protein-A — PAPP-A) [5]. Тонкое взаимодействие ИПФР I и II, а также белков, связывающих эти факторы, и их протеаз является важным направлением в изучении фолликулогенеза, а также таких состояний, как синдром поликистозных яичников, инсулинорезистентность и овариальная стимуляция.
Большое значение в последние годы уделяется васкулярному эндотелиальному фактору роста. Выяснилось, что рост сосудов и васкуляризация играют важнейшую роль в росте доминантного фолликула. Исследования с помощью цветной допплерультрасо нографии показали, что только фолликулы с хорошей васкуляризацией способны продуцировать жизнеспособные ооциты в программах ЭКО [19, 20].
Роль цитокинов в фолликулогенезе до конца не изучена, однако известно, что интерлейкин-1 b является антиапоптотическим фактором, вызывая продукцию в гранулезе преовуляторных фолликулов оксида азота [21].
В последние годы роль ингибинов и активинов в регуляции менструального цикла изучена основатель но. Ингибины представляют собой димерные белки, состоящие из цепи альфа и бета. Предшественник цепи альфа (про-a-С), ранее считавшийся собственно ингибином и выявляемый в крови в высоких концентра циях, не обладает высокой активностью и в настоящее время не определяется. Цепь бета имеет два варианта: А и В. Каждый из этих вариантов может быть ковалентно соединен с цепочкой альфа и соответст венно образовать ингибины альфа-бета А (ингибин А) и альфа-бета В (ингибин В). Молекулярная масса обоих ингибинов составляет примерно 31—32 кДа. Две цепочки бета могут образовывать димеры, которые называются активинами, и соответственно существуют активины А, В и АВ. Основная роль ингибинов состоит в подавлении выделения ФСГ в передней доле гипофиза, в то время как активины способствуют выбросу ФСГ. Синтез ингибинов и активинов обнаружен в головном мозге человека, плаценте, костном мозге, гипофизе, яичках и яичниках, однако у взрослой женщины главным источником этих гормонов являются клетки гранулезы фолликулов. Долгое время оставалось загадочным то, как регулируется уровень ФСГ в начале менструального цикла женщины. Предположения о том, что это может происходить под воздействием эстрадиола, не оправдались, так как уровень синтеза этого гормона в фолликуле значителен только после достижения фолликулом диаметра 10 мм и более. В последние годы благодаря работам группы N. Groome из Оксфордского университета выяснилось, что клетки гранулезы предоминантных фолликулов (до 10 мм в диаметре) продуцируют ингибин В, и именно он регулирует продукцию ФСГ в начале и середине менструального цикла. В то же время доминантный фолликул и желтое тело продуцируют ингибин А и эстрадиол, которые в свою очередь ингибируют выделение ФСГ гипофизом (рис. 3).
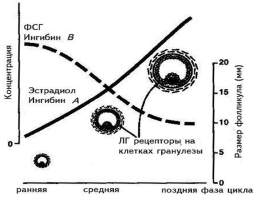 |
| Рис. 3. Изменения в концентрации основных гормонов в фолликулярной фазе цикла и механизм селекции доминантного фолликула. |
Рисунок воспроизведен из работы D. Baird [39].
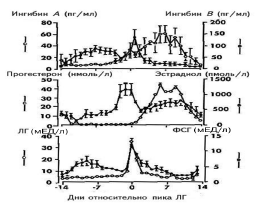 |
| Рис. 4. Концентрации ингибинов А и В, эстрадиола, прогестерона, ФСГ и ЛГ в зависимости от фаз менструального цикла. |
Данные представлены в зависимости от овуляторного пика ЛГ. Рисунок воспроизведен из работы N. Groome и соавт. [22].
Знания о взаимодействии традиционных гормонов (ФСГ, ЛГ, эстрадиол и прогестерон) и новых (ингибины А и В) значительно обогащают наши представления о регуляции менструального цикла женщины и должны использоваться в учебном процессе как врачей гинекологов, так и специалистов общей практики (рис. 4) [22].
Двухклеточная теория стероидогенеза в яичниках остается наиболее важной теоретической базой, на которой строится современная регуляция менструаль ного цикла и индукция суперовуляции. Согласно современной интерпретации этой теории, в растущих фолликулах начала менструального цикла синтез андрогенов (тестостерона и других) из холестерола происходит в клетках теки фолликулов под воздействием стимулирующего действия ЛГ. В то же время в клетках гранулезы фолликулов из тестостерона происходит синтез эстрадиола с помощью фермента ароматазы. Главным стимулятором ароматазы является ФСГ, который действует через свой аденилатциклазный рецептор. Уровень синтеза эстрадиола в фолликулах до 10 мм в диаметре остается невысоким. При достижении доминантным фолликулом более 10 мм в диаметре на клетках гранулезы яичников появляются рецепторы не только к ФСГ, но и к ЛГ. Под воздействием стимуляции ФСГ и ЛГ синтез эстрадиола значитель но увеличивается.
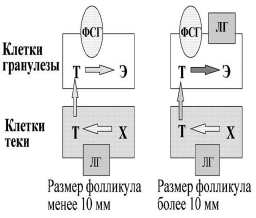 |
| Рис. 5. Двухклеточная теория синтеза эстрадиола в зависимости от размера фолликулов. |
Т — тестостерон; Х — холестерол; Э — эстрадиол.
Высокая концентрация эстрадиола в крови вызывает по принципу отрицательной обратной связи снижение выделения ФСГ гипофизом (см. рис. 3, рис. 5). Под воздействием снижающегося уровня ФСГ все фолликулы, которые не успели достигнуть 10 мм в диаметре, подвергаются атрезии. В то же время уровень синтеза эстрадиола в доминирующем фолликуле растет экспоненциально и строго коррелирует с диаметром фолликула. При достижении фолликулом овуляторного диаметра (16—23 мм) высокий уровень эстрадиола вызывает по принципу положительной обратной связи пик ЛГ и овуляцию фолликула. Данный механизм лежит в основе селекции доминантного фолликула не только человека, но, вероятно, и других моноовулярных млекопитающих [23, 24].
В конце 70-х годов прошлого века исследователя ми было отмечено, что при овариальной стимуляции препаратами кломифенцитрата и чМГ растущие фолликулы продуцируют высокий уровень эстрадиола, который в естественном цикле мог бы вызвать по принципу положительной обратной связи выброс ЛГ и преждевременную лютеинизацию фолликулов. Однако этот выброс часто не происходит до достижения фолликулами преовуляторных размеров 15—20 мм. Предположено, что фолликулы продуцируют некую субстанцию, ингибирующую выброс ЛГ. Установле но, что данное биологически активное вещество по своим свойствам и структуре отличается от ингибинов и выделяется клетками гранулезы в ответ на стимуляцию ФСГ. Лишь в середине 90-х годов XX века эта субстанция была охарактеризована и получила название фактор отмены пика гонадотропинов — ФОПК (Gonadotropin Surge — Attenuating/Inhibiting Factor, LH-RH Attenuating Factor) [13]. Найдено, что активность этого вещества в фолликулярной жидкости зависит от размеров фолликула и максимальна в фолликулах от 5 до 15 мм в диаметре, после чего резко снижается [14]. Также установлено, что присутствие ФОПК может отражать качество фолликулов, и у женщин со сниженным овариальным резервом фолликулы продуцируют низкую активность данного фактора, что может объяснять частую раннюю лютеиниза цию фолликулов у таких пациенток [15].
Появление в начале 60-х годов минувшего столетия первых препаратов, содержащих ФСГ [человеческий менопаузальный гонадотропин (чМГ) и человеческий гипофизарный гонадотропин (чГГ)], позволило проводить лечение пациенток с хронической ановуляцией. Основываясь на этих работах, J. Brown (1978) и D. Baird (1987) предложили теорию роста и селекции доминантного фолликула, получившую название теории окна [31, 38] (рис. 6). Согласно этой теории, для роста антральных фолликулов 3—5 мм в начале фолликулярной фазы цикла уровень ФСГ должен преодолеть определенное значение, так называемый порог. Уровень данного порога строго индивидуален и скорее всего зависит от овариального резерва (уровня базального ФСГ). В нормальном менструальном цикле механизм, описанный выше, снижает уровень ФСГ в середине фолликулярной фазы цикла и в овуляцию уходит только один фолликул. Однако при индукции суперовуляции длительное воздействие экзогенного ФСГ позволяет фолликулам до 10 мм в диаметре избежать атрезии и достигнуть овуляторного размера. Долгое время существовали дискуссии, что важнее для множественного роста фолликулов — однократное воздействие высокой дозы ФСГ (превышение порога) или хроническое воздействие более низкой дозы ФСГ (расширение окна). В недавней работе B. Fauser и соавт. сравнили действие однократной высокой дозы ФСГ (375 мЕД), назначенной в самом начале менструального цикла, и низких доз ФСГ (75 мЕД), назначаемых ежедневно со 2—3-го дня менструального цикла. Выяснилось, что однократное воздействие высокой дозы ФСГ не влияет на формирование одиночного доминантного фолликула и лишь вызывает более бурный рост предоминантных фолликулов. В то же время хроническое назначение низких доз ФСГ позволяет фолликулам преодолеть механизм формирования одного доминантного фолликула и вызывает образование нескольких преовуляторных фолликулов [25]. Это свидетельствует о том, что расширение окна более, чем преодоление порога, важно для индукции суперовуляции.
За последние 40 лет индукция овуляции и суперовуляции претерпела значительные изменения. Первым препаратом, успешно примененным для индукции овуляции человека, был чГГ [26]. Однако широкое применение данного препарата было ограничено сложностью технологии изготовления и возможностью передачи болезни Крейнфельда—Якоба. В 1961 г. появились сообщения об использовании чМГ (B. Lunenfeld) и кломифенцитрата (R. Greenblaat) [26]. Использование этих двух препаратов в комбинации с хорионическим гонадотропином (ХГ) стало классической схемой для индукции овуляции одного или нескольких фолликулов до конца 80-х годов XX века. Мощной стимуляцией использования данного класса препаратов стала возможность совместить индукцию суперовуляции и проведение экстракорпорального оплодотворения с последующим переносом эмбрионов в полость матки. В середине 80-х годов прошлого века появились технологии очистки мочевых препаратов и резкого снижения содержания ЛГ, таким образом, появились мочевые препараты ФСГ — метродин в 1985 г. и высокоочищенный мочевой ФСГ — метродин-ВЧ в 1993 г.
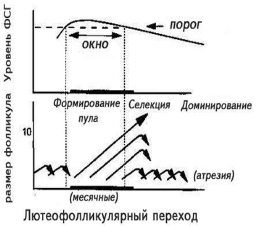 |
| Рис. 6. Теория окна/порога. |
Зависимость селекции доминантного фолликула в естествен ном цикле женщины от подъема уровня ФСГ. Рисунок воспроизведен из работы B. Fauser, A. van Heusden [40].
В конце 80-х годов XX в. было предложено и получило широкое применение в программах ЭКО использование препаратов агонистов люлиберина (а-ГнРГ). Данный класс аналогов люлиберина при начале назначения вызывает кратковременный подъем уровня гипофизарных гонадотропинов (так называемый «flare-up» эффект), но затем наступает стойкая десенсити зация гипофиза, что позволяет предотвратить преждевременный пик ЛГ. Из всех предложенных схем применения а-ЛГРГ стоит отметить так называемый длинный протокол, который включает в себя применение препаратов а-ГнРГ с середины лютеиновой фазы предшествующего стимуляции цикла до дня назначения овуляторной дозы ХГ.
Однако подлинной революцией в современной индукции суперовуляции стал синтез и применение рекомбинантных препаратов ФСГ (пурегон и фоллистим, «Органон» и гонал-Ф, «Сероно»). С первых контролируемых мультицентровых исследований выяснилось, что пурегон («Органон») является эффективным препаратом с точки зрения большего количества ооцитов, эмбрионов высокого качества и числа прогрессирующих беременностей, включая беременности после переноса размороженных эмбрионов [27]. В фолликулярной жидкости пациенток, у которых была получена беременность после применения пурегона («Органон») и ЭКО, обнаружена низкая концентрация тестостерона, что говорит о высоком качестве фолликулов и их низкой склонности к атрезии [34].
В конце 90-х годов прошлого века на рынке появились препараты антагонистов люлиберина (ант-ГнРГ), которые способны вызывать быстрое снижение выработки гипофизарных гонадотропинов и не имеют «flare-up» эффекта. Были предложены такие схемы применения ант-ЛГРГ, как ежедневные инъекции препаратов (по 0,25 мг подкожно) с 6-го дня стимуляции до дня назначения ХГ или введение однократно 3 мг препарата подкожно на 7—8-й день стимуляции. Несмотря на то, что рандомизированные исследования пока не показали преимуществ данной схемы стимуляции перед традиционным длинным протоколом, нельзя не отметить такие достоинства применения ант-ГнРГ, как более короткое время стимуляции, а также меньшее число ампул, необходимых для адекватного овариального ответа [28].
Другим важным вопросом современной индукции овуляции остается роль ЛГ. В соответствии с классической двухклеточной теорией стероидогенеза ЛГ необходим для адекватного синтеза андрогенов в клетках теки и в растущих фолликулах более 10 мм в диаметре, а также для синтеза эстрадиола в клетках гранулезы. У пациенток с выраженной гипофизарной недостаточностью назначение одного только ФСГ приводит к удовлетворительному фолликулярному росту, однако уровень эстрадиола в фолликулярной жидкости и в сыворотке крови сохраняется низким и эндометрий остается на уровне базального роста [37]. Однако при применении аналогов люлиберина в рекомендуемых стандартных дозах: агонистов люлиберина декапептила дейли («Ферринг») 0,05—0,1 мг ежедневно подкожно или препаратов антагонистов люлиберина — оргалютрана («Органон») или цетротайда («Аста-Медика»/«Сероно») в дозе 0,25 мг ежедневно подкожно уровень базального экзогенного ЛГ достаточен для адекватного синтеза эстрадиола [29, 30].
Дозировка препаратов для овуляторной дозы ХГ была разработана австралийскими учеными в конце 60-х годов прошлого века. Согласно их представлени ям, овуляция и окончательное созревание преовуляторных фолликулов после стимуляции препаратами ФСГ могут быть достигнуты дозой ХГ от 5000 до 80 000 мЕД [31]. Современные схемы используют от 5000 до 10 000 мЕД ХГ, однако к существенным недостаткам ХГ можно отнести высокую вероятность развития синдрома гиперстимуляции яичников, что связано с большой продолжительностью периода полужизни ХГ — 56 ч, тогда как время полужизни ЛГ только около 3—5 ч. Предложено применение рекомбинантного ЛГ в дозах от 15 000 до 30 000 мЕД. В недавнем рандомизированном контролируемом исследовании было показано, что данные дозы по эффективности могут быть сравнимы с дозой ХГ 5000 мЕД, однако частота гиперстимуляции меньше [32]. Другим новым методом достижения окончательной зрелости и индукции овуляции является назначение одиночной инъекции препарата а-ЛГРГ. Данное назначение вызывает выброс пика ЛГ гипофизом, по своим характеристикам сходным с естественным пиком. К преимуществам данного метода стоит отнести низкую вероятность синдрома гиперстимуляции, однако этот метод может быть применим лишь в циклах, в которых не используют препараты а-ЛГРГ, например, в схемах с ант-ЛГРГ или в схемах с применением только препаратов ФСГ и/или кломифенцитрата [33].
Ниже мы попытаемся ответить на сложные вопросы, касающееся фолликулогенеза и овариальной стимуляции, которые часто задают как коллеги, так и пациенты.
Может ли овариальная стимуляция, особенно многократная и с применением современных высокоактивных препаратов (рекомбинантного ФСГ, чМГ, а-ЛГРГ и ант-ЛГРГ) вызвать более раннюю менопаузу?
Могут ли операции на яичниках, такие, как односторонняя овариэктомия, резекция яичников, химиотерапия, облучение яичников, влиять на время наступления менопаузы?
Несомненно, могут. Стоит отметить, что если у женщины до 35 лет данные вмешательства влияют на время наступления менопаузы не столь значительно, то у женщин старшей возрастной группы данные вмешательства в большинстве случаев приводят к преждевременной менопаузе.
Может ли применение гормональных пероральных контрацептивов отсрочить менопаузу?
Скорее всего нет. Данные препараты влияют на процессы овуляции, тогда как собственно процесс роста фолликулов и их атрезии остается нетронутым.
Какие экологические факторы влияют на время наступления менопаузы?
Несмотря на то, что влияние окружающей среды на репродуктивную функцию человека является модной темой средств массовой информации, строгих научных исследований в данной области мало. В настоящее время доказано, что лишь курение снижает овариальный резерв, и длительное курение ускоряет наступление менопаузы на 2—3 года, причем если женщина все-таки отказывается от курения, показатели овариального резерва могут стабилизироваться.
Какие клинические симптомы связаны с началом процесса старения яичников женщины и как эти процессы влияют на эффективность вспомогательных репродуктивных технологий?
Возраст пациентки является одним из наиболее важных факторов, определяющих успех лечения бесплодия. Условия современной цивилизации и малая информированность пациенток и, зачастую, врачей о процессах старения репродуктивной системы женщины приводят к тому, что деторождение откладывается на долгий срок. Однако современные исследования показывают, что первые симптомы угасания репродуктивной функции появляются у женщины уже в 27—28 лет, когда статистически достоверно начинает повышаться базальный уровень ФСГ и снижается частота зачатия, рассчитанная на один менструальный цикл женщины. Интересно отметить, что собственно овуляторная функция женщины и регулярность менструального цикла не страдают до 45 лет, и такой важный диагностический признак для ановуляторного бесплодия, как наличие собственно овуляции, мало говорит о снижении репродуктивного потенциала у женщин старшей возрастной группы. Первым клиническим симптомом старения может служить сокращение продолжительно сти менструального цикла, которое происходит в конце четвертой декады жизни женщины и связано с укорочением фолликулярной фазы цикла. Стоит отметить, что только показатели овариального резерва, такие как базальный уровень ФСГ, тест с нагрузкой кломифенцитратом, наличие фолликулов при УЗИ яичников в начале цикла, могут говорить о процессах старения репродуктивной функции.
Может ли неоднократная стимуляция яичников вызывать повышенную частоту рака яичников и злокачественных заболеваний других локализаций?
Многочисленные эпидемиологические исследова ния последнего времени не показали зависимости между применением овариальной стимуляции при ЭКО и повышенной частотой рака яичников и таких заболеваний, как рак эндометрия, рак молочной железы, рак шейки матки. С другой стороны, отмечалось незначительное повышение частоты злокачественных и пограничных опухолей яичников у женщин, принимавших более 6 циклов кломифенцитрата, и поэтому не рекомендуется применять данный препарат при лечении бесплодия более 6 циклов.
1. Salha O., Abusheika N., Sharma V. Dynamics of follicular growth and in vivo oocyte maturation. Hum Reprod Update 1998; 4: 816—832.
2. Baker S., Spears N. The role of intra-ovarian interactions in the regulation of follicle dominance. Hum Reprod Update 1999; 5: 153—165.
3. Falck B. Site of production of oestrogen in rat ovary as studied in microtransplants. Acta Physiol Scand 1959; 47: 1—101.
4. Erickson G., Shimasaki S. The role of the oocyte in folliculogenesis. Trends Endocrinol Metab 2000; 11: 193—198.
5. Erickson G., Shimasaki S. The physiology of folliculogenesis: the role of novel growth factors. Fertil Steril 2001; 76: 943—949.
6. Faddy M., Gosden R. A mathematical model of follicle dynamics in the human ovary. Human Reprod 1995; 10: 770—775.
7. McGee E., Hsueh A. Initial and cyclic recruitment of ovarian follicles. Endocrin Rev 2000; 21: 200—214.
8. Perez G., Robles R., Knudson M., Flaws J., Korsmeyer S., Tilly J. Prolongation of ovarian lifespan into advanced chronological age by Bax — deficiency. Nat Genet 1999; 21: 200—203.
9. Teixeira J., Maheswaran S., Donahoe P. Mullerian inhibiting substance: an instructive developmental hormone with diagnostic and possible therapeutic applications. Endocrin Rev 2001; 22: 657—674.
10. de Wet A., Laven J., de Jong F., Themmen A., Fauser B. Antimulleran hormone serum levels: a putative marker for ovarian aging. Fertil Steril 2002; 77: 357—362.
11. Seifer D., MacLaughlin, Christian B., Feng B., Shelden R. Early follicular serum mullerian-inhibiting substance levels are associated with ovarian response during assisted reproductive technology cycles. Fertil Steril 2002; 77: 468—477.
12. Cook C., Siow Y., Brenner A., Fallat M. Relationship between serum mullerian-inhibiting substance and other reproductive hormones in untreated women with polycystic ovary syndrome and normal women. Fertil Steril 2002; 77: 141—146.
13. Fowler P., Tempelton A. The nature and function of putative gonadotopin surge — attenuating/inhibiting factor (GnSAF/IF). Endocrin Rev 1996; 17: 103—120.
14. Fowler P., Sorsa T., Harris W., Knight P., Mason H. Relationship between follicle size and gonadotropin surge attenuating factor (GnSAF) bioactivity during spontaneous cycles in women. Hum Reprod 2001; 16; 1353—1358.
15. Martinez F., Barri P., Coroleu B., Tur R., Sorsa-Leslie T., Harris W., Groome N., Knight P., Fowler P. Women with poor response to IVF have lowered circulating gonadotropin surge attenuating factor (GnSAF) bioactivity during spontaneous and stimulated cycles. Hum Reprod 2002; 17; 634—640.
16. Gougeon A. Regulation of ovarian follicular development in primates: facts and hypotheses. Endocrin Rev 1996; 17: 121—155.
17. Weestergaad L., Andersen C., Byskov A. Epidermal growth factors in small antral follicles in pregnant women. J Endocrinol 1990; 127: 363—367.
18. Mason H., Carr L., Leake R., Franks S. Production of transforming growth factor-a by normal and polycystic ovaries.
J Clin Endocrinol Metab 1995; 80: 2053—2056.
19. Zimmermann R., Xiao E., Husami N., Sauer M., Lobo R., Kitajewski J., Ferin M. Short-term administration of antivascular endothelial growth factor antibody in the late follicular phase delays follicular development in the rhesus monkey. J Clin Endocrinol Metab 2001; 86: 768—772.
20. Gregory L. Ovarian markers of implantation potential in assisted reproduction. Hum Reprod 1998; 13: Suppl 4: 117—132.
21. Chun S., Eisenhauer K., Kubo M., Hsueh A. Interleukin-1b suppresses apoptosis in rat ovarian follicles by increasing nitric oxide production. Endocrinology 1995; 136: 3120—3127.
22. Groome N., Illingworth P., O’Brien M. et al. Measurement of dimeric inhibin B throughout the human menstrual cycle. J Clin Endocrinol Metab 1996; 81: 1401—1405.
23. Ginter O., Wiltbank M., Fricke P., Gibbons J., Kot K. Selection of the dominant follicle in Cattle. Biol Repr 1996; 55: 1187—1194.
24. Levy D., Navarro J., Schattman G., Davis O., Rosenwaks Z. Exogenous LH: let’s design the future. Hum Reprod 2000; 15: 2258—2265.
25. Schipper I., Hop W., Fauser B. The FSH threshold/window concept examined by different interventions with exogenous FSH during the follicular phase of the normal menstrual cycle: duration, rather than magnitude, of FSH increase affects follicle development. J Clin Endocrinol Metab 1998; 83: 1292—1298.
26. Townsend S., Brown J., Johnstone J., Adey F., Evans J., Taft H. Induction of ovulation. J Obstet Gynec Br Com 1966; 73: 529—543.
27. Out H., Mannaerts B., Driessen S., Bennink C. Recombinant FSH (rFSH; Puregon) in assisted reproduction: more oocytes, more pregnancies. Results from five comparative studies. Hum Reprod Update 1996; 2: 162—171.
28. Huirne J., Lambalk C. Gonadotropin-releasing-hormone-receptor antagonists. Lancet 2001; 358: 1793—1803.
29. The Ganirelix Dose Finding Study Group. A double blind, randomized, dose-finding study to assess the efficacy of the Gn-RH antagonist ganirelix (Org 37462) to prevent premature LH surges in women undergoing ovarian stimulation with recombinant FSH hormone (Puregon). Hum Reprod 1998; 13: 3023—3031.
30. Janssens R., Lambalk C., Vermeiden J. et al. Dose-finding study of treptorelin acetate for prevention of a premature LH surge in IVF: a prospective, randomized, double-blind, placebo-controlled study. Hum Reprod 2000; 15: 2333—2340.
31. Brown J. Pituitary control of ovarian function — concepts derived from gonadotropin therapy. Aust N Z J Obstet Gynaec 1978; 18: 47—54.
32. The European recombinant LH study group Recombinant hLH is an effective, but saferthan, urinary hCG in inducing final follicular maturation and ovulation in IVF procedures: results of a multicenter double-blind study. J Clin Endocrinol Metab 2001; 86: 2607—2618.
33. Itskovitz-Eldor J., Kol S., Mannaerts B. Use of a single bolus of GnRH agonist triptorelin to trigger ovulation after GnRH antagonist ganirelix treatment in women undergoing ovarian stimulation for assisted reproduction, with special reference to the prevention of OHSS: preliminary report. Hum Reprod 2000; 15: 1965—1968.
34. Леонов Б.В., Кулаков В.И., Финогенова Е.Я., Козлова А.Ю., Беляева А.А., Кузмичев Л.Н. Использование препарата рекомбинантного ФСГ (фоллитропина- b) при лечении бесплодия в программах ЭКО. Акуш гин 2001; 6: 35—40.
35. Боярский К.Ю. Овариальная стимуляция и фолликулоге нез в конце 80-х: на пороге будущего. Пробл репрод 1997; 3: 4: 61—68.
36. Китаев Э.М. Элиминация половых клеток в процессе гаметогенеза и ее значение в репродукции. Акуш гин 1977; 86: 31—36.
37. Fauser B. Follicular development and oocyte maturation in hypogonadotrophic women employing recombinant FSH: the role of oestradiol. Hum Reprod Update 1997; 3: 101—108.
38. Baird D. A model for follicular selection and ovulation: lessons from superovulation. J Steroid Biochem 1987; 27: 15—23.
39. Baird D. Folliculogenesis and gonadotropins. In: Gonadotropins and fertility in the women. Eds Adashi E., Baird D. and Crosignani P. Serono Fertility Series, Roma 1999; 1—10.
40. Fauser B., van Heusden A. Manipulation of human ovarian function: physiological concepts and clinical consequences. Endocrin Rev 1997; 18: 71—106.
К.Ю. Боярский
Центр планирования семьи Пушкинского района, Санкт-Петербург
Вышло в свет «Руководство по климактерию»
(Под редакцией В.П. Сметник и И.В. Кулакова ).
Тел.: (095) 245-8620; 242-9110



