Атрофический гастрит обострение что делать
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой М. А., гастроэнтеролога со стажем в 22 года.
Определение болезни. Причины заболевания
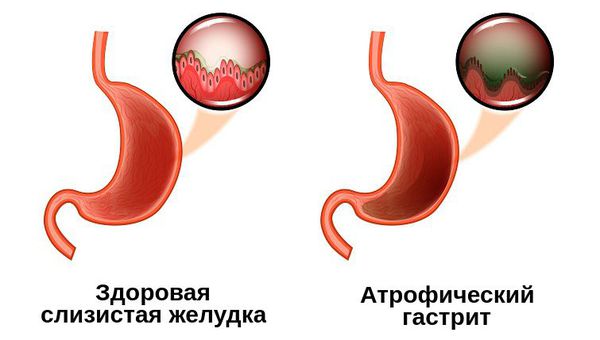
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Первоначально заболевание повреждает слизистую оболочку дна желудка (фундального отдела), а затем нарушает продукцию соляной кислоты и пепсиногена, которые обеспечивают желудочное пищеварение [4].
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Гастрит с атрофией желёз отличается прогрессирующим течением болезни и более высокой частотой озлокачествления [1]. Известно, что рак желудка не развивается на фоне неизменённой слизистой желудка — ему предшествуют изменения, называемые предраковыми, к которым и относится атрофический гастрит. Длительное течение этой болезни способствует появлению клеток, характерных для тонкого кишечника, вместо желудочных, а избыточное разрастание клеток слизистой провоцирует развитие опухоли.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
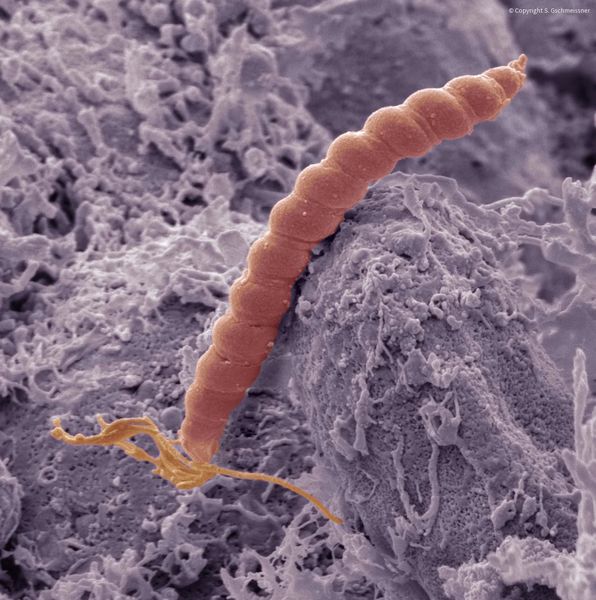
Наиболее значимыми факторами развития считаются инфекция Helicobacter pylori (H. pylori) и аутоиммунный гастрит, связанный с выработкой антител к собственным париетальным клеткам [6]. H. Pylori обнаруживают у 80 % с атрофическим гастритом, тогда как аутоиммунный гастрит считается достаточно редким заболеванием. Чаще всего оно встречается у женщин. Он может сопровождаться клиническими проявлениями, а может протекать бессимптомно, т. е. обнаружиться только при гистологическом исследовании после проведения биопсии. При хроническом аутоиммунном гастрите образуются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и внутреннему фактору Касла — белку, который связывает витамин B12, поступающий с пищей, и переводит его в усвояемую форму.
Важную роль в появлении атрофического гастрита играет длительный приём лекарств. Чаще всего он связан с нестероидными противовоспалительными средствами — аспирином, ибупрофеном, диклофенаком, дифлунизалом, пироксикамом, индометацином, кетопрофеном, напроксеном, сулиндаком и др. Также гастрит может развиться после приёма антибиотиков и таких препаратов, как инсулин, сульфаниламид, гормональные препараты, противотуберкулёзные средства. Кроме того, химическое воздействие на слизистую желудка оказывает рефлюкс — процесс заброса агрессивного содержимого кишечника в желудок, вследствие чего повреждается слизистая желудка и развиваются дальнейшие атрофические изменения.
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
К остальным причинам развития атрофического гастрита относят эмоциональные нагрузки, депрессию, сахарный диабет, гипертиреоз, дефицит железа и витамина В12, гипоксию (нехватку кислорода в тканях) при лёгочной и сердечной недостаточности, а также сочетание взаимоусиление нескольких воздействующих факторов [3].
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Выработка соляной кислоты постепенно снижается, вплоть до полного её отсутствия. Часто присоединяется сопутствующая патология: панкреатит, холецистит, энтероколит. В компенсированной стадии, когда потеря париетальных клеток ещё не приводит к значительному снижению кислотности, диспепсические симптомы могут быть менее выражены, большинство функций желудка сохранены, при этом гистологическая оценка выявляет атрофию. Поэтому понятие атрофический гастрит (морфологический диагноз) и гастрит с пониженной кислотностью (функциональное состояние) неоднозначны.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Патогенез атрофического гастрита
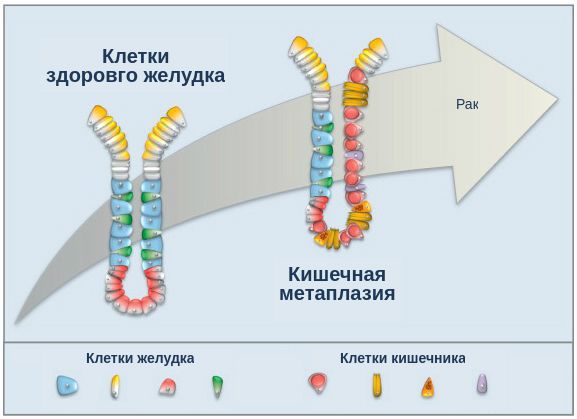
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
При резко выраженной атрофии фундальных желёз возникает компенсаторная, рикошетная гиперпродукция гастрина, также увеличивается активность G-клеток. У людей после 50 лет более выражены явления атрофии с метаплазией железистого эпителия по кишечному типу. Риск появления рака желудка на фоне аутоиммунного гастрита в 3-10 раз выше, чем у других людей. Сочетание такого гастрита с инфекционным существенно ухудшает прогноз [5].
Классификация и стадии развития атрофического гастрита
По принятой в Сиднее в 1990 году классификации, диагноз гастрита должен учитывать локализацию патологических изменений, гистологические характеристики, выявленные при исследовании биоптатов, эндоскопические находки и вероятные причины развития болезни [5].
| По типу | По локализации изменений | По эндоскопическими признакам | По причинам развития |
|---|---|---|---|
| •⠀Острый •⠀Хронический | •⠀Антральный (в антруме) •⠀Фундальный (в своде желудка) •⠀Пангастрит (во всём желудке) | •⠀Эритематозный (поверхностный) •⠀Эрозивный (с появлением эрозий) •⠀Геморрагический (с очагами кровоизлияния) •⠀Атрофический (с атрофией желёз) •⠀Гиперплазия складок (с разрастанием клеток слизистой) | •⠀Тип А (аутоиммунный гастрит) •⠀Тип В (связан с H. pylori) •⠀Тип С (реактивный гастрит) •⠀Особые формы |
| Также выделяют фазы ремиссии и обострения, стадии компенсации и декомпенсации | |||
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
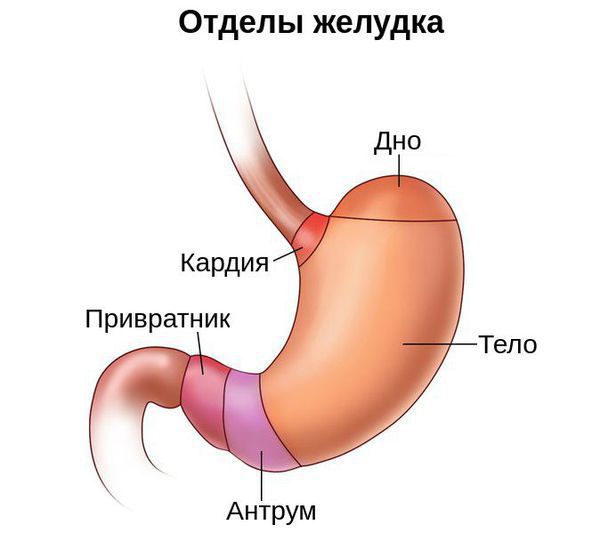
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
Самым серьёзным осложнением атрофического гастрита является рак желудка. Развитие злокачественной опухоли проходит несколько этапов на протяжении нескольких лет [5]. При этом железы желудка перестают вырабатывать соляную кислоту и гастрин, приобретают свойства тонко- или толстокишечных желёз. Такие изменённые железы в процессе зарождения рака становятся всё более незрелыми, метаплазия эпителия переходит от полного типа (тонкокишечного) к неполному (толстокишечному) типу. Такой процесс существенно повышает риск развития опухоли.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
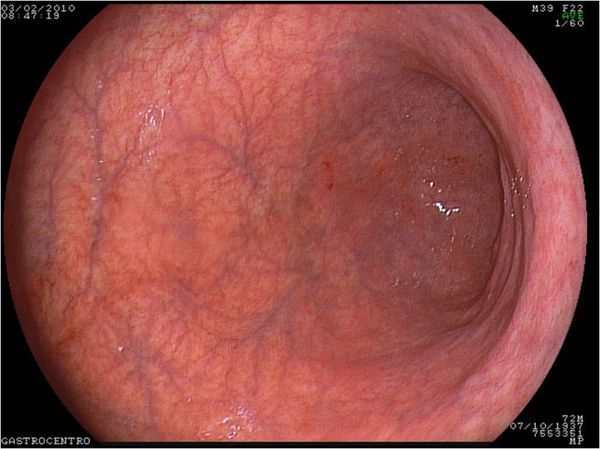
Во время гастроскопии (ФГДС) выявляются истончение слизистой, уменьшение складок и усиление сосудистого рисунка. Чтобы обнаружить дисплазию или метаплазию, можно воспользоваться хромографией. Для этого слизистую желудка окрашивают специальным красителем: изменённые участки приобретают окраску, отличающую их от здоровой ткани. На УЗИ можно обнаружить сопутствующую патологию органов пищеварительной системы — печени, желчного пузыря, поджелудочной железы.
Способность париетальных клеток выделять соляную кислоту изучается при помощи рН-метрии. Это исследование проводится одномоментно с проведением ФГДС. От его результатов зависит тактика лечения и прогноз заболевания. Также он помогает контролировать эффективность терапии. Так как при атрофическом гастрите кислотность снижена, pH может колебаться в пределах 3-6.
Лабораторными маркерами атрофического гастрита являются уровень пепсиогена I, пепсиогена II и гастрина-17 в крови. Определить его можно при помощи гемотеста. Снижение выработки пепсиногена I и II указывает на уменьшение функционирующих главных клеток.
Научно доказана возможность скрининга с помощью анализа крови для выявления атрофического гастрита и рака желудка [8]. Существенное значение имеет определение антител к фактору Кастла и антител к париетальным клеткам желудка в сыворотке крови. Тест значительно чувствителен — положителен у 95 % пациентов с В12-дефицитной анемией, хотя специфичность теста низкая: эти антитела могут присутствовать у небольшого процента людей с сахарным диабетом 1-го типа, тиреотоксикозом и аутоиммунным тиреоидитом.
Диагностика H. pylori необходима при любом варианте гастрита. Выяснив причину болезни, можно устранить инфекцию и прерывать патогенетический каскад заболевания и предупредить грозные осложнения, особенно на ранних стадиях [11]. Методы диагностики инфекции могут быть прямыми и косвенными. Настоятельно рекомендуется использовать несколько методов, чтобы исключить ложноположительные и ложноотрицательные результаты.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Важно также исследовать кровь по общим показателям. При атрофическом гастрите и В12-дефицитной анемии в анализе крови можно обнаружить снижение уровня гемоглобина.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Согласно исследованиям американских учёных [6], игнорирование наличия H. pylori при назначении антисекреторной терапии приводит к тому, что воспаление распространяется на всю слизистую оболочку желудка. В итоге через 10-15 лет хронический воспалительный процесс приводит к развитию атрофии главных желёз, повышая риск появления рака желудка. Поэтому при наличии показаний для длительного назначения ИПП необходимо предварительно пройти исследование для выявления H. pylori, а также курс эрадикационной терапии при положительном результате.
Первая линия терапии включает ИПП в полной суточной дозе (40 мг) и два антибиотика: кларитромицин + амоксициллин либо кларитромицин и фуразолидон. Пациентам с резко пониженной секреторной функцией вместо ингибиторов кислотной секреции показано назначение висмута субцитрата (де-нол). Если проводимая терапия не привела к полному уничтожению H. pylori, считается, что бактерия устойчива к проводимому лечению. В таком случае необходимо определить чувствительность бактерии к антибиотикам, применяемым в практике [2].
Если первая линия терапии неэффективна, проводится вторая линия терапии: препарат висмута (висмута трикалия дицитрат), ИПП, тетрациклин и метронидазол. Длительность лечения составляет 7-14 дней.
В России широко используются препараты висмута в качестве терапии первой и второй линии (в комбинации трёх препаратов), чаще других назначается де-нол (улькавис). Назначение висмута при лечении хронического гастрита оправдано, т. к. нет необходимости быстро купировать боль, как при обострении язвенной болезни, когда применяются схемы с ИПП. Малосимптомное течение хронического гастрита позволяет провести эрадикацию на основе висмутсодержащих препаратов.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
После устранения инфекции уже через месяц снижается активность гастрита. Если атрофия ещё не успела развиться, то можно говорить о полном излечении болезни. При атрофическом гастрите нормализуется клеточное обновление слизистой желудка, прерывается патогенетический каскад, что не даёт развиться раку желудка [9].
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori. При выявлении инфекции после проведения терапии необходимо повторное лечение.
Существенно влияет на прогноз заболевания площадь распространения метаплазии и атрофического процесса. Если метаплазия распространилась на 20 % слизистой, то риск ракового развития достигает почти 100 %. По статистике, хронический атрофический гастрит в 13 % случаев неизбежно заканчивается онкологией [10]. Большое значение для прогноза болезни имеет и снижение выработки соляной кислоты, т. к. при этом нарушаются механизмы противоопухолевой защиты.
Принципиально важно постоянное наблюдение пациентов с хроническим гастритом. Оно предполагает эндоскопию с биопсией и гистологическим исследованием, которое должно проводиться не реже двух раз в год. Чем больше степень воспалительных изменений, тем выше риск развития атрофии. Если атрофический гастрит уже развился, то необходимо установить его стадию. Это позволит определить, входит ли пациент в группу риска развития рака желудка [10][12].
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.
Список литературы
Данная статья использована в качестве основы для видео для пациентов Чернова И.С., Жукова М.А. Атрофический гастрит.
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой М. А., гастроэнтеролога со стажем в 22 года.
Определение болезни. Причины заболевания
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Краткое содержание статьи — в видео:
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Основными функциями желудка являются:
При значительном снижении синтеза и отсутствии соляной кислоты возникают следующие местные проявления :
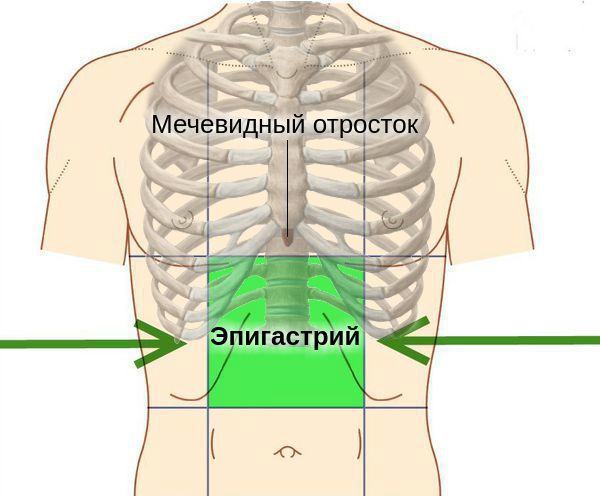
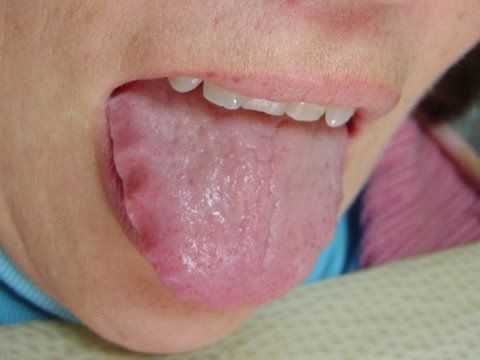
У людей с атрофическим гастритом отмечается «лакированный» язык, при обострениях язык увеличивается (видны отпечатки зубов), он обложен густым белым налётом. При пальпации (прощупывании) области желудка болезненность обычно отсутствует, но иногда возникает слабо выраженная разлитая болезненность в эпигастральной области.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Симптомы общих расстройств:
Клинические симптомы гастрита нельзя сопоставить с гистологическими изменениями. Атрофический гастрит развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. Считается, что на первых этапах умеренно выраженного атрофического гастрита клиника малосимптомная, стёртая и не имеет специфических проявлений. Но на дальнейших стадиях появляются симптомы, связанные с моторной и секреторной недостаточность желудка.
Патогенез атрофического гастрита
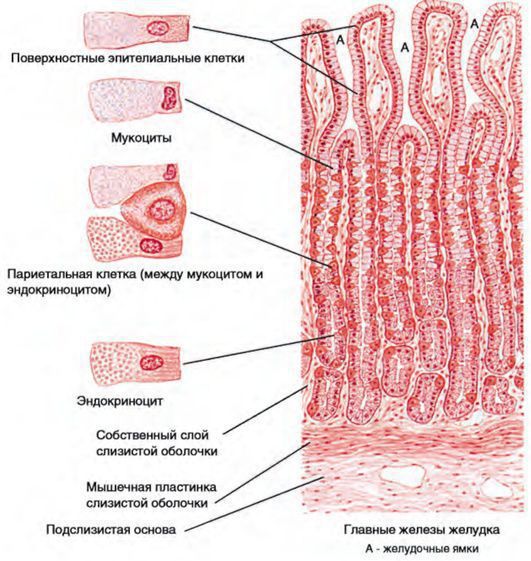
Эпителий слизистой оболочки желудка двухслойный:
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
Повреждение слизистой оболочки желудка при аутоиммунном гастрите реализуется через другой механизм: нарушение иммунитета приводит к образованию антител, повреждению ткани желудка иммунными комплексами. Чаще всего антитела вырабатываются к фактору Касла, который отвечает за всасывание витамина В12, и G-клеткам. Из-за этого постепенно снижается кислотность желудка, изменяется структура слизистой, снижается выработка соляной кислоты. В желудке нарушается всасывание железа и витаминов, развивается В12-дефицитная анемия. При этом заболевании в 90 % случаев выявляются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и к Н + /К +- АТФазе, в 60 % случаев — антитела к фактору Касла.
Классификация и стадии развития атрофического гастрита
Сиднейская классификация гастритов
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
Морфологическая классификация гастрита широко применяется в практике, т. к. именно гистологические характеристики процесса помогают определить прогноз и тактику лечения пациента. Для этого используют визуально-аналоговую шкалу. Она позволяет оценить морфологическую картину слизистой желудка по:
Степень атрофии также оценивается по визуально-аналоговой шкале, изображённой на схеме ниже. По выраженности атрофии и её виду выделяют три категории изменений слизистой оболочки желудка:
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Развитие болезни проходит определённые стадии:
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
Хронический химикоиндуцированный или желчный рефлюкс-гастрит объединяет большую группу больных, включая:
Цель лечения — нормализовать моторику желудочно-кишечного тракта и связывание желчных кислот.
Тактика лечения зависит от основной причины гастрита:
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori (иногда лечение помогает только времено подавить активность инфекции [13] ). При выявлении H. pylori после проведённой терапии необходимо повторное лечение.
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.