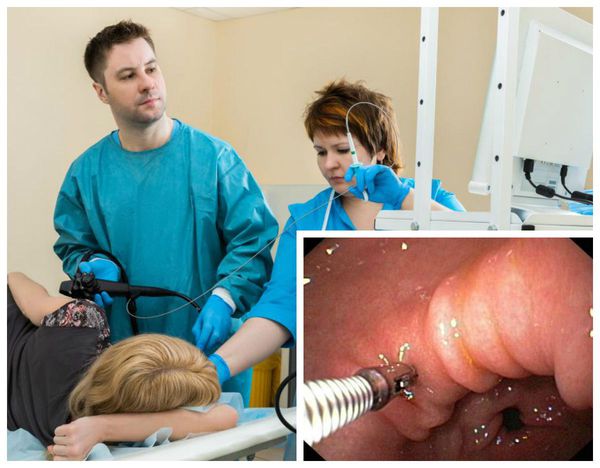
Атрофия кишечника что делать
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой М. А., гастроэнтеролога со стажем в 22 года.
Определение болезни. Причины заболевания
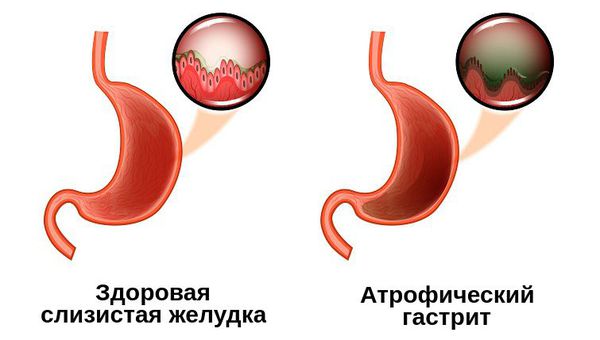
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Краткое содержание статьи — в видео:
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Основными функциями желудка являются:
При значительном снижении синтеза и отсутствии соляной кислоты возникают следующие местные проявления :
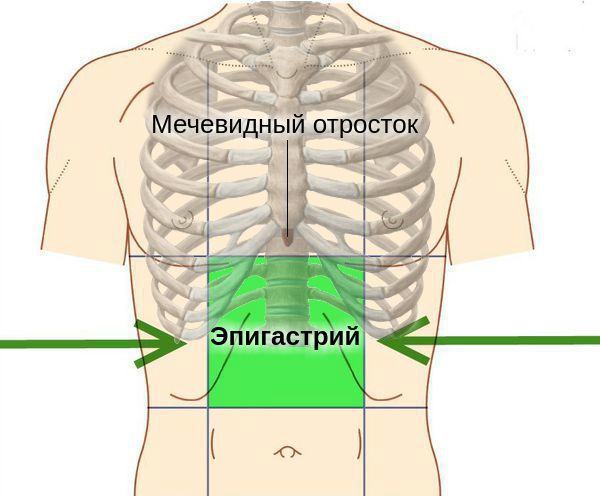
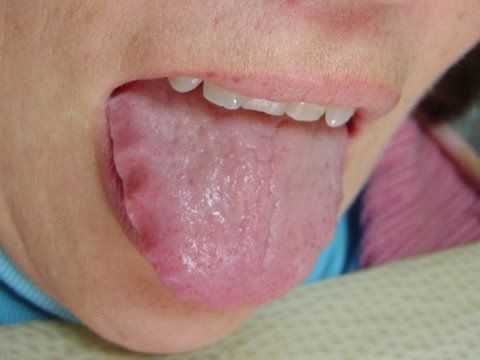
У людей с атрофическим гастритом отмечается «лакированный» язык, при обострениях язык увеличивается (видны отпечатки зубов), он обложен густым белым налётом. При пальпации (прощупывании) области желудка болезненность обычно отсутствует, но иногда возникает слабо выраженная разлитая болезненность в эпигастральной области.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Симптомы общих расстройств:
Клинические симптомы гастрита нельзя сопоставить с гистологическими изменениями. Атрофический гастрит развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. Считается, что на первых этапах умеренно выраженного атрофического гастрита клиника малосимптомная, стёртая и не имеет специфических проявлений. Но на дальнейших стадиях появляются симптомы, связанные с моторной и секреторной недостаточность желудка.
Патогенез атрофического гастрита
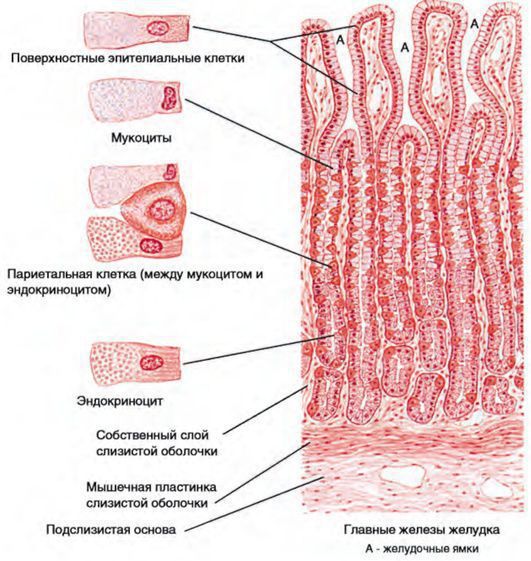
Эпителий слизистой оболочки желудка двухслойный:
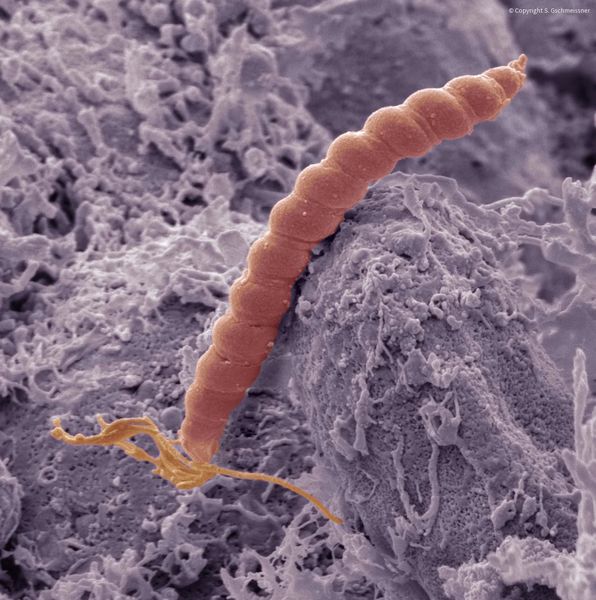
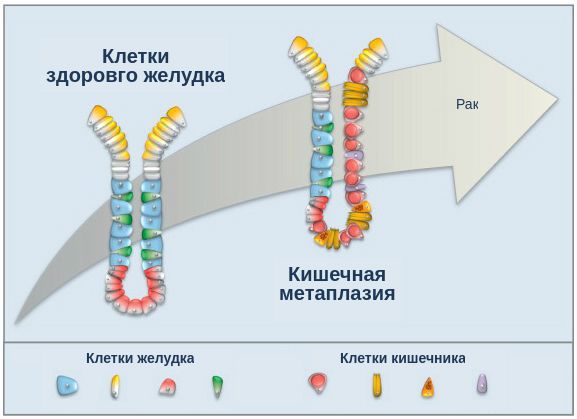
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
Повреждение слизистой оболочки желудка при аутоиммунном гастрите реализуется через другой механизм: нарушение иммунитета приводит к образованию антител, повреждению ткани желудка иммунными комплексами. Чаще всего антитела вырабатываются к фактору Касла, который отвечает за всасывание витамина В12, и G-клеткам. Из-за этого постепенно снижается кислотность желудка, изменяется структура слизистой, снижается выработка соляной кислоты. В желудке нарушается всасывание железа и витаминов, развивается В12-дефицитная анемия. При этом заболевании в 90 % случаев выявляются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и к Н + /К +- АТФазе, в 60 % случаев — антитела к фактору Касла.
Классификация и стадии развития атрофического гастрита
Сиднейская классификация гастритов
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
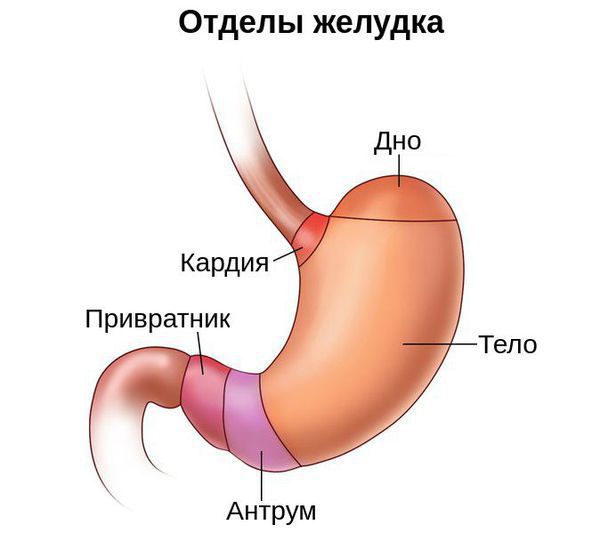
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
Морфологическая классификация гастрита широко применяется в практике, т. к. именно гистологические характеристики процесса помогают определить прогноз и тактику лечения пациента. Для этого используют визуально-аналоговую шкалу. Она позволяет оценить морфологическую картину слизистой желудка по:
Степень атрофии также оценивается по визуально-аналоговой шкале, изображённой на схеме ниже. По выраженности атрофии и её виду выделяют три категории изменений слизистой оболочки желудка:
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Развитие болезни проходит определённые стадии:
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
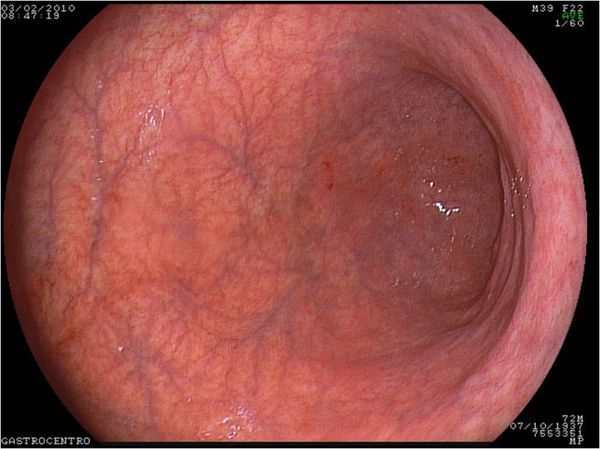
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
Хронический химикоиндуцированный или желчный рефлюкс-гастрит объединяет большую группу больных, включая:
Цель лечения — нормализовать моторику желудочно-кишечного тракта и связывание желчных кислот.
Тактика лечения зависит от основной причины гастрита:
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori (иногда лечение помогает только времено подавить активность инфекции [13] ). При выявлении H. pylori после проведённой терапии необходимо повторное лечение.
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.
Хронические воспалительные заболевания кишечника
Что принято считать хроническим невоспалительным заболеванием кишечника? Какими методами можно подтвердить диагноз? Какая терапия наиболее эффективна? Рисунок 1. Слизистая кишечника при болезни Крона Хроническим воспалительным забо
Что принято считать хроническим невоспалительным заболеванием кишечника?
Какими методами можно подтвердить диагноз?
Какая терапия наиболее эффективна?
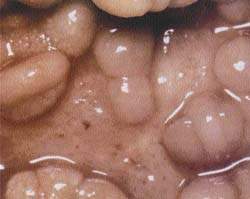 |
| Рисунок 1. Слизистая кишечника при болезни Крона |
Хроническим воспалительным заболеванием кишечника принято считать каждый длительный энтерит — как инфекционной, так и иммуноаллергической этиологии, который ведет к хроническому воспалительному процессу в кишечнике.
Помимо целиакии, эти заболевания включают в себя язвенный ректоколит, болезнь Крона и другие более редкие заболевания: колит при болезни Бехчета, некротизирующий энтероколит у детей младшего возраста. Все эти заболевания характеризуются:
— неизвестной этиологией (кроме целиакии);
— воспалительным характером поражений;
— хроническим течением и возможными рецидивами;
— ассоциацией с другими некишечными заболеваниями;
— хорошей реакцией на кортикостероидную терапию;
— возможностью хирургического разрешения (лечения).
В возникновении данных заболеваний большую роль играют как географический (встречаются чаще в Северной Европе), так и генетический факторы.
Болезнь Крона встречается чаще в западных странах и среди городского населения.
Этиология неизвестна, можно лишь предположить влияние инфекционных заболеваний и питания. Патогенез связан с нарушением ответной иммунной реакции со стороны слизистой кишечника, характер которой недостаточно изучен, известно лишь, что происходит активация Т- и В-лимфоцитов, увеличивается производство цитокинов и комплемента.
Гистопатологические наблюдения позволяют выявить два основных и множество промежуточных типов нарушений при хроническом воспалении кишечника.
Болезнь Крона. Характеризуется четко отграниченными трансмуральными сегментарными поражениями, разделенными между собой внешне неизмененной слизистой. Поражение распространяется на мезентериальные лимфоузлы. Может быть затронут любой участок желудочно-кишечного тракта, но чаще поражается кишечный отдел подвздошной кишки. Типично формирование стенозов, абсцессов и фистул. Характерны отек слизистой, изъязвления, атрофия и утолщение кишечной стенки, гиперплазия лимфоузлов.
Наблюдается гранулематозное поражение. В 60-70% случаев гранулема обнаруживается на хирургическом материале и лишь в 30-40% при биопсии. Гранулема состоит из эпителиоидных и гигантских клеток. Несмотря на тенденцию к некрозу, казеозного некроза не отмечается. Легко формируются язвы и фистулы.
Язвенный ректоколит. Это заболевание ободочной кишки. Начинается с ректального уровня и распространяется вверх. Процесс поверхностный, затрагивает подслизистую, слизистую и редко более глубокие слои. Для острой стадии характерны гиперемия слизистой, отек, легко кровоточащие эрозии и язвы. В промежутках между язвенными поражениями слизистая гипертрофирована, нередко образуются псевдополипы. Описанные поражения могут сочетаться с перианальными трещинами. Гистологически характерно образование крипт и абсцессов, в которых накапливаются лимфоциты, эозинофилы, нейтрофилы, плазматические клетки. Гранулематозная ткань отсутствует.
Варианты вышеописанных двух основных типов хронических воспалительных заболеваний кишечника:
1. Язвенный энтероколит. Некоторыми авторами считается врожденной формой болезни Крона. Поражения затрагивают весь пищеварительный тракт, но преимущественно локализуются в конечной части подвздошной кишки и в начальном участке ободочной кишки.
2. Синдром Бехчета, при котором к кишечным поражениям присоединяются ретинит, слепота, болезненные язвенные и некротические поражения слизистой рта и гениталий.
3. Некротизирующий энтероколит у грудных детей часто приводит к летальному исходу. Клинические проявления болезни приходятся на первую неделю жизни: диарея с примесью крови, признаки перитонита и шок. Характерны множественные язвенные поражения с перфорацией.
Классически хронические заболевания кишечника характеризуются как желудочно-кишечными (диарея, боли в животе, наличие крови в кале), так и общими (температура, потеря веса, задержка физического развития) симптомами.
Болезнь Крона: на фоне анорексии, типичной для этого заболевания, преобладают общие симптомы. Боли в животе напоминают приступы аппендицита. Кровь в кале обнаруживается редко. При осмотре отмечается болезненность в правой подвздошной области, там же иногда пальпируется масса.
Язвенный ректоколит: преобладают кишечные симптомы — тенезмы, диарея с примесью крови. При пальпации живота отмечается болезненность по ходу ободочной кишки.
Стенозы, абсцессы и фистулы, трещины, мегаколон, перфорации с массивным кровотечением, карцинома ободочной кишки, энтеропатия с потерей белка. Характерны такие общие осложнения, как воспаление радужки, сосудистой оболочки глаза, афтозный стоматит, артрит, перихолангит, склерозирующий холангит.
Хроническая диарея с болями в животе, кал с примесью крови позволяют думать о хроническом воспалительном заболевании кишечника.
Для подтверждения диагноза необходимо оценить данные лабораторного анализа: общий анализ крови; сидеремию; трансферинемию; иммуноглобулины; время свертываемости крови; содержание в крови кальция, фосфора, цинка, меди; костный возраст; С-реактивный белок, a1-антитрипсин; анализ кала. Особо важную роль для постановки диагноза приобрела контрастная рентгенография с барием. Широко используется рентгенография с двойным контрастированием, при которой отмечается:
— уменьшение просвета кишечной стенки;
— неоднородность рисунка;
— кистовидные участки.
Наличие этих трех признаков в терминальной части подвздошной кишки образует триаду Bodart, типичную для болезни Крона.
О распространении воспалительного процесса позволяют судить участки, заполненные лейкоцитами, меченными радиоактивным йодом I111. Компьютерная томография незаменима для выявления осложнений (фистул, абсцессов).
Окончательный диагноз ставится на основе биопсии.
Дифференциальный диагноз проводится с
— аллергическим колитом;
— узловой лимфоидной гиперплазией;
— хроническим гранулематозным заболеванием;
— аппендицитом;
— полипозом и лимфомой кишечника;
—болезнью Шенлейна — Геноха.
За последние годы значительно улучшился. Детская смертность практически исчезла (от 15 до 2%).
Большую тенденцию к рецидивам имеет язвенный ректоколит. Наблюдение за детьми заключается в
— контроле за ростом;
— контроле за показателями воспалительного процесса;
— за терапией [10].
Диетотерапия играет важную роль, особенно при болезни Крона, для которой характерна потеря веса и задержка роста [1, 2, 10, 15, 17].
Новый подход к терапии заключается в возможности достигнуть ремиссии с помощью диеты без гормональной терапии [1, 18, 21, 23, 24, 25].
Фармакотерапия основана на применении кортикостероидов [26], сульфасалазина, салазопирина [27, 28, 29], метронидазола [30]. Иммуносупрессоры малоприменимы из-за их токсичности.
Хирургическое лечение возможно при тяжелых осложнениях (мегаколон, стенозы, абсцессы, фистулы) и в случаях задержки роста в пубертатном и препубертатном периодах [13, 14].
Из клинической практики
Поражение печени, хотя и без явных клинических проявлений, встречается довольно часто при хронических заболеваниях кишечника. У взрослых в 70% случаев развивается перихолангит с портальной триадой. У 50% отмечаются жировые изменения печени. 10% приобретают заболевания печени. Цирроз печени развивается у 5%.
Другие, более тяжелые и редкие осложнения — это хронический активный гепатит, склерозирующий холангит и карцинома желчевыводящих путей.
Необходимо отметить, что у детей частым осложнением является хронический активный гепатит, в то время как перихолангит и склерозирующий холангит встречаются очень редко и протекают бессимптомно.
Представляем клинический случай язвенного колита у девочки трех лет. Начальная фаза заболевания протекала бессимптомно. Впоследствии развилась ярко выраженная гепатомегалия.
Девочка была госпитализирована в трехлетнем возрасте. За 8 месяцев до госпитализации отмечались раздражительность, потеря аппетита, непостоянные боли в животе, кал с примесью алой крови. С вышеописанной симптоматикой девочка была госпитализирована. При осмотре отмечалась значительная гепатомегалия (+4 см из-под реберной дуги по правой среднеключичной линии). В анализе крови СОЭ 104 мм в час; общий белок крови 9,9 гр%; альбумин 2,5 гр%; a1-глобулин 0,3; a2-глобулин 1,1; b-глобулин 1,0; g-глобулин 5,0; IgG 4810 мг%; щелочная фосфатаза 1273 МЕ; антитела противоядерные и против гладких мышц отсутствуют.
В период госпитализации девочка жаловалась на частые боли в животе. В кале примесь слизи и алой крови. При анализе слизи кала выявлено множество нейтрофильных лейкоцитов. Эндоскопически выявлен обширный воспалительный процесс по всей ободочной кишке с отеком слизистой. При контакте с инструментом слизистая легко кровоточила.
При множественных биопсиях проводился гистологический анализ, который выявил изрежение железистых протоков с моно- и полинуклеарной инфильтрацией.
Чрескожная печеночная биопсия выявила воспалительные и грануломатозные изменения преимущественно в портобилиарных пространствах. Более того, отмечался воспалительный процесс типа перихолангита и начального холангита в межлобулярных протоках.
Лечение преднизолоном в начальной стадии и далее салазопиридином (SAZP) привело к полной ремиссии кишечной симптоматики. Клиническая ремиссия с полной регрессией гепатомегалии (печень пальпировалась у реберной дуги) была подтверждена гистологически. Нормализовались и лабораторные показатели (IgG 997 мг%).
Известно, что язвенный колит нередко сопровождается непереносимостью белка коровьего молока, поэтому были проведены кожный тест и тест на определение специфичных IgE. IgE были значительно увеличены.
Быстрая клиническая ремиссия была обусловлена двумя факторами: назначением салазопиридина (SAZP) и одновременным исключением из диеты коровьего молока.
Chronic inflammatory bowel diseases
Summary
Chronic inflammatory bowel diseases are commonly believed to present in the form of two diseases with aetiologies of unknown origin, Ulcerative Rectocolitis and Chron’s Disease, which are characterised by important inflammatory events affecting the normal structure of the intestinal wall, with a tendency to relapse.
Both diseases share a variety of common characteristics and are thus considered by many as one single clinical entity.
The common features are the following:
— unknown aetiology
— inflammatory aspect of the lesions
— chronicity of the course of disease, with possible relapses
— association with extra-intestinal symptoms
— good response to corticosteroid therapy
— recourse to surgery (for a limited number of cases).
The aforenamed two paradigmatical pictures constitute the essentials of a spectrum comprising an indefinite number of intermediate pictures, for example Behcet’s Colitis, similar to Ulcerative Colitis but where ulcers can be found in the area of the mouth and the genitals, or Ulcerative Enterocolitis of the infant, thought to be a congenital form of Chron’s Disease.
Both pictures display gastrointestinal symptoms such as diarrhoea, tenesmus and bloody stools, usually prevailing in Ulcerative Colitis, and are accompanied by general symptoms such as fever and weight loss, usually found in Chron’s Disease.
One of the recent and most interesting aspects of Chron’s disease is the possibility to induce remission as well as restoration of the patient’s growth by administration of an elementary diet. The administration of a hypercaloric diet has also proved useful in correcting growth speed and in reducing the need of steroids, which also play an important role in inducing disease remission.
In order to further maintain remission, the administration of salazopirina (sulfosalazina) and corresponding salacylates, as well as of immunosoppressors such as azathioprine and cyclosporins, have proved useful. The administration of metronidazolo is indicated in the case of perineal injuries only. The use of surgery should be limited to complications and, in the presence of failure to thrive, only if the lesions are well delimited.