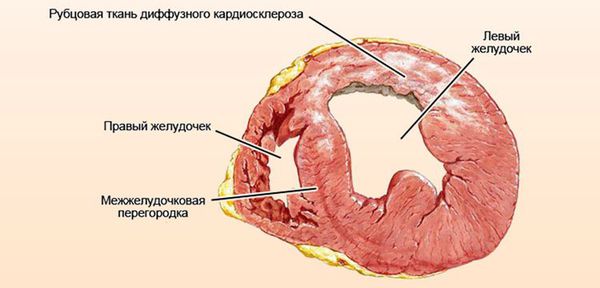
Атрофия правого желудочка сердца что это такое
Что такое миокардиодистрофия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мадоян М. А., кардиолога со стажем в 20 лет.
Определение болезни. Причины заболевания
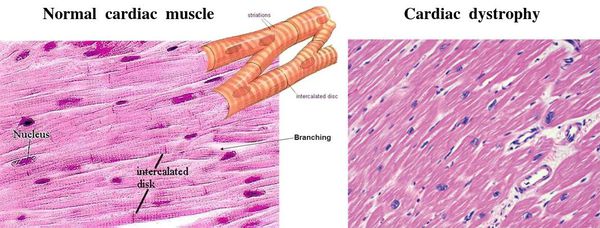
Миокардиодистрофия (МКД) — группа вторичных обратимых поражений мышечного слоя сердца (миокарда) невоспалительной и некоронарогенной природы, которые обусловлены нарушением обмена веществ в миокарде и проявляются нарушением его функций. [1] [3] [5]
Общие признаки миокардиодистрофий:
Заболевание поражает разные возрастные группы, но чаще встречается после 40 лет. [2] [3] [4] [6] [7]
К миокардиодистрофии могут приводить самые различные внутренние и внешние факторы, нарушающие обмен веществ и энергии в тканях сердца. [1] [3] [5] [6] [7]
Внутренние (эндогенные) факторы — патологические процессы в организме, осложнившиеся миокардиодистрофией. Эндогенные факторы можно разделить на две большие группы: сердечные и несердечные причины возникновения МКД.
К сердечным факторам относятся:
Внешние (экзогенные) факторы — патологические воздействия на организм внешней среды и образа жизни:
Симптомы миокардиодистрофии
Характеристика симптомов при миокардиодистрофии:
Виды симптомов при МКД:
Патогенез миокардиодистрофии
В патогенезе миокардиодистрофии задействованы ткани сердца следующих видов:
При нарушении обменных процессов (электролитного, белкового, энергетического) нарушаются и функции сердечных тканей [1] [2] [5] : мышечные клетки утрачивают способность к нормальным сокращениям, нервные — к генерированию и проведению нормальных импульсов.
Причём поражается не сразу вся ткань сердца. Сначала возникают одиночные очаги дистрофии из нескольких клеток, а соседние неповреждённые клетки пытаются восполнить потерю и усиливают свою функцию. Затем количество и размер поражённых очагов увеличиваются, происходит их слияние, здоровые участки теряют способность компенсировать ухудшение работы, появляется расширение сердечных камер и выраженное нарушение функций сердца. [3]
Далее при прекращении воздействия причинного фактора начинается медленное восстановление структуры и функции клеток. [7] При продолжающемся воздействии причинного фактора происходит гибель клеток и их замещение рубцовой (соединительной) тканью. Соединительная ткань не способна сокращаться и расслабляться, генерировать и проводить импульсы, заменяться здоровыми клетками. Процесс формирования соединительной ткани в сердце называется кардиосклероз, на этом этапе у болезни уже не может быть обратного развития. [3]
Классификация и стадии развития миокардиодистрофии
Миокардиодистрофии классифицируют по причинам возникновения, перечисленным выше, а также по скорости развития и стадиям заболевания. [1] [5]
По скорости развития миокардиодистрофий различают:
По стадиям миокардиодистрофий выделяют:
Осложнения миокардиодистрофии
Диагностика миокардиодистрофии
Задачи диагностического процесса:
В диагностике миокардиодистрофий большое значение имеет грамотный расспрос и внимательный осмотр пациента. Также проводят электрокардиографию, УЗИ сердца, рентгенологичесское исследование органов грудной клетки, лабораторные исследование крови и мочи. [3] Специфических изменений результатов данных исследований для миокардиодистрофий нет, но они позволяют выявить заболевания — причины миокардиодистрофий. ЭКГ и УЗИ сердца могут проводить повторно для оценки положительной динамики функций сердца на фоне проводимого лечения.
Лечение миокардиодистрофии
Задачи лечебного процесса:
Своевременность и полнота устранения причины миокардиодистрофии определяет эффективность терапии и её сроки. На этапе устранения причины лечебный процесс сильно разнится у больных с разными причинами заболевания: [1] [2] [5] [6] [7]
Однако не всякую выявленную причину миокардиодистрофии можно устранить. Например, сами заболевания (длительные или хронические) и токсические препараты, применяемые для их лечения, лучевая терапия онкологических больных, некупируемые зависимости и другое.
Параллельно лечению основного заболевания, вызвавшего миокардиодистрофию (независимо от того, можно его устранить или нет), всех больных наблюдает кардиолог, по его назначению применяются виды лечения, направленные на улучшение обмена веществ в сердечных тканях, уменьшение симптомов и профилактику осложнений. [3]
Немедикаментозное лечение — нормализация образа жизни и питания, отказ от вредных привычек. Важно, чтобы пациент придерживался определённого режима дня, полноценно отдыхал и питался, обязательно имел регулярные, адекватные именно для него физические нагрузки, ежедневно находился на свежем воздухе. Также очень важно, чтобы в жизни пациента было увлекающее его дело. Немедикаментозное лечение — это зона ответственности пациента. Врач может порекомендовать, но реализовывать должен сам пациент.
Медикаментозное лечение:
Медикаментозное лечение — это зона ответственности врача. Ни в коем случае не надо пытаться лечиться самостоятельно. Каждый медикаментозный препарат (витамины и стимуляторы обменных процессов в том числе) может при определённых условиях нанести вред.
Прогноз. Профилактика
При I и II стадиях прогноз благоприятный. После устранения причинного фактора функции сердца могут полностью восстановиться. Длительность периода восстановления зависит от времени начала лечения (чем быстрее начата адекватная терапия, тем быстрее регрессируют патологические изменения) и от общего состояния организма (молодой возраст, отсутствие сопутствующих заболеваний способствуют быстрейшему восстановлению) и может составлять от года до многих лет. [7]
При III стадии прогноз зависит от выраженности изменений и наличия осложнений. Так как изменения в сердце уже необратимы, речь идёт не о восстановлении нормальных параметров сердца и хорошего самочувствия, а о замедлении прогрессирования хронической сердечной недостаточности и нарушений ритма. При III стадии необходимо пожизненное лечение, профессиональная деятельность ограничена либо невозможна, а при отсутствии лечения неблагоприятным становится и прогноз жизни.
Профилактика:
Аритмогенная дисплазия правого желудочка
Терминология
Аритмогенная дисплазия правого желудочка (АДПЖ) – сравнительно редкое кардиологическое заболевание, в отношении которого по сей день остается множество вопросов и противоречивых представлений.
Первое клиническое описание принадлежит выдающемуся итальянскому мыслителю, врачу, анатому Джованни-Мария Ланчизи (все прочие транскрибации итальянской фамилии Lancisi, а именно «Ланциси», «Ланцизи» и т.п. – являются неверными). Ему же принадлежат авангардные для того времени (ХVII- ХVIII вв) труды о нервно-мозговой организации, о малярии, о связи сифилиса и сосудистых аневризм, об эпизоотиях крупного рогатого скота. Датой же написания кардиологического исследования «De Motu Cordis et Aneurysmatibus», где Дж.-М. Ланчизи подробно описал АДПЖ как наследственное заболевание в четырех поколениях одного рода, отечественные источники называют то 1736 год, то 1745, – без каких-либо оговорок касательно того факта, что сам Ланчизи умер в 1720 году. На самом деле издание было посмертным и вышло в 1728 году.
Все это может показаться несущественным, но есть и другие неоднозначности в отношении аритмогенной дисплазии ПЖ. Современная формулировка диагноза АДПЖ была предложена только в 1977 году, но уже через пять лет (1982) в употребление вошел синонимический диагноз «аритмогенная кардиомиопатия правого желудочка», который используется, в частности, в МКБ-10 (рубрика «Другие болезни сердца / Кардиомиопатии»). Заболевание обычно называют наследственным, но зачастую в том же самом тексте сообщается, что генетический фактор прослеживается менее чем в половине случаев. Эпидемиологические данные неполны и неточны, аритмогенная кардиомиопатия ПЖ отнесена к редким болезням, но при этом является второй по частоте причиной внезапной сердечной смерти в молодом возрасте.
Причины
Какая бы из этих гипотез ни подтвердилась дальнейшими исследованиями, лежащие в ее основе причины, патогенетические механизмы, закономерности также необходимо будет еще найти и аргументировать.
Симптоматика
Выше показано, что АДПЖ считается болезнью преимущественно молодого возраста. Это так и есть, хотя возрастной интервал учтенных различными исследованиями больных простирается, строго говоря, от 2 до 70 лет; на долю допубертатной и пожилой (старше 50 лет) категорий приходится в общей сложности около 8% всего объема выявляемой аритмогенной дисплазии ПЖ. Клиническая картина неспецифична и может включать признаки любых других аритмий; наиболее частыми симптомами являются усиленное сердцебиение, ощущение «сбоев» в работе миокарда, чувство нехватки воздуха, сердечные боли, синкопальные обмороки, головокружения, утомляемость, постепенное снижение выносливости к физическим нагрузкам и т.д. Риск внезапной смерти (см. выше), которая при АДПЖ наступает от фибрилляции желудочков, после сорока лет снижается.
Во многих случаях аритмогенная дисплазия ПЖ в течение длительного времени протекает бессимптомно, однако процесс структурного перерождения ткани неостановим; в той или иной степени он прогрессирует, пусть даже латентно.
Диагностика
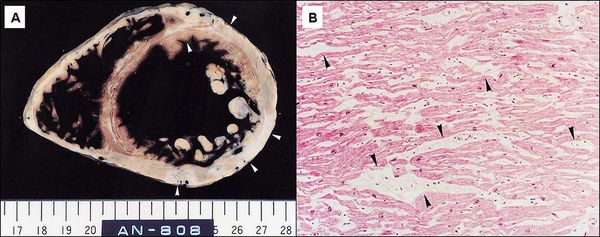
Аритмогенная кардиомиопатия правого желудочка сложна в диагностике и дифференциации от других кардиологических заболеваний, особенно на ранних стадиях развития. Неоднократно предпринимались попытки разработать четкие критерии клинической, электрофизиологической, патоморфологической диагностики. Сегодня применяются, в целом, достаточно информативные диагностические протоколы, опирающиеся на анамнестические сведения (включая семейный анамнез), данные осмотра, а также результаты ЭКГ, ЭхоКГ, тредмил-тестов, суточного мониторирования. По мере необходимости назначают обзорные и специальные рентгенографические методы, МРТ; иногда решающие аргументы удается получить только путем инвазивной диагностической процедуры – эндомиокардиальной биопсии (ЭМБ), позволяющей отобрать прижизненные образцы ткани ПЖ для гистологического анализа. Согласно современным представлениям, для уверенной диагностики АДПЖ в биоптате должно присутствовать не менее 3-5% соединительной ткани и не менее 40% жировой; другие критерии базируются, наоборот, на сокращении доли интактных кардиомиоцитов до 60% и ниже.
В значительной части случаев аритмогенная кардиомиопатия правого желудочка остается недиагностированной, что является одной из причин статистической неопределенности.
Лечение
Первоочередной задачей является снижение риска внезапной сердечной смерти и профилактика аритмий. В консервативных терапевтических схемах применяют антиаритмические препараты (в основном, стандартные бета-адреноблокаторы), иногда в сочетании с другими медикаментами, однако эффективность подобных мер в плане решения упомянутых профилактических задач пока недостаточно исследована. Обязательной является коррекция образа жизни, в частности, исключение экстремальных физических нагрузок и других факторов, могущих спровоцировать острые нарушения сердечной деятельности. Накапливается и изучается опыт применения радиочастотной катетерной абляции. Некоторые авторы рекомендуют методом выбора считать хирургическое вмешательство, – вплоть до пересадки сердца, – однако другие обоснованно возражают, что даже имплантация кардиовертера-дефибриллятора (что представляется наиболее адекватным решением), из-за определенного риска постоперационных осложнений едва ли целесообразна в тех случаях, когда АДПЖ протекает бессимптомно или малосимптомно. Однако к имплантации КД необходимо прибегать при наличии прогностически неблагоприятных признаков (например, эпизодов необъяснимой и внешне беспричинной потери сознания).
По индивидуальным показаниям назначают диуретики, ингибиторы АТФ, сердечные гликозиды и т.д.
В целом, для современной кардиологии проблема АДПЖ остается достаточно острой, актуальной, требующей по возможности быстрого прояснения всех накопившихся вопросов.
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений и постепенно прогрессирующим течением с высоким риском развития жизнеугрожающих аритмий и внезапной смерти.
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов.
При ГКМП происходит массивная гипертрофия миокарда левого (и реже правого желудочка), чаще асимметричного характера за счет утолщения межжелудочковой перегородки, часто с развитием обструкции выходного тракта левого желудочка (ЛЖ) при отсутствии каких-либо явных причин.
Общепризнанной является представление о преимущественно наследственной природе ГКМП. В связи с этим, широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми, при этом основной тип наследования – аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
Гипертрофическая кардиомиопатия – это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений.
Возможны три гемодинамических варианта обструктивной ГКМП:
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой.
Повышение диастолического давления в левом желудочке из-за диастолической дисфункции, динамическая обструкция выносящего тракта левого желудочка проявляются одышкой в покое и при физической нагрузке, утомляемости, слабости. Нарастание давления в малом круге кровообращения сопровождается развитием острой левожелудочковой недостаточности (чаще в ночные часы – сердечная астма, альвеолярный отек легких).
Падение фракции выброса при физической нагрузке или нарушениях сердечного ритма сопровождается ухудшением кровообращения головного мозга. Преходящая ишемия мозговых структур проявляется кратковременной потерей сознания (обморок) или предобморочными состояниями (внезапная слабость, головокружение, потемнение в глазах, шум и «заложенность» в ушах).
Методы исследования:
ЭХО-КГ – основной метод диагностики ГКМП. Критериями диагностики ГКМП на основании данных ЭХО-КГ являются:
Если в покое обструкции выносящего тракта левого желудочка нет, ее можно спровоцировать медикаментозными (ингаляция амилнитрита, введение изопреналина, добутамина) или функциональными пробами (проба Вальсальвы, физическая нагрузка), которые уменьшают преднагрузку или повышают сократимость левого желудочка.
Катетеризация сердца и коронарная ангиография проводятся для оценки коронарного русла перед миоэктомией или операцией на митральном клапане, а также чтобы выяснить причину ишемии миокарда. При этом к характерным признакам ГКМП относят:
Сцинтиграфия миокарда и позитронно-эмиссионная томография
При гипертрофической кардиомиопатии сцинтиграфия миокарда имеет некоторые особенности, однако в целом ее значение в диагностике ишемии такое же, как и обычно. Стойкие дефекты накопления указывают на рубцовые изменения после инфаркта миокарда, обычно они сопровождаются снижением функции левого желудочка и плохой переносимостью физической нагрузки. Обратимые дефекты накопления указывают на ишемию, вызванную снижением коронарного резерва при нормальных артериях или коронарным атеросклерозом. Обратимые дефекты часто никак не проявляются, однако, по-видимому, они повышают риск внезапной смерти, особенно у молодых больных с гипертрофической кардиомиопатией. При изотопной вентрикулографии можно выявить замедленное наполнение левого желудочка и удлинение периода изоволюмического расслабления.
Позитронно-эмиссионная томография – более чувствительный метод, кроме того, она позволяет учесть и устранить помехи, связанные с затуханием сигнала. Позитронно-эмиссионная томография с фтордезоксиглюкозой подтверждает наличие субэндокарлиальной ишемии, вызванной снижением коронарного резерва.
Современные подходы к лечению ГКМП
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза.
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск внезапной смерти (в частности, скрытых, прогностически значимых аритмий).
Общие мероприятия
Ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска внезапной смерти.
Медикаментозное лечение
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью внезапной смерти. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов. Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид (антиаритмический препарат IA класса) и амиодарон.
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
Инвазивные методы лечения:
1. Чрезаортальная септальная миэктомия
2. Вальвулопластики или протезирования митрального клапана
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты миэктомии позволяет последующая длительная терапия верапамилом, обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
3. Иссечения межжелудочковой перегородки
В настоящее время разработаны и успешно применяются отличные от классической миэктомии методики. В частности, в НЦССХ им. А. Н. Бакулева под руководством академика Л. А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части правого желудочка. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
4. Транскатетерная септальная аблация
Другим альтернативным методом лечения рефракторной обструктивной ГКМП является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающей от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматике заболевания.
В Волынской больнице отработана методика выполнения транскатетерной септальной аблации при ГКМП. Доказан положительный результат данного вмешательства при относительно низком риске развития осложнений.
Гипертрофия правого желудочка
Гипертрофия миокарда правого желудочка представляет собой больше физиологические отклонения, нежели какую-то конкретную болезнь. Физиологический недуг проявляется под воздействием прогрессивного роста сердечных клеток мышц и также кардиомитоцитов. Болезнь очень часто возникает в результате опасных заболеваний органов сердца и сосудов системы дыхания организма человека.
Главным органом, отвечающим за циркуляцию крови считается четырехкамерный орган сердца, которое у человека состоит из желудочка (2 шт.) и предсердия (2 шт.). Желудочек с правой стороны отвечает за циркуляцию крови в малом круге, а также создает в соединении с правосторонним предсердием треугольный вид. Кровь из вены перетекает от органа предсердия внутрь желудочка сквозь створки клапанов, затем перетекает через легочный клапан, продолжая протекать по артериям.
На прогрессивный рост заболевания влияют патологические состояния желудочков, по мнению медицинских специалистов. Определенные патологии несут значительные риски для жизнедеятельности пациентов. Данная патология отвечает за образование врожденных пороков человека. На развитие заболевания отвечают заболевания гипертрофии, стеноза, инфаркта, блокады правых желудочков, зачастую симптомокомплекс выражен слабо и не ярко.
Причины
Признаки гипертрофии правого желудочка встречаются у пациентов самого разного возраста, но причины патологии не у всех одинаковы. У новорожденных болезнь развивается чаще всего потому, что в первые дни жизни основная нагрузка приходится на правую сторону сердца. А у старших детей и взрослых этиология практически одинакова. Гипертрофия может затрагивать один из желудочков либо оба. Если появляется в обеих камерах, сердце может достигать невероятных размеров. Данное состояние носит название «бычьего сердца».
Симптоматика
Гипертрофия правого желудочка в начале своего роста симптомов не имеет. Позже, по мере увеличения мышц и развития патологии, могут появиться признаки сердечной недостаточности либо легочной гипертензии. Однако часто симптомов мало либо нет вовсе, даже когда одна из камер органа начинает увеличиваться.
Прежде всего, пациента беспокоят признаки основной болезни, которая и становится впоследствии причиной гипертрофии правого желудочка.
Обратить усиленное внимание на свое здоровье нужно при следующих симптомах:
Особенности гипертрофии у детей
Так как патология у детей часто развивается вследствие порока сердца, обращают на себя внимание следующие симптомы:
Диагностика
Для правильной диагностики гипертрофии правого желудочка и проведения лечения необходимо провести ряд обследований. Вначале проводится подробный опрос больного на предмет жалоб (собирается анамнез). После стетоскопом прослушивается сердце (ритм, шумы), назначаются анализы и исследования. Выясняется, чем в данный момент болеет пациент.
По результатам ЭКГ специалист в состоянии определить отклонения в работе сердца и поставить диагноз. Однако в самом начале развития гипертрофии ЭКГ может и не проявить каких-либо отклонений – в этом случае врач назначит другие обследования, которые покажут картину состояния более детально.
При диагностике заболевания и сопутствующих патологий берется во внимание наследственная предрасположенность пациента, его род деятельности, увлечения, образ жизни и привычки (спорт, курение, избыточный вес, пьянство).