Ацетат натрия что это
Ацетат натрия
| Ацетат натрия | |
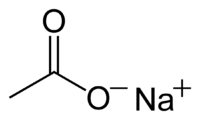 | |
| Общие | |
|---|---|
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Химическая формула | CH3COONa |
| Эмпирическая формула | C2H3O2Na |
| Физические свойства | |
| Состояние (ст. усл.) | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура разложения | 324 °C |
| Удельная теплота плавления | 264—289 к Дж/кг |
| Химические свойства | |
| Растворимость в воде | 76 г/100 мл |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, производится и широко применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
На этом свойстве основан довольно красивый опыт — «горячий лёд»
Способы получения
Ацетат натрия недорог и его легче приобрести в хим. магазинах, чем синтезировать в лабораторных условиях. В лабораторных условиях получается при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 грамма гидрокарбоната натрия реагируют с 750 граммами 8 % винного уксуса (или же с 86 граммами 70 % уксусной эссенции) с образованием 82 грамм ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия или его концентрированный раствор.
Характерные реакции
Ацетат натрия может быть использован для образования эфира с алкил галогенидами такими как бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
Одновременно может проходить разложение до оксида натрия, ацетона и диоксида углерода:
Галерея
Химический обогреватель, содержащий перенасыщенный раствор ацетата натрия, выделяющего тепло при фазовом переходе в кристаллическую форму тригидрата ацетата натрия.
Натрия Ацетат
Химическое название
Натриевая соль уксусной кислоты, натрия этаноат.
Химические свойства
Белый гигроскопичный мелкий порошок, растворимый в воде. Разлагается при 324 градусах Цельсия. Молекулярная масса = 82 грамма на моль для безводной формы, 136,1 грамм на моль – для тригидрата. Формула Натрия Ацетата: CH3COONa; рацемическая формула: C2H3O2Na; формула тригидрата: C2H3O2Na х 3H2O.
Химические свойства
Вещество можно получить с помощью реакции уксусной кислоты с карбонатом или гидрокарбонатом натрия, с NaOH. В домашних условиях — это реакция винного уксуса с пищевой содой, к 1 грамму соды добавляют 9 грамм уксуса.
Реакция электролиза Ацетата Натрия. Во время превращения происходит диссоциация CH3COONa до CH3COO- и Na+. У анода выделяется этан и углекислый газ. Далее углекислый газ вступает в реакцию с гидроксидом бария или натрия (NaOH), во втором случаев пробирке останется чистый этан.
Достаточно популярна в химии реакция гидролиза Ацетата Натрия. Для наглядности, образованную слабой к-ой и сильным основанием соль, смешивают с индикатором-фенолфталеином. Смесь нагревают, при этом соль частично плавится и в расплаве появляются гидроксид-ионы. Затем пробирку охлаждают, соль кристаллизуется, и смесь утрачивает фиолетовую окраску. Соединение также реагирует с алкилгалогенидами, бромэтаном с образованием сложных эфиров.
Качественная реакция на Ацетат Натрия проводится в два этапа. Сначала определяют наличие в соединении ионов Na, а затем – кислотного ацетат-остатка. Натрий будет гореть ярко желтым пламенем, если небольшое количество раствора (или сухого вещ-ва) внести в пламя спиртовой горелки. Качественную реакцию на ацетат ион можно провести с помощью любой растворимой соли трехвалентного железа. Раствор станет красно-коричневого цвета, а при нагревании выпадет темно-коричневый осадок Fe(OH)3.
Химическое соединение используют при производстве текстиля; в качестве фоторезиста после применения анилиновых красителей; при вулканизации и в кожевенном производстве. Вещество получило широкое применение в виде пищевой добавки E262, используется в качестве консерванта; его применяют для сохранения стабильного рН в биохимии. Соединение используют при производстве химических обогревателей и грелок, («горячий лёд»). В медицине также используют тригидрат Натрия Ацетата.
Фармакологическое действие
Восстанавливает водно-солевой баланс.
Фармакодинамика и фармакокинетика
Натрия Ацетат применяют в комбинации с другими хим. соединениями. Вещество используют для дезинтоксикации и регидратации. Средство обладает способностью восстанавливать водный и электролитный баланс во время обезвоживания. Стимулирует диурез и предотвращает развитие метаболического ацидоза. Обладает дезинтоксикационным, регидратирующим и плазмозамещающим действием.
Показания к применению
Применяется при регидратации, интоксикации, гиперкалиемии, обезвоживании у пациентов с пищевыми инфекциями, холерой, острой дизентерией и так далее.
Противопоказания
Побочные действия
Редко при применении растворов для внутривенного введения с данным лекарственным средством возникает отечность, тахикардия, озноб.
Инструкция по применению (Способ и дозировка)
Натрия Ацетат в составе различных препаратов для внутривенного введения применяется в условиях стационара, под контролем лабораторных показателей. Растворы вводят струйно или капельно. Дозировка зависит от состояния пациента и тяжести состояния. Как правило, если пациент находится в тяжелом состоянии, то сначала вводят лекарство струйно, затем переходят на инфузии.
Передозировка
Нет сведений о передозировке средством.
Взаимодействие
Вещество часто применяют в комбинации с другими электролитами.
Ацетат Натрия можно сочетать с натрия хлоридом и натрием фумаровокислым, при этом необходимо визуально следить за совместимостью растворов.
Условия продажи
Может потребоваться рецепт.
Особые указания
Лечение препаратом проводят под контролем уровня электролитов крови и гематокрита.
Список опасных и безопасных Е-кодов продуктов питания
Вредны ли эти добавки? Специалисты-пищевики считают, что буква «Е» не так страшна, как ее малюют: применение добавок разрешено во многих странах, большинство из них не дает побочных эффектов. Но у медиков часто иное мнение.
Но медики все же настаивают на таком выводе: даже те пищевые добавки, которые производятся из натурального сырья, все же проходят глубокую химическую обработку. А поэтому последствия, сами понимаете, могут быть неоднозначными. Так что лучше есть то, что выращено своими руками без всяких химикатов и сохранено без консервантов. Жаль только, что не все мы садоводы и огородники.
Пищевые добавки, запрещенные к применению в РФ:
Пищевые добавки, не разрешенные к применению в РФ:
E103, E107, E125, E127, E128, E140, E153-155, E160d, E160f, E166, E173-175, E180, E182, E209, E213-219, E225-228, E230-233, E237, E238, E241, E252, E253, E264, E281-283, E302, E303, E305, E308-314, E317, E318, E323-325, E328, E329, E343-345, E349, E350-352, E355-357, E359, E365-368, E370, E375, E381, E384, E387-390, E399, E403, E408, E409, E418, E419, E429-436, E441-444, E446, E462, E463, E465, E467, E474, E476-480, E482-489, E491-496, E505, E512, E519-523, E535, E537, E538, E541, E542, E550, E552, E554-557, E559, E560, E574, E576, E577, E579, E580, E622-625, E628, E629, E632-635, E640, E641, E906, E908-911, E913, E916-919, E922-926, E929, E942-946, E957, E959, E1000, E1001, E1105, E1503, E1521.
Некоторые характеристики других пищевых добавок:опасны E110, E123, E127, E129, E150, E151, E173-175, E210, E212, E216-219, E227, E228, E235, E242, E339-341, E400-403, E450-452, E521-523, E541-556, E559, E574-579, E620-625, E900, E912, E951, E954, E965, E967, E999, E1200-1202
сомнительны E102, E104, E120, E122, E124, E141, E150, E161, E173, E180, E241
канцерогены E131, E142, E210-217, E239
разрушают витамин B12 E220
нарушают деятельность желудочно-кишечного тракта E221-226
нарушают функцию кожи E230, E231, E233
вызывают сыпь E311, E312
содержат много холестерина E320, E321
нарушают пищеварение E338, E340, E341, E407, E450, E461-463, E466, E468
Перечень химических обозначений пищевых добавок в алфавитном порядке:
Классификация пищевых добавок:
ААгар-агар, 1)РК РЖ E406
Адипаты натрия E356
Адипаты калия Е357
Адипиновая кислота E355
Азорубин, кармазин С E122
Аллура красная AC О E129
Алюминий (порошкоподобный)О E173
Алюмосиликат О Е559
Алюмосиликат кальция О Е556
Алюмосиликат калия О E555
Алюмосиликат натрия О E554
Алюмофосфат натрия О Е541
Альгинат амония О E403
Альгинат калия О E402
Альгинат кальция О E404
Альгинат натрия E401
Альгинова кислота О E400
Амарант ОР Ведет к накоплению извести в почках! E123
Аннато, биксин, норбиксин E160b
Аскорбат кальция E302
Аскорбат натрия E301
Аскорбинова кислота E300
Аспартам 2)ОО ГМ E951
Ацесульфам калия E950
Ацетаты калия E261
Ацетаты кальция E263
Ацетаты натрия E262
Ацетилированый дикрахмаладипат E1422
Ацетилированый дикрахмалфосфат E1414
Ацетилированый крахмал E1420
Ацетатизобутират сахарозы Е444
1) Натуральное, растительное желирующее вещество из красных водорослей. Неудобоваримое. Препятствует усвоению минеральных веществ организмом. В больших дозах оказывает слабительный эффект.
ББензоат калия ОС E212
Бензоат кальция E213
Бензоат натрия ОС E211
Бензойна кислота ОС E210
Бета-апо-8′-каротинал (C 30) E160e
Бета-апо-8′-каротиновой кислоты (C 30) этиловый эфир E160f
Бифенил, дифенил ВК E230
Борная кислота E284
Бутилгидроксианизол (BHA) РС Х E320
Бутилгидрокситолуол, ионол (BHT) С Х E321
ВВинная кислота (L(+)-винная кислота) E334
Воск канделильский E902
Воск карнаубский E903
Воск оксидированый полиэтиленовый E914
Воск пчелиный, белый и желтый E901
Гваяковая смола Е314
Гидроксид амония E527
Гидроксид калия E525
Гидроксид кальция E526
Гидроксид магния E528
Гидроксид натрия E524
Гидросульфит калия E228
Глутамат магния О E625
Глутаминова кислота О E620
Глутамат натрия I-замещенный О Е621
Глутамат калия I-замещенный О Е622
Глутамат аммония I-замещенный О Е624
Гуанилат кальция E629
Гуаниловая кислота E626
Гуарова камедь С E412
2) Искусственное вещество, производится из аммониака и формальдегида. В Западной Европе допущен только в сырах Provalone. Применяется в лекарственных препаратах, для дезинфекции кожи и мочевыводящих путей, а также в качестве консерванта в косметике
Динатрий 5′-рибонуклеотид E635
Дифенил С О 3) Е230
Диметилдикарбонат О Е242
Диоксид кремния аморфный (кремневая кислота) Е551
Двуокись углерода E290
Двуокись кремния E551
Двуокись титана E171
Додецилгалат С E312
3) Разрешен, как консервант против плесени и грибков для обработки кожуры цитрусовых, может быть перенесен пальцами на мякоть самого фрукта. Рекомендуется, после чистки, тщательно вымыть руки. У животных в больших дозах вызывает внутреннее кровотечение и изменения органов.
ЖЖирные кислоты E 570
ИИзоаскорбинат натрия Е316
Изоаскорбиновая (эриторбовая) кислота Е315
Инозиновая кислота Е630
KКамедь рожкового дерева С E410
Камедь карайи О Е416
Камедь гваяковая П Е241
Камедь ксантановая Е415
Камедь тары С Е417
Камедь геллановая Е418
Каррагинан О РК Е407
Карбамид (мочевина) Е927b
Краситель синий блестящий E133
Краситель черный ВК E151
Краситель пищевой оранжево-желтый ‘солнечный закат’ ОС E110
Краситель пищевой зеленый-S E142
Краситель пищевой ‘золото’ Е175
Краситель пищевой ‘индиго-кармин’ Е132
Краситель пищевой куркумин Е100
Краситель пищевой рибофлави Е101
Краситель пищевой тартразин ОС Е102
Краситель пищевой алканет (алканин) Е103
Краситель пищевой желтый хинолиновый С Е104
Краситель пищевой кармин (из насекомых щитовок!) C Е120
Краситель пищевой азорубин (кармуазин) С Е122
Краситель пищевой амарант С Е123
Краситель пищевой пунцовый С Е124
Краситель пищевой красный С Е128
Краситель пищевой красный ‘очаровательный’ (аллура) С Е129
Краситель пищевой синий патентованный Е131
Краситель пищевой индигокармин Е132
Краситель пищевой синий блестящий Е133
Краситель пищевой хлорофилл Е140
Краситель пищевой медные комплексы хлорофиллов Е141
Краситель пищевой зеленый S Е142
Краситель пищевой cахарные колеры простые Е150a
Краситель пищевой cахарные колеры сульфитные Е150b
Краситель пищевой cахарные колеры аммония О Е150с
Краситель пищевой cахарные колеры аммоний-сульфитные О Е150d
Краситель пищевой черный блестящий О Е151
Краситель пищевой уголь растительный Е153
Краситель пищевой коричневый FK С Е154
Краситель пищевой коричневый HT С Е155
Краситель пищевой каротины Е160a
Краситель пищевой экстракты аннато Е160b
Краситель пищевой маслосмолы паприки Е160c
Краситель пищевой ликопин Е160d
Краситель пищевой бета-апокаротиновый альдегид Е160e
Краситель пищевой эфиры бета-апо-8′-каротиновый кислоты Е160f
Краситель пищевой флавоксантин Е161b
Краситель пищевой красный свекольный Е162
Краситель пищевой антоцианы Е163
Краситель пищевой углекислые соли кальция Е170
Краситель пищевой титана диоксид Е171
Краситель пищевой окиси железа Е172
Краситель пищевой алюминий О Е173
Краситель пищевой серебро О Е174
Краситель пищевой золото О Е175
Краситель пищевой литолрубин BK С Е180
Концентрат токоферолов Е306
Краситель из паприки, капсантин, капсорубин E160c
Карбонаты натрия Е500
Карбонаты калия Е501
Карбонаты аммония Е503
Карбонаты магния Е504
Квасцы алюмо-натриевые О Е521
Квасцы алюмо-калиевые О Е522
Квасцы алюмо-аммиачные О Е523
ЛЛецитины, фосфатиды Е322
Лактат натрия Е325
Лактат кальция Е327
Лактат аммония Е328
Лимонная кислота Е330
Лактилаты натрия Е481
Лактилаты кальция Е482
ММуравьиная кислота Е236
Молочная кислота Е270
Малат аммония Е349
Малаты натрия Е350
Малаты кальция Е352
Мета-винная кислота Е353
Моно- и диглицериды жирных кислот Е471
Нитрит калия О Е249
Нитрат натрия О Е251
Нитрат натрия О Е252
ООрто-фенилфенол ВК О Е231
Орто-фенилфенола натриевая соль О Е232
Октилгаллат С О Е311
Орто-фосфорная кислота О РК Е338
Оксид кальция Е529
Пропионовая кислота О Е280
Пропионат натрия О Е281
Пропионат кальция О Е282
Пропионат калия О Е283
Пропилгаллат О Е310
Боровая кислота О Е284
Полиоксиэтиленсорбитан тристеарат О Е436
Пирофосфаты О Е450
Полифосфаты О Е452
Полидиметисилоксан О Е900
Полидекстрозы О Е1200
РРибонуклеотиды-5′ кальция Е 634
Сорбиновая кислота Е200
Сорбат натрия Е203
Сорбит и сорбитовый сироп Е420
Соли жирных кислот Е470
Сорбитанмоностеарат О Е491
Сорбитантристеарат О Е492
Сорбитанмонолаурат, СПЭН 20 О Е493
Сорбитанмоноолеат, СПЭН 80 О Е494
Сорбитанмонопальмитат, СПЭН 40 О Е495
Сорбитантриолеат, СПЭН 85 О Е496
Соляная кислота Е507
Серная кислота О Е513
Сульфаты натрия Е514
Сульфаты калия Е515
Сульфаты кальция Е516
Сульфаты аммония Е517
Сульфат алюминия О Е520
TТиабендазол ВК О Е233
Тартраты натрия Е335
Тартраты калия Е336
Тартраты калия-натрия Е337
Тартрат кальция Е354
Твин (полисорбат 20) О Е432
Твин (полисорбат 80) О Е433
Твин (полисорбат 40) О Е434
Твин (полисорбат 60) О Е435
Тиосульфат натрия Е539
УУголь растительный E153
Уксусная кислота ледяная Е260
Углерода диоксид Е290
ФФумаровая кислота Е297
Фосфаты натрия О Е339
Фосфаты калия О РК Е340
Фосфаты кальция О РК Е341
Фосфаты аммония Е342
Фосфаты аммония О Е343
Ферроцианид натрия Е535
Ферроцианид калия Е536
Ферроцианид кальция Е538
ХХлорид калия Е508
Хлорид кальция Е509
Хлорид аммония Е510
Хлорид магния Е511
ЦЦитраты натрия Е331
Цитраты калия Е332
Цитраты кальция Е333
Цитрат магния Е345
Цитраты аммония Е380
Цикламовая кислота и ее соли О Е952
Эфиры глицерина и смоляных кислот E445
(c) Федеральное бюджетное учреждение здравоохранения «Центр гигиены и эпидемиологии в Рязанской области», 2006-2021 г.
Адрес: 390046, Рязанская область, город Рязань, ул. Свободы, дом 89
Ацетат натрия: свойства, применение, вред
Ацетат натрия (натрия этаноат, натрий уксуснокислый) – это натриевая соль этановой кислоты, вещество, активно производимое и применяемое в пром. масштабах. На вид – твердая рассыпчатая масса белого цвета (возможно, с желтоватым или коричневатым оттенком, зависимо от наличия в составе примесей). Часто используется в пищепроме в качестве добавки к пище, консерванта Е262. Но окрашенный продукт подходит только для промышленных задач.
Получение
Промышленный синтез выглядит как сухая перегонка древесины. На самом же деле, большинство из нас хоть раз в жизни тоже производило данное вещество на собственной кухне. Каким образом? Гася для приготовления теста питьевую соду уксусом! В результате такой реакции формируются этаноат натрия и угольная кислота. Последняя очень нестойкая и почти сразу превращается в воду и углекислый газ. Так что получение водного раствора ацетата натрия – это ничто иное, как реакция между этановой кислотой и хорошо известной каждой хозяйке пищевой содой. Чтобы получить материал в твердой форме, необходимо дополнительно осуществить выпаривание раствора.
Свойства
Это кристаллический продукт без вкуса и запаха (или с легким запахом уксусной кислоты). Хорошему растворению поддается в воде (76 г/100 мл), с образованием раствора, а вот в спиртах и эфирах растворение слабое. Характеризуется гигроскопичностью. К горючим веществам не принадлежит. Степень токсичности – низкая.
К слову, так как данная соль вступает в реакцию с водой, для ее перевозки и хранения необходимо использовать упаковку, дополненную изнутри полиэтиленовой подкладкой, с отметкой «Беречь от влаги». Вообще это могут быть текстильные пищевые мешки, гофрокартонные ящики, пакеты, состоящие из многих слоев бумаги, а также бочки и контейнеры.
Примечательно, что натрия этаноат широко распространен в естественной среде (похвалиться этим могут далеко не все пищевые добавки). Он присутствует в составе растительных и животных клеток. Как и природные кислоты, есть в преимущественном количестве фруктов. Кроме того, формируется в ходе бактериальной ферментации, как результат, является постоянным ингредиентом всей кисломолочки (кефира, простокваши, сливок и др.).
Рассматриваемому продукту свойственно еще одно название – «горячий лед». Объясняется оно тем, что в ходе кристаллизации происходит выделение обильного количества тепла.
Молярная масса – 82,03 и 136,08 г/моль (в безводном состоянии и в форме тригидрата, соответственно), плотность – 1,45 г/см³, t разложения – 324 °C, pH водного раствора – 8-9,5. Количество основного компонента – 98,5 %. Формула: C2H3O2Na.
Применение
Ацетат натрия – доступный и безвредный для людей и окружающей среды материал с большим спектром применения, что объясняется вышеупомянутыми химическими свойствами. Главное из направлений – производство пищевых продуктов.
Значение Е262 для пищепрома. Здесь эту добавку ценят, прежде всего, за способность регулировать уровень кислотности химической среды, выступать отменным консервантом, ароматизатором и стабилизатором. В ее функциональных обязанностях – сохранность вкусо-ароматических характеристик, формы и текстуры, а также улучшение консистенции продуктов. Следовательно, есть ряд продуктов, производство которых на сегодняшний день без нее практически не обходится.
Уксуснокислый натрий наиболее часто вводят в муку с целью предотвращения «картофельной болезни» хлеба (прежде всего пшеничного с низкой кислотностью) и хлебобулочных изделий, которую провоцируют формирующие споры бактерии, очень распространенные в природных условиях. Популярно совместное применение с кальция ацетатом.
В овощных и фруктовых консервах он призван смягчать избыточно острый вкус этановой кислоты, нивелировать резкость запаха. С его участием часто производят чипсы, сухарики и аналогичные продукты, чтобы сделать их вкус и запах более приятными, пикантными, немного уксусными. Также Е262 можно встретить в майонезе, бульонных кубиках и сублимированных продуктах (к примеру, в супах быстрой готовки).
Этаноат натрия разрешен к применению в пищепроме во всей Европе, США и в Украине. В виду низкотоксичности, считается, что данная пищевая добавка может употребляться здоровым человеком вместе с пищей в неограниченных объемах. Поэтому даже максимальные суточные дозы потребления не везде нормированы.
Другие сферы применения:
— химия. Находит место при создании красителей и разноплановых химических соединений (в частности, хлористого ацетила, ангидрида и винилового эфира уксусной кислоты). Также выступает катализатором поликонденсации;
— биохимия. Здесь, а именно в pH-зависимых реакциях, очень важна способность данного реактива выступать буфером, сохраняющим сравнительно постоянный pH;
— медицина. Эту субстанцию можно встретить в составе некоторых мочегонных препаратов, заживляющих раны, антисептических мазей и лекарств иного назначения. Кроме того, оно служит ощелачивателем при метаболическом ацидозе и низком уровне натрия в крови. А способность легкого растворения объясняет ее использование в качестве ингредиента инъекционных составов против воспалений и для обезболивания;
— изготовление гигиенических средств, прежде всего мыла;
— текстильная и кожевенная отрасли. Служит фоторезистом (полимерным светочувствительным материалом) при задействовании анилиновых красителей. В качестве протравы принимает участие в покраске текстиля и кожедублении хромовыми солями;
— резиновое и каучуковое направление. Тормозит вулканизацию хлорбутадиена при изготовлении искусственной резины;
— аграрный комплекс. Задействуется в роли добавки-консерванта, призванной сохранять фуражное зерно и зеленые корма. Также повышает количество удоев и привес рогатого скота. А у птиц увеличивает яйценоскость;
— строительство. Создает антиморозный эффект для бетона (любой вид бетона, благодаря ему, становится более устойчивым к пониженным температурам). Применяется при сооружении конструкций-монолитов, бетонных и ЖБ зданий из легких и мелкозернистых бетонов. Отлично зарекомендовал себя при реализации кладки из камня тогда, когда работы проводятся при низкой t окружающей среды. А еще ему под силу препятствовать промерзанию бетоносмесей при перевозке, укладывании и утрамбовке;
— гальванотехника. Служит электролитом и буферным раствором;
— фотодело. Входит в структуру кислых закрепляющих композиций для фото;
— сохранность экологии. Нейтрализует отработанную H2SO4 (серную кислоту) в стоках;
— быт. Используется в создании химических грелок и обогревателей, как важный элемент популярной совокупности «горячий лед». Обусловлено такое применение способностью этого вещества нагреваться до весьма значительных температур. Кристаллизуясь, натрия ацетат выделяет тепло (экзотермическая реакция). Нагрев его тригидрата с t плавления 58 °C до температуры 100 °C (например, путем размещения емкости с данным соединением в кипящей воде) приводит к расплавлению (или, если сказать точнее, к растворению в своей же кристаллизационной воде) с превращением в водный раствор ацетата натрия. Охлаждаясь, этот раствор становится перенасыщенным. Его переохлаждение к комнатной t происходит отменно, с минованием появления твердой фазы. Надавливание на диск из металла, находящийся в емкости, приводит к возникновению кристаллизационного центра, который увеличивается и переводит перенасыщенный р-вор в твердую фазу тригидрата натрия этаноата. Количество тепла, которое возникает – 264-289 кДж/кг.
Описанная реакция, кстати, лежит в основе интересного химического опыта с одноименным названием «горячий лед».
В целом, использование в той или иной отрасли находит один из двух видов выпускаемого промышленностью ацетата натрия: пищевой или технический.
Вред
Выше было упомянуто, что данному материалу характерно незначительное токсичное воздействие. Обратите внимание: незначительное, а не полное его отсутствие. Определенное пагубное влияние на здоровье и самочувствие все же возможно (при поступлении увеличенных доз и регулярности потребления). И по разным данным вред определяется от крайне малого уровня до среднего.
Так, попадая в кишечник (всасывается организмом при проглатывании), этот продукт может трансформироваться в крайне ядовитые нитраты с канцерогенным воздействием. Считается, что избыточное поступление натрия уксуснокислого в организм чревато повышением риска появления онкообразований и мощных аллергий. Но официального научного подтверждения этому нет, поэтому данную добавку не зачислено к онкогенным или опасным.
Также значительные количества могут стать причиной интоксикаций, сопровождающихся следующими признаками: головные боли и головокружения, резкие болевые ощущения в животе, побледнение кожи и слизистых, судороги, координационные нарушения, утрудненное дыхание, обмороки.
Употребление продуктов, содержащих ацетат натрия, стоит ограничить тем, кто не понаслышке знает, что такое ВСД, гипертоническая болезнь, дисбиоз, недуги мочевых путей, кишечника, желчного пузыря, печени, сердца и сосудов.
В пищевую продукцию, предназначенную для детей, эту добавку вводить нельзя. Родителям, переживающим, чтобы у ребенка не возникла аллергия, лучше не давать ему еду с Е262.
С одной стороны, мировое сообщество на сегодняшний день не установило максимальных суточных доз ацетата натрия, разрешенных к применению, считая его вполне безопасным. С другой стороны, ряд негативов и ограничений есть, а изучения в этом направлении продолжаются и некоторые данные не могут пока считаться абсолютно истинными. Поэтому каждый – будь то производитель, или потребитель – должен ответственно подходить к применению указанной добавки. Без страха, но с осознанием того, что в чрезмерных количествах к добру не приводит ничто. Соблюдайте золотую середину – и все будет хорошо.