Ацетат натрия для чего
Ацетат натрия
| Ацетат натрия | |
|---|---|
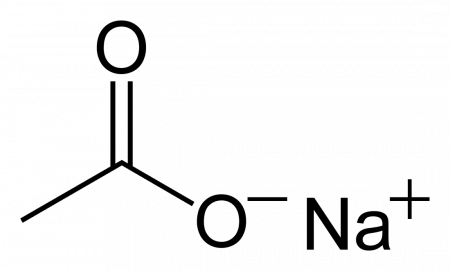 | |
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат натрий уксуснокислый |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES | |
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Токсичность | ирритант, малотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad ) или химических обогревателей (англ. Hand warmer ), применяется как составная часть смеси «горячего льда» (англ. «hot ice» ), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 г гидрокарбоната натрия реагируют с 750 г 8%-го винного уксуса (или же с 86 г 70%-й уксусной эссенции) с образованием 82 г ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия. Для получения тригидрата ацетата натрия без выпаривания необходимо смешать 84 г гидрокарбоната натрия (пищевой соды) с 86 г 70%-ной уксусной кислоты и 10 г воды.
Характерные реакции
Ацетат натрия может быть использован для образования сложного эфира по реакции с алкилгалогенидами, такими как, например, бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
2CH3COONa → Na2CO3 + (CH3)2CO
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.
Натрия Ацетат
Химическое название
Натриевая соль уксусной кислоты, натрия этаноат.
Химические свойства
Белый гигроскопичный мелкий порошок, растворимый в воде. Разлагается при 324 градусах Цельсия. Молекулярная масса = 82 грамма на моль для безводной формы, 136,1 грамм на моль – для тригидрата. Формула Натрия Ацетата: CH3COONa; рацемическая формула: C2H3O2Na; формула тригидрата: C2H3O2Na х 3H2O.
Химические свойства
Вещество можно получить с помощью реакции уксусной кислоты с карбонатом или гидрокарбонатом натрия, с NaOH. В домашних условиях — это реакция винного уксуса с пищевой содой, к 1 грамму соды добавляют 9 грамм уксуса.
Реакция электролиза Ацетата Натрия. Во время превращения происходит диссоциация CH3COONa до CH3COO- и Na+. У анода выделяется этан и углекислый газ. Далее углекислый газ вступает в реакцию с гидроксидом бария или натрия (NaOH), во втором случаев пробирке останется чистый этан.
Достаточно популярна в химии реакция гидролиза Ацетата Натрия. Для наглядности, образованную слабой к-ой и сильным основанием соль, смешивают с индикатором-фенолфталеином. Смесь нагревают, при этом соль частично плавится и в расплаве появляются гидроксид-ионы. Затем пробирку охлаждают, соль кристаллизуется, и смесь утрачивает фиолетовую окраску. Соединение также реагирует с алкилгалогенидами, бромэтаном с образованием сложных эфиров.
Качественная реакция на Ацетат Натрия проводится в два этапа. Сначала определяют наличие в соединении ионов Na, а затем – кислотного ацетат-остатка. Натрий будет гореть ярко желтым пламенем, если небольшое количество раствора (или сухого вещ-ва) внести в пламя спиртовой горелки. Качественную реакцию на ацетат ион можно провести с помощью любой растворимой соли трехвалентного железа. Раствор станет красно-коричневого цвета, а при нагревании выпадет темно-коричневый осадок Fe(OH)3.
Химическое соединение используют при производстве текстиля; в качестве фоторезиста после применения анилиновых красителей; при вулканизации и в кожевенном производстве. Вещество получило широкое применение в виде пищевой добавки E262, используется в качестве консерванта; его применяют для сохранения стабильного рН в биохимии. Соединение используют при производстве химических обогревателей и грелок, («горячий лёд»). В медицине также используют тригидрат Натрия Ацетата.
Фармакологическое действие
Восстанавливает водно-солевой баланс.
Фармакодинамика и фармакокинетика
Натрия Ацетат применяют в комбинации с другими хим. соединениями. Вещество используют для дезинтоксикации и регидратации. Средство обладает способностью восстанавливать водный и электролитный баланс во время обезвоживания. Стимулирует диурез и предотвращает развитие метаболического ацидоза. Обладает дезинтоксикационным, регидратирующим и плазмозамещающим действием.
Показания к применению
Применяется при регидратации, интоксикации, гиперкалиемии, обезвоживании у пациентов с пищевыми инфекциями, холерой, острой дизентерией и так далее.
Противопоказания
Побочные действия
Редко при применении растворов для внутривенного введения с данным лекарственным средством возникает отечность, тахикардия, озноб.
Инструкция по применению (Способ и дозировка)
Натрия Ацетат в составе различных препаратов для внутривенного введения применяется в условиях стационара, под контролем лабораторных показателей. Растворы вводят струйно или капельно. Дозировка зависит от состояния пациента и тяжести состояния. Как правило, если пациент находится в тяжелом состоянии, то сначала вводят лекарство струйно, затем переходят на инфузии.
Передозировка
Нет сведений о передозировке средством.
Взаимодействие
Вещество часто применяют в комбинации с другими электролитами.
Ацетат Натрия можно сочетать с натрия хлоридом и натрием фумаровокислым, при этом необходимо визуально следить за совместимостью растворов.
Условия продажи
Может потребоваться рецепт.
Особые указания
Лечение препаратом проводят под контролем уровня электролитов крови и гематокрита.
Ацетат натрия
Sodium acetate
Е262
Описание
Ацетат натрия, пищевая добавка Е262 – это натриевая соль уксусной кислоты. В пищевой промышленности добавка Е262 используется в качестве консерванта, регулятора кислотности и ароматизатора. В промышленном масштабе ацетаты натрия получают несколькими способами, например путем реакции карбонатов или гидроксидов натрия с уксусной кислотой.
Пищевая добавка Е262 представлена двумя соединениями: ацетат натрия ангидридный (безводный) Е262(i) и диацетат натрия Е262(ii). Одно из них является нормальной натриевой солью уксусной кислоты, а второе – ассоциат, состоящий из ацетата натрия и свободной уксусной кислоты.
Ацетат натрия широко встречается в природе, вещество входит в состав, как животных, так и растительных клеток. Большинство фруктов наравне с природными кислотами содержат в себе и ацетат натрия. Также образуется и в процессе бактериальной ферментации, поэтому всегда можно обнаружить в любой кисломолочной продукции. Добавка Е262 имеет низкую растворимость в эфирах и спиртах, но в то же время высокую растворимость в водных растворах. Ацетаты натрия негорючи и обладают малой токсичностью.
В пищевой промышленности ацетат натрия ценят, прежде всего, за способность регулировать уровень кислотности среды, выступать отменным консервантом, ароматизатором и стабилизатором. В функциональных обязанностях ацетата натрия – сохранность вкусо-ароматических характеристик, формы и текстуры, а также улучшение консистенции продуктов. Следовательно, есть ряд продуктов, производство которых без нее практически не обходится.
Пищевая добавка Е262 используется при консервировании овощей и фруктов для смягчения вкуса уксусной кислоты. Кроме этого, добавляя ацетат натрия вместе с ацетатом кальция в небольшом количестве в муку, производители защищают от бактерий «картофельной болезни» (Bacillus mesentericus) свою хлебобулочную продукцию. Также пищевая добавка Е262 используется в качестве ароматизатора при производстве чипсов, придавая продукции слегка уксусный вкус и аромат.
Пищевая добавка ацетат натрия обеспечивает качество и увеличивает срок хранений майонезов, сухих бульонов и супов, предназначенных для ускоренного приготовления. Диацетат натрия добавляют к тесту в процессе приготовления хлебобулочных изделий, применяют при производстве чипсов и разнообразных сухариков.
В мясной промышленности, из всех солей уксусной кислоты, наибольшей популярностью пользуется диацетат натрия. Обычно его используют в комбинации с лактатом натрия или калия, эта смесь особенно эффективна в отношении подавления роста L.monocytogenes. Стандартная рецептура такой смеси содержит 60% лактата и 4- 8% диацетата, а ее дозировка составляет 25-30 г/кг.
В других отраслях производства ацетаты натрия также находят широкое применение: в медицине – как мочегонное средство и средство для лечения метаболического ацидоза, в строительстве – как противоморозная добавка к бетонам, в химии – для получения уксусного ангидрида и других химических соединений, а также в текстильном производстве, фотографии, гальванотехнике. При помощи ацетатов натрия делают химические грелки, поскольку при его кристаллизации из водного раствора выделяется большое количество тепла.
Пищевая добавка ацетат натрия входит в список разрешенных пищевых добавок в большинстве стран мира, в том числе в РФ.
Натрия ацетат
Фармакологическое действие
Натрия ацетат — натриевая соль уксусной кислоты, источник натрия, также используется как пищевой краситель E262(i).
Показания
Для предотвращения или коррекции гипонатриемии.
Противопоказания
Гипернатриемия, задержка жидкости.
С осторожностью
Отёки, сердечная недостаточность, тяжёлая печёночная недостаточность, почечная недостаточность.
Беременность и грудное вскармливание
Применение при беременности
Адекватных и строго контролируемых исследований по безопасности применения натрия ацетата при беременности не проведено.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения натрия ацетата в период грудного вскармливания не проведено.
Способ применения и дозы
Побочные действия
Частота встречаемости нежелательных реакций от 1 % до 10 %:
Со стороны сердечно-сосудистой системы
Локализованный флебит, тромбоз.
Со стороны эндокринной система и метаболизма
Электролитные нарушения, гипернатриемия, гиперволемия, гипокальциемия, гипокалиемия, метаболический алкалоз, водная интоксикация.
Со стороны желудочно-кишечного тракта
Вздутие живота, метеоризм.
Со стороны органов дыхания
Меры предосторожности
Необходим мониторинг электролитов, pH, концентрации натрия, кальция в сыворотке крови.
Классификация
Категория при беременности по FDA
C ( риск не исключается )
Поделиться этой страницей
Подробнее по теме
Ознакомьтесь с дополнительной информацией о действующем веществе Натрия ацетат:
Натрий уксуснокислый
Химическая формула: CH3COONa*3H2O
Международное название: SODIUM ACETATE
CAS No: 6131-90-4 (Trihydrate)
Квалификация: Имп. «ч», ГОСТ 199-78
Внешний вид: бесцветные кристаллы, в массе белого цвета
Фасовка: мешки, 25 кг
Условия хранения: в сухом, хорошо проветриваемом помещении
Синонимы: Натрий ацетат, Натрий ацетат 3 водный, тригидрат натриевой соли уксусной кислоты
Мы предлагаем Натрий уксуснокислый, натрий ацетат по выгодным ценам с доставкой по всей России.
| Спецификация | |
|---|---|
| Молекулярный вес | 136.08 |
| Молекулярная масса (в а.е.м.) | 136,08 |
| Температура плавления (°C) | 58 |
| Температура разложения (°C) | 120 |
| Плотность | 1,45 (20°C, г/см3) |
| PH (5% р-р при 25 °C) | 7.5-9.0 (по факту 8.15) |
| Основного вещества | 99,0-101,0 % (по факт. 99,18 %) |
| Тяжелые металлы (как Pb), не более | 0.001 % (по факт. 0,0003 %) |
| Нерастворимые в воде вещества, не более | 0.03 % |
| Щелочи (как Na2CO3), не более | 0.05% (по факту менее) |
| Потери при высушивании (120°C) | 36-41 % (по факт. 40,54 %) |
Для согласования условий оплаты, звоните нашим менеджерам по телефонам в Москве:
(495) 787-01-37, 36, 38
(495) 787-43-51
и Санкт- Петербурге:
(812) 309-38-06 (многоканальный)
Применение
Натрий ацетат 3 водный или Натрий уксуснокислый применяется:
• в медицине,
• в строительстве,
• в производстве красителей, мыл, уксусного ангидрида, ацетилхлорида, винилацетата, ацетатов меди и др.,
• как протрава при крашении тканей и дублении кож;
• как катализатор поликонденсации;
• как компонент кислых закрепителей в фотографии буферного раствора электролитов в гальванотехнике и др.
Новые поступления по выгодным ценам
В нашем ассортименте новые поступления на склад по выгодной цене:
борная кислота,
нтф кислота,
цинк хлористый,
салициловая кислота и др.
Для покупки этой и другой химической продукции и пищевых добавок в Москве или Санкт-Петербурге, звоните нам!
Для получения подробной информации о ценах на химреактивы
и согласования условий оплаты звоните по телефонам:
в Москве:
+7 (495) 787-01-37
+7 (495) 787-43-51
в Санкт- Петербурге:
+7 (812) 309-38-06





