Ацетат серебра с чем реагирует
Ацетат серебра
СОДЕРЖАНИЕ
Синтез и структура [ править ]
Структура ацетата серебра состоит из 8-членных колец Ag 2 O 4 C 2, образованных парой ацетатных лигандов, соединяющих пару центров серебра. [2]
Реакции [ править ]
Синтез сульфенамида [ править ]
Ацетат серебра используется для получения сульфенамидов из дисульфидов и вторичных аминов : [3]
R 2 NH + AgOAc + (RS) 2 → R 2 NSR + AgSR + HOAc
Гидрирование [ править ]
Раствор ацетата серебра в пиридине поглощает водород, образуя металлическое серебро : [4]
Окислительное дегалогенирование [ править ]
Цис-гидроксилирование Вудворда [ править ]
Использует [ редактировать ]
В области здравоохранения продукты, содержащие ацетат серебра, используются в жевательной резинке, спреях и пастилках, чтобы удерживать курильщиков от курения. Серебро в этих продуктах при смешивании с дымом создает неприятный металлический привкус, препятствуя тем самым курению. Пастилки, содержащие 2,5 мг ацетата серебра, показали «умеренную эффективность» на 500 взрослых курильщиках, испытанных в течение трехмесячного периода. Однако через 12 месяцев профилактика не увенчалась успехом. В 1974 году ацетат серебра был впервые представлен в Европе как безрецептурная таблетка для предотвращения курения (Repaton), а затем три года спустя как жевательная резинка (Tabmint). [7]
Ацетат серебра также является хорошо известным предшественником, используемым в печатной электронике. В частности, сообщалось, что комплексы ацетата серебра образуют свободные от частиц «реактивные чернила», которые образуют следы, приближающиеся к объемной проводимости серебра (в пределах одного порядка величины). [8]
Безопасность [ править ]
Ацетиленид серебра
| Ацетиленид серебра | |
|---|---|
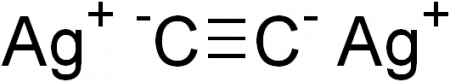 | |
| Хим. формула | Ag2C2 |
| Молярная масса | 239.76 г/моль |
| Рег. номер CAS | 7659-31-6 |
| SMILES | |
| ChemSpider | 25934157 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетиленид серебра — очень неустойчивое кристаллическое взрывчатое вещество.
Содержание
Внешний вид
Получение
Получают пропусканием ацетилена через аммиачный раствор оксида серебра.
Ацетилен получают действием воды на карбид кальция. Атомы водорода в молекуле ацетилена обладают большой подвижностью, поэтому они легко могут быть замещены металлами. Через аммиачный раствор оксида серебра пропускается ацетилен. Выпадает осадок белого цвета — ацетиленид серебра.
Высушенный ацетиленид серебра — очень опасное взрывчатое вещество. Его уничтожают обработкой концентрированной соляной кислотой, реже сульфидом аммония:
AgC ≡ CAg + 2 HCl ⟶ HC ≡ CH↑ + 2 AgCl↓ AgC ≡ CAg + (NH4)2S ⟶ HC ≡ CH↑ + Ag2S↓ + 2 NH3↑
Безопасность
Очень опасен. Взрывается при нагревании и механических воздействиях, даже от тлеющей лучины. Необходимо получать только небольшие количества ацетиленида серебра.
Применение
Применяется во взрывчатых веществах, в детонаторах.
Ацетат серебра химические свойства
Ацетат серебра
| Ацетат серебра | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Ацетат серебра |
| Традиционные названия | Уксуснокислое серебро |
| Химическая формула | AgCH3COO |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Молярная масса | 166,92 г/моль |
| Плотность | 3,259 г/см³ |
| Химические свойства | |
| Растворимость в воде | 1,04 20 ; 2,52 80 г/100 мл |
| Классификация | |
| Рег. номер CAS | 563-63-3 |
| Рег. номер PubChem | 11246 |
| SMILES | CC(=O)[O-].[Ag+] |
| Номер ООН | 19PPS85F9H |
| Регистрационный номер EC | 209-254-9 |
Ацетат серебра — неорганическое соединение, соль металла серебра и уксусной кислоты с формулой AgCH3COO, белые кристаллы, растворяется в воде.
Получение
Физические свойства
Ацетат серебра образует белые кристаллы.
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Смотреть что такое «Ацетат серебра» в других словарях:
Ацетат марганца(II) — Общие Систематическое наименование Ацетат марганца(II) Традиционные названия Уксуснокислый марганец Химическая формула Mn(CH3COO)2 Физические свойства … Википедия
Перманганат серебра — Общие Систематическое наименование Перманганат серебра Традиционные названия Марганцовокислое серебро Химическая формула AgMnO4 Физические свойства … Википедия
Фульминат серебра — Общие Систематическое наименование Фульминат серебра(I) Традиционные названия Гремучее серебро Химическая формула AgCNO Эмпирическая формула AgCNO Физические свойства … Википедия
Нитрат серебра(I) — Под вечный гул вертящихся колес. Нитрат серебра … Википедия
Ацетиленид серебра — Общие … Википедия
Азид серебра — Азид серебра … Википедия
Хлорид серебра(I) — Хлорид серебра(I) … Википедия
Арсенат серебра(I) — Общие Систематическое наименование Ортоарсенат серебра(I), арсенат серебра(I) Традиционные названия Арсенат серебра Химическая формула Ag3AsO4 Эмпирическая формула Ag3AsO4 … Википедия
Ортоарсенит серебра(I) — Общие Систематическое наименование Ортоарсенит серебра(I) Традиционные названия Арсенит серебра Химическая формула Ag3AsO3 Эмпирическая формула Ag3AsO3 … Википедия
Бромид серебра(I) — Бромид серебра(I) … Википедия
Ацетат серебра — Silver acetate
СОДЕРЖАНИЕ
Синтез и структура
Структура ацетата серебра состоит из 8-членных колец Ag 2 O 4 C 2, образованных парой ацетатных лигандов, соединяющих пару центров серебра.
Реакции
Сульфенамидный синтез
Ацетат серебра используется для получения сульфенамидов из дисульфидов и вторичных аминов :
R 2 NH + AgOAc + (RS) 2 → R 2 NSR + AgSR + HOAc
Гидрирование
Раствор ацетата серебра в пиридине поглощает водород, образуя металлическое серебро :
Окислительное дегалогенирование
Цис-гидроксилирование по Вудворду
Использует
В области здравоохранения продукты, содержащие ацетат серебра, используются в жевательной резинке, спреях и пастилках, чтобы удерживать курильщиков от курения. Серебро в этих продуктах при смешивании с дымом создает неприятный металлический привкус, препятствуя тем самым курению. Пастилки, содержащие 2,5 мг ацетата серебра, показали «умеренную эффективность» на 500 взрослых курильщиках, испытанных в течение трехмесячного периода. Однако через 12 месяцев профилактика не увенчалась успехом. В 1974 году ацетат серебра был впервые представлен в Европе как безрецептурная таблетка для предотвращения курения (Repaton), а затем три года спустя как жевательная резинка (Tabmint).
Ацетат серебра также является хорошо известным предшественником, используемым в печатной электронике. В частности, сообщалось, что комплексы ацетата серебра образуют свободные от частиц «реактивные чернила», которые образуют следы, приближающиеся к объемной проводимости серебра (в пределах одного порядка величины).
Безопасность
Ацетат серебра является координационное соединение с эмпирической формулой CH3CO2Ag (или AgC2ЧАС3О2). А светочувствительный, белое кристаллическое твердое вещество, это полезный реагент в лаборатории в качестве источника ионов серебра без окисляющего аниона.
Содержание
Синтез и структура
Ацетат серебра можно синтезировать по реакции уксусная кислота и карбонат серебра. [1]
Твердый ацетат серебра выпадает в осадок при концентрировании растворов нитрат серебра и ацетат натрия.
В состав ацетата серебра входит 8-членный Ag2О4C2 кольца, образованные парой ацетатных лигандов, соединяющих пару центров серебра. [2]
Реакции
Ацетат серебра находит применение в определенных превращениях в органический синтез. [3]
Сульфенамидный синтез
Ацетат серебра используется для приготовления сульфенамиды из дисульфиды и вторичные амины: [3]
Гидрирование
Раствор ацетата серебра в пиридине поглощает водород, образуя металлический серебро: [4]
Прямой орто-арилирование
Окислительное дегалогенирование
Ацетат серебра можно использовать для преобразования некоторых органогалоген соединения в спирты. Несмотря на свою высокую стоимость, его можно использовать в тех случаях, когда требуется мягкий и селективный реагент.
Цис-гидроксилирование по Вудворду
Ацетат серебра в сочетании с йод составляет основу Цис-гидроксилирование по Вудворду. Эта реакция избирательно превращает алкен в СНГдиол. [6]
Использует
В области здравоохранения продукты, содержащие ацетат серебра, используются в жевательной резинке, спреях и пастилках, чтобы удерживать курильщиков от курения. Серебро в этих продуктах при смешивании с дымом создает неприятный металлический привкус, препятствуя тем самым курению. Пастилки, содержащие 2,5 мг ацетата серебра, показали «умеренную эффективность» на 500 взрослых курильщиках, испытанных в течение трехмесячного периода. Однако через 12 месяцев профилактика не увенчалась успехом. В 1974 году ацетат серебра был впервые представлен в Европе как безрецептурная таблетка для предотвращения курения (Repaton), а затем три года спустя как жевательная резинка (Tabmint). [7]
Ацетат серебра также является хорошо известным предшественником, используемым в печатной электронике. В частности, сообщалось, что комплексы ацетата серебра образуют свободные от частиц «реактивные чернила», которые образуют следы, приближающиеся к объемной проводимости серебра (в пределах одного порядка величины). [8]
Безопасность
Химические свойства альдегидов и кетонов
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
Структурная формула кетонов:
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.



















