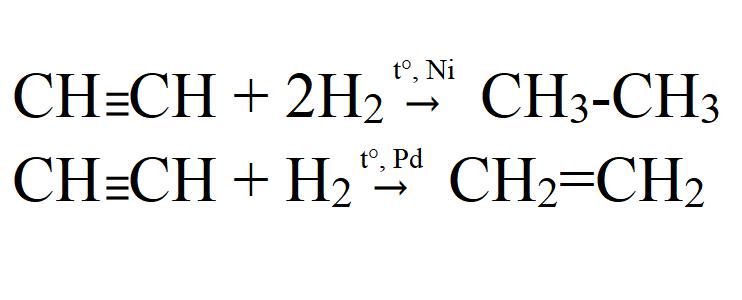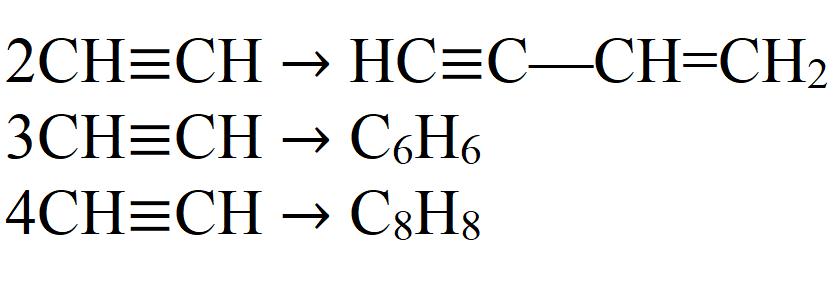Ацетилен для чего используют
Получение и применение ацетилена
Прежде чем приступить к объяснению, где применяется ацетилен, давайте рассмотрим, как его получить.
Содержание
Получение ацетилена производят двумя основными способами:
На данный момент способ получения ацетилена из карбида кальция используется редко, поскольку он довольно громоздкий, дорогой и требующий затрат большого количества электроэнергии.
Поэтому на смену ему пришел способ получения ацетилена из природного газа (метана) термоокислительным пиролизом метана с кислородом (так называемый пиролизный ацетилен).
Получение ацетилена пиролизным способом
Пиролизный ацетилен получают путем сжигания метана в смеси с кислородом в реакторах при температуре 1300-1500°C. В результате чего получается смесь, которая содержит:
При помощи растворителя (диметилформамида) из нее извлекается ацетилен концентрации 99,0-99,2%. Оставшаяся часть пиролизных газов используется для производства аммиака и других продуктов.
Также ацетилен получают путем разложения жидких горючих (нефть, керосин) действием электродугового разряда, который называется электропиролизом.
Пиролизный и электропиролизный ацетилена по своим свойствам является идентичным ацетилену, получаемому из карбида кальция, но дешевле на 30-40%.
Применение ацетилена
Ацетилен применяется при всех процессах газопламенной обработки металлов (газовой сварке и газовой резки), благодаря высокой температуре пламени, достигнуть которой при использовании других горючих не удается.
Для пайки, резки, наплавки, газопламенной закалки, металлизации, газопрессовой сварки, сварки цветных металлов и сплавов с успехом применяются газы-заменители ацетилена:
По химическому составу все они, за исключением водорода, представляют собой или соединения, или смеси различных углеводородов.
Правильный выбор и использование газов-заменителей позволяет добиться высокого качества сварки и резки, а при газовой резке металлов малых толщин дает более высокую чистоту резки.
Газовая сварка возможна при условии, что температура пламени в два раза превышает температуру плавления свариваемого металла. Поэтому газы-заменители температура пламени которых ниже, чем у ацетилена применяют для сварки металлов с температурой плавления ниже, чем у сталей
Для газовой резки выбор горючего газа основывается на его теплотворной способности, но необходимо учитывать, что газ при сгорании в смеси с кислородом должен образовывать пламя с температурой не ниже 2000°C.
Влияние примесей в ацетилене на качество сварного шва
Давайте остановимся еще на некоторых особенностях применения ацетилена при газовой сварке – влияние примесей на качество сварного шва. Вредное влияние имеют следующие примеси:
Вышеуказанные примеси обязательно удаляются из ацетилена, не только из-за влияния на качество сварного шва, но также из-за пагубного влияния на органы дыхания и зрения сварщика (см. статью Взрывоопасность, ядовитость и самовоспламенение ацетилена).
Сероводород при сгорании образовывает серную кислоту, которая при переходе в металл сварного шва вызывает красноломкость. Установлено, что наличие сероводорода до 0,007% не оказывает вредного влияния на прочность сварного шва.
Процесс очистки от сероводорода тоже довольно простой – необходимо ацетилен пропустить через воду, в результате чего сероводород растворится в воде.
Фосфористый водород при сгорании образовывает фосфорную кислоту, которая при переходе в металл сварного шва вызывает хладноломкость. Установлено, что наличие фосфористого водорода до 0,027% не оказывает вредного влияния на прочность сварного шва.
Химическим путем очистка ацетилена от фосфористого водорода производится путем пропускания через особую очистительную массу – гератоль. Гератоль представляет собой массу желтого цвета, которая в результате взаимодействия с фосфористым водородом приобретает зеленый цвет.
Применение ацетилена в химической отрасли
Помимо газопламенной обработки ацетилен используют в области химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и т. п. Далее мы рассмотрим, как ацетилен используется для получения тех или иных химических соединений.
Уксусный альдегид
Продуктом присоединения воды к ацетилену является уксусный альдегид. Впервые этот синтез был осуществлен М. Г. Кучеровым в 1881 г. Реакция протекает по уравнению:
Реакция проводится пропусканием ацетилена через сернокислый раствор соли окиси ртути при температуре 70-80°C.
Применение этой реакции явилось началом промышленного синтеза органических веществ с применением ацетилена в качестве исходного продукта.
Ацетон
При пропускании смеси ацетилена и паров воды в соотношении примерно 1:10 при температуре 430-450°C над цинк-ванадиевым катализатором происходит образование ацетона по уравнению:
Указанный процесс нашел применение в промышленных масштабах.
Хлористый винил
При взаимодействии ацетилена с хлористым водородом при 200°C над катализатором, представляющим собой двухлористую ртуть, нанесенную на активированный уголь, образуется хлористый винил по уравнению:
Винилацетат
C уксусной кислотой также в присутствии ртутных солей ацетилен образует винилацетат:
Хлористый винил и винилацетат широко применяются при производстве пластмасс.
Винилацетилен
При пропускании ацетилена через насыщенный раствор однохлористой меди и хлористого аммония при температуре 50°C образуется винилацетилен.
Реакция протекает по уравнению:
В результате присоединения хлороводорода к винилацетилену образуется хлоропрен, который способен к быстрой и самопроизвольной полимеризации с образованием каучука высоких технических качеств.
Химия винилацетилена нашла широкое теоретическое обобщение, что позволило значительно расширить область применения этого продукта.
При взаимодействии ацетилена со спиртами в щелочном растворе образуются простые виниловые эфиры.
Так, например, реакция между ацетиленом и этиловым спиртом протекает по уравнению:
Эта реакция была открыта А. Е. Фаворским в 1887 г.
Подводя итог всему вышенаписанному, мы установили, что ацетилен получают не только из карбида кальция, но также путем сжигания метана. При этом выяснили, что ацетилен применяют не только для газовой сварки и газовой резки, но и в химической отрасли для получения пластмасс, растворителей и т. д.
Области применения ацетилена
Сварочные работы с использованием ацетилена
Традиционно этот газ применяют при проведении процедуры по автогенной сварке, а также резке металлов. Технология подразумевает использованием двух баллонов с газом, в одном из которых находится кислород, а в другом — ацетилен. Вещества поступают в специализированную горелку, и при сгорании образуется очень горячее пламя. Его температура может достигать 3200 градусов по Цельсию. Самым «эффективным» считается сочетание газов, при котором в смеси содержится 45% ацетилена. При таких условиях удается оперативно расплавить даже достаточно толстые куски листовой стали.
Использование в промышленности и быту
Впрочем, автогенная сварка и резка металлов — не единственная сфера применения. Достаточно часто ацетилен используют в качестве источника яркого белого света в автономных приборах освещения. В данном случае его получают с помощью реакции воды и карбида кальция.
Такие лампы были крайне востребованы в прошлом столетии, ими освещали кареты и автомобили. Но и сегодня карбидные устройства, то есть созданные с использованием ацетилена, применяют при благоустройстве отдаленных маяков. Ключевое преимущество карбидных ламп — экономичность и отсутствие необходимости в подключении к электросети. Соответственно, при их установке на маяке не возникает необходимости в подведении линии электропередач, то есть оплате дорогостоящей услуги. Также лампы востребованы на судах дальнего плавания.
Ацетилен используют в промышленности. Его применяют при получении различных продуктов органического синтеза. Например, его используют для создания:
Следует отметить, что ацетилен нашел применение и в медицине, например, его иногда используют при ингаляционном наркозе.
Сфера и область применения ацетилена. Где применяется ацетилен.
Открыт несколько веков назад – ацетилен – остается одним из самых популярных органических соединений и сегодня. В быту его начали использовать еще в 20 веке, а сегодня этот углеводород востребован в разных отраслях промышленности и даже в медицине.
Что собой представляет ацетилен?
Применение ацетилена в обработке металлов
Сегодня чаще всего ацетилен используется при газовой и автогенной сварке. Сварку совершают с помощью горячего пламени, образованного при работе ацетилено-кислородной горелки. Температура такого пламени может достигать 3000 градусов Цельсия и плавить даже листы стали. Такую сварку применяют и для пластмасс, в том числе и при ремонте автомобильных пластмассовых бамперов.
Огневая чистка ацетиленом позволяет получить металлическую поверхность без грязи и коррозии. Такой способ отлично очищает металл перед последующей обработкой. Пайка твердым припоем, при которой также используется данное соединение, позволяет соединять между собой материалы различной структуры.
Другие сферы применение ацетилена
Помимо сварки и обработки металлов ацетилен имеет множество других сфер применения, например, в различных отраслях промышленности. Химическая промышленность активно применяет ацетилен в органическом синтезе для производства таких веществ как уксусная кислота, технический углерод, этиловый спирт, каучук, пластмассы, растворители, лаки, взрывчатые вещества, органическое стекло. Помимо этого, раствор ацетилена в аммиаке используют в ракетной промышленности как ракетное топливо.
На протяжении всего прошлого века большой популярностью пользовались карбидные лампы, которые работали на основе ацетиленового пламени. Такими лампами оснащали кареты, автомобили и велосипеды. На сегодняшний день карбидные лампы утратили былую полярность, но их по-прежнему используют на кораблях дальнего плаванья и маяках, так как они работают без электричества и очень экономичны.
Статьи на схожую тематику:
Ацетилен применяется даже в медицинских целях при ингаляционном наркозе. Применяют его не часто, так как на данный момент существуют более современные способы анестезии. Кроме этого, ацетилен обладает небольшой токсичностью и поэтому более безопасно стало использовать другие методы наркоза.
Содержание
История получения ацетилена
В 1836 г. в Бристоле на заседании Британской ассоциации Эдмунд Дэви (Edmund Davy), профессор химии Дублинского Королевского общества и двоюродный брат Гемфри Дэви (Humphry Davy), сообщил:
Дэви получил карбид калия К2С2 и обработал его водой.
В статье о получении карбида кальция мы писали о том, что его «двууглеродистый водород» впервые был назван ацетиленом французским химиком Пьером Эженом Марселеном Бертло (Marcellin Berthelot) в 1860 г. Только через 60 лет после открытия Дэви предсказанное им использование ацетилена для освещения явилось первым толчком для его промышленного получения.
Получение ацетилена
Получение ацетилена производится двумя основными способами:
А вот какой способ сейчас более распространён можно узнать из статьи о получении ацетилена.
Применение ацетилена
Применение ацетилена при газовой сварке обусловлено тем, что у него самая большая температуры горения. Но он также нашел свое применение в химической отрасли для получения пластмасс, синтетического каучука, уксусной кислоты и растворителей. Более подробный ответ по данному вопросу можно найти в статье о применении ацетилена.
Горение ацетилена
312?1,1709?1000/26,036 = 14000 ккал/м 3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м 3 (55890 кДж/м 3 ).
Реакция неполного горения ацетилена протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад С2Н2 на его составляющие по реакции:
где Q4?54 ккал/моль или 2070 ккал/кг С2H2.
При содержании С2Н2 в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура горения ацетилена, которая составляет 3200°С.
Следовательно, температура пламени изменяется в зависимости от состава смеси.
При содержании 27% С2Н2 достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек.
Следовательно, в зависимости от состава смеси также изменяется и скорость воспламенения.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
| Содержание С2Н2 в смеси в объемных процентах | 12 | 15 | 20 | 25 | 27 | 30 | 32 | 35 | 40 | 45 | 50 | 55 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Максимальная температура горения ацетилена, °С | — | 2920 | 2940 | 2960 | 2970 | 2990 | 3010 | 3060 | 3140 | 3200 | 3070 | 2840 |
| Скорость воспламенения смеси, м/сек | 8,0 | 10,0 | 11,8 | 13,3 | 13,5 | 13,1 | 12,5 | 11,3 | 9,3 | 7,8 | 6,7 | — |
Необходимо понимать, что полное сгорание ацетилено-воздушной смеси достигается при наличии в ней не более 1?100/(1+11,905)=7,75% ацетилена (так называемая стехиометрическая смесь). При этом продуктами реакции являются только углекислый газ (СО2) и вода (H2О). При содержании ацетилена более 17,37% в виде сажи выделяется свободный углерод.
Хранение и транспортировка ацетилена
Ацетилен выпускают по ГОСТ 5457 растворенным и газообразным. Хранят и транспортируют его в растворенном состоянии в специальных стальных баллонах по ГОСТ 949, заполненных пористой, пропитанной ацетоном массой. Ацетилен, растворенный в ацетоне не склонен к взрывчатому распаду.
Баллоны окрашены в серый цвет и надписью красными буквами «АЦЕТИЛЕН» на верхней цилиндрической части.
Максимальное давление ацетилена при заполнении баллона составляет 2,5 МПа (25 кгс/см 2 ), при отстое и охлаждении баллона до 20°С оно снижается до 1,9 МПа (19 кгс/см 2 ). При этом давлении в 40-литровый баллон вмещается 5-5,8 кг С2Н2 по массе (4,6-5,3 м 3 газа при 20°С и 760 мм рт. ст.).
Давление ацетилена в полностью наполненном баллоне изменяется при изменении температуры следующим образом:
| Температура, °С | -5 | 0 | 5 | 10 | 15 | 20 | 30 | 40 |
|---|---|---|---|---|---|---|---|---|
| Давление, МПа | 1,3 | 1,4 | 14 | 1,7 | 1,8 | 12 | 2,4 | 3,0 |
Другие требования техники безопасности можно узнать из статьи о классе опасности и мерах безопасности при работе с ацетиленом
Физические свойства ацетилена
Физические свойства ацетилена представлены в таблицах ниже.
Коэффициенты перевода объема и массы С2Н2 при Т=15°С и Р=0,1 МПа
Коэффициенты перевода объема и массы С2Н2 при Т=0°С и Р=0,1 МПа
Ацетилен в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м 3 ) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| С2Н2 | 40 | 5 | 4,545 |
Благодаря информации в таблице можно дать ответы на часто задаваемые вопросы:
Ацетилен — формула, свойства, получение, преимущества
Ацетилен (или по международной номенклатуре — этин) — это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена — C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Ацетилен
Меры безопасности при работе с ацетиленом
Получение
В лаборатории
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция (Ф. Вёлер, 1862 год):
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы.
Получение пиролизом
Электрокрекинг
Регенеративный пиролиз
Окислительный пиролиз
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
Известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Как синтезировался ацетилен
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + 2Н2О=С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Этот газ был, в основном, интересен химикам с точки зрения теории строения органических соединений. Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3ацетилом.
На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила. Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н = С2Н2. Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку. В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами. Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С = СаС2 + СО. Это произошло в конце XIX века.
Тогда ацетилен стали использовать для освещения. В пламени при высокой температуре этот газ, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому).
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина, арсина.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
CH≡CH + HCN → CH2=CH-CN
CH≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
2CH≡CH + 2Na → 2CH≡CNa + H2
CH≡CH + 2NaNH2 → NaC≡CNa + 2NH3
Это далеко не все химические свойства ацетилена.
Ацетилен сегодня: способы получения
В промышленности ацетилен часто получают действием воды на карбид кальция.
Сейчас широко применяются методы получения ацетилена из природного газа – метана:
электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена);
термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
Применение ацетилена при сварке
Ацетилен – основной горючий газ, используемый при газовой сварке, а также широко применяется для газовой резки (кислородной резки). Температура ацетилено-кислородного пламени может достигать 3300°C. Благодаря этому ацетилен по сравнению с более доступными горючими газами (пропан-бутаном, природным газом и др.) обеспечивает более высокое качество и производительность сварки.
Снабжение постов ацетиленом для газовой сварки и резки может осуществляться
Для хранения ацетилена обычно используются стандартные баллоны емкостью 40 л, окрашенные в белый цвет, с надписью «Ацетилен» красного цвета (ПБ 10-115-96, ГОСТ 949-73). Согласно ГОСТ 5457-75 для газопламенной обработки металлов применяется технический ацетилен растворенный марки Б и газообразный.
Таблица. Характеристики марок технического ацетилена (ГОСТ 5457-75), используемого при сварке и резке.
| Параметр | Ацетилен технический | ||
| растворенный марки Б | газообразный | ||
| первого сорта | второго сорта | ||
| Объемная доля ацетилена C2H2, %, не менее | 99,1 | 98,8 | 98,5 |
| Объемная доля воздуха и других газов, малорастворимых в воде, %, не более | 0,8 | 1,0 | 1,4 |
| Объемная доля фосфористого водорода PH3, %, не более | 0,02 | 0,05 | 0,08 |
| Объемная доля сероводорода H2S, %, не более | 0,005 | 0,05 | 0,05 |
| Массовая концентрация водяных паров при давлении 101,3 кПа (760 мм рт. ст.) и температуре 20°С, г/м3, не более | 0,5 | 0,6 | не нормируется |
| что соответствует температуре насыщения, не выше (°C) | -24 | -22 | |
Баллоны заполнены пористой массой, пропитанной ацетоном. Ацетилен хорошо растворяется а ацетоне: при нормальной температуре и давлении в 1 л ацетона растворяется 23 л ацетилена (в 1 л бензина растворяется 5,7 л ацетилена, в 1 л воды – 1,15 л ацетилена). Пористая масса выполняет следующие функции:
В качестве пористых масс могут применяться активированный уголь, пемза, волокнистый асбест.
Таблица. Допустимое давление газа в баллоне в зависимости от температуры (при номинальном давлении 1,9 МПа / +20°С) (ГОСТ 5457-75)
| Температура, °С | -5 | 0 | +5 | +10 | +15 | +20 | +25 | +30 | +35 | +40 | |
| Давление в баллоне, не более | МПа | 1,34 | 1,4 | 1,5 | 1,65 | 1,8 | 1,9 | 2,15 | 2,35 | 2,6 | 3 |
| кгс/см2 | 13,4 | 14 | 15 | 16,5 | 18 | 19 | 21,5 | 23,5 | 26 | 30 | |
Таблица. Остаточное давление газа в баллоне, поступающем от потребителя (ГОСТ 5457-75)
| Температура, °С | до 0 | от 0 до +15 | от +15 до +25 | от +25 до +35 | |
| Остаточное давление в баллоне, не менее | МПа | 0,05 | 0,1 | 0,2 | 0,3 |
| кгс/см2 | 0,5 | 1 | 2 | 3 | |
40-литровые баллоны с максимальным давлением газа 1,9 МПа при температуре 20°С обычно заполняют 5–5,8 кг ацетилена (4,6–5,3 м3 газа при температуре 20°С и давлении 760 мм рт. ст.). Масса ацетилена в баллоне определяется по разности масс баллона до и после наполнения газом. Объем ацетилена равен отношению его массы и плотности. Так, объем 5,5 кг ацетилена при температуре 20°С и давлении 760 мм рт. ст. составляет 5,5/1,09 = 5,05 м3.
Таблица. Сравнительные характеристики ацетилена, пропана и метилацетилен-алленовой фракции (МАФ)
| Параметр | ацетилен | пропан | МАФ |
| Чувствительность к удару, безопасность | нестабилен | стабилен | стабилен |
| Токсичность | незначительная | ||
| Предел взрываемости в воздухе (%) | 2,2–81 | 2,0–9,5 | 3,4–10,8 |
| Предел взрываемости в кислороде (%) | 2,3–93 | 2,4–57 | 2,5–60 |
| Температура пламени (°С) | 3087 | 2526 | 2927 * |
| Реакции с обычными металлами | избегать сплавов, содержащих более 70% меди | незначительные ограничения | избегать сплавов, содержащих более 65–67% меди |
| Склонность к обратному удару | значительная | незначительная | незначительная |
| Скорость сгорания в кислороде (м/с) | 6,10 | 3,72 | 4,70 |
| Плотность газа (кг/м3) | 1,17 (при 0°С) 1,09 (при 20°С) | 2,02 (при 0°С) | 1,70 (при 0°С) * |
| Плотность в жидком состоянии при 15,6°С (кг/м3) | – | 513 | 575 |
| Отношение расхода кислорода к горючему газу (м3/м3) при нормальном пламени | 1–1,2 | 3,50 | 2,3–2,5 |
Преимущества
Газ является непредельным углеводородом, который обладает тройной связью атомов углерода. Формула ацетилена – С2Н2. При этом структурная формула ацетилена выглядит следующим образом Н-С=С-Н, так как связь идет между атомами углерода.
Химические и физические свойства
Газ требует очень аккуратного обращения. Баллон может взорваться от обыкновенного удара при падении или при нагреве около 500 градусов Цельсия. Воспламениться струя может даже от статического электричества от пальца человеческой руки. Молярная масса ацетилена составляет 26 г/моль. Температура горения ацетилена в ядре пламени может составлять более 2600 градусов Цельсия.
Состав
Горение ацетилена и прочие его практические свойства во многом зависят от состава. Даже небольшие отклонения от нормы могут привести к тому, что газ поменяет свои характеристики. Поэтому, выделяют несколько основных сортов, отличающихся друг от друга по своему составу.
Состав ацетилена газообразного технического:
Растворенное вещество первого сорта марки Б должно обладать следующим составом:
Растворенное вещество второго сорта марки Б должно обладать следующим составом:
Растворенное вещество марки А должно обладать следующим составом:
Технология и режимы сварки
Перед началом сварки нужно подобрать баллон с ацетиленом и понять саму его конструкцию.
Конструкция баллона с ацетиленом
Потом подбирается горелка требуемого размера от 0 до 5. Толщина этого инструмента определяет расход газа, а также ширину образуемого шва. Чтобы проверить готовность изделия к работе, ее нужно продуть ацетиленом до тех пор, чтобы почувствовать его запах.
Поджог газа осуществляется еще до добавления кислорода. После загорания можно добавить понемногу струю кислорода, пока не образуется устойчивое пламя. Выходное давление основного газа должно быть до 4 атмосфер, а дополнительного – до 2 атмосфер. Затем подбирается мощность пламени согласно толщине свариваемого металла.
Заранее очищенные заготовки предварительно прогреваются пламенем горелки до нужной температуры. После этого добавляется сварочная проволока, которая вместе с основным металлом образует сварочную ванну. Процесс сварки может проводиться как правым, так и левым способом. После окончания процедуры горение ацетилена поможет постепенному охлаждению шва с подогревом.
Заключение
Разбираясь, для чего нужен ацетилен в сварочной области, в первую очередь нужно думать о безопасности. Отличные практические качества и низкая стоимость газа не позволяют отказаться от него полностью из-за взрывоопасности. Любой специалист может оценить все преимущества работы с ним, но сложности хранения затрудняют его применение в домашних условиях.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.



карта сайта
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен