Ацикловир таблетки чем заменить
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
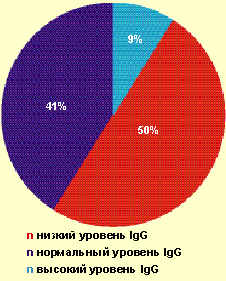 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
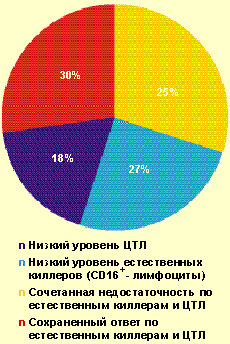 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Эффективность таблетированной (кишечнорастворимой) формы циклоферона в терапии герпетической инфекции
Среди лекарственных препаратов, применяемых для лечения герпетической инфекции, наибольшее распространение в клинической практике приобрели синтетические аналоги пуриновых и пиримидиновых нуклеозидов, ингибирующих ключевые ферменты репликации вируса: — ац
Среди лекарственных препаратов, применяемых для лечения герпетической инфекции, наибольшее распространение в клинической практике приобрели синтетические аналоги пуриновых и пиримидиновых нуклеозидов, ингибирующих ключевые ферменты репликации вируса: — ацикловир (вролекс, зовиракс, ациклогуанозин), а также валцикловир (валтрекс), фамцикловир (пенцикловир), фоскарнет, видарабин и их всевозможные комбинации, а также препараты ненуклеозидной природы — интерфероны, ДС-РНК, ингибиторы протеолиза и др.
Однако опыт длительного применения этих средств, особенно ацикловира, показал существенное снижение клинического эффекта во времени, что обусловлено образованием резистентных штаммов вируса герпеса.
Вследствие этого в настоящее время наибольшее внимание уделяется разработке комбинированных методов лечения с применением аналогов нуклеозидов, ингибиторов ферментов, цитокинов и индукторов интерферона.
В настоящее время наиболее изученным из разрешенных к клиническому применению индукторов интерферона является препарат циклоферон, выпускаемый в виде раствора для инъекций и хорошо себя зарекомендовавший для лечения широкого спектра вирусных и бактериальных инфекций, в том числе герпетической.
Исследования показали, что препарат in vitro полностью подавляет репликацию вируса герпеса первого типа и цитомегаловируса в культуре клеток, и проявляет высокую эффективность in vivo на моделях герпетического поражения (герпетический конъюнктивит и герпетический энцефалит) у экспериментальных животных (кроликов).
Учитывая эпидемиологию герпетической инфекции и необходимость амбулаторного применения препарата, представляется целесообразным внедрение в клиническую практику более удобной оральной формы циклоферона.
Целью настоящей работы явилось проведение рандомизированного клинико-лабораторного исследования эффективности оральной лекарственной формы циклоферона у 90 пациентов для лечения герпетической инфекции двойным слепым методом.
Исследуемый препарат: циклоферон (Cycloferonum) N-метил-N-(1-дезокси-d-глуцитол-1-ил) аммоний-10-карбоксиметиленакридон в виде таблеток коричневого цвета с кишечнорастворимой оболочкой по 0,15 г. Вводился орально один раз в сутки в дозе 0,3-0,6 г (две-четыре таблетки).
Препарат сравнения: ацикловир (Acyclovirum, производства AZT, Россия) в виде таблеток по 0,2 г. Принимается орально пять раз в сутки в суточной дозе 80-100 мг/кг.
В клиническое исследование были включены больные герпетической инфекцией, удовлетворяющие следующим условиям: возраст 14-60 лет; отсутствие тяжелых сопутствующих заболеваний.
Диагноз герпетической инфекции ставился на основе клинико-эпидемиологических данных и подтверждался лабораторными методами (ПЦР, ИФА).
Всего было обследовано 125 пациентов, из них 42 мужчины и 83 женщины. Возраст — от 18 до 60 лет, в среднем 33,9±10,3 лет. Диагноз H.labialis был поставлен 23 пациентам, H.henitalis — у 94, сочетанная форма — у 8.
Длительность заболевания колебалась от 0,5 лет до 16 лет, составляя в среднем 4,1±0,8 лет.
35 пациентов ранее использовали ацикловир или его аналоги в лечении герпетической инфекции.
Было сформировано три группы больных.
Первая группа (группа I) из 38 пациентов получала циклоферон по одной таблетке орально два раза в сутки на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29-й день лечения. Курс лечения один месяц. Всего на курс лечения 24 таблеток циклоферона.
Вторая группа (группа II) из 36 человек получала ацикловир ежедневно по две таблетки по 0,2 г пять раз в день в течение 8—10 дней. Всего на курс лечения 40—50 таблеток ацикловира.
Третья группа (группа III) из 51 пациентов принимала циклоферон по одной таблетке на прием два раза в сутки на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29-й день лечения и дополнительно ацикловир ежедневно по одной таблетке пять раз в день в течение 8—10 дней.
Рандомизация больных осуществлялась по очередности поступления (первый в группу I, второй в группу II и т. д.).
Эффективность проводимой терапии оценивалась по клиническим и лабораторным критериям оценки протекания герпетической инфекции.
Для этого использовали следующие клинические показатели:
— частота обострений;
— длительность обострений;
— интенсивность обострений.
Частота обострений у пациентов с положительной динамикой показана в табл. 1.
Таблица 1. Количество обострений в год
При сравнении действия препаратов на пациентов каждой группы было выявлено, что частота обострений в группе I снизилась на достоверно большую величину (Р
Таблица 2. Длительность обострений, дни
Среднее значение снижения длительности рецидивов в группе I было достоверно выше (Р
Таблица 3. Интенсивность обострений, в баллах по 5-балльной шкале
Степень проявления инфекции у пациентов I группы снижалась на достоверно большую величину, чем у пациентов II группы (Р
Таблица 4. Содержание общего сывороточного IFN, ME/мл (норма: 0-8)
Как видно из таблицы, содержание IFN под действием ацикловира увеличивалось в среднем на 7%, тогда как циклоферон повышал уровень IFN в крови в среднем на 18%. Наиболее эффективным оказалось сочетание этих двух препаратов, их совместное применение приводило к повышению содержания IFN в среднем на 22%. Различие по этому показателю между группами II и III было статистически достоверным (Р
Таблица 5. Уровень продукции IFN-a/b, ME/мл (норма: 250—520)
Из таблицы видно, что монотерапия циклофероном и сочетание циклоферона с ацикловиром приводили к увеличению уровня продукции IFN-a/b практически до нормы, тогда как у пациентов, принимавших ацикловир, уровень продукции интерферона после лечения оставался ниже нормальных значений.
Наибольший стимулирующий эффект в отношении продукции интерферонов a и b наблюдался у пациентов III группы, принимавших одновременно циклоферон и ацикловир.
Сравнение средних величин относительного приращения уровня продукции IFN-g показало отсутствие значимых различий между группами. Таким образом, на основании полученных результатов можно сделать вывод о том, что изучаемые препараты и их сочетание равноценны по своему воздействию на продукцию IFN-g клетками.
Естественные цитотоксические клетки (natural killer — NK), обладающие спонтанной цитотоксической активностью в отношении широкого спектра клеток-мишеней, в том числе клеток, инфицированных вирусами, являются важным клеточным звеном неспецифического иммунного ответа. Эти клетки представляют первую линию защиты от вирусинфицированных клеток, а также продуцируют ряд цитокинов.
Средние значения активности NK-клеток у больных с положительными изменениями представлены в табл. 6.
Таблица 6. Цитотоксическая активность NK-клеток, % (норма: 46—50)
Как видно из таблицы, активность NK-клеток в группах II и III повышается на большую величину, чем в группе II, причем в группах I и III показатель активности после лечения практически достигал нормы, тогда как в группе II эти значения до и после лечения оставались ниже нормальных показателей.
Терапия циклофероном как в отдельности, так и в сочетании с ацикловиром более эффективно повышала активность мононуклеарных фагоцитов, чем терапия ацикловиром, средние показатели фагоцитоза после лечения в группах I и III практически соответствовали норме, тогда как в группе II и после лечения эти величины оставались пониженными.
Спонтанная миграция клеток увеличивалась приблизительно на треть. Статистический анализ показал, что достоверных различий между группами по этому показателю нет.
Наибольшее среднее приращение результатов НСТ-теста наблюдалось в группе II, однако статистический анализ свидетельствует о том, что различия между группами недостоверны.
Определение сывороточных иммуноглобулинов является одним из основных количественных тестов, позволяющих оценить состояние гуморального звена иммунитета. В данном исследовании измеряли концентрацию иммуноглобулинов трех основных классов — М, А и G. Для определения использовали метод радиальной иммунодиффузии по Манчини.
Различия в величине приращения концентрации Ig М после лечения были статистически недостоверны для всех трех групп.
Циклоферон и ацикловир по отдельности вызывают сходные эффекты. Продукции Ig А и их средние значения статистически не отличаются друг от друга. Сочетанное применение этих препаратов, напротив, повышало уровень Ig А в крови.
Эффект воздействия циклоферона и ацикловира на уровень IgG был одинаков.
Для оценки специфического гуморального ответа, направленного против вируса герпеса, определяли IgG к вирусу простого герпеса I и II типа методом иммуноферментного анализа.
Различия в эффектах препаратов между группами были статистически недостоверны.
В рамках данного исследования определялось наличие или отсутствие делеции гена GSTM1. Этот анализ проводился с целью проверки предположения о том, что продукт этого гена участвует в метаболизме циклоферона в организме и тем самым способствует интерферон-индуцирующей активности этого препарата. Группы пациентов, получавших циклоферон (группы I и III), были разделены на две подгруппы: пациенты, имеющие ген (GSTM+), и пациенты с делецией гена (GSTM 0/0). В этих подгруппах анализировали результаты клинических наблюдений (частота и длительность рецидивов, интенсивность проявления обострений заболевания) и данные лабораторных исследований (интерфероновый статус и активность NK-клеток). Сравнивались изменения как в подгруппе в целом, так и отдельно у пациентов с положительными и отрицательными изменениями.
Проведенный статистический анализ данных не выявил достоверных различий между подгруппами GSTM 0/0 и GSTM1+ по эффекту препаратов на частоту и длительность рецидивов, интенсивность обострений, уровень общего интерферона в сыворотке, продукцию интерферонов a, b и g in vitro, а также цитотоксическую активность NK-клеток.
На основе полученных данных можно предположить, что действие циклоферона не связано с его метаболизмом, и это позволяет одинаково эффективно использовать этот препарат в генетически гетерогенных группах пациентов.
Заключение
При проведении исследования было использовано несколько схем терапии таблетированным препаратом циклоферон. Помимо стандартной схемы, описанной выше, наиболее эффективными, особенно с профилактической точки зрения, оказались короткие схемы приема препарата (по одной таблетке два раза в день в течение недели) с месячным перерывом.
В целом результаты исследования позволяют сделать следующие выводы.
1. Таблетированная форма циклоферона хорошо переносится и не вызывает побочных эффектов при использовании вышеупомянутых схем терапии. В настоящем исследовании не было отмечено случаев индивидуальной непереносимости препарата.
2. Наиболее эффективной в терапии рецидивирующей герпетической инфекции оказалась схема лечения, сочетающая использование противовирусного препарата (в нашем исследовании ацикловир) и индуктора интерферона циклоферон.
3. Препарат циклоферон не обладает иммунотоксическими эффектами, об этом можно судить по отсутствию подавления функциональных и количественных параметров иммунной системы.
5. Самостоятельный курс приема таблеток циклоферона в виде монотерапии может эффективно использоваться при лечении герпетической инфекции.
6. Отсутствие различий в эффективности терапии у генетически гетерогенных по экспрессии гена, кодирующего глутатион-S-трансферазу, пациентов может быть важным доказательством того, что именно неизменная молекула циклоферона является действующим индуктором.
Полученные данные позволяют рекомендовать таблетки циклоферона в стандартных дозах различным пациентам независимо от их способности к метаболизму ксенобиотиков.
Литература
1. Кондратьева Г. А., Екимова В. И., Иовлев В. И. Определение противовирусной активности интерферонов человека микрометодом / Реаферон (сборник научных трудов). Л., 1988, с. 105-109.
2. Manaseki S., Searle R. F. Natural killer (NK) cells activity of first trimester human decidua // Cellular Immunology. 1989. Vol. 121. № 1. P. 166-173.
3. Park B. H. Infection and nitroblutetrasolium reduction by neutrophis // Lancet. 1968. Vol. 2. P. 532-534.