Ацилакт или бифидумбактерин что лучше в гинекологии
Бактериальный вагиноз: место пероральной пробиотической терапии
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма.
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма. Значительная часть (более 60%) микрофлоры заселяет различные отделы желудочно-кишечного тракта, примерно 15% приходится на ротоглотку, на урогенитальный тракт — 11%(из них на вагинальный отдел — 9%), 14% — на кожные покровы. Одновременная эволюция организма хозяина и микроорганизмов благодаря двунаправленному обмену способствовала закреплению взаимовыгодных коллективных взаимодействий. Резидентные микроорганизмы, взаимодействующие с человеком на протяжении тысячелетий, контактируют с толл-подобными рецепторами (toll-like receptors (TLR)) слизистых оболочек пищеварительного тракта. Активация TLR влияет на секрецию цитокинов мукоцитами, воздействуя, таким образом, на дальнейший процессинг и презентацию антигенов бактерий клеткам хозяина, выработку и секрецию иммуноглобулина А, связанного с секреторным компонентом лизоцима, лактоферрина и других биологически активных веществ.
Взаимодействие между физиологической микрофлорой и организмом хозяина происходит на поверхности слизистых оболочек, из которых самой большой по площади является слизистая оболочка кишечника.
Попытки воздействовать на кишечный биоценоз и через него — на здоровье человека имеют долгую историю. Еще И. И. Мечников в 1910 г. предлагал использовать кисломолочные продукты для омоложения и продления жизни.
Сегодня фармацевтический рынок предлагает практическому врачу широкий спектр лекарственных средств, способствующих нормализации микробиоценоза толстой кишки. Все средства, положительно влияющие на состав кишечной микрофлоры, можно разделить на пробиотики, пребиотики и синбиотики.
Пробиотики представляют собой гетерогенную группу непатогенных бактерий. С 30-х годов прошлого столетия ведут отсчет препараты, содержащие лактобактерии и бифидобактерии, так называемые пробиотики. В соответствии с определением рабочей группы ВОЗ к ним относят живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.
Препараты, входящие в группу пробиотиков, должны соответствовать следующим требованиям:
В ходе международного конгресса гастроэнтерологов (Монреаль, 2005 г.) было дано определение пробиотиков как препаратов на основе кишечных комменсалов, способных осуществлять биологический контроль в организме и обладающих регуляторными, триггерными свойствами. Такой биологический потенциал пробиотиков объясняется многочисленными метаболическими эффектами энтеральной микрофлоры, включая синтез витаминов В и К, короткоцепочечных жирных кислот, инактивацию пищевых канцерогенов, бактериальную ферментацию некоторых лекарственных препаратов, синтез сигнальных молекул и др.
К пробиотикам относят такие препараты, как Линекс, Энтерол, Бактисубтил, Бифидумбактерин, Лактобактерин и др. Пробиотики подразделяются по количеству входящих в состав препарата культур на монокомпонентные (Бифидумбактерин, Энтерол, Бактисубтил и т. д.) и поликомпонентные (Линекс), а также по свойству пробиотической культуры на самоэлиминирующиеся антагонисты (Энтерол, Бактисубтил) и на бифидосодержащие, лактосодержащие и колисодержащие. Например, препарат Линекс относится к поликомпонентным бифидо- и лактосодержащим пробиотикам, так как в его состав входят три микроорганизма — Bifidobacterium infantis, Lactobacillus acidophilus и Enterococcus faecium. Комбинированные пробиотики отличаются большей эффективностью в сравнении с монокомпонентными: лактобактерии и энтерококк преимущественно колонизируют тонкую кишку, а бифидобактерии — толстую, поэтому пробиотические культуры наиболее физиологично поддерживают колонизационную резистентность и способствуют выполнению функций индигенной кишечной микрофлоры.
Пребиотики представляют собой стабилизаторы среды обитания и стимуляторы роста нормальной микрофлоры. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством — стимулировать рост и развитие нормальной микрофлоры кишечника. К пребиотикам относят лактулозу, глюкозу, протеины, камедь, аминокислоты, витамины и минералы, каолин, пищевые волокна, инулин и олигофруктозу.
Комбинированные средства, сочетающие в себе как про-, так и пребиотический компоненты, относят к синбиотикам (например, Линекс Био).
Действие пероральной пробиотической терапии не сводится к простому заселению кишечника, как это зачастую представляется. Их влияние более сложно и многопланово. Это и конкуренция с патогенной и условно-патогенной микрофлорой; адгезия к слизистой оболочке кишечника и взаимодействие с эпителиоцитами; иммуномодулирующий эффект. Микробные липополисахариды и гликопептиды пробиотической флоры взаимодействуют с TLR с последующей передачей стимулирующего импульса на белок NFkB, вследствие чего последний транспортируется в ядро клетки. Активация NFkB приводит к переключению дифференцировки Th0-лимфоцитов на Thl-путь и стимуляции выработки провоспалительных цитокинов. Пробиотические штаммы лактобактерий (LGG, L. acidophylus), E. faecium, Str. thermophylus воспринимаются TLR и стимулируют ответ хозяина, усиливая выработку Th1 и IL-1, INF-альфа. Они стимулируют фагоцитарную активность нейтрофилов и выработку sIgА. В то же время бифидобактерии оказывают стимулирующее воздействие на Th-reg и, соответственно, выработку TGF-бета, IL-10, способствуя формированию иммунологической толерантности. Этот процесс сопровождается снижением синтеза IgE и усилением синтеза sIgA. Наиболее активно повышают уровень IL-10 В. longum, B. bifidum, B. infantis. Пробиотики, в состав которых входят симбионтные штаммы бактерий, аэробы и анаэробы, вероятно, могут оказывать более многоплановое и мощное иммуномодулирующее действие, чем монокомпонентные препараты.
Иммунорегулирующее действие пробиотиков расширяет возможности их использования и раскрывает широкие перспективы для применения в разных клинических ситуациях. Например, с позиций гастроэнтеролога эффективность пробиотических средств изучается в лечении заболеваний, ассоциированных с инфекцией Helicobacter pylori, воспалительных заболеваний кишечника, диффузных заболеваний печени, а также функциональной патологии кишечника. Мы имеем собственный опыт применения поликомпонентного пробиотика Линекс в лечении пациентов с язвенной болезнью, ассоциированной с инфекцией H. pylori. Эффективность включения Линекса в качестве препарата сопровождения к стандартной эрадикационной терапии тестировалась в открытом когортном проспективном рандомизированном (метод простой рандомизации с помощью конвертов) исследовании с включением 30 пациентов. Полученные нами данные свидетельствуют, что комбинация стандартной антихеликобактерной терапии с пробиотиком существенно снижает частоту развития синдрома кишечной диспепсии посредством протективного действия в отношении кишечного микробиоценоза, повышает приверженность пациентов к лечению и, таким образом, способствуют эрадикации инфекта.
Иммуногенный потенциал пробиотических средств привлекает внимание не только специалистов-гастроэнтерологов, но и врачей других специальностей, являясь отражением необходимости междисциплинарного подхода к восстановлению микроэкологического статуса макроорганизма. Так, проблема лечения и профилактики рецидивирующего бактериального вагиноза все чаще заставляет искать возможности восстановления физиологической микрофлоры влагалища путем нормализации кишечного биотопа для достижения адекватного функционирования местного иммунного ответа слизистых оболочек.
Бактериальный вагиноз — общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа и сопровождающийся чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища. Трудности в курации пациенток с бактериальным вагинозом определяются нередким сочетанием с папилломавирусной инфекцией (ПВИ) гениталий у женщин и другими инфекциями, передаваемыми половым путем (ИППП). Восстановление микробиоценоза влагалища уменьшает риск ИППП, и способствует улучшению репродуктивного здоровья и качества жизни женщин.
Пероральная терапия пробиотиками в лечении бактериального вагиноза
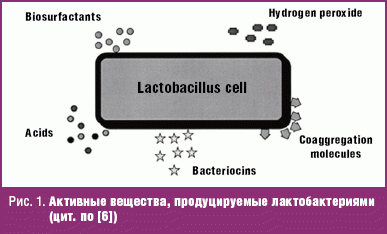
Предпосылкой к разработке схем терапии бактериального вагиноза с включением в антибактериальную терапию приема пробиотических культур послужило появление доказательств об эффективности определенных штаммов пробиотических культур при прямом введении во влагалище или когда они восходят из прямой кишки после перорального приема, а также благодаря их иммуногенному потенциалу. Как минимум для двух штаммов лактобактерий (Lactobacullus rhamnosus GR-1 и L. fermentum RC-1) доказана возможность колонизации влагалища восходящим путем. Основной акцент в отношении лактобактерий сделан в связи с тем, что именно лактобациллы доминируют в микробном пейзаже влагалища. Эти физиологические бактерии продуцируют кислоты, бактериоцины, перекись кислорода, биосульфактанты, препятствуют колонизации патогенной и грибковой флоры (рис. 1).
Результаты проведенных контролируемых исследований подтверждают положительный эффект применения пробиотиков, в том числе и перорально, при бактериальном вагинозе, рецидивирующих инфекциях мочеполового тракта и вульвовагинальном кандидозе у женщин. В 2007 году был опубликован систематизированный обзор, включивший результаты адекватных контролируемых исследований, посвященных оценке эффективности пробиотической терапии в лечении больных бактериальным вагинозом. Результаты клинических исследований с пероральным приемом пробиотиков разнились в зависимости от стартового фона микробиоценоза (не только влагалища, но и кишечника), наличия сопутствующей соматической патологии, а также вида назначенных пробиотических культур. Вместе с тем была отмечена эффективность, статистически достоверно превышающая эффект плацебо, перорального приема культур L. аcidophilus, L. rhamnosus GR-1, L. fermentum RC-14 при условии их приема от 14 дней до 2 месяцев в лечении бактериального вагиноза.
Эффективность пробиотических культур, содержащих лактобактерии, в качестве средств сопровождения к антибактериальной терапии, статистически достоверно выше плацебо и составляет от 60% (р = 0,004) до 88% (р Купить номер с этой статьей в pdf
Бактерийные и биологические препараты для коррекции дисбиозов и их рациональное применение
Статья опубликована в «Омской медицинской газете» №8 (29), май 1997 г.
В последние годы получили распространение новые подходы к лечению, связанные с восстановлением естественной экологии организма и основанные на использовании активных биологических продуктов. Одним из аспектов такого подхода является нормализация измененного микробного пейзажа организма при помощи бактерийных и биопрепаратов. В настоящее время усилиями новых промышленных и коммерческих структур традиционно существовавший дефицит бактерийных и биопрепаратов в основном снят. Более того, помимо таких давно знакомых препаратов, как бифидумбактерин, лактобактерин, колибактерин и бификол, появилось множество новых средств, среди которых трудно ориентироваться врачам, фармацевтам и пациентам. Надеемся, что предложенная в данной публикации систематизация бактерийных препаратов, предназначенных для коррекции биоценоза слизистых оболочек, поможет более полному и эффективному использованию всего их богатого арсенала в повседневной практике.
1.1.Препараты семейства бифидобактерий.
Самым известным и широко применяемым препаратом-эубиотиком является Бифидумбактерин, содержащий бифидобактерии вида бифидум. Именно этот вид бифидобактерий преобладает в кишечнике у новорожденных и детей первых лет жизни, поэтому бифидумбактерин является базовым препаратом для коррекции биоценоза кишечника у детей. Показания к применению бифидумбактерина очень широкие, но основными из них являются дисфункции кишечника вследствие дисбактериоза, острые кишечные инфекции (ОКИ), применение с профилактической целью у ослабленных детей с анемией, рахитом, диатезом и при раннем переводе детей с грудного на искусственное вскармливание и т.д..
Существует четыре основные формы выпуска Бифидумбактерина: флаконная, ампульная, таблетированная и в порошках в пакетах из ламинированной фольги. Применение бифидумбактерина в педиатрии диктует чрезвычайно жесткие требования к качеству препарата, и, прежде всего по отсутствию посторонней микрофлоры. В связи с этим, таблетированная форма бифидумбактерина разрешена к применению только с трех лет. С неонатального периода разрешен к применению только Бифидумбактерин в порошке, флаконах или ампулах. Ряд существенных преимуществ имеет форма Бифидумбактерина в порошке производства АО «Партнер», которая представляет собой смесь сухих бифидобактерий с химически чистой лактозой, упакованную в газонепроницаемые пакеты из ламинированной алюминиевой фольги. Технология производства этого препарата предусматривает удаление среды культивирования и практически полное отсутствие (менее 10%) мертвых бактериальных клеток. Поэтому при растворении препарата образуется почти бесцветная опалесцирующая взвесь без выраженного запаха и вкуса. Лактоза, способствующая росту бифидобактерий в кишечнике, несколько увеличивает время растворения препарата.
Бифидумбактерин в свечах используется для лечения дисфункции кишечника с поражением его дистальных отделов (колиты, проктиты) и в гинекологической практике (сенильные неспецифические бактериальные кольпиты, бактериальные вагинозы, нарушение чистоты влагалища 3-4 степени, подготовка родовых путей к родам и т.п.).
Бифидин в качестве действующего вещества содержит бифидобактерии вида адолесцентис, которые обладают более широким спектром ферментации углеводов. Однако данный вид бифидобактерий вегетирует в кишечнике взрослых и детей старше трех лет. У детей до года бифидобактерии адолесцентис встречаются только в случае их искусственного вскармливания. Препарат назначается детям старше трех лет при кишечных расстройствах сопровождающихся дисбактериозом, больным детям на раннем искусственном вскармливании, при затяжном течении кишечных дисфункций, при повторном выделении возбудителей после ОКИ.
Бифилонг содержит бифидобактерии вида лонгум, являющимися вторыми по количественному содержанию после бифидобактерий вида бифидум представителями нормальной микрофлоры детей, находящихся на грудном вскармливании. Промышленный выпуск Бифидина и Бифилонга в настоящее время не осуществляется.
В Новосибирске, в ЗАО «НПФ Вектор-Биомед» освоен выпуск Концентрата бифидобактерий, представляющего собой взвесь бифидобактерий, вида бифидум в культуральной молочной среде. Препарат зарегистрирован как пищевая добавка и распространяется через дистрибьютерскую сеть врачей. В качестве достоинства Концентрата указывается на то, что бифидобактерии в препарате находятся в фазе роста и, следовательно, они более активные. Однако тот факт, что для достижения клинического эффекта требуется прием Концентрата в дозах, в десятки раз превышающий те, что используются при лечении фармакопейным бифидумбактерином (соответственно 8000 и 300 доз) позволяет усомниться в этом.
В Новосибирске в ООО «Био-Веста», выпускается почти аналогичный препарат — Жидкий концентрат бифидобактерий (Биовестин), действующим веществом в котором выступают бифидобактерии вида адолесцентис, особенности применения которых названы выше.
1.2. Препараты семейства лактобактерий
Лактобактерии вместе с бифидобактериями являются также основными представителями нормальной микрофлоры человека. Лактобактерии присутствуют во всех отделах пищеварительного тракта, начиная с полости рта и, кончая толстой кишкой, являются превалирующей флорой генитального тракта, обнаруживаются в грудном молоке.
Первые попытки лечебного применения лактобактерий для коррекции биохимических процессов, протекающих в кишечнике, предпринимались И.И.Мечниковым еще 100 лет назад. В последующем была обнаружена выраженная антагонистическая активность лактобактерий против гнилостных условно-патогенных микроорганизмов и возбудителей острых кишечных и инфекций, которая связывается со способность лактобацилл образовывать молочную кислоту, перекись водорода, лизоцим и другие вещества с противомикробным действием к широкому спектру грампозитивных и грамнегатиивных бактерий. Выявлены репаративные свойства и иммунномодулирующая роль лактобактерий, проявляющаяся в частности в способности повышать общий уровень секреторного Ig A и титры специфических секреторных антител, усиливать фагоцитоз и др. Обсуждается роль лактобактерий в снижении уровня холестерина в крови, в предупреждении продукции канцерогенов и в разрушении щавелевой кислоты, препятствуя тем самым образованию в организме оксалатов.
В нашей стране широко используется препарат Лактобактерин, созданный в начале 70-х годов на основе лактобактерий вида плантарум (plantarum), оказывающие как и бифидобактерии, антагонистическое действие в отношении патогенных и условно-патогенных микроорганизмов. Показания к его применению схожи с таковыми у бифидумбактерина.
В Московском НИИ Эпидемиологии и Микробиологии им.Г.Н.Габричевского был разработан новый препарат Ацилакт, в состав которого входят лактобактерии вида ацидофилус (acidophilus). В отличие от лактобактерий вида плантарум, используемые для приготовления Ацилакта ацидофильные лактобактерии принадлежат к категории облигатных для человека микроорганизмов. Критериями для отбора нового промышленного вида лактобактерий служили способность бактерий к кислотообразованию, противомикробная активность, адгезивные свойства, способствующие длительному сохранению в кишечнике, устойчивость к действию пищеварительных секретов и применяемым антибиотикам. Всем этим условиям соответствуют новый препарат Ацилакт.
Ацилакт применяют по показаниям, общими с другими бактерийными препаратами: дисбактериозы кишечника, острые кишечные инфекции, хронические энтероколиты, а также воспалительные заболевания слизистой оболочки полости рта. Поскольку Ацилакт характеризуется повышенной кислотообразующей активностью, он предпочтителен для лечения дисбактериозов у больных с гипоацидными состояниями и сниженной перистальтикой кишечника.
Уменьшенное содержание в Ацилакте лактозы, в сочетании с высокой способностью составляющих основу препарата ацидофильных лактобактерий расщеплять лактозу, делают Ацилакт средством выбора для лечения дисбактериозов кишечника у пациентов с непереносимостью молока (лактазной недостаточностью).
Применение Ацилакта в течение 2-3-х курсов у детей с атопическим дерматитом приводит к нормализации исходно угнетенного иммунитета и улучшению клинической симптоматики.
Ацилакт может использоваться для лечения гинекологических заболеваний, сопровождающихся нарушением вагинальной микрофлоры, однако в данном случае более удобно применение Ацилакта в свечах. В норме микрофлора влагалища представлена преимущественно лактобактериями, так называемыми палочками Дедерлейна, которые поддерживают во влагалище кислую среду и подавляют рост условно-патогенных микроорганизмов. Ацилакт в свечах применяют при патологических состояниях, связанных с дефицитом лактофлоры женских половых путей, которые особо значимы при следующих заболеваниях:
Противопоказанием к назначению Ацилакта в свечах является кандидоз, так как в некоторых случаях быстрое смещение pH в кислую сторону способствует росту грибков. Ацилакт в данном случае используется после специфической противогрибковой терапии или после применения Бифидумбактерина в свечах.
Выпускается также Ацилакт в таблетках, применение которого путем рассасывания во рту показано при воспалительных заболеваниях десен и слизистой ротовой полости
1.3.Препараты семейства колибактерий
Комбинированный препарат Бификол содержит бифидобактерии вида бифидум и кишечную палочку штамма М-17, следовательно, его действие и показания к применению во многом схожи с таковыми у Бифидумбактерина и Колибактерина.
За рубежом также выпускается немало препаратов-эубиотиков, однако из-за высокой стоимости попытки их широкого внедрения на российском фармацевтическом рынке до сих пор успеха не имели.
Бифиформ (Ferrosan) выпускается в капсулах с желудочнонерастворимым покрытием и содержит бифидобактерии вида бифидум и энтерококки.
Другой большой класс биопрепаратов, используемых для коррекции дисбактериоза и лечения диарейных заболеваний составляют пробиотики. Пробиотики являются активаторами роста нормальной микрофлоры и выделяют вещества, подавляющие размножение патогенных микроорганизмов.
Все препараты на основе спор бактерий Bacillus subtilis имеют схожий механизм действия. Споры бацилл прорастают в вегетативную форму в тонкой кишке. Этот процесс достигает максимума в илеоцекальной области. При прорастании спор высвобождаются ферменты, способствующие расщеплению белков, жиров и углеводов, а также образуется кислая среда, препятствующая процессам гниения и росту патогенных бактерий. Кроме того, ферменты вызывают непосредственный лизис клеточных стенок протея, кишечной палочки, патогенного стафилококка. Поскольку данный штамм бацилл получен искусственным путем и не является физиологическим компонентом биоценоза кишечника, при назначении препаратов из спорообразующих микроорганизмов рекомендуется осторожность: применение их короткими курсами и при слабом эффекте от предшествующего использования бактерийных препаратов-эубиотиков.
Более физиологично действие препарата Линекс (Lek), содержащего в качестве активных действующих веществ ацидофильные лактобактерии бактерии, бифидобактерии вида инфантис и фекальные стрептококки. Молочнокислые бактерии продуцируют молочную, уксусную и пропионовые кислоты. Создаваемая ими в кишечнике кислая среда является неблагоприятной для роста патогенных микроорганизмов. Молочнокислые бактерии участвуют в резорбции моносахаридов, стабилизируют мембраны клеток кишечного эпителия и регулируют всасываемость электролитов. Представители нормальной микрофлоры (бифидобактерии и фекальные стрептококки) способствую при этом восстановлению биоценоза кишечника.
Энтерол (Biocodex) содержит лиофилизированные грибки Sacchoromyces boulardii. Препарат нормализует нарушенное равновесие кишечной микрофлоы, способствует выработке лимфоидными клетками слизистой кишечника секреторного Ig A. Энтерол эффективен при диареях, обусловленных приемом антибиотиков, в том числе при псевдомембранозном колите, вызываемом клостридиальной спорообразующей микрофлорой.
Необычные свойства обнаружены у синтетического ингибитора протеолитических ферментов препарата ПАМБА (BYK GULDEN). ПАМБА увеличивает рост лактобацилл, бифидобактерий и кишечных палочек, одновременно снижая в протеолитическую активность протеев, псевдомонад и других микроорганизмов и усиливая макрофагальный фагоцитоз.
Бифидогенными свойствами обладает также пантотеновая кислота (Кальция пантотенат, Пантенол), входящая в состав многих поливитаминных препаратов, или используемая в виде отдельного препарата.
Для санации слизистых оболочек, кожных покровов и раневых поверхностей от патогенных и условнопатогенных бактерий с успехом применяются специфические бактериофаги. Бактериофаги являются вирусами, поражающими исключительно бактерии, относятся к экологически безопасным для человека биологическим объектам и могут быть использованы для лечения дисбактериозов, ОКИ, гнойных инфекций кожи в любом возрасте.
Бактериофаги, подобно другим вирусам, являются абсолютными внутриклеточными паразитами, их размножение происходит в живой клетке. Проникнув в бактерию через расположенные на ее поверхности фагоспецифические рецепторы, ДНК фага изменяет синтезирующие механизмы клетки, заставляя бактерию синтезировать ДНК и белки фага. На определенном этапе бактерия разрушается, и из нее выходит новое поколение дочерних бактериофагов. Важным свойством бактериофагов является их высокая специфичность, они избирательно лизируют бактерии не только определенного вида, но даже их отдельные серологические группы. Бактериофаги безошибочно находят и уничтожают только те бактерии, против которых направлено их действие, не затрагивая нормальную микрофлору организма, не говоря уже о его собственных клетках. Именно этим и объясняется отсутствие побочных эффектов и противопоказаний к применению бактериофагов, что делает особенно привлекательным их использование в педиатрической практике. Возникновение у бактерий антибиотикоустойчивости не сказывается на их чувствительности к бактериофагам, поэтому последние зачастую активны даже в отношении полирезистентной госпитальной микрофлоры. Однако следует учитывать специфичность бактериофагов: каждый вид фага распознают в качестве своей мишени только те серотипы бактерий, которые имеют определенные фагоспецифические рецепторы. Поэтому назначать бактериофаги необходимо под микробиологическим контролем чувствительности к ним данного возбудителя.
Отечественная промышленность выпускает большой спектр лекарственных бактериофагов: Стафилококковый, Стрептококковый, Коли, Протейный, Синегнойный, Клебсиеллезный, Брюшнотифозный, Дизентерийный, Сальмонеллезный. Имеются и их комбинированные формы: Колипротейний бактериофаг, Интести бактериофаг (содержит фаги шигелл Флекснера серовара 1,2,3,4,6 и Зонне, сальмонелл (паратифа А и В, энтерилитис, тифимуриум, холера суис, ораниенбург), энтеропатогенных групп кишечной палочки, протея вульгарис и мирабилис, стафилококков, синегнойной палочки и патогенных энтерококков), Пиобактериофаг комбинированный (содержит фаги стафилококков, стрептококков, патогенной кишечной палочки, протея и синегнойной палочки). Созвучный, но все-таки иной препарат Пиобактериофаг поливалентный очищенный содержит фаги стафилококков, стрептококков, патогенной кишечной палочки, синегнойной палочки, протея и клебсиелл пневмонии. Данный препарат отличается наиболее высокой степенью очистки от бактериальных метаболитов, что значительно улучшает его вкусовые качества и делает средством первого выбора у детей до года. Бактериофаг клебсиелл поливалентный очищенный активен в отношении клебсиелл пневмонии, озены, риносклеромы. Бактериофаг обычно выпускаются в жидкой форме или в таблетках, в настоящее время также налажен выпуск Пиобактериофага комбинированного и Стафилококкового бактериофага в форме линимента.
Пока наибольшее распространение бактериофаги нашли в лечении дисбактериозов кишечника, острых кишечных инфекций, энтероколитов, гнойно-воспалительных заболеваний горла и носа. Однако область их клинического применения значительно шире и они могут быть с успехом использованы для лечения хирургической, уро-генитальной, кожной и других инфекций.
4. ИММУНОГЛОБУЛИНОВЫЕ ПРЕПАРАТЫ
Принципиально новое направление в терапии дисбактериозов и ОКИ связано с созданием на шей стране оригинального лекарственного средства Комплексный иммуноглобулиновый препарат (КИП) КИП содержит иммуноглобулины человека трех классов: Ig A (15-25%), Ig M (15-25% ) и Ig G (50-70%). От всех других иммуноглобулиновых препаратов, применяемых в России, КИП отличает высокое содержание Ig A и Ig M, повышенная концентрация антител к энтеропатогенным бактериям кишечной группы (шигеллы, сальмонеллы, эшерихии, клебсиеллы и др.), высокая концентрация антител к ротавирусам, а также пероральный способ применения.
Входящий в состав КИПа Ig M оказывает бактерицидный эффект на патогенные микроорганизмы, Ig A затрудняет их прикрепление к эпителию слизистой оболочки, размножение и обеспечивает быстрое удаление из кишечника, Ig G нейтрализует микробные токсины и вирусы, опосредует «прилипание» бактерий к макрофагам с последующим их фагоцитозом. Помимо выведения из организма патогенных и условно-патогенных микроорганизмов, КИП способствует росту нормальной микрофлоры кишечника (бифидобактерий, лактобактерий, энтерококков и непатогенных кишечных палочек), повышает выработку секреторного Ig A и нормализует измененные показатели системного иммунитета. Пероральный способ приема КИПа обеспечивает поступление больших доз действующего вещества к месту поражения с последующим снижением адсорбции патогенов на клетках эпителия слизистой оболочки кишечника и местным иммуномодулирующим эффектом.
В ходе крупного сравнительного исследования показано, что среди всевозможных схем лечения ОКИ у детей именно терапия КИПом дает наилучшие результаты, оцениваемые по таким параметрам, как продолжительность симптомов интоксикации и диарейного синдрома, повторный высев возбудителей, изменения биоценоза кишечника и динамика основных показателей иммунитета.
Отмечено положительное влияние КИПа при терапии аллергодерматозов. Это объясняется повышением уровня секреторного Ig A, в результате чего усиливается местная резистентность слизистой ЖКТ и увеличивается выведение из кишечника поступающих с пищей аллергенов.
Основными показаниями к применению КИПа являются следующие заболевания и патологические процессы:
В НИИ эпидемиологии и микробиологии им Г.Н.Габричесвского совместно с ффирмой «Алфарм» разработан комбинированной препарат Кипферон в ректальных и вагинальных свечах, в состав которого входит КИП в количестве 50 мг и рекомбинантный интерферон- альфа2а в дозе 500.000 МЕ.
Для коррекции кишечной микрофлоры применяются специальные пищевые добавки, содержащие пищевые волокна, относящиеся к углевадам, которые не подвергаются перевариванию под действием пищеварительных ферментов, но служат питательным субстратом для микрофлоры толстого кишечника. К пищевым волокнам, оказывающим стимулирующий эффект на кишечную микрофлору относятся олигосахариды, в частности фруктоолигосахариды, наиболее известным представителем которых является инулин. Большое количество инулина содержится в корнеплодах топинамбура. Существуют несколько пищевых добавок содержащих концентрат топинамбура (Концентрат топинамбура, Топивит, Концентрат иерусалимского артишока и др.). Фруктоолигосахариды и, в частности, инулин существенно стимулируют рост бифидобактерий в кишечнике, изменяют pH толстого кишечника в кислую сторону, способствуют образованию в кишечнике короткоцепочных жирных кислот и других биологически активных веществ оказывающих благоприятное действие на биоценоз кишечника.
6. ЛЕЧЕБНЫЕ КИСЛОМОЛОЧНЫЕ ПРОДУКТЫ
7. РАЦИОНАЛЬНАЯ ТЕРАПИЯ БОЛЬНЫХ С ДИСБАКТЕРИОЗОМ КИШЕЧНИКА
Схема коррекции дисбактериоза кишечника может быть разделена на несколько этапов.
1. Санация кишечника от условно-патогеной микрофлоры. Традиционное лечение больных с дисбактериозом кишечника предусматривает предварительную деконтаминацию кишечника при помощи противомикробных средств. Однако последние нередко вызывают побочные эффекты, затрудняющие составление рациональной программы лечения, особенно для ребенка. В большинстве случаев возможна эффективная и безопасная деконтаминация кишечника от условно-патогенных бактерий путем замены противомикробных средств на более безопасные и высокоэффективные бактерийные препараты: КИП и бактериофаги. Энтеральный прием КИПа по 1 дозе 1-2 раза в день оказывает санирующее действие в отношении большинства грамотрицательных энтеропатогенных бактерий (эшерихий, клебсиелл, протеев, а также шигелл и сальмонел). В зависимости от присутсвующей условно-патогенной микрофлоры дополнительно внутрь назначаются бактериофаги (Интести-бактериофаг, Пиобактериофаг комбинированный, Пиобактериофаг поливалентный очищенный, Стафилококковый или Клебсиеллезный бактериофаги). При наличии избыточного роста клостридий применяется Энтерол.
Одновременно с началом лечения больной принимает витамины А, Е и группы В в составе поливитаминных препаратов (Глутамевит, Компливит, Квадевит, Юникап-М, Центрум и др.), ферментные препараты: Фестал, Панзинорм-Форте, Дигестал (при запорах) или Мезим-Форте, Панкреатин, Панкурмен, Панцинтрат (при диарейном синдроме).
При проведении данной терапии необходимо иметь ввиду, что дисбактериоз является не самостоятельной нозологической единицей, а только патогенетическим звеном основного заболевания, поэтому главное внимание должно быть направлено именно на его расшифровку и лечение.
Таким образом, врачи и пациенты сегодня имеют достаточный выбор средств для сохранения и поддержания равновесия нормальной микрофлоры организма. Задача состоит в рациональном и направленном их применении с учетом индивидуальных особенностей биоценоза у конкретного больного, что зависит от понимания различий в действии отдельных препаратов и ясным представлением терапевтических целей, преследуемых при их назначении.