Ацилакт или бифидумбактерин свечи что эффективнее
Бактериальный вагиноз: место пероральной пробиотической терапии
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма.
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма. Значительная часть (более 60%) микрофлоры заселяет различные отделы желудочно-кишечного тракта, примерно 15% приходится на ротоглотку, на урогенитальный тракт — 11%(из них на вагинальный отдел — 9%), 14% — на кожные покровы. Одновременная эволюция организма хозяина и микроорганизмов благодаря двунаправленному обмену способствовала закреплению взаимовыгодных коллективных взаимодействий. Резидентные микроорганизмы, взаимодействующие с человеком на протяжении тысячелетий, контактируют с толл-подобными рецепторами (toll-like receptors (TLR)) слизистых оболочек пищеварительного тракта. Активация TLR влияет на секрецию цитокинов мукоцитами, воздействуя, таким образом, на дальнейший процессинг и презентацию антигенов бактерий клеткам хозяина, выработку и секрецию иммуноглобулина А, связанного с секреторным компонентом лизоцима, лактоферрина и других биологически активных веществ.
Взаимодействие между физиологической микрофлорой и организмом хозяина происходит на поверхности слизистых оболочек, из которых самой большой по площади является слизистая оболочка кишечника.
Попытки воздействовать на кишечный биоценоз и через него — на здоровье человека имеют долгую историю. Еще И. И. Мечников в 1910 г. предлагал использовать кисломолочные продукты для омоложения и продления жизни.
Сегодня фармацевтический рынок предлагает практическому врачу широкий спектр лекарственных средств, способствующих нормализации микробиоценоза толстой кишки. Все средства, положительно влияющие на состав кишечной микрофлоры, можно разделить на пробиотики, пребиотики и синбиотики.
Пробиотики представляют собой гетерогенную группу непатогенных бактерий. С 30-х годов прошлого столетия ведут отсчет препараты, содержащие лактобактерии и бифидобактерии, так называемые пробиотики. В соответствии с определением рабочей группы ВОЗ к ним относят живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.
Препараты, входящие в группу пробиотиков, должны соответствовать следующим требованиям:
В ходе международного конгресса гастроэнтерологов (Монреаль, 2005 г.) было дано определение пробиотиков как препаратов на основе кишечных комменсалов, способных осуществлять биологический контроль в организме и обладающих регуляторными, триггерными свойствами. Такой биологический потенциал пробиотиков объясняется многочисленными метаболическими эффектами энтеральной микрофлоры, включая синтез витаминов В и К, короткоцепочечных жирных кислот, инактивацию пищевых канцерогенов, бактериальную ферментацию некоторых лекарственных препаратов, синтез сигнальных молекул и др.
К пробиотикам относят такие препараты, как Линекс, Энтерол, Бактисубтил, Бифидумбактерин, Лактобактерин и др. Пробиотики подразделяются по количеству входящих в состав препарата культур на монокомпонентные (Бифидумбактерин, Энтерол, Бактисубтил и т. д.) и поликомпонентные (Линекс), а также по свойству пробиотической культуры на самоэлиминирующиеся антагонисты (Энтерол, Бактисубтил) и на бифидосодержащие, лактосодержащие и колисодержащие. Например, препарат Линекс относится к поликомпонентным бифидо- и лактосодержащим пробиотикам, так как в его состав входят три микроорганизма — Bifidobacterium infantis, Lactobacillus acidophilus и Enterococcus faecium. Комбинированные пробиотики отличаются большей эффективностью в сравнении с монокомпонентными: лактобактерии и энтерококк преимущественно колонизируют тонкую кишку, а бифидобактерии — толстую, поэтому пробиотические культуры наиболее физиологично поддерживают колонизационную резистентность и способствуют выполнению функций индигенной кишечной микрофлоры.
Пребиотики представляют собой стабилизаторы среды обитания и стимуляторы роста нормальной микрофлоры. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством — стимулировать рост и развитие нормальной микрофлоры кишечника. К пребиотикам относят лактулозу, глюкозу, протеины, камедь, аминокислоты, витамины и минералы, каолин, пищевые волокна, инулин и олигофруктозу.
Комбинированные средства, сочетающие в себе как про-, так и пребиотический компоненты, относят к синбиотикам (например, Линекс Био).
Действие пероральной пробиотической терапии не сводится к простому заселению кишечника, как это зачастую представляется. Их влияние более сложно и многопланово. Это и конкуренция с патогенной и условно-патогенной микрофлорой; адгезия к слизистой оболочке кишечника и взаимодействие с эпителиоцитами; иммуномодулирующий эффект. Микробные липополисахариды и гликопептиды пробиотической флоры взаимодействуют с TLR с последующей передачей стимулирующего импульса на белок NFkB, вследствие чего последний транспортируется в ядро клетки. Активация NFkB приводит к переключению дифференцировки Th0-лимфоцитов на Thl-путь и стимуляции выработки провоспалительных цитокинов. Пробиотические штаммы лактобактерий (LGG, L. acidophylus), E. faecium, Str. thermophylus воспринимаются TLR и стимулируют ответ хозяина, усиливая выработку Th1 и IL-1, INF-альфа. Они стимулируют фагоцитарную активность нейтрофилов и выработку sIgА. В то же время бифидобактерии оказывают стимулирующее воздействие на Th-reg и, соответственно, выработку TGF-бета, IL-10, способствуя формированию иммунологической толерантности. Этот процесс сопровождается снижением синтеза IgE и усилением синтеза sIgA. Наиболее активно повышают уровень IL-10 В. longum, B. bifidum, B. infantis. Пробиотики, в состав которых входят симбионтные штаммы бактерий, аэробы и анаэробы, вероятно, могут оказывать более многоплановое и мощное иммуномодулирующее действие, чем монокомпонентные препараты.
Иммунорегулирующее действие пробиотиков расширяет возможности их использования и раскрывает широкие перспективы для применения в разных клинических ситуациях. Например, с позиций гастроэнтеролога эффективность пробиотических средств изучается в лечении заболеваний, ассоциированных с инфекцией Helicobacter pylori, воспалительных заболеваний кишечника, диффузных заболеваний печени, а также функциональной патологии кишечника. Мы имеем собственный опыт применения поликомпонентного пробиотика Линекс в лечении пациентов с язвенной болезнью, ассоциированной с инфекцией H. pylori. Эффективность включения Линекса в качестве препарата сопровождения к стандартной эрадикационной терапии тестировалась в открытом когортном проспективном рандомизированном (метод простой рандомизации с помощью конвертов) исследовании с включением 30 пациентов. Полученные нами данные свидетельствуют, что комбинация стандартной антихеликобактерной терапии с пробиотиком существенно снижает частоту развития синдрома кишечной диспепсии посредством протективного действия в отношении кишечного микробиоценоза, повышает приверженность пациентов к лечению и, таким образом, способствуют эрадикации инфекта.
Иммуногенный потенциал пробиотических средств привлекает внимание не только специалистов-гастроэнтерологов, но и врачей других специальностей, являясь отражением необходимости междисциплинарного подхода к восстановлению микроэкологического статуса макроорганизма. Так, проблема лечения и профилактики рецидивирующего бактериального вагиноза все чаще заставляет искать возможности восстановления физиологической микрофлоры влагалища путем нормализации кишечного биотопа для достижения адекватного функционирования местного иммунного ответа слизистых оболочек.
Бактериальный вагиноз — общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа и сопровождающийся чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища. Трудности в курации пациенток с бактериальным вагинозом определяются нередким сочетанием с папилломавирусной инфекцией (ПВИ) гениталий у женщин и другими инфекциями, передаваемыми половым путем (ИППП). Восстановление микробиоценоза влагалища уменьшает риск ИППП, и способствует улучшению репродуктивного здоровья и качества жизни женщин.
Пероральная терапия пробиотиками в лечении бактериального вагиноза
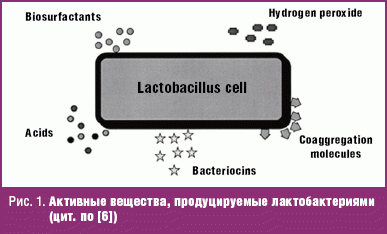
Предпосылкой к разработке схем терапии бактериального вагиноза с включением в антибактериальную терапию приема пробиотических культур послужило появление доказательств об эффективности определенных штаммов пробиотических культур при прямом введении во влагалище или когда они восходят из прямой кишки после перорального приема, а также благодаря их иммуногенному потенциалу. Как минимум для двух штаммов лактобактерий (Lactobacullus rhamnosus GR-1 и L. fermentum RC-1) доказана возможность колонизации влагалища восходящим путем. Основной акцент в отношении лактобактерий сделан в связи с тем, что именно лактобациллы доминируют в микробном пейзаже влагалища. Эти физиологические бактерии продуцируют кислоты, бактериоцины, перекись кислорода, биосульфактанты, препятствуют колонизации патогенной и грибковой флоры (рис. 1).
Результаты проведенных контролируемых исследований подтверждают положительный эффект применения пробиотиков, в том числе и перорально, при бактериальном вагинозе, рецидивирующих инфекциях мочеполового тракта и вульвовагинальном кандидозе у женщин. В 2007 году был опубликован систематизированный обзор, включивший результаты адекватных контролируемых исследований, посвященных оценке эффективности пробиотической терапии в лечении больных бактериальным вагинозом. Результаты клинических исследований с пероральным приемом пробиотиков разнились в зависимости от стартового фона микробиоценоза (не только влагалища, но и кишечника), наличия сопутствующей соматической патологии, а также вида назначенных пробиотических культур. Вместе с тем была отмечена эффективность, статистически достоверно превышающая эффект плацебо, перорального приема культур L. аcidophilus, L. rhamnosus GR-1, L. fermentum RC-14 при условии их приема от 14 дней до 2 месяцев в лечении бактериального вагиноза.
Эффективность пробиотических культур, содержащих лактобактерии, в качестве средств сопровождения к антибактериальной терапии, статистически достоверно выше плацебо и составляет от 60% (р = 0,004) до 88% (р Купить номер с этой статьей в pdf
Ацилакт или бифидумбактерин свечи что эффективнее
Кафедра женских болезней и репродуктивного здоровья Национального медико-хирургического центра им. Н.И. Пирогова, Москва
Роль пробиотиков в лечении инфекций влагалища
Журнал: Российский вестник акушера-гинеколога. 2010;10(5): 33-39
Кира Е. Ф. Роль пробиотиков в лечении инфекций влагалища. Российский вестник акушера-гинеколога. 2010;10(5):33-39.
Kira E F. Role of probiotics in the treatment of vaginal infections. Russian Bulletin of Obstetrician-Gynecologist. 2010;10(5):33-39.
Кафедра женских болезней и репродуктивного здоровья Национального медико-хирургического центра им. Н.И. Пирогова, Москва
Кафедра женских болезней и репродуктивного здоровья Национального медико-хирургического центра им. Н.И. Пирогова, Москва
Расстройства деятельности нормальной микрофлоры, наблюдающиеся при дисбактериозах, тормозят целый ряд ферментативных каскадов (расщепление и реабсорбция энтерокиназы и щелочной фосфатазы), приводят к выраженным нарушениям витаминообразования, особенно витаминов групп В и К, способствуют угнетению факторов местного иммунитета, что отрицательно сказывается на течении физиологических процессов и на общем состоянии организма. С этих позиций проблема борьбы с дисбактериозом приобретает большую актуальность для акушерства и гинекологии, а разработка и внедрение рациональных средств восстановления нормальной микрофлоры рассматриваются как один из путей повышения эффективности специфического лечения.
Пробиотиками называют препараты, содержащие живые микроорганизмы в управляемом достаточном количестве, благодаря которым поддерживается оптимальный уровень здоровья хозяина. При назначении в адекватных количествах они оказывают благотворное влияние на состояние макроорганизма путем изменения свойств нормальной микрофлоры.
Однако в последующем было установлено, что пробиотические микроорганизмы чувствительны к большинству групп антимикробных препаратов. Вследствие этого целесообразность одновременного применения пробиотиков с большинством используемых в клинической практике антибиотиков сомнительна.
Интересные исследования были проведены McLean N.W. и McGroaty J.A. [13]. Они культивировали в присутствии метронидазола чувствительные к нему штаммы G. vaginalis, после чего последние приобрели к данному препарату устойчивость. Было установлено, что метронидазолустойчивые штаммы в меньшей степени подавляют рост культуры лактобацилл. Кроме того, авторы показали, что низкие значения рН и наличие молочной кислоты подавляют активность культуры лактобацилл на 60-95%, в то время как подавляющая активность перекиси водорода составляет всего 0-30%. Однако при наличии миелопероксидазы лактобациллы, продуцирующие Н2О2, снижают жизнеспособность метронидазолчувствительных штаммов G. vaginalis в 2000 (!) раз. Однако в другом исследовании высказано предположение, что Н2О2-продуцирующие лактобациллы предотвращают развитие только БВ, но не защищают от кандидоза или трихомоноза.
Современные пробиотики являются результатом селекции и комбинации различных составляющих, главными среди которых являются лактобактерии, обладающие протективными свойствами. Вот основные критерии, которым должны отвечать пробиотики:
1) жизнеспособность: в момент использования бактерии должны быть живыми;
2) сверх жизнеспособность: бактерии могут выжить в соляной кислоте желудка;
3) рост: возможен рост этих бактерий, изменения pH могут быть неблагоприятными для патогенных штаммов;
5) продукция бактерицидов очень важна в отношении качества неспецифической резистентности;
6) колонизация: пробиотические штаммы лактобактерий могут стать постоянными обитателями влагалища.
Пробиотики действуют следующим образом:
— восстанавливают вагинальную флору после различных ее нарушений;
— поддерживают и сохраняют микробное равновесие во влагалище;
— предупреждают расстройства, связанные с приемом антибиотиков;
— предупреждают рекуррентные инфекции.
Для оценки эффективности использования пробиотиков были разработаны критерии, которые представлены в табл. 2.
Большинство из известных в настоящий момент пробиотических штаммов микроорганизмов является частью нормальной микрофлоры организма или присутствует в пищевых продуктах, потребляемых уже несколькими поколениями людей по всему миру. Поэтому ВОЗ, FDA США и Организация по продуктам питания и сельскому хозяйству ООН (FAO) заключают, что пробиотики в целом считаются безопасными и имеют GRAS-статус (Generally Regarded As Safe). Это означает, что они могут использоваться без ограничения в пищевой и фармацевтической промышленности.
В последние годы наблюдается большой бум в отношении производства и применения пробиотиков. И это не только в Европе, но и на Северо-Американском континенте. Так, с целью лечения БВ применяли разработанный в Италии препарат прегин (PreGyn) (Sofar, Италия) в виде вагинальных ирригаций 1 раз в день в течение 6 дней. Один флакон для влагалищного душа содержал 10 9 КОЕ/ мл живых клеток Lactobacillus acidophilus человеческого происхождения. Этот препарат обладал тройным действием: гиперкислотообразованием, гидросмазкой и очищением. Авторы показали, что аминовый тест отсутствовал и рН влагалищного содержимого был 8 КОЕ/мл Lactobacillus acidophilus и рН менее 4,5. Во 2-й группе использовали вагинальные тампоны, пропитанные 10-15 мл 5% раствора уксусной кислоты. Результаты показали, что только коррекция рН влагалища и лактобациллярной флоры, необходимых для нормальной экологии влагалища, обеспечивают высокий процент излечения. Более 10 лет назад были опубликованы работы T. Chimura и соавт. [9], в которых авторы в качестве экологической терапии БВ успешно применяли коммерческий йогурт с рН 4,3±0,2 и препарат био-три (bio-three), в состав которого были включены E. faecalis Т-110, C. butyricum «k», B. mesentericus «k» при рН 6,9±0,3. Похожее исследование провели и другие исследователи, показавшие, что ежедневное употребление 150 мл йогурта, обогащенного живыми лактобактериями, приводит к высокому содержанию этих бактерий в прямой кишке и влагалище, что способствует снижению эпизодов бактериального вагиноза.
Так, G. Reid и соавт. [14, 15] сообщили о 37% успешного лечения БВ в плацебо-контролируемом исследовании орального применения пищевых добавок (лактогин), содержащих L. rhamnosus и L. fermentum в течение 60 дней. В отличие от этого, исследования, в которых использовались влагалищные свечи, содержащие L. аcidophilus, показали благоприятное воздействие приблизительно в 57% случаев, правда только в течение ограниченного периода. Также было показано благоприятное действие на биоценоз влагалища и тампонов, пропитанных L. fermentum, L. rhamnosus и L. gasseri, используемых в течение 5 дней после 3-дневного курса терапии свечами клиндамицина.
В 2007-2008 гг. нами проведено в соответствии со стандартам GCP многоцентровое рандомизированное плацебо-контролируемое исследование эффективности и безопасности лактогина (вагилака, капсулы для перорального применения) в терапии бактериального вагиноза. В данном исследовании приняли участие несколько центров Москвы, Санкт-Петербурга и Кемерова. Полученные результаты терапии бактериального вагиноза вагилаком и плацебо показали эффективность и безопасность исследуемого препарата. Выраженное и значительное улучшение сразу после окончания лечения отмечено у 30,0 и 13,3% больных, пролеченных вагилаком. То есть, суммарный положительный эффект составил на 16-17-й день лечения 43,3%. Через месяц после лечения положительный эффект зарегистрирован у 22 (73,2%) больных в группе получавших лактогин (вагилак). Были сделаны выводы, что вагилак безопасен при лечении БВ, способствует увеличению числа молочнокислых бактерий во влагалище и нормализует вагинальную микрофлору, а Lactobacillus rhamnosus GR-1 и Lactobacillus reuteri RC-14 восстанавливают естественную кислую среду во влагалище. В то же время ожидаемого эффекта от применения вагилака в качестве монотерапии БВ мы не получили. Этот пробиотик может стать альтернативой второго (восстановительного) этапа лечения БВ в тех случаях, когда по каким-либо причинам интравагинальное применение биопрепаратов невозможно.
Проведение комплексной этиотропной и патогенетической терапии БВ по разработанному нами двухэтапному методу позволило достичь стойкого клинического выздоровления у 92,6% больных, тем самим снизив частоту рецидивов до минимума (7,4%). Для трансплантации лактобактерий использовали лактобактерин, ацилакт, а также их комбинации с бифидумбактерином или бифидином [6].
A. Hallen и соавт. (1992) сообщили о двойном слепом плацебо-контролируемом изучении эффективности и безопасности экофемина при лечении бактериального вагинита в виде вагинальных свечей, содержащих лиофилизированные Lactobacillus acidophilus человеческого происхождения. Используемые бактерии производили H2O2. В эксперименте приняли участие 60 женщин. Сразу после лечения, по данным микроскопии нативного влажного мазка, у 16 из 28 женщин основной группы, которые лечились при помощи лактобактерий, восстановился вагинальный баланс микрофлоры. В группе плацебо ни у одной из 29 женщин не произошло восстановления микробного равновесия влагалища. После лечения лактобактериями у 12 из 16 женщин из влагалища исчезли Bacteroides. Активное лечение действительно восстановило нормальную вагинальную микрофлору у 57% пациенток. У некоторых женщин произошел рецидив бактериального вагинита, однако это произошло после последующей менструации, что подтверждает доказанную мной еще в 1987 г. эффективность и необходимость двухэтапного способа лечения. Как и при кандидозе, так и при БВ без предварительного восстановления биохимических и биофизических параметров применение лактобактерий или иных биологических препаратов бесперспективно.
З.М. Алиханова и А.Х. Коллаева [1] применяли лактофильтрум (лексир) у беременных орально и/или вагинально, при этом получили хороший эффект. Е.И. Карымова и А.А. Симонов [5] для профилактики послеоперационных осложнений перорально назначали пробиотик споробактерин жидкий по 1 мл 2 раза в сутки в течение 5 дней плюс 0,1 г сигетина. Однако в доступных нам источниках мы не нашли более подробных данных об этих препаратах, а представленные результаты еще далеки от доказательности.
О.Б. Калинкина и соавт. [4] в чем-то повторили опыт применения собственных лактобактерий, предложенный профессором А.А. Смородинцевым в 1929 г. Так, наши современники из Самары использовали собственные живые лактобактерии пациенток для формирования индивидуального биоценоза. Эта идея коррекции биоценоза влагалища из собственных лактобактерий, получаемых из влагалища (если это еще возможно) или из полости рта, или из прямой кишки, была апробирована нами еще в 1993 г. у 8 пациенток с рецидивирующим тяжелым БВ. Успешным лечение оказалось у 3 больных, еще у 2 наступила стойкая ремиссия. В 3 случаях лечение было безрезультатным.
Как уже неоднократно упоминалось выше, наиболее перспективным является двухэтапный метод лечения БВ, когда на первом этапе проводится коррекция биохимических и биофизических параметров влагалищного биотопа. Второй же этап предусматривает восстановление биоценоза влагалища за счет местного или орального применения ББП. Механизм терапевтической эффективности биопрепаратов является многофакторным и наряду с прямым воздействием на микрофлору включает стимуляцию репаративных процессов в слизистой оболочке влагалища, повышение иммунологической реактивности и общей неспецифической резистентности организма больной. Назначение ББП без предварительного первого этапа бесперспективно ввиду выраженной конкурентности между БВ-ассоциированными микроорганизмами и бактериями препаратов в пользу первых. По сути, введение во влагалище живых культур молочнокислых бактерий является «трансплантацией» этих микроорганизмов, и их «приживаемость» во многом зависит от эндокринного статуса пациентки, биохимического состояния биотопа влагалища, местного иммунитета и наличия факторов роста.
Механизм действия пробиотиков в лечении БВ окончательно не установлен, однако на основании проведенных исследований можно констатировать, что создание оптимальных физиологических условий во влагалище перед их назначением значительно улучшает адгезивные свойства молочнокислых бактерий, а добавление к препаратам пребиотиков обеспечивает необходимый питательный субстрат для лакто- и бифидобактерий.
Как видно из представленных материалов, не все лактобациллы (имеются в виду различные штаммы) и способы их применения (вагинальный, оральный) в одинаковой степени эффективны при лечении БВ и проявляют идентичные пробиотические эффекты. Очевидно, что различные препараты, путь их введения и длительность курса по-разному могут влиять на конечный результат [6, 12]. Эффективность пробиотических продуктов из лактобактерий зависит от используемых специфических видов и их качества (жизнеспособность, стабильность и др.).
Немаловажным является и дальнейшая разработка новых пробиотиков с учетом свойств, которыми они должны обладать:
— способности оставаться жизнеспособными при введении вагинально (устойчивость к щелочной среде БВ-ассоциированных микроорганизмов и их метаболитов) или при прохождении через ЖКТ (устойчивость к действию желчных кислот, соляной кислоты и панкреатических ферментов);
— способности адгезии с эпителием слизистой влагалища (кишечника);
— возможности колонизации влагалища (кишечника);
— синтеза антимикробных веществ против патогенных микроорганизмов;
— безопасности применения у человека;
— стабильности при хранении в обычных условиях;
— клинически доказанной пользы для здоровья.
Несмотря на то, что пробиотики в основном не имеют серьезных побочных эффектов, теоретически они могут вызывать 4 типа нежелательных лекарственных реакций:
1) системные инфекции,
2) негативное влияние на метаболизм,
3) чрезмерную стимуляцию иммунной системы у чувствительных лиц,
4) перенос генов резистентности.
В настоящее время имеется несколько сообщений, описывающих случаи возникновения системных инфекций, вызванных применением пробиотиков. С 1995 по 2000 г. в Финляндии проводилась национальная программа мониторинга безопасности пробиотиков с целью оценки возможного влияния увеличения применения пробиотиков (в частности, L. rhamnosus GG) на частоту возникновения бактериемии, вызванной лактобактериями. Данный штамм лактобактерий широко используется в Финляндии как пробиотик с 1990 г. Как оказалось, лактобактерии были выделены в 0,02% случаев всех бактериологических исследований крови и в 0,2% случаев всех исследований крови с положительным результатом, но не было отмечено тенденции к росту частоты возникновения бактериемии, вызванной лактобактериями. Результаты исследования свидетельствуют о том, что увеличение применения пробиотика L. rhamnosus GG не привело к росту частоты возникновения бактериемии, вызванной Lactobacillus.
Важно отметить, что подавляющее большинство существующих на сегодняшний день исследований не включало идентификацию микробной влагалищной флоры, лишая возможности определить, была ли наблюдаемая нормализация влагалищного биоценоза связана с экзогенно введенными лактобациллами в процессе лечения, которые могли бы колонизировать влагалищную слизистую оболочку в течение более, чем 15 дней, или с эндогенным заселением лактобацилл, рост которых мог бы быть простимулирован проводимым лечением. И все-таки наши и более поздние зарубежные исследования эффективности использования пробиотиков показывают, что при применении L. аcidophilus, содержащихся в некоторых препаратах, отмечается выраженный положительный эффект нормализации вагинальной микрофлоры при БВ. В то же время, требуются рандомизированные, контролируемые, проспективные, долгосрочные испытания, чтобы можно было сравнить эффективность восстановления влагалищной лактофлоры с помощью пробиотиков при лечении БВ и стандартных методов терапии.