Ацинетобактер что это такое
Acinetobacter (ацинетобактер)

Acinetobacter — повсеместно встречающаяся бактерия. У здоровых людей, в частности, он обитает на коже, также выделяется из кишечника.
Ацинетобактер — причина внутрибольничных инфекций
Ацинетобактер в анализах кала
Ацинетобактер в систематике бактерий
Род Acinetobacter относится к семейству Moraxellaceae, которое входит в порядок Pseudomonadales, класс гамма-протеобактерии (γ proteobacteria), тип протеобактерии (Proteobacteria), царство бактерии.
В род ацинетобактер включены следующие виды: Acinetobacter albensis, Acinetobacter antiviralis, Acinetobacter apis, Acinetobacter baumannii, Acinetobacter baylyi, Acinetobacter beijerinckii, Acinetobacter bereziniae, Acinetobacter bohemicus, Acinetobacter boissieri, Acinetobacter bouvetii, Acinetobacter brisouii, Acinetobacter calcoaceticus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter celticus, Acinetobacter courvalinii, Acinetobacter defluvii, Acinetobacter dispersus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter endosymbiont of Culex pipiens, Acinetobacter endosymbiont of Nilaparvata lugens, Acinetobacter equi, Acinetobacter gandensis, Acinetobacter genospecies, Acinetobacter gerneri, Acinetobacter glutaminasificans, Acinetobacter guangdongensis, Acinetobacter guillouiae, Acinetobacter gyllenbergii, Acinetobacter haemolyticus, Acinetobacter halotolerans, Acinetobacter harbinensis, Acinetobacter idrijaensis, Acinetobacter indicus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter kookii, Acinetobacter kyonggiensis, Acinetobacter lactucae, Acinetobacter larvae, Acinetobacter lwoffii, Acinetobacter marinus, Acinetobacter modestus, Acinetobacter movanagherensis, Acinetobacter nectaris, Acinetobacter oleivorans, Acinetobacter oryzae, Acinetobacter parvus, Acinetobacter plantarum, Acinetobacter populi, Acinetobacter proteolyticus, Acinetobacter psychrotolerans, Acinetobacter puyangensis, Acinetobacter qingfengensis, Acinetobacter radioresistens, Acinetobacter refrigeratoris, Acinetobacter rhizosphaerae, Acinetobacter rudis, Acinetobacter schindleri, Acinetobacter seohaensis, Acinetobacter septicus, Acinetobacter soli, Acinetobacter tandoii, Acinetobacter tjernbergiae, Acinetobacter towneri, Acinetobacter ursingii, Acinetobacter variabilis, Acinetobacter venetianus, Acinetobacter vivianii, Acinetobacter xiamenensis.
Ряд видов, а именно: Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter nosocomialis, Acinetobacter pittii объединены в отдельную группу Acinetobacter calcoaceticus/baumannii complex.
Антибиотики, активные и неактивные в отношении ацинетобактера
Необходимо отметить, что ацинетобактер отличаются высокой и поливалентной резистентностью к антибиотикам, что крайне затрудняет эффективное лечение больных (Гельфанд Е.Б. и др.).
A. Противомикробные средства из имеющих описание в данном справочнике
Ацинетобактер устойчив к: рокситромицину.
Б. Иные противомикробные препараты
Ацинетобактер умеренно чувствителен к цефалоспоринам IV поколения: цефепиму, цефпирому и другим (Яковлев С.В.).
Из карбапенемов в отношении ацинетобактера активны меропенем, имипенем, биапенем и панипенем. Эртапенем, наоборот, не активен (Белобородов В.Б.).
Ацинетобактер имеет высокий уровень устойчивости к фторхинолонам. В частности, к ципрофлоксацину на территории России в отделениях реанимации частота устойчивости варьирует от 13 до 53% (Сидоренко С.В.).
По мнению С.В. Яковлева, при выявленном возбудителе, препаратам первого ряда для лечения инфекции (мочевыводящих путей у больных пожилого возраста) ацинетобактера, являются фторхинолоны, в качестве альтернативных средств рекомендуются карбапенемы, амикацин и цефалоспорины IV поколения.
Ацинетобактер чувствителен к сульбактаму и к комбинации амоксициллин + сульбактам (Царапкин Г.Ю. и др.).
Виды ацинетобактера в общем резистентны к азтреонаму (R. de Groot).
Acinetobacter calcoaceticus и рассеянный склероз
E. Cekanaviciute и др. из США в своём исследовании* установили связь микробиоты толстой кишки человека и рассеянного склероза. Они определили, что у больных рассеянным склерозом количество Acinetobacter calcoaceticus и Akkermansia muciniphila повышено, а Parabacteroides distasonis снижено. Было высказано предположение, что состав микробиоты кишечника может стимуловать развитие рассеянного склероза. Определенные виды бактерий способны модулировать иммунный ответ в организме, подстегивая или подавляя заболевание.
*Cekanaviciute E et al. Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models / Proc. Natl. Acad. Sci. USA, vol. 114, no. 40, 10713–10718, doi: 10.1073/pnas.1711235114.
Инфекции, вызываемые Acinetobacter
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, FACP, Wellington Regional Medical Center
Acinetobacter – грамотрицательные аэробные бациллы или коккобациллы, принадлежащие к семейству Moraxellaceae. Они встречаются повсеместно и могут выживать на сухих поверхностях в течение месяца, обычно обнаруживаются на коже медицинских работников, увеличивая вероятность колонизации пациентов и контаминации медицинского оборудования. Существует много видов Acinetobacter; все они могут вызвать заболевание человека, однако на долю Acinetobacter baumannii (АВ) приходится около 80% инфекций (1 Общие справочные материалы Вид Acinetobacter – это грамотрицательные организмы, которые могут вызывать гнойные инфекции в любой системе организма; эти бактерии часто являются оппортунистами у госпитализированных пациентов. Прочитайте дополнительные сведения ).
Общие справочные материалы
1. Wong D, Nielsen TB, Bonomo RA, et al: Clinical and pathophysiological overview of Acinetobacter infections: A century of challenges. Clin Microbiol Rev 30(1):409–447, 2017. doi: 10.1128/CMR.00058-16.
Болезни, вызываемые Acinetobacter (АВ)
Наиболее распространенными проявлениями заболеваний, вызванных Acinetobacter, являются:
Инфекции AB, как правило, выявляют у пациентов, госпитализированных в критическом состоянии. Внебольничные инфекции (преимущественно, пневмония) чаще возникают в тропическом климате. Уровень смертности, связанный с инфекцией AB, составляет 19–54%.
Acinetobacter часто колонизирует места трахеостомы и может вызывать внебольничный бронхиолит и трахеобронхит у здоровых детей и трахеобронхит у взрослых с ослабленным иммунитетом. Приобретенные в больнице пневмонии, вызванные Acinetobacter, часто многодолевые и осложненные. Характерны вторичная бактериемия и септический шок, что предопределяет неблагоприятный прогноз.
Вид Acinetobacter может также вызывать раневые инфекции и гнойные инфекции (например, абсцессы) в любой системе организма, включая легкие, мочевыводящие пути, кожу и мягкие ткани; возможна бактериемия.
В редких случаях эти микроорганизмы вызывают менингит (прежде всего после нейрохирургических процедур), флегмону или флебит у пациентов с постоянным венозным катетером, глазные инфекции, эндокардит нативного или искусственного клапана, остеомиелит, септический артрит или абсцессы поджелудочной железы и печени.
Значимость Acinetobacter изолятов из клинических образцов, таких как секрет из органов дыхания у интубированных пациентов или из открытых ран, определить трудно, потому что они часто представлены колониями.
Факторы риска
Резистентность к препарату
В последнее время появились штаммы АВ с множественной лекарственной устойчивостью (МЛУ), в частности, в отделениях интенсивной терапии у пациентов с иммуносупрессией, пациентов с серьезными первичными заболеваниями, а также пациентов, получавших лечение антибиотиками широкого спектра действия после инвазивных процедур. Распространение штаммов АВ в отделениях интенсивной терапии было связано с медицинским персоналом, у которых выявлена высокая колонизация данного микроорганизма, а также с зараженным оборудованием общего использования и зараженными растворами для парентерального питания. Кроме того, возросло число случаев мультирезистентности, вызванной АБ, среди военнослужащих, которые были ранены и проходили лечение в Ираке, Кувейте и Афганистане.
Лечение ассоциированных инфекций
Обычно, эмпирическая комбинированная лекарственная терапия при тяжелых инфекциях
Для пациентов с установленным инородным телом (например, катетер, шов), удаление инородного тела плюс местная обработка обычно существенны. Трахеобронхит после эндотрахеальной интубации может разрешится с помощью одной гигиены легких Пациенты с осложненным течением заболевания должны лечиться антибиотиками с последующей санацией.
У AB давно регистрируется множественная резистентность к антибактериальным препаратам. Инфекция AB с множественной лекарственной устойчивостью определяется как штаммы, которые устойчивы к ≥ 3 классам антибактериальных препаратов; некоторые изоляты являются стойкими ко всем антибиотикам. До получения результатов чувствительности к антибиотикам в качестве стартовой терапии можно использовать карбапенемы (например, меропенем, имипенем, дорипенем), колистин или фторхинолоны вместе с аминогликозидами, рифампицином, или с обеими. У сульбактама (ингибитора бета-лактамазы) имеется свойственная ему бактерицидная активность против многих штаммов инфекции АБ данного типа. Тигециклин, антибиотик класса глицилциклинов также эффективен; однако отмечено ограничение его активности и появлении резистентности во время терапии. Миноциклин, как и новый сидериофор-цефалоспориновый антибиотик, цефидерокол обладает активностью in vitro (1 Справочные материалы по лечению Вид Acinetobacter – это грамотрицательные организмы, которые могут вызывать гнойные инфекции в любой системе организма; эти бактерии часто являются оппортунистами у госпитализированных пациентов. Прочитайте дополнительные сведения ).
Инфекции легких (при среднетяжелых формах) могут реагировать на монотерапию. Раневые инфекции также можно лечить одним препаратом, например миноциклиномом.
Тяжелые формы АБ инфекций лечат, используя комбинированную терапию – как правило, карбапенемы (имипенем или меропенем) или препарат ампициллин/сульбактам в комплексе с аминогликозидом; при условии устойчивости к лекарственным препаратам, единственными доступными вариантами могут быть тигециклин или комбинация колистина и миноциклина.
Чтобы предотвратить распространение возбудителя, необходимо применять меры по предотвращению контакта (ручная стирка, барьер) и соответствующие меры по проветриванию и гигиене, связанной с пациентами, колонизированными или зараженными инфекцией такого рода.
Справочные материалы по лечению
1. Munier AL, Biard L, Rousseau C, et al: Incidence, risk factors, and outcome of multidrug-resistant Acinetobacter baumannii acquisition during an outbreak in a burns unit. J Hosp Infect 97(3):226–233, 2017. doi: 10.1016/j.jhin.2017.07.020.
Ключевые моменты ацинетобактериальных инфекций
A. baumannii (АВ) является причиной около 80% инфекций, вызванных Acinetobacter, часто встречается у больных в критическом состоянии, находящихся в стационаре.
Наиболее распространенным местом локализации инфекции является дыхательная система, однако некоторые виды Acinetobacter также могут вызвать гнойную инфекцию в любой другой органной системе.
Мультирезистентные штаммы АВ стали проблемой; проводить множественную лекарственную терапию следует после проведения исследований на чувствительность.
Ацинетобактер
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.
Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Ацинетобактер (или ацинетка, как любит обзывать ее автор), является фактически «кровной родней» другого общеизвестного неферментера – синегнойной палочки. Но, в отличие от синегнойки, природно-устойчивого ацинетобактера вам могут принести прямо с улицы. То есть в природе имеются штаммы, и в очень большом количестве, которые изначально природно-устойчивы фактически ко всему арсеналу имеющихся в медицине антибиотиков. А еще таких же, но уже внутрибольничных мутантов не менее «удачно» выращивают в отделениях с высокой частотой использования антибактериальных препаратов. И это при том, что принести такого микроба в больницу, а также занести его в больного, может вообще любой человек, так как изначально ацинетка, как и синегнойка, является почвенным микробом, а потому горшки с цветами, садоводы-огородники, зимой растящие рассаду, летом ковыряющиеся на даче, а потом, нормально не отмыв руки, начинающие перевязывать раны или менять катетеры, да просто посетители с пылью на ботинках – все они в каждый момент времени приносят в больницы миллиарды подобных микробов. И это как раз то, о чем автор упоминал в разговоре о клебсиелле – вывести ацинетку, в отличие от синегнойки, несопоставимо труднее. Напомню, синегнойка предпочитает мокрую теплую грязь, поэтому ее проще отсечь от заноса в чистые отделения и внутри самой больницы проще выбить. А теперь представьте, чего будет стоить избавиться от пыли, комнатных растений, любителей-огородников и ломящихся, теперь уже даже в реанимации, посетителей. Практически нереально, если это только не ламинарный бокс.
Поэтому будем изучать врага в лицо
Общее представление о том, что из себя представляют дикие и непуганые антибиотиками ацинетобактеры, можно составить на EUCAST. Для тех, кто никогда не пользовался данным ресурсом, небольшая подсказка – тыкаем мышкой (или пальцем, смотря откуда читаете этот опус) в плашку «Species», выбираем один из 25-ти ацинетобактеров и наслаждаемся изучением. Общую антибиотикочувствительность семейства Acinetobacter spp. можно рассмотреть тут. Небольшое пояснение для тех, кто здесь впервые, – клинически значимыми минимальными подавляющими концентрациями (MIC), которыми можно и нужно пользоваться в клинической практике (а также как маркер того, какие антибиотики будут работать, а какие нет – их MIC указаны с чисто исследовательскими целями), являются показатели, отмеченные синими клеточками. На эти же показатели настроены аппараты для определения антибиотикочувствительности, с помощью которых продемонстрированы антибиотикограммы в наших статьях.
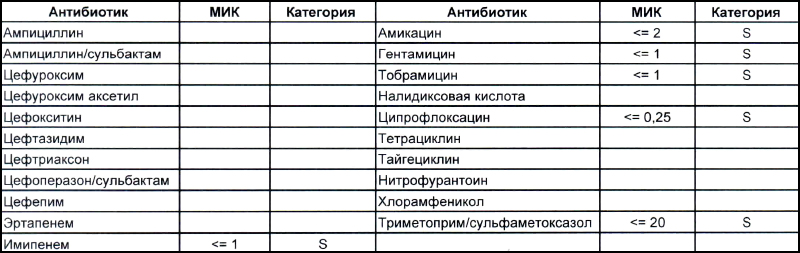
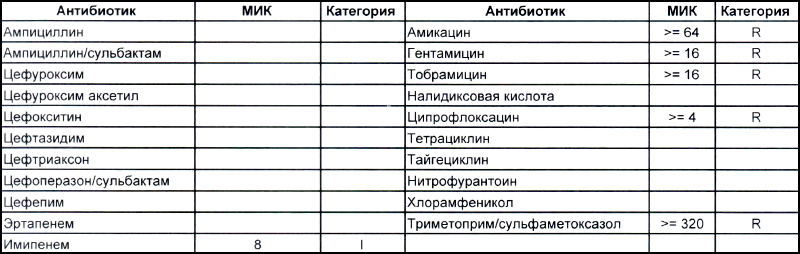
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Хороший вопрос. Точно такой же, как «чем лечить внутрибольничную клебсиеллу», которым мы задавались ранее.
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.
Ацинетобактер что это такое
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Проклятая дюжина
Опубликован список из 12 бактерий, устойчивых к действию большинства антибиотиков
В конце февраля 2017 г. Всемирная организация здравоохранения впервые опубликовала список бактерий с уже выработанной или растущей устойчивостью к действию большинства антибиотиков. Задача публикации — стимулировать на государственном уровне поиск новых лекарственных препаратов против перечисленных возбудителей, «представляющих наибольшую угрозу для здоровья человека». Включенные в список бактерии разделены на три группы по приоритетности в плане поиска новых антибиотиков.
Критически высокий уровень приоритетности
Рейтинг бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит. У ослабленных пациентов особое значение имеют инфекции кровотока и ИВЛ-ассоциированная пневмония. Для бактерий этой группы практически не осталось антибиотиков резерва.
Acinetobacter baumannii
«Природное» местообитание A. baumannii не установлено, однако этих бактерий обнаруживают в стационарах по всему миру. Вызывает до 1 % всех нозокомиальных инфекций, с уровнем смертности от 8 до 35 %. A. baumannii резистентна к пенициллинам, цефалоспоринам, аминогликозидам, хинолонам и тетрациклину. Отмечено значительное увеличение резистентности к карбапенемам — более 50 % в отдельных странах. Выявлены случаи резистентности к «последнему резерву» антибактериальной терапии, полимиксинам, ранее широко не использовавшимся из‑за высокой нефротоксичности.
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е + рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Pseudomonas aeruginosa
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует. В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму. Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Enterobacteriaceae
Из большого семейства энтеробактерий основные проблемы в стационарах доставляют Klebsiella, Escherichia coli, Citrobacter, Salmonella, Enterobacter, Serratia, Proteus. Вызывает опасения растущее повсеместное снижение чувствительности семейства к карбапенемам. Описаны единичные случаи резистентности E. coli ко всем существующим антибиотикам, включая полимиксин Е.
Высокий уровень приоритетности
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Средний уровень приоритетности
Третью группу также представляют широко распространенные бактерии, чья устойчивость к «обычным» антибиотикам пока не приняла угрожающих масштабов, однако чревата большими проблемами в будущем.
Streptococcus pneumoniae
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране. В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Haemophilus influenzae
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии. Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться. В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Shigella spp.
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.
Итого
Появление устойчивых к антибиотикам бактерий и публикация этого списка в очередной раз привлекают внимание человечества к необходимости создания — в идеале — принципиально новых средств борьбы с микроорганизмами, иначе, по пессимистичным прогнозам, из-за появления бактерий, устойчивых к антибиотикам, через несколько десятилетий одна только послеоперационная летальность может скатиться до уровня начала прошлого века. Разработка таких препаратов — занятие неблагодарное, поэтому фармацевтические компании не стремятся развивать данное направление, и ВОЗ выносит проблему на межгосударственный уровень.
Проблема лекарственной устойчивости среди возбудителей нозокомиальных инфекций — первые пять бактерий списка — актуальна и для российского здравоохранения. Остальные перечисленные микроорганизмы, по данным российских исследований, на территории РФ в целом сохраняют чувствительность к «своим» антибиотикам. Тем не менее, учитывая возросшую мобильность населения, можно ожидать завоза и распространения резистентных штаммов.
Сводная таблица: чувствительность возбудителей к антибактериальной терапии