Ацинетобактер урсинги что это
Ацинетобактер
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.
Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Ацинетобактер (или ацинетка, как любит обзывать ее автор), является фактически «кровной родней» другого общеизвестного неферментера – синегнойной палочки. Но, в отличие от синегнойки, природно-устойчивого ацинетобактера вам могут принести прямо с улицы. То есть в природе имеются штаммы, и в очень большом количестве, которые изначально природно-устойчивы фактически ко всему арсеналу имеющихся в медицине антибиотиков. А еще таких же, но уже внутрибольничных мутантов не менее «удачно» выращивают в отделениях с высокой частотой использования антибактериальных препаратов. И это при том, что принести такого микроба в больницу, а также занести его в больного, может вообще любой человек, так как изначально ацинетка, как и синегнойка, является почвенным микробом, а потому горшки с цветами, садоводы-огородники, зимой растящие рассаду, летом ковыряющиеся на даче, а потом, нормально не отмыв руки, начинающие перевязывать раны или менять катетеры, да просто посетители с пылью на ботинках – все они в каждый момент времени приносят в больницы миллиарды подобных микробов. И это как раз то, о чем автор упоминал в разговоре о клебсиелле – вывести ацинетку, в отличие от синегнойки, несопоставимо труднее. Напомню, синегнойка предпочитает мокрую теплую грязь, поэтому ее проще отсечь от заноса в чистые отделения и внутри самой больницы проще выбить. А теперь представьте, чего будет стоить избавиться от пыли, комнатных растений, любителей-огородников и ломящихся, теперь уже даже в реанимации, посетителей. Практически нереально, если это только не ламинарный бокс.
Поэтому будем изучать врага в лицо
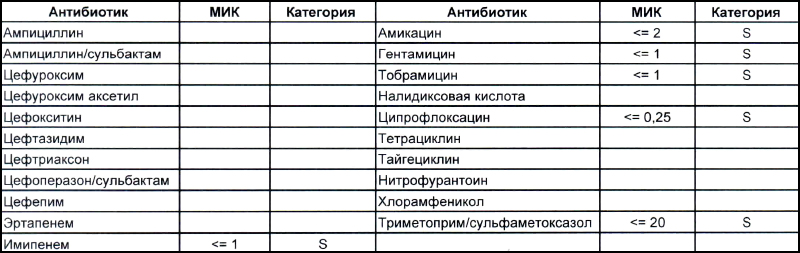
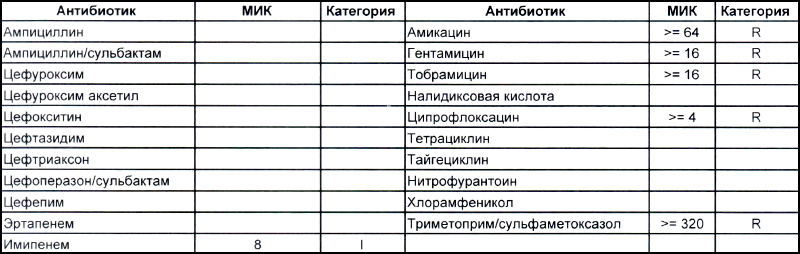
Общее представление о том, что из себя представляют дикие и непуганые антибиотиками ацинетобактеры, можно составить на EUCAST. Для тех, кто никогда не пользовался данным ресурсом, небольшая подсказка – тыкаем мышкой (или пальцем, смотря откуда читаете этот опус) в плашку «Species», выбираем один из 25-ти ацинетобактеров и наслаждаемся изучением. Общую антибиотикочувствительность семейства Acinetobacter spp. можно рассмотреть тут. Небольшое пояснение для тех, кто здесь впервые, – клинически значимыми минимальными подавляющими концентрациями (MIC), которыми можно и нужно пользоваться в клинической практике (а также как маркер того, какие антибиотики будут работать, а какие нет – их MIC указаны с чисто исследовательскими целями), являются показатели, отмеченные синими клеточками. На эти же показатели настроены аппараты для определения антибиотикочувствительности, с помощью которых продемонстрированы антибиотикограммы в наших статьях.
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Хороший вопрос. Точно такой же, как «чем лечить внутрибольничную клебсиеллу», которым мы задавались ранее.
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.
Ацинетобактер урсинги что это
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции, вызываемые Acinetobacter
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, FACP, Wellington Regional Medical Center
Acinetobacter – грамотрицательные аэробные бациллы или коккобациллы, принадлежащие к семейству Moraxellaceae. Они встречаются повсеместно и могут выживать на сухих поверхностях в течение месяца, обычно обнаруживаются на коже медицинских работников, увеличивая вероятность колонизации пациентов и контаминации медицинского оборудования. Существует много видов Acinetobacter; все они могут вызвать заболевание человека, однако на долю Acinetobacter baumannii (АВ) приходится около 80% инфекций (1 Общие справочные материалы Вид Acinetobacter – это грамотрицательные организмы, которые могут вызывать гнойные инфекции в любой системе организма; эти бактерии часто являются оппортунистами у госпитализированных пациентов. Прочитайте дополнительные сведения ).
Общие справочные материалы
1. Wong D, Nielsen TB, Bonomo RA, et al: Clinical and pathophysiological overview of Acinetobacter infections: A century of challenges. Clin Microbiol Rev 30(1):409–447, 2017. doi: 10.1128/CMR.00058-16.
Болезни, вызываемые Acinetobacter (АВ)
Наиболее распространенными проявлениями заболеваний, вызванных Acinetobacter, являются:
Инфекции AB, как правило, выявляют у пациентов, госпитализированных в критическом состоянии. Внебольничные инфекции (преимущественно, пневмония) чаще возникают в тропическом климате. Уровень смертности, связанный с инфекцией AB, составляет 19–54%.
Acinetobacter часто колонизирует места трахеостомы и может вызывать внебольничный бронхиолит и трахеобронхит у здоровых детей и трахеобронхит у взрослых с ослабленным иммунитетом. Приобретенные в больнице пневмонии, вызванные Acinetobacter, часто многодолевые и осложненные. Характерны вторичная бактериемия и септический шок, что предопределяет неблагоприятный прогноз.
Вид Acinetobacter может также вызывать раневые инфекции и гнойные инфекции (например, абсцессы) в любой системе организма, включая легкие, мочевыводящие пути, кожу и мягкие ткани; возможна бактериемия.
В редких случаях эти микроорганизмы вызывают менингит (прежде всего после нейрохирургических процедур), флегмону или флебит у пациентов с постоянным венозным катетером, глазные инфекции, эндокардит нативного или искусственного клапана, остеомиелит, септический артрит или абсцессы поджелудочной железы и печени.
Значимость Acinetobacter изолятов из клинических образцов, таких как секрет из органов дыхания у интубированных пациентов или из открытых ран, определить трудно, потому что они часто представлены колониями.
Факторы риска
Резистентность к препарату
В последнее время появились штаммы АВ с множественной лекарственной устойчивостью (МЛУ), в частности, в отделениях интенсивной терапии у пациентов с иммуносупрессией, пациентов с серьезными первичными заболеваниями, а также пациентов, получавших лечение антибиотиками широкого спектра действия после инвазивных процедур. Распространение штаммов АВ в отделениях интенсивной терапии было связано с медицинским персоналом, у которых выявлена высокая колонизация данного микроорганизма, а также с зараженным оборудованием общего использования и зараженными растворами для парентерального питания. Кроме того, возросло число случаев мультирезистентности, вызванной АБ, среди военнослужащих, которые были ранены и проходили лечение в Ираке, Кувейте и Афганистане.
Лечение ассоциированных инфекций
Обычно, эмпирическая комбинированная лекарственная терапия при тяжелых инфекциях
Для пациентов с установленным инородным телом (например, катетер, шов), удаление инородного тела плюс местная обработка обычно существенны. Трахеобронхит после эндотрахеальной интубации может разрешится с помощью одной гигиены легких Пациенты с осложненным течением заболевания должны лечиться антибиотиками с последующей санацией.
У AB давно регистрируется множественная резистентность к антибактериальным препаратам. Инфекция AB с множественной лекарственной устойчивостью определяется как штаммы, которые устойчивы к ≥ 3 классам антибактериальных препаратов; некоторые изоляты являются стойкими ко всем антибиотикам. До получения результатов чувствительности к антибиотикам в качестве стартовой терапии можно использовать карбапенемы (например, меропенем, имипенем, дорипенем), колистин или фторхинолоны вместе с аминогликозидами, рифампицином, или с обеими. У сульбактама (ингибитора бета-лактамазы) имеется свойственная ему бактерицидная активность против многих штаммов инфекции АБ данного типа. Тигециклин, антибиотик класса глицилциклинов также эффективен; однако отмечено ограничение его активности и появлении резистентности во время терапии. Миноциклин, как и новый сидериофор-цефалоспориновый антибиотик, цефидерокол обладает активностью in vitro (1 Справочные материалы по лечению Вид Acinetobacter – это грамотрицательные организмы, которые могут вызывать гнойные инфекции в любой системе организма; эти бактерии часто являются оппортунистами у госпитализированных пациентов. Прочитайте дополнительные сведения ).
Инфекции легких (при среднетяжелых формах) могут реагировать на монотерапию. Раневые инфекции также можно лечить одним препаратом, например миноциклиномом.
Тяжелые формы АБ инфекций лечат, используя комбинированную терапию – как правило, карбапенемы (имипенем или меропенем) или препарат ампициллин/сульбактам в комплексе с аминогликозидом; при условии устойчивости к лекарственным препаратам, единственными доступными вариантами могут быть тигециклин или комбинация колистина и миноциклина.
Чтобы предотвратить распространение возбудителя, необходимо применять меры по предотвращению контакта (ручная стирка, барьер) и соответствующие меры по проветриванию и гигиене, связанной с пациентами, колонизированными или зараженными инфекцией такого рода.
Справочные материалы по лечению
1. Munier AL, Biard L, Rousseau C, et al: Incidence, risk factors, and outcome of multidrug-resistant Acinetobacter baumannii acquisition during an outbreak in a burns unit. J Hosp Infect 97(3):226–233, 2017. doi: 10.1016/j.jhin.2017.07.020.
Ключевые моменты ацинетобактериальных инфекций
A. baumannii (АВ) является причиной около 80% инфекций, вызванных Acinetobacter, часто встречается у больных в критическом состоянии, находящихся в стационаре.
Наиболее распространенным местом локализации инфекции является дыхательная система, однако некоторые виды Acinetobacter также могут вызвать гнойную инфекцию в любой другой органной системе.
Мультирезистентные штаммы АВ стали проблемой; проводить множественную лекарственную терапию следует после проведения исследований на чувствительность.
Ацинетобактер урсинги что это
В последнее десятилетие наблюдается неуклонный рост числа инфекций, вызванных Acinetobacter spp. [1, 8]. Данные зарубежной статистики свидетельствуют о том, что ацинетобактер входит в число шести самых опасных бактерий для населения развитых стран [5]. Являясь условными патогенами, ацинетобактеры, тем не менее, представляют серьезную угрозу для пациентов отделений, где широко используют инвазивные методы диагностики и лечения (длительное лечение, катетеризация сосудов, искусственная вентиляция легких, многочисленные наркозы и перевязки) [9]. Ацинетобактерии вызывают инфекционный процесс только на фоне иммуносупрессии. Факторами риска являются тяжелые травмы, длительные операции, тяжелые термические травмы. Раневая ожоговая инфекция нередко обусловлена наличием ацинетобактерий, которые занимают второе место после стафилококков в общей структуре возбудителей [2]. Факторы патогенности, определяющие повреждение тканей и выживание ацинетобактерий в организме, активно действуют на всех этапах инфекционного процесса – адгезии, инвазии, в случае диссеминации и персистенции вызывают интоксикацию и обеспечивают неэффективность иммунного ответа. Бактерии рода Acinetobacter отличаются высокой природной резистентностью к антимикробным препаратам. Выживаемость ацинетобактерий в условиях антибиотикотерапии может быть связана с существованием персистирующих штаммов. Среди Acinetobacter baumanii обнаружено пять наборов токсин-антитоксин, ответственных за трансформацию метаболически активных форм в персистирующие [7]. Клиническая значимость Acinetobacter spp. с одной стороны вызвана их распространенностью, они колонизируют кожу рук персонала, клавиатуры компьютеров, поверхности оборудования, а с другой стороны – способностью приобретать устойчивость к антимикробным препаратам. Если в 2002–2004 гг. в России выявляли всего 6 % имипенемрезистентных Acinetobacter baumanii, то в 2011–1012 гг. их доля выросла до 96 % [4]. Одной из главных причин резистентности ацинетобактерий является продукция β-лактамаз. Ацинетобактерии продуцируют все три класса сериновы β-лактамазы А, С и D классов, а также метало-β-лактамазы (класс В). Большое число штаммов Acinetobacter baumanii продуцируют оксацилиназы – лактамазы, обуславливают резистентность не только к пенициллинам, но и к карбапенемам [10]. Карбапенемрезистентные A. baumanii могут служить источником для переноса карбапенемаз другим видам грамотрицательных бактерий. Это осложняет выбор адекватного антимикробного препарата, результатом чего является неэффективность терапии, увеличение продолжительности и стоимости лечения, а нередко и исход ожоговой болезни [6].
Цель работы: анализ распространенности карбапенемрезистентных штаммов A. baumanii в детском и взрослом ожоговом стационаре ФГБУ «ПФМИЦ» Минздрава России г. Нижнего Новгорода для составления рациональных протоколов стартовой антимикробной терапии.
Материалы и методы исследования
В работе проанализировано 942 раневых штамма Acinetobacter spp., выделенных у взрослых пациентов и детей с термической травмой за период 2012–2015 гг.
Идентификация микроорганизмов проводилась на анализаторе iEMS Reader FM (Labsystems, Финляндия) с помощью набора тест-систем (Lachema, Чехия), в 2015 году – масс-спектрометрически на приборе Autoflex (Bruker). Статистический анализ видового состава выделенной микрофлоры проводили с помощью компьютерной программы «Микроб-2». Антибиотикорезистентность микробных изолятов оценивалась диско-диффузионным методом с использованием агара Мюллера-Хинтон и сенси-дисков Oxoid (Англия) в соответствии с методическими указаниями, минимальные подавляющие концентрации рассчитывали на анализаторе «ADAGIO» (BioRad, США) [3].
Выявление карбапенем-гидролизующих β-лактамаз (ОХА-карбапенемаз группы ОХА-23, ОХА-58 и ОХА-40 подобных и метало-β-лактамаз (MBL группы IMP, VIM и NDM), а также видоспецифических β-лактамаз Acinetobacter baumanii (ген ОХА-51) осуществляли методом мультиплексной полимеразноцепной реакции (ПЦР) с гибридизационно-флюоресцентной детекцией продукции амплификации в режиме «реального времени». В качестве контрольного использовали штамм Acinetobacter baumanii 19606 коллекции АТСС.
Выделение ДНК и выявление наличия генов MBL и ОХА-карбапенемаз проводили с помощью коммерческих наборов «Рибо-преп», «АмплиСенс MDR MBL-FL» и «АмплиСенс MDR Acinetobacter ОХА-FL» проводили с помощью коммерческого набора «Рибо-преп» производства ФГУН ЦНИИЭМ. Амплификация проводилась в термоциклере «Rotor Gene 6000» (Corbett Research, Австралия) по инструкции к наборам. Статистическую обработку полученных данных проводили с помощью компьютерной программы Statistica.
Результаты исследования и их обсуждение
Анализ раневой микрофлоры показал, что в детском ожоговом отделении Acinetobacter spp. составляют в среднем 10 % всей раневой микрофлоры, во взрослом ожоговом – 15 % (табл. 1).
За период наблюдения в разные годы выявлены определенные колебания численности раневых ацинетобактерий, однако достоверных изменений в обоих отделениях не произошло. Следует подчеркнуть, что в структуре возбудителей раневой ожоговой инфекции у взрослых и детей с термической травмой в настоящее время Acinetobacter spp. занимают второе место после стафилококков и первое место среди грамотрицательных микроорганизмов.
Клинически значимыми представителями рода Acinetobacter являются виды Acinetobacter baumanii и Acinetobacter Lwoffii, которые могут вызывать пневмонии, инфекции мочевого тракта, раневые и катетерассоциированные инфекции. Молекулярные исследования видоспецифичности бактерий Acinetobacter spp. по наличию гена ОХА-51 подтвердили принадлежность 97 % анализируемых штаммов к виду Acinetobacter baumanii, 2 % по данным масс-спектрометрии относились к Acinetobacter Lwoffii и 1 % – к Acinetobacter calcoaceticus.
Частота выделения Acinetobacter spp. в ожоговых отделениях ( %)