Аутофагия и апоптоз в чем разница
Аутофагия, протофагия и остальные
Протофагия концептуально является аналогом аутофагии в мире микробов
Автор
Редакторы
Аутофагия — это процесс, с помощью которого эукариотические клетки утилизируют свои внутренние компоненты, «переваривая» их ферментами лизосом. Это непрерывный процесс, поддерживающий баланс между синтезом и деградацией и обеспечивающий необходимые условия для нормального клеточного роста, развития и смерти. В этой статье мы обобщаем понятие аутофагии до общего принципа работы живых систем и предлагаем термин протофагия для обозначения прокариотических процессов, подобных аутофагии.
Аутофагия (от греч. αυτος — «само» и φαγειν — «есть»: самопоедание) является клеточным механизмом утилизации избыточных или поврежденных белков, белковых комплексов и клеточных органелл, осуществляемый лизосомами той же клетки. Такая утилизация выполняет несколько важных функций, в том числе — получение питательных веществ при голодании, поддержку клеточного гомеостаза и клеточного иммунитета, осуществление апоптоза и т.п. [1].
Как правило, термин аутофагия применяется для описания внутриклеточных процессов. Однако в определенном смысле ее можно рассматривать и как общий принцип, работающий не только на уровне клеток эукариот, но и в биосистемах других уровней, таких как организм, популяция или даже биосфера в целом. И на всех уровнях организации живого с принципом аутофагии можно соотнести многие известные процессы, — в частности, регуляцию жизнедеятельности бактериальных колоний. Здесь же мы рассмотрим аутофагию в более широком смысле — как процесс поглощения биологической системой своей части для поддержания собственной структуры и жизнедеятельности. Действительно: процессы, аналогичные аутофагии, появляются на разных «этажах» живой материи (см. примеры в таблице 1):
Например, на уровне организма одним из проявлений аутофагии является метаболизм подкожного жира, когда организм при голодании потребляет свою часть (жировую ткань) с перераспределением высвобожденной энергии. Другим примером служит апоптоз — регулируемое «самоубийство» клеток, необходимое для правильного развития любого растительного или животного организма [2].
Аутофагия присутствует и на уровне экосистем. Так же, как эукариотическая клетка постоянно утилизирует старые или дефектные органеллы, в экосистемах одни организмы «поглощаются» и служат источником энергии для других. Такой круговорот энергии и вещества в биосфере известен под термином «трофические цепи», которые можно определить как постоянное перераспределение биологического материала внутри экосистем.
Приведенные выше примеры аналогичны аутофагии в том, что в них для поддержания стабильности целого в жертву приносится часть системы. Так же, как аутофагия требуется эукариотической клетке для поддержания жизнедеятельности во время нехватки питательных веществ, сжигание жира организмом и экосистемные трофические цепи необходимы для адаптации к периодической нехватке энергии и стабилизации энергетического обмена.
Еще одна принципиальная функция процессов, подобных аутофагии, — обновление частей системы с целью поддержания ее стабильности как целого (гомеостаза). Время существования любого дифференцированного сообщества намного больше, нежели время жизни отдельных его частей, — вот тут-то и требуется механизм поддержания стабильности. Стабильность биосистем достигается путем постоянного обновления компонентов через аутофагию. Непрерывная утилизация старых компонентов обновляет биосистему, а также позволяет пополнить энергетические запасы. Этот же принцип используется и на других уровнях: в эукариотической клетке отработавшие свой ресурс органеллы перевариваются лизосомами, уступая место новым. На уровне организма поврежденные клетки элиминируются апоптозом или иммунной системой. В экосистемах отношения хищник–жертва не только поддерживают численность хищных видов, но и регулируют гомеостаз всей экосистемы, очищая ее от слабых и больных животных и предохраняя виды от вырождения.
Аутофагия является распространенным механизмом, используемым на различных уровнях биосферы. Почти любая живая система использует процессы, аналогичные аутофагии, для выживания и саморегуляции. Здесь мы использовали слово «почти», так как аутофагия до сих пор не была описана у прокариот [3]. Принимая во внимание роль аутофагии во всех других биосистемах, отсутствие ее у прокариот выглядит, по меньшей мере, странным. В этой статье мы попытаемся показать, что прокариоты не являются исключением, и аналог аутофагии у них также присутствует, — но обнаружить его можно лишь, если рассматривать прокариотические сообщества не как единичные клетки, а как мультиклеточные «организмы».
Прокариоты как многоклеточные организмы
На сегодня собрано достаточно данных о том, что в природе прокариоты существуют не в виде изолированных клеток, а в виде сложных микробных сообществ [4]. Впервые эта смелая идея была выдвинуты в 80-х годах ХХ века, а сегодня она подкреплена солидной экспериментальной базой. Природные колонии прокариот имеют аналог эндокринной сигнализации внутри сообщества (например, чувство кворума [5]), дифференциацию клеток на специализированные подвиды, а также сложные паттерны коллективного поведения (совместная охота, коллективное переваривание добычи, коллективная устойчивость к антибиотикам [4] и т.п.). Аутофагия как характеристика дифференцированных сообществ вполне может стать еще одним пунктом в этом списке.
«Аутофагия» у бактерий
Типичные аутофагические модели описаны на молекулярном уровне у многих бактерий. Например, при нехватке пищи часть бактерий в колонии выделяет в окружающую среду токсин. При этом только некоторые из них способны производить молекулу антитоксина — белка, который обезвреживает токсин при его попадании в клетку. Такие клетки выживают и поглощают остальные, погибшие и лизированные под действием токсина. Это дает оставшимся в живых энергию, необходимую для споруляции [6], [7]. Подобные процессы обнаружены у многих видов бактерий.
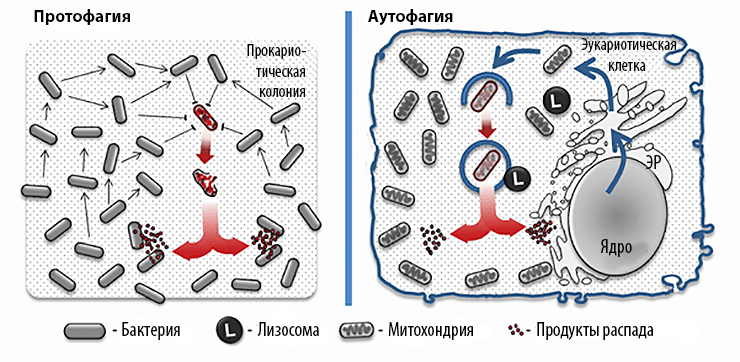
Для простоты описания мы введем термин протофагия как собирательный синоним процессов бактериального каннибализма, альтруизма, аутолиза и запрограммированной клеточной смерти. Прокариотическое сообщество представляет собой целостную биосистему, которая в случае необходимости перерабатывает часть себя для поддержания стабильности. При протофагии аутофагосомой (мембранной везикулы с продуктами деградации) служит сама прокариотическая клетка. Протофагия во многом схожа с аутофагией у эукариот (рис. 1):
Рисунок 1. Принципиальная похожесть протофагии и аутофагии.
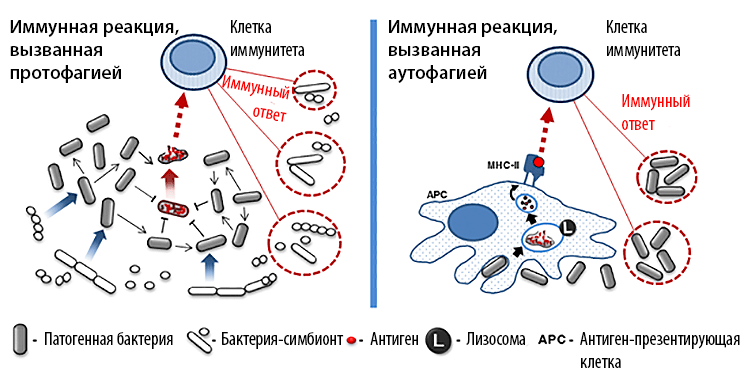
Как и эукариотическая аутофагия, протофагия используется не только для получения пищи. Например, протофагия служит патогенным бактериям для инвазии организма-хозяина (рис. 2). Известно, что микрофлора хозяина (симбионты) может эффективно сдерживать рост патогенных микроорганизмов. С целью подавления конкуренции некоторые патогенные бактерии с помощью протофагии активируют антибактериальный иммунный ответ организма-хозяина. Для этого часть патогенной популяции индуцированно самолизируется, высвобождая токсины, что вызывает локальное воспаление. В итоге иммунная система организма уничтожает большую часть бактерий-симбионтов, в то время как патогенные бактерии избегают обнаружения и после окончания воспалительной реакции беспрепятственно размножаются в тканях хозяина [9]. Интересно, что в отсутствие симбионтной микрофлоры (например, при экспериментальном заражении специальных линий стерильных мышей) такие патогенные бактерии заселяют кишечник без индукции воспаления. Это говорит о том, что протофагия тут является специфическим механизмом выживания патогенных организмов, который активируется только при неблагоприятных условиях.
Рисунок 2. Аналогичная роль протофагии и аутофагии в активации иммунного ответа.
Что дает нам концепция протофагии
Введенное понятие протофагии интересно не только как голая теория, но может быть полезно и на практике. Например, в биотехнологии сегодня широко используют бактерии, и манипуляция процессами протофагии может подсказать способ поддержания стабильности бактериальной культуры в промышленных масштабах. Так, активаторы протофагии должны повысить качество культур путем активации естественных механизмов устранения ослабленных и поврежденных микроорганизмов.
Другой важной областью применения протофагии может стать медицина. На сегодняшний день резистентность бактерий к антибиотикам является одной из ключевых фармакологических проблем. Вместо того, чтобы убивать отдельные бактериальные клетки (как это делают сегодня с помощью антибиотиков), можно сконцентрироваться на дезорганизации бактериальных сообществ как единого целого. Такие методы уже разрабатываются — это, например, блокаторы бактериального «чувства кворума», которые нацелены именно на нарушение межклеточной сигнализации в бактериальных колониях, чтобы сделать их уязвимыми для иммунной системы человека [10], [11]. И хотя эта тема только развивается, и вопросов пока больше чем ответов, общий вектор работ показывает, что нарушение коммуникации между отдельными бактериями имеет все шансы стать терапией завтрашнего дня. В этом контексте активаторы протофагии помогут разрушить защитные барьеры бактериальной колонии и сделать ее уязвимой для иммунной системы организма хозяина.
Послесловие
Главный вопрос, который может возникнуть после прочтения этой статьи — а так ли необходимо введение нового термина — протофагия — для описания хорошо известных фактов? На наш взгляд, расширение понятия аутофагии и введение термина «протофагия» необходимо и полезно.
Биосфера в определенном смысле напоминает фрактал, где каждый последующий уровень повторяет предыдущий. Аналогичные процессы похожи между собой не только внешне — все они имеют сходные причины и принципы регуляции. Понятие протофагии, объединяющее разрозненные процессы прокариот вместе, позволяет обобщить и лучше понять глубинные механизмы, регулирующие жизнь прокариотических колоний. Это дает несомненные выгоды для биотехнологии и медицины завтрашнего дня.
Приживется ли термин «протофагия» и найдут ли его полезным другие ученые — покажет время. То, что нам показалось важным, мы изложили в статье, вышедшей в журнале Autophagy [12]. Если микробиологи воспримут эти обобщения и найдут их полезными для себя — нам будет очень приятно. Если же цитируемость нашей статьи не будет бить рекордов — значит, мы ударились в средневековую схоластику и переоценили значимость собственных измышлений. В любом случае, представить данную работу на суд почтенной публике стоило — ведь протофагия является частным случаем аутофагии в бактериальном мире и следует тем же законам, что и остальные ее проявления — будь то аутофагия в эукариотической клетке, трофические цепи в биосфере или голодание по модной методике перед пляжным сезоном, который, кстати, уже на носу.
Написано по материалам оригинального эссе в Autophagy [12].
Аутофагия и апоптоз в чем разница
Заболеваемость инсультом в мире постоянно растет. Европейская ассоциация по борьбе с инсультом (ESO) совместно с Национальной ассоциацией по борьбе с инсультом (НАБИ) указывают на необходимость формирования единой противоинсультной программы, главной задачей которой является разработка новых алгоритмов профилактики и ранней диагностики заболевания с целью сокращения смертности и инвалидизации [1].
В настоящее время особый интерес исследователей вызывает гибель нейронов по механизму апоптоза и аутофагии – программированной клеточной гибели I и II типа, усиление которой отмечается после острой ишемической атаки и приводит к увеличению объема очага поражения паренхимы головного мозга [2, 3]. В экспериментах установлено, что аутофагия, как и апоптоз, активируется в пенумбре [4]. По мнению ряда авторов, выяснение путей, которые лежат в основе патогенетических механизмов, действующих в пенумбре и, как было показано, влияющих на распространение аутоиммунного постишемического воспаления, имеет большой клинический интерес для разработки новых терапевтических стратегий [5]. Считается, что поврежденные апоптозом и аутофагией нейроны в зоне пенумбры можно восстановить, в отличие от нейронов, погибших по механизму некроза, локализующихся в зоне ишемического ядра и не подлежащих регенерации [6, 7]. Кроме того, эффекторные молекулы, участвующие в сигнальных каскадах апоптоза и аутофагии при остром ишемическом инсульте (ОИИ), представляют интерес не только в качестве мишеней для разработки новых методов лечения ОИИ, но и как новые биологические маркеры в диагностике данного заболевания [8, 9].
Большинство результатов по изучению механизмов апоптоза и аутофагии в патогенезе ОИИ получено в экспериментальных моделях церебральной ишемии. Не вызывает сомнений тот факт, что патологические изменения в организме человека носят более глубокий характер и экстраполяция эффектов, выявленных в системе in vitro или в экспериментальных моделях ОИИ с использованием животных, на организм человека не всегда правомочна. В связи с актуальностью проблемы и малой освещенностью вопроса, касающегося взаимодействия ключевых медиаторов апоптоза и аутофагии в патогенезе ОИИ, представляется перспективным изучение маркеров апоптоза и аутофагии в периферической крови у больных ОИИ в динамике острого периода заболевания [10].
Цель исследования – провести анализ данных литературы за последние 10 лет, посвященных современным лабораторным методам оценки биологических маркеров аутофагии и апоптоза, представляющим интерес для углубленного понимания патогенеза ОИИ и создания новых методов диагностики ОИИ.
Материал и методы исследования
При подготовке обзора были проанализированы 350 источников литературы, полученных из международных и отечественных баз данных: Scopus, Web of Science, Springer, Pubmed и РИНЦ. 45 публикаций были отобраны и включены настоящий обзор.
Результаты исследования и их обсуждение
Актуальность исследуемой задачи
По данным Всемирной организации здравоохранения ежегодно от цереброваскулярных заболеваний (ЦВЗ) умирают около 5 млн человек. При этом удельный вес острого ишемического инсульта (ОИИ) среди форм острого нарушения мозгового кровообращения достигает 80 –85% [1, 11].
В обновленных клинических рекомендациях по ведению пациентов с ОИИ, разработанных совместно с Национальной ассоциацией по борьбе с инсультом, Всероссийским обществом неврологов, Ассоциацией нейрохирургов России, а также Союзом реабилитологов России, особое внимание уделяется нейропротекции. В текущей редакции выделено важнейшее направление нейропротекции – уменьшение выраженности «отдаленных последствий» ишемии: окислительного стресса, избыточного синтеза NO, дисбаланса цитокинов, а также снижение активности процессов апоптоза, лежащих в основе отсроченной смерти клеток нервной ткани [11].
В РФ в качестве нейропротективной терапии наиболее часто назначаются препараты мексидол (этилметилгидроксипиридина сукцинат, ООО «НПК Фармасофт», РФ) и церебролизин (МНН: нет, РУ: «ЭВЕР Нейро Фарма ГмбХ», Австрия) [11, 12]. В рандомизированном двойном слепом мультицентровом плацебо-контролируемом исследовании, проведенном в Российской Федерации в 2017 г., в параллельных группах оценивались эффективность и безопасность длительной последовательной терапии мексидолом у пациентов с полушарным ОИИ в остром и раннем восстановительном периодах. В исследование были включены 150 человек (62 мужчины и 88 женщин). В группе пациентов, получавших мексидол, были выявлены статистически достоверное снижение тяжести неврологического дефицита, оцениваемого по шкале NIHSS (National Institutes of Health Stroke Scale), достоверное улучшение жизнедеятельности, измеренное по модифицированной шкале Рэнкина, и улучшение качества жизни по сравнению с группой пациентов, получавших плацебо [12]. Следует подчеркнуть, что важнейшим фармакологическим свойством мексидола является ингибирование апоптоза, лежащего в основе отсроченной гибели нейронов [11].
В систематическом обзоре, включающем 221 публикацию, проиндексированную в базах данных Scopus и Pubmed в период с октября 1993 г. по август 2019 г., А. Steliga и соавторы [13] проводят сравнительный анализ известных на сегодняшний день биомаркеров, используемых для диагностики ОИИ. Обсуждая перспективы дальнейшего улучшения диагностики заболевания, авторы обращают внимание на необходимость разработки лабораторных предикторов отсроченной гибели нейронов, влияющей на исход заболевания. Данное утверждение подчеркивает диагностическую значимость биомаркеров апоптоза и аутофагии – процессов, принимающих непосредственное участие в отсроченной гибели клеток головного мозга.
Таким образом, апоптоз и аутофагия представляют собой перспективные задачи для исследования с целью разработки принципиально новых методов нейропротекции, диагностики и прогноза исхода ОИИ.
Ключевые маркеры аутофагии, имеющие патогенетическое значение при ОИИ
Результаты анализа, полученные в ходе структурированного исследования библиографических баз данных последних 10 лет, посвященных роли аутофагии в патогенезе ОИИ, позволили сделать вывод, что в настоящее время наиболее надежными молекулярными биомаркерами аутофагии, определяемыми с помощью методов лабораторной диагностики, являются белки LC3, Beclin-1 и р62. В нескольких новейших литературных источниках, суммирующих результаты последних экспериментальных данных, полученных на клеточных культурах, а также с использованием лабораторных животных, делается вывод, что для получения более достоверных результатов рекомендована одновременная оценка всех трех показателей аутофагии в исследуемом биологическом материале [14, 15].
Белок LC3, являющийся убиквитин-подобным белком (кодируется геном Atg8), представляет собой надежный маркер аутофагии, так как его содержание в исследуемом биологическом материале положительно коррелирует с количеством активных аутофагосом – важнейших компонентов процесса аутофагии [16]. Показано, что синтез LC3 усиливается в процессе аутофагии [17]. Следует подчеркнуть, что белок LC3 существует в растворимой форме (LC3-I) и липидированной форме (LC3-II) [18]. Они также называются «цитоплазматическая и аутофагосомальная формы», так как в процессе аутофагии происходит транслокация цитоплазматического LC3-I в аутофагосому, где он липидируется с переходом в LC3-II форму и изолируется в аутофагосомальной мембране. Для оценки активности процесса аутофагии определяют липидированную форму LC3-II [19]. Установлено, что повышенные концентрации белков LC3-II и Beclin-1 в сыворотке и в спинномозговой жидкости пациентов с острым ИИ связаны с хорошим исходом заболевания [10]. Эти данные свидетельствуют в пользу защитной роли аутофагии при остром ИИ.
Другим маркером аутофагии является белок Beclin-1 (кодируется геном Atg6), играющий ключевую роль в инициации аутофагии [20]. В составе белкового комплекса, включающего серин-треониновую киназу р150, фосфатидилинозитол-3-киназу класса III (PI3КIII), протеин Atg14L и белки семейства Bcl-2, Beclin-1 участвует в инициации аутофагии [21]. При стимуляции аутофагии Beclin-1 и протеинкиназа PIK3III образуют агрегаты в области комплекса Гольджи, которые можно верифицировать с помощью метода флуоресцентной микроскопии или вестерн-блоттинга (Western blotting) и рассматривать в качестве маркера ранней аутофагии (фаза инициации) [22]. Beclin-1 необходим для нормального протекания митофагии (митохондриальной аутофагии). В эксперименте установлено, что ингибирование Beclin-1 в нейронах мышей с ОИИ приводит к митохондриальной дисфункции и прогрессированию постишемического нейровоспаления [23, 24].
Белок р62 (nucleoporin) является убиквитин-связывающим каркасным белком, участвующим в регуляции аутофагии и в формировании аутофагосомы [25]. Этот протеин непосредственно взаимодействует с белком LC3 и служит связующим звеном между LC3 и убиквитинированными субстратами [26]. Протеин р62 активно диссоциирует в процессе аутофагии. Таким образом, количественное определение уровня p62 может быть использовано для мониторинга аутофагического процесса [14, 27]. Установлено, что в отличие от белка LC3 содержание р62 в исследуемом биологическом материале обратно коррелирует с интенсивностью аутофагии, поэтому активность процесса аутофагии оценивают по отношению LC3-II/p62 [15, 28]. Скопление p62-позитивных включений, выявляемое иммуноцитохимическим методом, или повышенный уровень p62, детектируемый с помощью вестерн-блоттинга, расцениваются как признак снижения активности аутофагии [18, 29]. В литературе имеются указания на то, что при поверхностной экспрессии белка р62 может происходить его самоагрегация, занижающая показатели активности процесса аутофагии, поэтому рекомендуется определять концентрацию растворимого p62 совместно с оценкой его поверхностной экспрессии [15, 29]. В экспериментальной модели ОИИ показано, что в нейронах мышей содержание р62 повышено [30]. По мнению авторов, повышение р62 носит компенсаторный характер, так как этот белок осуществляет элиминацию поврежденных митохондрий посредством p62-опосредованной митофагии, основными целями которой являются осуществление «контроля качества» митохондрий и поддержание митохондриального гомеостаза [4, 30].
Ключевые маркеры апоптоза, имеющие патогенетическое значение при остром ИИ
Критический анализ 250 литературных источников последних 10 лет, посвященных роли ключевых апоптотических белков в патогенезе ОИИ, позволил выделить 56 наиболее релевантных исследований, 47 из которых свидетельствовали о двойственной роли белков р53 и Bcl-2 в гибели клеток головного мозга при ОИИ, в то время как 9 публикаций указывали на прямое участие этих белков в апоптотической гибели нейронов. Эти 9 работ были отобраны и включены в настоящий обзор.
Новейшие исследования выявили статистически достоверное повышение концентрации р53 в сыворотке пациентов с ОИИ на 1-е, 2-е и 3-и сутки после ишемической атаки по сравнению с пациентами с хронической ишемией головного мозга (группа сравнения) [31].
Семейство Вcl-2 включает как противоапоптотические белки Вcl-2 и Bcl-xL, так и проапоптотические белки Bax, Bim, Bik и Bak [33, 34]. Эти белки являются регуляторами митохондриального пути запуска апоптоза [35], играющего ключевую роль в гибели нейронов при церебральной ишемии [16, 31]. Установлено, что избыток противоапоптотических белков семейства Bcl-2 защищает ткань мозга от ишемии [30].
Экспериментальные исследования на лабораторных животных показали, что объем ишемического поражения головного мозга может быть уменьшен при введении таурина, способствующего активации противоапоптотических белков семейства Bcl-2, которые ингибируют митохондриально-опосредованный апоптоз нейронов за счет подавления цитозольного цитохрома C и поддержания активности противоапоптотического белка Bcl-xL [4, 30]. Отношение Bax/Вcl-2 регулирует баланс между процессами индукции и ингибирования апоптоза, предотвращая падение мембранного потенциала митохондрий через блокирование экспрессии кальпаина и активной каспазы-3 [3].
Современные подходы к верификации биологических маркеров аутофагии с помощью методов лабораторной диагностики
В систематическом обзоре, включающем 86 литературных источников, опубликованных в период с 1997 по 2010 гг., посвященном анализу лабораторных методов оценки аутофагии в клеточных культурах, тканевых биоптатах и периферической крови экспериментальных животных, N. Mizushima и соавторы [14] приходят к выводу, что среди современных лабораторных методов единого «золотого стандарта» для мониторинга активности процесса аутофагии не существует. Считается необходимым параллельное использование нескольких различных методов для точной оценки аутофагической активности в любом биологическом материале [15, 18, 23].
Оценка аутофагии с помощью лабораторных методов включает определение количества активных аутофагосом, мониторинг всех стадий аутофагии, а также измерение активности аутофагического процесса, осуществляемое с использованием индукторов и ингибиторов аутофагии [14, 15].
Для определения количества аутофагосом в клетке оценивают содержание липидированной формы белка LC3 (LC3-II), так как LC3-II является маркером активных аутофагосом [28]. Для определения LC3-II применяют моноклональные антитела, тандемные флуорохромы и используют следующие методы лабораторной диагностики: электронную микроскопию, флуоресцентную микроскопию, вестерн-блоттинг, проточную цитометрию [14].
Электронная микроскопия дает возможность визуализировать аутофагосомы и аутофаголизосомы, образующиеся на этапе слияния аутофагосом с лизосомами. На ультраструктурном уровне аутофаголизосома определяется в виде двухчленной структуры, содержащей непереваренные фрагменты цитоплазмы, которые не слились с лизосомой [18, 36]. Аутофагосомы также могут содержать включения в виде внутриклеточных органелл, например поврежденные митохондрии или фрагменты эндоплазматического ретикулума, выявляемые при электронной микроскопии [14, 22].
Флуоресцентная микроскопия позволяет визуализировать LC3-I, конъюгированный с флуоресцентным красителем GFP (green fluorescent protein), выявляемый по характерному диффузному зеленому свечению в цитоплазме или в виде пунктатных структур, которые в основном представляют собой активные аутофагосомы [22].
Метод вестерн-блоттинга (Western blotting) позволяет осуществлять мониторинг преобразования растворимой формы белка LC3-I, конъюгированного с GFP, в липидированную форму LC3-II [36, 37]. С помощью моноклональных антител (МКАТ) к LC3-I, к LC3-II и флурохрома GFP можно выявить превращение комплекса GFP-LC3-I в комплекс GFP-LC3-II [37]. Данный метод позволяет оценивать уровень экспрессии и других маркеров аутофагии: Beclin-1 и р62 [16, 19]. Проспективное исследование, включавшее 72 пациента с ревматоидным артритом и 20 доноров (контрольная группа), проведенное в 2018 г. Y. Chen и соавторами [28], выявило статистически достоверное повышение экспрессии LC3-I и LC3-II (р