Аутоиммунное бесплодие что это
Иммунологическое бесплодие
Иммунологическое бесплодие – гипериммунное состояние женского или мужского организма, сопровождающееся секрецией специфических антиспермальных антител. Иммунологическое бесплодие проявляется несостоятельностью зачатия и наступления беременности при регулярной половой жизни без контрацепции при отсутствии других женских и мужских факторов инфертильности. Диагностика иммунологического бесплодия включает исследование спермограммы, антиспермальных антител плазмы, проведение посткоитального теста, MAR-теста и других исследований. При иммунологическом бесплодии применяются кортикостероиды, методы иммунизации и вспомогательные репродуктивные технологии.
Общие сведения
Причины иммунологического бесплодия
У мужчин
Под действием определенных неблагоприятных факторов нарушение защитных механизмов делает возможным контактирование спермальных антигенов с иммунной системой и приводит к развитию иммунологического бесплодия. Причинами выработки аутоантител на сперматозоиды и клетки сперматогенеза у мужчин могут выступать:
У женщин
Сбой внутриматочной иммунной толерантности и появление АСАТ у женщин в предимплантационный период могут быть спровоцированы:
Симптомы иммунологического бесплодия
Иммунологическое бесплодие внешне протекает бессимптомно, не имея видимых проявлений у обоих партнеров. У мужчин с аутоиммунным бесплодием обычно сохраняется активный сперматогенез, эректильная функция и полноценность полового акта. При гинекологическом обследовании женщины не обнаруживаются маточные, трубно-перитонеальные, эндокринные и иные факторы, препятствующие зачатию.
При этом у супружеской пары детородного возраста при условии нормального менструального цикла женщины и регулярной половой жизни без предохранения имеет место отсутствие беременности в течение года и более. При АСАТ у женщин из-за дефекта имплантации и нарушения развития эмбриона наблюдается его гибель и отторжение, прерывание беременности на очень ранних сроках, обычно до того, как женщина может ее обнаружить.
Диагностика иммунологического бесплодия
Наличие мужского фактора иммунологического бесплодия можно предположить при нарушении спермограммы (резком падении количества, искажении формы, агглютинации и слабой активности сперматозоидов, низкой выживаемости спермы, полном отсутствии живых спермиев). Данные основного посткоитального теста помогают выявить АСАТ в цервикальной слизи по ее воздействию на подвижность и жизнеспособность сперматозоидов в содержимом шеечного канала. Для соединенных с АСАТ сперматозоидов характерна низкая мобильность и адинамия, маятникообразные движения и феномен «дрожания на месте».
Одновременно со спермограммой выполняется MAR-тест, определяющий количество АСАТ-позитивных подвижных сперматозоидов (при MAR IgG >50% очевиден диагноз «мужское иммунное бесплодие»). 1ВТ-тест устанавливают локализацию АСАТ на поверхности сперматозоида и процент АСАТ-связанных спермиев. Методом проточной цитофлуорометрии (ПЦМ) оценивают концентрацию АСАТ на одном сперматозоиде, спонтанную и индуцированную акросомальную реакцию. При выявлении отклонений в спермограмме и посткоитальном тесте показано проведение ИФА с целью определения спектра АСАТ в сыворотке крови. Дополнительно может проводиться ПЦР-исследование на урогенитальные инфекции (хламидии, микоплазмы, ВПГ, ВПЧ, и др.), определение аутоантител к фосфолипидам, ДНК, кардиолипину, тиреоидным гормонам, HLA-типирование. Иммунологическое бесплодие необходимо дифференцировать от женского и мужского бесплодия другого генеза.
Лечение иммунологического бесплодия
Устранение мужского компонента иммунологического бесплодия основано на лечении фоновой патологии, приведшей к образованию АСАТ, и может включать оперативные вмешательства, корригирующие аномалии репродуктивного тракта и кровообращения. Возможно назначение приема протеолитических ферментов, цитостатиков и кортикостероидов.
Для выхода полноценной яйцеклетки проводится гормональная стимуляция суперовуляции. Получение сперматозоидов у мужчин производят путем эякуляции, биопсии яичка (TESA, TESE, Micro-TESE) или биопсии придатка яичка (PESA, MESA). В тяжелых случаях мужского иммунологического бесплодия используется донорская сперма. Наличие высокого титра АСАТ в крови женщины является противопоказанием для инсеминации, ИКСИ и ЭКО и требует продолжительного лечения до нормализации их уровня. Перспективно при лечении иммунологического бесплодия использование более качественных морфологически селекционных или генетически здоровых и функционально активных сперматозоидов (ИМСИ и ПИКСИ) и предимплантационной выбраковки или обработки эмбрионов (ассистированный хэтчинг). Для повышения вероятности наступления беременности производится предимплантационная криоконсервация эмбрионов.
Иммунологическое бесплодие имеет достаточно специфический характер: АСАТ вырабатываются на сперматозоиды конкретного мужчины, и при смене партнера появляется возможность беременности. При полноценном лечении с использованием современных ВРТ иммунологическое бесплодие удается преодолеть в большинстве нетяжелых случаев. Вероятность беременности в естественном цикле в отсутствие лечения мужчины с MAR IgG > 50% составляет
Иммунологическое бесплодие
Иммунологическое бесплодие встречается и у мужчин, и у женщин. Оно выражается в выработке организмом антител к собственным или партнёрским половым клеткам. Их также называют АСАТ – антиспермальные антитела. Частота распространения иммунологического фактора бесплодия у лиц женского пола – до 32%, у мужского – до 15%.
На базе «СМ-Клиника» функционирует Центр репродуктивного здоровья. Пары с подозрением на иммунологическое бесплодие могут пройти полный комплекс обследований. Наличие современного технического оснащения позволяет гарантировать пациентам точные результаты.
Причины женского иммунологического бесплодия
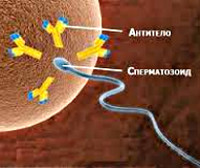
Причины женского аутоиммунного бесплодия. Для женского организма сперматозоид – это чужеродное тело, попавшее в тело извне. В организме существует механизм, препятствующий подобным вторжениям, который называется иммунитет. Однако если бы антитела постоянно атаковали сперматозоиды, беременность не наступала бы никогда. Но иммунный ответ не происходит. Влагалищные клетки не позволяют сперматозоидам столкнуться с иммунной системой.
В ряде случаев в женском организме начинают вырабатываться АСАТ. Этому способствуют:
Все эти состояния ведут к возникновению аутоиммунного фактора невозможности зачатия.
Причины мужского иммунологического бесплодия
Это особое состояние организма, когда тело начинает атаковать собственные половые клетки.
Оно может возникнуть вследствие:
Всё это приводит к разрушению естественного барьера между кровью и семенными протоками. Из-за этого сперматозоиды попадают в кровь, где к ним начинают вырабатываться антитела.
Симптомы иммунологического бесплодия
При иммунологическом бесплодии ярко выраженные симптомы отсутствуют. У мужчины активно вырабатываются сперматозоиды, нет проблем с эрекцией и эякуляцией. При женском иммунном бесплодии эмбрион отторгается и гибнет на очень раннем сроке беременности. Гинекологическое обследование не выявляет у женщины никаких эндокринных, маточных и иных факторов, препятствующих зачатию. Основным симптомом иммунологического бесплодия можно считать отсутствие беременности более одного года при нормальном менструальном цикле у партнёрши и регулярных половых актах без предохранения.
Диагностика
При подозрении на аутоиммунное бесплодие врачи «СМ-Клиника» назначают комплексные исследования обоим партнёрам. Им проводят анализ крови на АСАТ. Мужчины также сдают семенную жидкость, а женщины – слизь из цервикального канала.
Также врачами выполняются тесты на совместимость будущих родителей:
Иммунологическое бесплодие
Онлайн-консультация
Невозможность зачатия и вынашивания беременности при отсутствии каких-либо других маркеров инфертильности у мужчин и женщин, а также регулярной половой жизни без использования средств контрацепции, называется иммунологическим бесплодием. При этом наблюдается секреция антиспермальных антител (АСАТ) в организме.
Для диагностики данного гипериммунного состояния требуется исследование выделяемых антител, а также подробная спермограмма, посткоитальный тест и прочие анализы. Для лечения применяются современные вспомогательные репродуктивные технологии, а также иммунизация партнеров и кортикостероиды.
Содержание
Что представляет собой иммунологическое бесплодие?
Основная причина данного заболевания – антиспермальный иммунитет, который является патологией. Именно он препятствует не только оплодотворению яйцеклетки, но и правильной фиксации эмбриона. Бесплодие может возникнуть как у мужчин, так и у женщин. После синтезирования антитела могут находиться во внутриматочной или цервикальной слизи, плазме семени, сыворотке крови и прочих жидкостях. Статистика показывает, что иммунологическое бесплодие наблюдается примерно у 20% семейных пар в возрасте до 40 лет. При этом антиспермальный иммунитет наблюдается как у одного, так и у обоих партнеров.
Для диагностики и подбора метода лечение необходима консультация гинеколога, андролога и специалистов в области репродуктивной медицины. Присутствие антител у фертильных женщин и мужчин снижает возможность успешной беременности, так как повреждена структура спермы и значительно снижена подвижность сперматозоидов. При этом наблюдаются проблемы с их проникновением в цервикальную слизь и блокада реакций еще на подготовительных этапах. Все это нарушает процесс оплодотворения.
АСАТ приводит к резкому уменьшению количества эмбрионов, нарушает алгоритм их имплантации, препятствует формированию плодных оболочек и правильному развитию плода в матке. Без диагностики и лечения иммунологическое бесплодие становится причиной гибели зародыша и выкидыша.
Основные причины патологии
Структура сперматозоидов имеет антигенную природу, по причине чего они являются инородными как для женского, так и для мужского организма. Для их защиты предусмотрена супрессия иммунного ответа. У женщин данный механизм выражается увеличением количества Т-супрессоров (в период овуляции), а также снижением уровня С3-компонента, Lg и T-хеллеров.
У мужчин сперматозоиды обладают способностью к мимикрии относительно сорбционных процессов антигенов, а в яичках и придатке присутствует ГТБ – гемато-текстикулярный барьер. Кроме того, механизм обуславливает иммуносупрессивный фактор спермоплазмы.
Причины иммунологического бесплодия у мужчин
Прямой контакт иммунной системы и спермальных антигенов возникает в случае дестабилизации защитных функций по причине ряда неблагоприятных факторов. В результате развивается данный тип бесплодия. К распространенным факторам можно отнести:
Каждый из вышеперечисленных факторов может стать причиной развития иммунологического бесплодия, при этом период формирования патологии не обязательно должен совпадать со сроками воздействия конкретного фактора.
Причины патологии у женщин
Возникновение АСАТ и нарушение механизма иммунной толерантности у женщин перед имплантацией плода могут быть следствием таких проблем:
Несовместимость ряда антигенов и систем, а также наличие определенных изоантигенов в эякуляте мужчины могут стимулировать развитие АСАТ. В зависимости от титра антигенов и степени поражения сперматазоидов зависит сила иммунного ответа и его последствия.
Кроме того, на данный процесс влияет и место их расположения. К примеру, если АСАТ находится в зоне головки сперматозоида, запускается механизм блокировки его слияния с ооцитом. Если речь идет о хвостовой части, это значительно затрудняет общую подвижность.
Симптоматика иммунологического бесплодия
У данной патологии нет выраженной симптоматики. Пара в возрасте до 40 лет с регулярной половой жизнью, отсутствием контрацептивов и нормальным менструальным циклом у женщины может не иметь детей 1 год и более. В случае зачатия возникает дефект имплантации, который нарушает развитие эмбриона и приводит к прерыванию беременности еще в первые недели (до ее выявления).
Если говорить о внешних симптомах, они отсутствуют у обоих партнеров. Более того, у мужчин наблюдается полноценная эректильная функция, сперматозоиды проявляют активность, а половой акт происходит без каких-либо отклонений. Обследование репродуктивной системы женщины также не показывает каких-либо нарушений, способных могут стать причиной отсутствия беременности.
Особенности диагностики
Для определения иммунологического бесплодия нужно пройти ряд исследований как мужчине, так и женщине. Диагностика проводится гинекологом, андрологом и репродуктологом. Лабораторные анализы включают посткоитальные тесты, определение антиспермальных антител в плазме, исследование эякулята и отбор специальных биологических проб. Перед анализами обязательно прекращают прием антибиотиков, гормональных и прочих препаратов, которые могут исказить результаты.
Одновременно с вышеперечисленными анализами делается MAR-тест, который позволяет получить точную информацию о количестве подвижных сперматазоидов с наличием АСАТ. Если данный показатель превышает 50%, можно утверждать о присутствии иммунологического бесплодия. Для вычисления локации антител выполняется 1ВТ-тест, а проточная цитофлуориметрия позволяет оценить количество АСАТ на одном подвижном сперматозоиде.
Дополнительно врач может назначить ИФА для исследования сыворотки крови на наличие антигенов, определение индуцированной или спонтанной акросомальной реакции. Параллельно делаются тесты на присутствие венерических инфекций, аутоантител к ряду гормонов, кардиолипину, фосфолипидам и ДНК. Важно выполнить дифференциацию данного вида бесплодия от возможных других.
У мужчин диагностика чаще всего проводится по результатам спермограммы. Искажение формы, слабая активность сперматазоидов и низкое количество живых в эякуляте, агглютинация, резкое снижение количества являются признаками заболевания. Обязательно проводится анализ содержимого шеечного канала и цервикальной слизи, изучается ее воздействие на активность сперматазоидов. Нередко наблюдаются движения в виде маятника, дрожание без движения и низкая мобильность.
Способы лечения иммунологического бесплодия
Основу лечения иммунологического бесплодия обычно составляют вспомогательные репродуктивные технологии. Предварительно каждый из супругов проходит тщательную подготовку и сдает необходимые анализы. В том случае, если есть активные сперматозоиды, используется метод искусственного оплодотворения. Еще один способ – искусственная инсеминация, во время которой сперма вводится непосредственно в матку без прохождения через шеечный канал.
Метод ИКСИ применяется в случае, если общий оплодотворяющий потенциал определен, как низкий. Инъекция включает один здоровый сперматозоид, который вносится в цитоплазму яйцеклетки. В дальнейшем эмбрион имплантируется в матку. Для лечения фоновой патологии, которая стала причиной бесплодия, возможно оперативное вмешательство и коррекция выявленных аномалий репродуктивной системы.
Если говорить о медикаментозном лечении женщины, оно включает длительные курсы приема антибактериальных, антигистаминных препаратов и ударные дозы кортикостероидов. Во время лечения минимум 6 месяцев нужно использовать презервативы во время полового акта, чтобы снизить чувствительность организма женщины к мужскому эякуляту. При развитии аутоиммунных процессов лечение проводят с использованием гепарина.
Нормализация иммунных процессов позволяет увеличить способность к зачатию на 50%. Подкожное введение лимфоцитов мужа (или донора) способствует подавлению иммунитета. Вместе с этим проводят внутривенное введение смеси белков плазмы (от разных доноров, отобранных по определенной системе). Чтобы получить полноценную здоровую яйцеклетку для дальнейшего оплодотворения, проводится процедура активной гормональной стимуляции суперовуляции. При этом сперматозоид получают путем биопсии яичка или придатка, а также в результате физиологической эякуляции. Если иммунологическое бесплодие сильно повлияло на здоровье сперматозоидов, используется донорская сперма. Если в крови женщины обнаружено высокое содержание титра АСАТ, перед ЭКО, инъекцией или инсеминацией требуется длительное лечения для достижения стабильного состояния. Врачи рекомендуют использовать функциональные и активные сперматозоиды, которые являются генетически здоровыми и прошли морфологическую селекцию.
Для обработки и выбраковки эмбрионов проводится ассистированный хэтчинг, которые позволяет получить наиболее здоровые и жизнеспособные из них. Технология криоконсервации эмбрионов (перед имплантацией) увеличивает вероятность наступления беременности (предварительно требуется консультация репродуктолога).
Главной спецификой иммунологического бесплодия является возникновение данной патологии между двумя конкретными партнерами. Нередко АСАТ является реакцией на сперму определенного мужчины, и при смене партнера женщина без проблем может забеременеть. Современные технологии, методики и медикаментозное лечение позволяют достичь желаемого результата в большинстве случаев и подарить пациентам радость родительства.
Для правильной диагностики и выбора метода лечения важно обследование обоих партнеров. Комплексный подход позволяет устранить причину возникновения патологии и обеспечить естественное течение беременности без осложнений.
Иммунологическое (аутоиммунное) бесплодие
Иммунологическое (аутоиммунное) бесплодие является ключевой причиной отсутствия беременности у 7–15 % пар. Причем у мужчин иммунологический фактор бесплодия выявляется в 15 % случаев бесплодия, а у женщин — до 30% случаев. Разделение «мужского» и «женского» иммунологического бесплодия является условностью.