Аутоиммунные эндокринопатии что это
Аутоиммунные эндокринопатии что это
Комплексное исследование основных аутоантител, обнаруживаемых при аутоиммунных полиэндокринопатиях, которое используется для диагностики этих заболеваний.
Антитела при аутоиммунных полиэндокринопатиях; антитела при аутоиммунных полигландулярных синдромах.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
• Тип I : гипопаратиреоз, недостаточность надпочечников (болезнь Аддисона), хронический кожно-слизистый кандидоз и эктодермальная дистрофия. Этот редкий вариант АПЭ чаще возникает в детстве (ювенильный тип АПЭ). Заболевание характеризуется моногенным, аутосомно-рецессивным типом наследования. Считается, что мутация в гене AIRE приводит к нарушению нормального механизма толерантности иммунной системы, активации Т-клеток и образованию целого спектра аутоантител к различным органам и тканям. Часто мишенью этих аутоантител являются эндокринные органы (например, надпочечники). Однако при АПЭ I типа также обнаруживаются аутоантитела и к неэндокринным органам (например, париетальные клетки желудка, меланоциты, компоненты синовиальной оболочки суставов и другие).
• Тип II : недостаточность надпочечников, гипотиреоз и/или сахарный диабет 1 типа. Это самый распространенный вариант АПЭ. Как правило, он возникает в возрасте 30-40 лет (взрослый тип АПЭ). Заболевание характеризуется полигенным типом наследования. Этиология и патогенез АПЭ II типа менее ясны, хотя вероятно, нарушение иммунной толерантности также играет определенную роль в развитии этого заболевания.
Диагностика АПЭ носит комплексный характер, при этом лабораторные методы исследования играют ведущую роль. Как правило, лабораторные исследования при АПЭ проводят в 2 этапа.
• оценка функции щитовидной железы: ТТГ, свободный Т4;
• оценка функции половых желез: ФСГ, ЛГ, тестостерон, эстрадиол;
• оценка функции поджелудочной железы: глюкоза, С-пептид;
• оценка функции надпочечников: кортизол, АКТГ, уровень натрия и калия, общий анализ крови.
Такой двухэтапный диагностический подход применяется при обследовании пациентов, у которых подозревается АПЭ, и у их ближайших родственников, даже при отсутствии у них клинических симптомов заболевания. Это связано с тем, что появление аутоантител в крови предшествует развитию эндокринной недостаточности. Анализ на аутоантитела позволяет выявить родственников, у которых с большой вероятностью разовьется АПЭ в будущем, обеспечить им более внимательное наблюдение, вовремя начать специфическое лечение и избежать серьезных проявлений болезни (например, адреналового криза). Кроме того, показано, что 1 из 7 родственников первой линии родства пациента с АПЭ уже имеет какое-либо нераспознанное эндокринное заболевание (чаще иммунный треоидит), протекающее субклинически.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:
Что может влиять на результат?
Присутствие в крови антинуклеарных антител препятствует проведению анализа.
Кто назначает исследование?
Терапевт, врач общей практики, эндокринолог, педиатр.
Аутоиммунный полигландулярный синдром
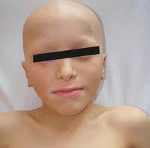
Аутоиммунный полигландулярный синдром 1 типа, иначе именуемый кандидополиэндокринным синдромом или синдромом Уайтекера, характеризуется многообразием клинических проявлений из-за множественного аутоиммунного поражения различных органов и тканей. Патологическая триада, состоящая из кандидоза кожных покровов и слизистых оболочек, гипопаратиреоза и признаков первичной надпочечниковой недостаточности, позволяет диагностировать аутоиммунный полигландулярный синдром 1 типа. Чаще всего заболевание возникает у детей 10-12 лет, поэтому иногда его называют ювенильной семейной полиэндокринопатией. Распространенность заболевания довольно низкая, за исключением представителей мужской популяции Ирана, Финляндии, Сардинии и ряда других стран с генетически обособленным народом.
Аутоиммунный полигландулярный синдром 2 типа возникает чаще у женщин в возрасте 20-33 лет и представляет собой сочетание первичной хронической надпочечниковой недостаточности с аутоиммунным тиреотоксикозом или диффузным токсическим зобом (так называемый синдром Шмидта), либо с сахарным диабетом 1 типа (синдром Карпентера).
Причины и механизм развития аутоиммунного полигландулярного синдрома
Заболевание передается из поколения в поколение, то есть можно говорить о его наследственной природе. Аутоиммунный полигландулярный синдром 1 типа является единственным атоиммунным заболеванием моногенной природы, так как известно, что его развитие связано с мутацией гена, который кодирует белок аутоиммунного регулятора. Данный ген расположен на длинном плече 21 хромосомы и ответственен за формирование клеточного иммунитета и механизмов иммунотолерантности. Наследование патологии происходит по аутосомно-рецессивному типу, а поражению часто подвержены братья и сестры одного поколения.
Аутоиммунный полигландулярный синдром 2 типа относят к разряду многофакторых патологических процессов с наследственной предрасположенностью, связанных с дефектной экспрессией антигенов системы HLA на клетках эндокринных желез, возникающей под влиянием факторов внешней среды. Патологический процесс может наследоваться представителями одной семьи на протяжении нескольких поколений.
Симптоматика аутоиммунного полигландулярного синдрома
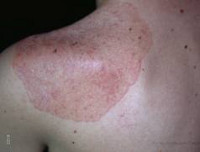
Аутоиммунный полигландулярный синдром 1 типа, развивающийся обычно в первые десять лет жизни, характеризуется первым признаком в виде хронического грибкового поражения кожи и слизистых оболочек (кандидоз), следом за которым развиваются гипопаратиреоз (снижение функции околощитовидных желез), первичная надпочечниковая недостаточность. Кандидомикоз при аутоиммунном полигландулярном синдроме имеет генерализованный характер, поражая слизистые оболочки полости рта, наружных половых органов, органов дыхания и пищеварения, кожные покровы и ногти. Гипопластические деформации ногтей и дисплазия эмали зубов служат признаками гипопаратиреоза. У ряда больных может отмечаться выпадение или поседение волос, воспаления век и роговицы глаз в виде кератоконъюнктивита и сухого кератита.
Изредка у больных диагностируют васкулит, ревматоидный артрит, нефрит с развитием хронической почечной недостаточности и различные типы анемий.
Аутоиммунный полигландулярный синдром 2 типа чаще всего проявляется в возрасте 30 лет хронической надпочечниковой недостаточностью. В течение последующего десятилетия присоединяются сахарный диабет 1 типа и аутоиммунный тиреоидит. Изредка встречаются случаи, когда функция щитовидной железы повышается, а не снижается, что приводит к развитию диффузного токсического зоба. Помимо вышеперечисленных патологий у больных могут наблюдаться воспалительные процессы в плевре и перикарде, поражения зрительных нервов, целиакия, опухолевые процессы в гипофизе.
Диагностические критерии аутоиммунного полигландулярного синдрома
Диагностика заболевания складывается из комплекса данных анамнеза, физикального обследования, лабораторно-инструментальных и молекулярно-генетических методов исследования.
Из анамнеза больного можно выяснить, встречалось ли подобное заболевание у кого-то из членов семьи, каким образом изменяется клиническая картина болезни, как часто присоединяются новые симптомы. При физикальном обследовании важно обратить внимание на кожные покровы для выявления отсутствия пигментации, гиперпигментации, сухости, бледности. Внимательному осмотру также подвергают ногти, волосы и слизистые оболочки для выявления признаков кандидомикоза и алопеции. Измерение массы тела и роста, а также оценка полового развития по шкале Таннера позволят оценить степень эффективности заместительной гормональной терапии, если таковая уже проводится, или степень тяжести течения аутоиммунного полигландулярного синдрома.
Так как для аутоиммунного полигландулярного синдрома характерно вовлечение в процесс и других органов, нелишней для постановки окончательного диагноза будет оценка функции половых желез. С этой целью исследуют уровень лютеотропного и фолликулостимулирующего гормона, а также тестостерона и эстрадиола.
Сахарный диабет 1 типа, входящий в аутоиммунный полигландулярный синдром 2 типа, выявляется измерением уровня сахара в крови, гликозилированного гемоглобина и при проведении перорального глюкозотолерантного теста. Для подтверждения того, что патологический процесс носит аутоимммунный характер, у больных исследуют наличие антител к органам-мишеням.
Молекулярно-генетическая диагностика предполагает проведение ДНК-диагностики аутоиммунного полигландулярного синдрома 1 типа всем пациентам, страдающим хроническим кандидомикозом, гипопаратиреозом и надпочечниковой недостаточностью с неясной этиологией. Этому же виду диагностики должны быть подвергнуты сестры и братья больного. Выявление мутировавшего гена может помочь в постановке окончательного диагноза на клиническом этапе или позволит выявить заболевание до появления клинических признаков.
Лечение аутоиммунного полигландулярного синдрома
Так какаутоиммунный полигландулярный синдром сочетает в себе сразу несколько патологических процессов в различных органах, есть определенные особенности лечения, несмотря на то, что основной целью его является устранение симптомов заболевания. В случае, если одновременно выявляются надпочечниковая недостаточность и гипотиреоз, для адекватной коррекции необходимо назначение заместительной гормональной терапии глюкокортикоидами и минералокортикоидами. Важно следить за дозировкой вводимых препаратов во избежание развития острого адреналового криза.
Пациенты должны употреблять в пищу продукты, богатые аскорбиновой кислотой и кальцием, в рационе увеличивают содержание хлорида натрия и запрещают прием алкогольных напитков.
Так как аутоиммунный полигландулярный синдром является хронической эндокринной патологией, больные должны находиться под наблюдением врача, проходить регулярное обследование дважды в год для выявления новых симптомов, достижения состояния компенсации и профилактики развития острых кризовых состояний.
Хроническая надпочечниковая недостаточность
Надпочечниковая недостаточность (недостаточность коры надпочечников) является одним из наиболее тяжелых заболеваний эндокринной системы, которое характеризуется снижением выработки гормонов корой надпочечников (глюкокортикоидов и минералокортикоидов)
Гормон Т4
Аутоиммунный тиреоидит (АИТ, тиреоидит Хашимото)
Гипотиреоз
Гипотиреозом называется состояние, отличающееся недостатком гормонов щитовидной железы. При длительном существовании нелеченного гипотиреоза возможно развитие микседемы («слизистого отека»), при котором развивается отечность тканей пациента в сочетании с основными признаками недостаточности гормонов щитовидной железы.
Гормоны щитовидной железы
Гормоны щитовидной железы делятся на два различных класса: йодитиронины (тироксин, трийодтиронин) и кальцитонин. Из двух этих классов гормонов щитовидной железы тироксин и трийодтиронин регулируют основной обмен организма (тот уровень энергозатрат, который необходим для поддержания жизнедеятельности организма в состоянии полного покоя), а кальцитонин участвует в регуляции обмена кальция и развития костной ткани.
Гипопаратиреоз
Псевдогипопаратиреоз
Анализы в СПб
Одним из важнейших этапов диагностического процесса является выполнение лабораторных анализов. Чаще всего пациентам приходится выполнять анализ крови и анализ мочи, однако нередко объектом лабораторного исследования являются и другие биологические материалы.
Анализ на гормоны щитовидной железы
Консультация эндокринолога
Специалисты Северо-Западного центра эндокринологии проводят диагностику и лечение заболеваний органов эндокринной системы. Эндокринологи центра в своей работе базируются на рекомендациях Европейской ассоциации эндокринологов и Американской ассоциации клинических эндокринологов. Современные диагностические и лечебные технологии обеспечивают оптимальный результат лечения.
Экспертное УЗИ щитовидной железы
УЗИ щитовидной железы является главным методом, позволяющим оценить строение этого органа. Благодаря своему поверхностному расположению, щитовидная железа легко доступна для проведения УЗИ. Современные ультразвуковые аппараты позволяют осматривать все отделы щитовидной железы, за исключением расположенных за грудиной или трахеей.
Анализ на АКТГ
Анализ на АКТГ применяется для диагностики заболеваний, связанных с нарушением работы коры надпочечников, а также в ходе наблюдения после оперативного удаления опухолей
Консультация детского эндокринолога
Очень часто на прием к специалистам Северо-Западного центра эндокринологии обращаются пациенты, не достигшие 18 лет. Для них в центре работают специальные врачи – детские эндокринологи
Отзывы
Истории пациентов
Видеоотзывы: опыт обращения в Северо-Западный центр эндокринологии
Аутоиммунный полигландулярный синдром
Аутоиммунный полигландулярный синдром – эндокринопатия аутоиммунного генеза, протекающая с одновременным первичным множественным поражением желез внутренней секреции и других органов. При аутоиммунном полигландулярном синдроме 1 типа отмечается надпочечниковая недостаточность, кандидоз кожи и слизистых, гипопаратиреоз; аутоиммунный полигландулярный синдром 2 типа протекает с развитием надпочечниковой недостаточности, гипер- или гипотиреоза, инсулинозависимого сахарного диабета, первичного гипогонадизма, миастении, стеатореи и др. нарушений. Диагностика включает определение комплекса лабораторных показателей (биохимического анализа, гормонов крови и мочи), УЗИ и КТ надпочечников, УЗИ щитовидной железы. Лечение аутоиммунного полигландулярного синдрома требует назначения заместительной терапии гормонами (кортикостероидами и минералокортикоидами, L-тироксином).
Общие сведения
Аутоиммунный полигландулярный синдром (АПГС) – иммуноэндокринное нарушение, характеризующееся первичной функциональной недостаточностью нескольких желез внутренней секреции, а также неэндокринными органоспецифическими заболеваниями. В эндокринологии различают аутоиммунный полигландулярный синдром 1 и 2 типов (АПГС-1, 2), которые имеют свои генетические, иммунологические и клинические особенности.
Аутоиммунный полигландулярный синдром 1 типа обычно манифестирует в детском возрасте (10-12 лет) и иногда обозначается в литературе термином «ювенильная семейная полиэндокринопатия». В целом распространенность АПГС-1 невелика, однако заболевание несколько чаще встречается в мужской популяции, преимущественно у жителей Финляндии, Сардинии, Ирана, что объясняется длительной генетической обособленностью этих народов. Аутоиммунный полигландулярный синдром 1 типа включает триаду признаков: надпочечниковую недостаточность, гипопаратироз и кандидамикоз.
Наиболее частым вариантом множественной эндокринопатии аутоиммунной природы является аутоиммунный полигландулярный синдром 2 типа, который развивается у взрослых (старше 20-30 лет); среди заболевших преобладают женщины. Компонентами АПГС-2 являются надпочечниковая недостаточность, сахарный диабет 1-го типа, аутоиммунное поражение щитовидной железы по типу первичного гипотиреоза или тиреотоксикоза. Кроме эндокринных нарушений, аутоиммунному полигландулярному синдрому 1 и 2 типов сопутствуют другие органоспецифические проявления.
Причины аутоиммунного полигландулярного синдрома
Оба типа аутоиммунного полигландулярного синдрома являются генетически детерминированными, на что указывает семейно-наследственный характер заболевания. При этом АПГС-1 поражаются братья и сестры одного поколения; аутоиммунным полигландулярным синдромом 2 типа – представители одной семьи на протяжении нескольких поколений.
Аутоиммунный полигландулярный синдром 1 типа – единственное известное аутоиммунное заболевание, имеющее моногенную природу. К развитию АПГС-1 приводит мутация гена аутоиммунного регулятора (AIRE), расположенного на длинном плече 21 хромосомы (21q22.3). Аутоиммунный полигландулярный синдром-1 наследуется по аутосомно-рецессивному типу и не связан с гаплотипами HLA.
Аутоиммунный полигландулярный синдром 2 типа ассоциирован с HLA-гаплотипом (антигенами DR3, DR4, DR5, В8, Dw3). Вероятно, что механизм развития АПГС-2 связан с аномальной экспрессией антигенов HLA-системы на клеточных мембранах желез внутренней секреции, которая запускается под воздействием каких-либо внешних факторов.
Симптомы аутоиммунного полигландулярного синдрома 1 типа
Аутоиммунный полигландулярный синдром 1 типа обычно впервые заявляет о себе в первые 10 лет жизни развитием гранулематозного кандидоза (кандидамикоза кожи и слизистых) и гипопаратиреоза. В дальнейшем (часто спустя десятилетия) присоединяется хроническая надпочечниковая недостаточность (аддисонова болезнь). Клиническими критериями установления диагноза синдрома служит сочетание двух из трех упомянутых эндокринных нарушений.
Кандидоз при АПГС-1 носит генерализованный характер и поражает слизистые оболочки полости рта, гениталий, дыхательных путей и желудочно-кишечного тракта, а также кожу, ногтевые валики, ногти. Гипопаратиреоз проявляется судорогами мышц конечностей, парестезией кожи, ларингоспазмом, судорожными припадками, напоминающими эпилепсию. Надпочечниковая недостаточность при аутоиммунном полигландулярном синдроме нарастает скрыто и может впервые проявится аддисоническим кризом на фоне стрессового состояния.
На фоне аутоиммунного полигландулярного синдрома 1 типа у женщин отмечается гипоплазия яичников (аутоиммунный оофорит), сопровождающийся первичной или вторичной аменореей. Мужской гипогонадизм проявляется снижением либидо, импотенцией, бесплодием.
Симптомы аутоиммунного полигландулярного синдрома 2 типа
Манифестация аутоиммунного полигландулярного синдрома 2 типа приходится на зрелый возраст (около 30 лет). Первым проявлением эндокринопатии обычно служит хроническая надпочечниковая недостаточность. Другие аутоиммунные компоненты (сахарный диабет 1-го типа, аутоиммунный тиреоидит), как правило, присоединяются через 7-10 и более лет.
У пациентов с аутоиммунным полигландулярным синдромом 2 типа часто развивается первичный гипогонадизм, миастения, витилиго, дерматит, алопеция, аутоиммунный гастрит, целиакия, стеаторея, полисерозиты (плеврит, перикардит, асцит), тимома. При аутоиммунном полигландулярном синдроме могут наблюдаться атрофия зрительных нервов, опухоли гипофиза, аутоиммунная тромбоцитопеническая пурпура и т. д.
Диагностика аутоиммунного полигландулярного синдрома
Критериями для постановки клинического диагноза служат подтвержденные лабораторным и инструментальным путем изолированные компоненты аутоиммунного полигландулярного синдрома (кожно-слизистый кандидоз, гипопаратиреоз и ХНН при АПГС-1; ХНН, аутоиммунный тиреоидит и сахарный диабет при АПГС-2). При АПГС 1 типа наиболее показательно проведение молекулярно-генетического анализа, позволяющего выявить характерную генную мутацию.
Лабораторное обследование при аутоиммунном полигландулярном синдроме включает определение биохимических показателей крови (уровня общего и ионизированного кальция, фосфора, калия, натрия, билирубина, трансаминаз, щелочной фосфатазы, общего белка, мочевины, креатинина, глюкозы), КОС крови и др. Важные диагностические сведения дают результаты исследований гормонов: ТТГ, свободного тироксина, паратгормона, АКТГ, инсулина, С-пептида, кортизола, ренина, альдостерона, соматомедина С, АТ-ТПО, АТ к бета-клеткам поджелудочной железы и GAD, тестостерона, ЛГ, ФСГ и др.
Инструментальные исследования включают УЗИ брюшной полости, щитовидной железы, органов малого таза (у женщин) и мошонки у мужчин, ЭхоКГ, КТ надпочечников. При наличии показаний проводятся консультации узких специалистов – диабетолога, гастроэнтеролога, гепатолога, дерматолога, миколога, невролога, гематолога, офтальмолога, гинеколога-эндокринолога, андролога, ревматолога.
Лечение аутоиммунного полигландулярного синдрома
При кандидамикозе, сопровождающем аутоиммунный полигландулярный синдром 1 типа, используются противогрибковые препараты. При сахарном диабете на фоне аутоиммунного полигландулярного синдрома 2 типа может потребоваться иммуносупрессивная терапия циклоспорином. Пациентам рекомендуется употребление повышенного количества аскорбиновой кислоты и соли. Запрещается прием алкоголя, некоторых лекарственных препаратов.
Прогноз аутоиммунного полигландулярного синдрома
Раннее выявление аутоиммунного полигландулярного синдрома и проведение адекватной заместительной терапии позволяют контролировать течение заболевания. Однако трудоспособность, как правило, снижается – пациентам присваивается II-III группа инвалидности.
Пациенты с аутоиммунным полигландулярным синдромом подлежат диспансерному наблюдению эндокринолога и других специалистов. При стрессовых состояниях, интеркуррентных инфекциях, физическом или умственном перенапряжении больным необходимо увеличение дозы гормонов. Необходимо немедленное обращение к врачу при любом ухудшении самочувствия. Летальный исход при аутоиммунном полигландулярном синдроме может наступать от ларингоспазма, висцерального кандидамикоза, острой надпочечниковой недостаточности.
Аутоиммунные заболевания эндокринной системы
Болезнь Грейвса. Антитела к рецептору тиреотропного гормона.
Рецептор тиреотропного гормона (рТТГ) экспрессируется преимущественно на поверхности тиреоидных фолликулярных клеток, но также на лимфоцитах, адипоцитах и фибробластах. Тиреотропный гормон является регулятором активности щитовидной железы. Сигнал от рТТГ запускает продукцию тиреоидных гормонов и рост тиреоидных фолликулярных клеток. Избыточная активация рТТГ аутоантителами при болезни Грейвса объясняет появление тиреотоксикоза и зоба при этом заболевании. Молекула рТТГ состоит из А и Б субъединиц гликопротеина. Эффект связывания аутоантител с рТТГ может быть разнонаправленным. Так, экстрацеллюлярная А субъединица рецептора распознается тиреоидными стимулирующими антителами, в то время как антитела, распознающие субъединицу Б, локализованную вблизи клеточной поверхности, действуют как функционально блокирующие антитела.
Стимулирующие антитела составляют основу болезни Грейвса – диффузного токсического зоба. Блокирующие антитела связываются с рецептором, но не вызывают его конформационных изменений, требуемых для сигнальной трансдукции. Они препятствуют связыванию ТТГ с рецептором, в результате чего возникает снижение тиреоидной функции. Блокирующие антитела были найдены у пациентов с атрофическим тиреоидитом Хашимото и у больных с болезнью Грейвса, протекающей с офтальмопатией. Блокирующая активность аутоантител может отчасти объяснить колебания тиреоидной функции, наблюдаемой у больных с болезнью Грейвса, и отсутствие корреляции между титром антител к рецептору тиреотропина и тиреоидной функцией. Блокирующие антитела могут проходить сквозь плаценту и вызвать транзиторный врожденный гипотиреоз. Наконец, выявлены нейтральные аутоантитела к рТТГ, которые связываются с рецептором, но блокируют связывание тиреотропина или других рецепторных антител. Нейтральные антитела отмечаются у пациентов с болезнью Грейвса. Их патогенетическое значение остается неустановленным.
Для выявления аутоантител к рТТГ в настоящее время используются радиоиммунный метод, ИФА и иммунохимический метод в ряде анализаторов закрытого типа. Хотя методы обладают высокой корреляцией между собой, однако ни один из них не позволяет уточнить присутствие в сыворотке крови стимулирующих или блокирующих антител. Для этой цели был разработан функциональный тест на культурах тиреоцитов животных или LATS-тест, от английского «long acting thyroid stimulator». В его основе лежит увеличение концентрации цАМФ в тиреоцитах под действием сыворотки больного, добавляемой в культуральную среду. В связи с трудоемкостью и сложностью стандартизации этот метод LATS используется только в исследовательских лабораториях.
Имеется четыре возможных клинических показания для определения антител к рецептору тиреотропина:1) диагностика транзиторной тиреоидной дисфункции у новорожденных от матерей с тиреотоксикозом и прогнозирования неонатальной болезни Грейвса; 2) выявление аутоиммуного генеза у больных с изолированной офтальмопатией без классических тиреоидных проявлений (эутиреоидная болезнь Грейвса); 3) предсказание рецидива тиреотоксикоза после прекращения 12-месячного цикла антитиреоидной терапии; 4) определение причины послеродового тиреотоксикоза.
Антитела к рТТГ высокоспецифичны, так как они крайне редко отмечаются у здоровых людей. В то же время, клиническая чувствительность составляет около 80%. То есть негативный результат определения аутоантител не позволяет исключить заболевание. Частично низкая чувствительность методов связана с тем, что аутоантитела к рецептору присутствуют в сыворотке в очень малой концентрации, на несколько порядков ниже, чем уровни аутоантител к тиреоглобулину и тиреоидной пероксидазе.
Сахарный диабет 1 типа. Латентный аутоиммунный диабет у взрослых (LADA-диабет).
Антитела к островковым клеткам.
Антитела к островковым клеткам (АОК или «islet cell antibodies»- ICA) направлены против ряда цитоплазматических антигенов β-клеток островков Лангерганса поджелудочной железы, которые синтезируют инсулин. Использование метода непрямой иммунофлюоресценции для выявления антител к островковым клеткам (ICA) имеет хорошую чувствительность и специфичность для диагностики дебюта сахарного диабета 1, что позволяет использовать этот тест в качестве референтного метода.
Антигенами антител к островковым клеткам является обширная группа мембранно-ассоциированных и цитоплазматических белков островковых клеток, причем ряд антигенов общие для эндокринной и нервной ткани. Среди данного семейства хорошо изучены несколько основных антигенов, таких как глютамат-декарбоксилаза (ГДК), эндогенный инсулин и тирозиназа (IA-2) и около 20 минорных антигенов.
Непосредственная роль АОК в разрушении островковых клеток при сахарном диабете остается спорной, однако была подтверждена способность антител фиксировать комплемент на островковых клетках, а также нарушать высвобождение инсулина. В то же время антитела к островковым клеткам поджелудочной железы могут быть обнаружены у 0,1-0,5% контрольной популяции без признаков диабета на момент обследования.
Антитела к островковым клеткам находят у 70-85% пациентов с сахарным диабетом на момент установления диагноза. Встречаемость значительно снижается с увеличением длительности заболевания и возраста дебюта болезни. Около 5-10% пациентов с симптоматикой сахарного диабета 2 типа могут иметь АОК на фоне инсулино-зависимой формы диабета взрослых (LADA), которая является разновидностью аутоиммунного диабета. Антитела к островковым клеткам могут служить важным предиктором заболевания среди родственников первой степени родства (сиблингов). Среди них 3-5% оказываются положительными, в то время как в общей популяции частота антител не превышает 0,4%. Риск заболевания брата или сестры максимален в течение 5 лет от заболевания пробанда.
Антитела к глютамат-декарбоксилазе (ГДК- GAD-антитела).
Глютамат-декарбоксилаза (ГДК – GAD англ.) является ферментом, участвующим в синтезе гамма-оксибутировой кислоты, которая контролирует освобождение инсулина из секреторных гранул β-клеток поджелудочной железы. Глютамат-декарбоксилаза не является специфичной для β-клеток поджелудочной железы, поскольку присутствует в нервной системе и семенных железах. Фермент глютамат-декарбоксилаза массой 65 кДа является основной мишенью аутоантител у больных сахарным диабетом, латентным аутоиммунным диабетом взрослых (LADA), диабетом беременных и при синдроме «ригидного человека».
При дебют сахарного диабета у детей старше 5 лет на антитела к глютамат-декарбоксилазе серопозитивны 70-90% пациентов. С момента дебюта заболевания титры и встречаемость аутоантител постепенно снижаются. Антитела к глютаматдекарбоксилазе выявляются задолго до развития заболевания, и в комбинации с другими серологическими маркерами могут использоваться для предсказания дебюта заболевания. В комбинации с антителами к инсулину, IA-2 и ICA, выявление антител к ГДК/GAD указывает на риск развития сахарного диабета у брата или сестры заболевшего, достигающий 90%. Выявление антител к ГДК в сыворотке может использоваться для идентификации лиц с риском сахарного диабета и для дифференциального диагноза между диабетом 1 и 2-го типов, особенно у лиц с ожирением. Антитела к ГДК/GAD отмечаются у 40% пациентов с LADA-диабета. Распространенность антител к ГДК при диабете беременных составляет 5-10%.
Наконец, аутоантитела к ГДК отмечаются при редких аутоиммунных паранеопластических синдромах, сопровождающихся поражением центральной нервной системы. Прежде всего это синдром «ригидного человека» (stiff–person syndrome, англ.), характеризующийся прогрессирующей ригидностью нижних конечностей, судоргами и эпилепсией. Синдром регидного человека может сочетаться с тимомой и мелкоклеточным раком легкого. Сахарный диабет 1 типа также обычно присутствует наряду с неврологической симптоматикой.
Антитела к глютамат-декарбоксилазе встречаются при многих аутоиммунных эндокринопатиях, наиболее частыми среди которых являются тиреоидит Хашимото и диффузный токсический зоб, целиакия и болезнь Аддисона.
Антитела к к тирозин-фосфатазе ( анти-IA2).
Нейроэндокринный антиген IA-2 (ICA512) является тирозин-фосфатазой, которая участвует в регуляции секреции инсулина. Антиген накапливается в секреторных гранулах нейроэндокринных клеток, а также бета клеток островков Лангерганса, где он участвует в регуляции секреции инсулина. Антитела к тирозин-фосфатазе IA-2 являются маркером сахарного диабета 1 типа и отмечаются у 50-70% пациентов у детей и подростков в дебюте заболевания. Как и встречаемость других серологических маркеров сахарного диабета, их встречаемость падает после дебюта заболевания. Антитела к IA2 используются в прогнозировании развития сахарного диабета у родственников больных, совместно с выявлением антителами к GAD, ICA и антителами к инсулину (Антитела к островкам поджелудочной железы (анти-GAD/IA2)). В связи с низкой встречаемостью, выявление антител к тирозин фосфатазе не обладает достаточной информативностью при минорных клинических формах сахарного диабета
Антитела к эндогенному инсулину.
Инсулин играет основную роль в регуляции содержания сахара в крови, кроме того он влияет на метаболизм липидов в организме. Он синтезируется β-клетками островков Лангерганса в виде прогоромона, после чего секретируется в соответствии с физиологической потребностью.
Антитела к эндогенному инсулину являются самым ранним маркером сахарного диабета и могут отмечаться в крови пациентов задолго до развития первых клинических симптомов заболевания. Выделяют антитела к эндогенному инсулину, которые являются маркером сахарного диабета у детей, и антитела к экзогенному инсулину, которые появляются в ходе инсулинотерапии. Появление антител к экзогенному инсулину затрудняет детекцию аутоантител, поэтому выявление антител к эндогенному инсулину в диагностических целях возможно только до начала инсулинотерапии. Аутоантитела, определяемые до назначения препаратов инсулина, т.е к эндогенному инсулину, присутствуют у 40-90% больных с клиническим дебютом сахарным диабетом, причем у детей младше 10 лет встречаемость аутоантител значительно выше, по сравнению со взрослыми пациентами. Титр антител обратно пропорционален возрасту и уменьшается по мере разрушения β-клеток в ходе заболевания. При прогнозировании заболевания у близких родственников больных отмечается зависимость между выявлением антител к инсулину и риском развития диабета, но вероятность заболевания значительно увеличивается если антитела к инсулину выявляются в комбинации с другими антителами к островковым антигенам. Антитела к инсулину могут быть найдены при аутоиммуных полиэндоринопатиях, при некоторых других аутоиммуных заболеваниях.
Аутоиммунный адреналит или аутоиммуное поражение надпочечников является наиболее частой формой первичной надпочечниковой недостаточности или болезни Аддисона. Заболевание характеризуется дефицитом продукции глюкокортикоидов и минералкортикоидных гормонов результате разрушения надпочечников аутоиммунным процессом. Болезнь Аддисона может быть частью аутоиммуного полиэндокринного синдрома, сочетающего аутоиммунное поражение нескольких эндокринных желез.
Серологическим маркером разрушения надпочечников являются аутоантитела, реагирующие с ферментами стероидогенеза коры надпочечников. Ферменты стероидогенеза обеспечивают окисление гормональных предшественников и локализуются в цитоплазме клеток всех трех слоев коры надпочечников. Антитела против стероидпродуцирующих клеток коры надпочечника представлены иммуноглобулинами класса IgG и способны фиксировать комплемент. Основной мишенью антител к коре надпочечников является 21-гидроксилаза. Кроме того, в надпочечниках представлены другие ферменты стероидогенеза – 17 альфа-гидроксилаза и фермент р450scc.
Чувствительность серологического обследования при болезни Аддисона в зависимости от длительности заболевания составляет 60-80%, а специфичность — 95-100%. При надпочечниковой недостаточности вследствии туберкулеза антитела отмечаются в 4-6% случаев, у здоровых лиц встречаемость не превышает 0,5%. Определение антител к стероидной 21-гидроксилазе у больных в дебюте аутоиммунной болезни Аддисона чаще дает положительный результат, чем у больных с длительным течением заболевания. Кроме того антитела к коре надпочечников и антитела к 21-гидроксилазе выявляются при аутоиммунных полиэндокринопатиях 1 и 2-го типов.
Особое значение имеет определение аутоантител у пациентов с аутоиммунными полиэндокринопатиями для прогнозирования развития надпочечниковой недостаточности. Может быть рекомендовано выявление аутоантител к коре надпочечников у больных с диабетом Iтипа моложе 10 лет, у родственников первой степени родства лиц, страдающих болезнью Аддисона и у лиц с первичной недостаточностью яичников. Повышенный титр антител к коре надпочечников, мужской пол, наличие хронического кандидоза кожи и слизистых и/или гипопаратиреоза указывают на высокий риск развития надпочечниковой недостаточности как компонента полиэндокринопатии 1 или 2 типов. У этих пациентов необходимо регулярно обследовать функцию коры надпочечников с интервалами каждые 6-12 месяцев для того, чтобы предупредить жизнеугрожающие адреналовые кризы и начало ранней заместительной терапии.
Антитела стероидпродуцирующим клеткам яичка связываются со своими антигенами в цитоплазме клеток Лейдига, основным продуктом синтеза которых в организме мужчин является тестостерон. Цитоплазма клеток Лейдига богата двумя ферментами стероидогенеза, а именно р450с17 (17-гидроксилаза) и фермент р450scc, которые принимают активное участие в синтезе тестостерона.
Антитела к стероидпродуцирующим клеткам яичника и яичка находят в 80-95% случаев у больных первичным гипогонадизмом (гипергонадотропный гипогонадизм) при отсутствии кариотипических аномалий (нормальном хромосомном наборе). Также аутоантитела могут отмечаться у больных при полоэндокринопатиях, т.е. сочетаниях нескольких аутоиммунных эндокринопатий у одного человека. Так сочетание клиники надпочечниковой и гонадной недостаточности между собой можно подтвердить сочетанным обнаружением аутоантител к нескольким ферментам стероидогенеза.
Аутоантитела можно изредка обнаружить у лиц со вторичной аменорреей без признаков болезни Аддисона. У этих больных часто выявляются антитела к стероид-продуцирующим клеткам надпочечников (см. описание теста), которые указывают на высокий риск развития аутоиммунной болезни Аддисона. Выявление аутоантител к стероидпродуцирующим клеткам у мужчин, направленные к р450scc, применяются для диагностики аутоиммунной тестикулярной недостаточности и задержкой полового развития.