Аутокость в позвоночнике что
Cистемы стабилизации позвоночника
Содержание:
За последние десятилетия хирургия позвоночника совершила огромный прорыв в своем развитии, благодаря развитию и внедрению различных доступов — вентральных, дорзальных, переднебоковых, комбинированных; анестезиологии и реанимации, которые позволяют пациентам выдерживать многочасовые, травматичные операции со значительной кровопотерей и конечно же постоянному совершенствованию стабилизирующих систем.
В данном небольшом обзоре собственного опыта лечения заболеваний позвоночника хотелось бы уделить особенное внимание именно современным конструкциям для стабилизации позвоночника, отметить слабые и сильные стороны, продемонстрировать различные сочетания имплантов между собой в той или иной клинической ситуации. Медицинский рынок имплантов в нашей стране стремительно развивается, на арену выходят все новые конструкции, представляемые различными производителями, что обусловлено технологическим прогрессом, конкуренцией и огромной коммерческой составляющей.
Традиционно лидируют западноевропейские и американские производители, но все чаще в нашу ежедневную практику приходят азиатские импланты, произведенные в Китае, Южной Корее и т.д.
Самым первым телозамещающим протезом позвонка была собственная кость (аутокость из гребня подвздошной кости, участок ребра или малая берцовая кость), которая устанавливалась между телами позвонков в специальные пазы вместо удаленного. Дополнительная фиксация не проводилась, в связи с чем сохранялась опасность миграции аутокости, а пациент был вынужден соблюдать длительный постельный режим до образования надежного костного сращения. Это значительно снижало качество жизни пациента, было сопряжено с гиподинамическими осложнениями. Со временем появились устройства, которые способствовали неподвижному положению костного трансплантата, в результате чего пациент мог быть активизирован в раннем послеоперационном периоде. До сих пор собственная кость считается «золотым» стандартом в создании корпородеза.
Клинический пример
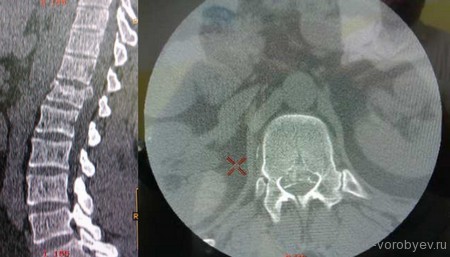
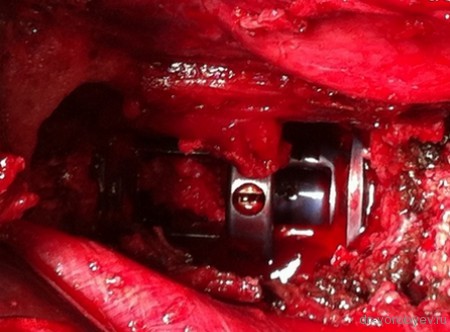
Представлены КТ пациента до и после оперативного лечения по поводу осложненного перелома пятого шейного позвонка. Выполнена корпорэктомия пятого шейного позвонка с комбинированным корпородезом аутокостью из подвздошного гребня и пластиной китайского производства.
Все большее количество клиник овладевает техникой «передних вмешательств на грудном и поясничном отделах позвоночника», где так же используется аутокость для межтелового корпородеза.
Клинический пример
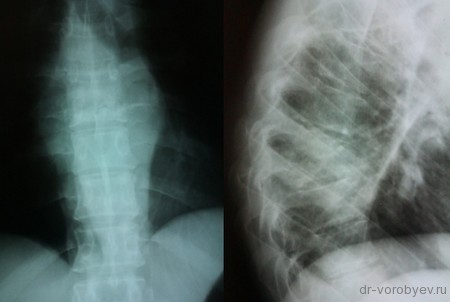
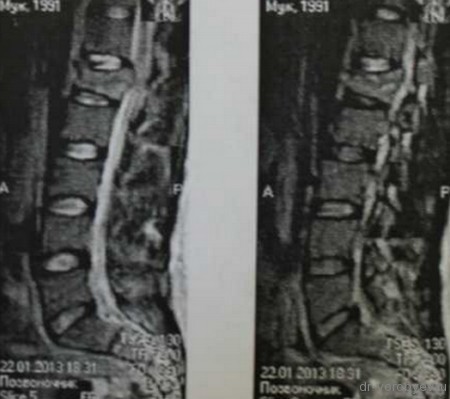
На данных томограммах представлен нестабильный перелом тела Тн12 позвонка
Первым этапом выполнена ламинэктомия с транспедикулярной фиксацией китайской системой, а затем проведена корпорэктомия, корпородез аутокостью и тораколюмбальной пластиной китайского производства.
Клинический пример
Пациент с неспецифическим спондилодисцитом в грудном отделе позвоночника
Выполнена операция торакотомия, трансплевральная корпорэктомия, комбинированный корпородез аутокостью и пластиной Centaur фирмы Stryker
Как уже упоминалось, собственная кость считается идеальным материалом и «золотым» стандартом для протезирования тела позвонка и создания прочного корпородеза, но данная методика не идеальна и имеет ряд недостатков:
1. Взятие аутокости является самостоятельной дополнительной операцией, которая удлинняет время основного оперативного вмешательства.
2. Она является дополнительным ослабляющим фактором у ослабленных, пожилых пациентов (в том числе с опухолевым поражением позвоночника), является дополнительным источником кровотечения из костной раны.
3. Не всегда возможна и удобна операция взятия аутотрансплантата из гребня подвздошной кости у пациентов с переломом костей таза.
4. Возможна резорбция костного аутотрансплантата с развитием нестабильности оперированного сегмента. Все эти доводы подталкивают на создание искусственных металлических, керамических и др. заменителей тела позвонка.
Титановый сетчатый МЭШ является распространенным заменителем тела позвонка и используется для всех отделов позвоночника. Он представляет из себя участок трубки различного диаметра и длины (в зависимости от того, в какой отдел позвоночника будет имплантирован) с ромбовидными отверстиями. С учетом высоты межпозвонкового промежутка после выполненной корпорэктомии МЭШ моделируется (обрезается по необходимой длине), заполняется собственной костью или остеоиндуктивным материалом и устанавливается между телами позвонков. Самостоятельно МЭШ не может обеспечить ротационную стабильность в оперированном сегменте позвоночника, в связи с чем требует дополнительной фиксации передней или передне-боковой пластиной, установки транспедикулярной системы.
Клинический пример
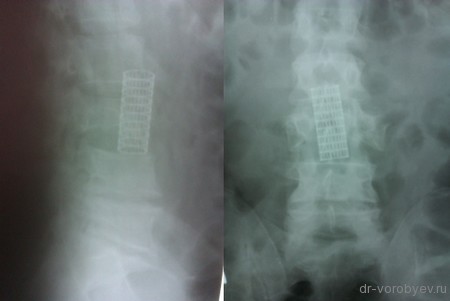
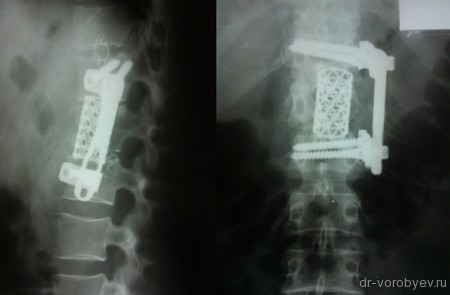
Первым этапом проведена корпорэктомия третьего поясничного позвонка и корпородез МЭШем, заполненным аутокостью
Вторым этапом, с целью создания ротационной стабильности, компрессии позвонков проведена транспедикулярная фиксация.
Клинический пример
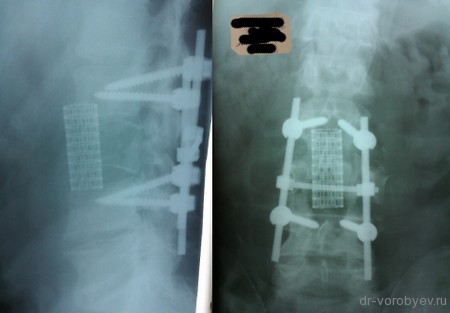
Пациентка с метастазом в рака молочной железы в первый поясничный позвонок
Выполнена корпорэктомия первого поясничного позвонка и комбинированный корпородез МЭШем и боковой пластиной Centaur фирма Stryker. Наряду с преимуществами, главным из которых является относительная дешевизна данного импланта, МЭШ так же не является идеальной конструкцией для переднего корпородеза и имеет на наш взгляд ряд недостатков:
1. Большинство отечественных МЭШей не имеют установочного инструментария для обрезания и моделирования по длине, что требует со стороны хирурга больших физических затрат с использованием подручного неприспособленного инструментария (различного вида кусачки и проволочные пилы).
2. При имплантации в свое ложе МЭШ может легко деформироваться и погнуться (не терпит подбивания импакторами).
3. МЭШи, лишенные торцевых площадок (чаще всего отечественные), имеют острые края, благодаря которым возможно продавливание замыкательных пластин опорных позвонков с нарушением стабильности в оперированном сегменте.
4. Требуют использования дополнительных фиксаторов.
Различные импланты из неорганических соединений – корундовая керамика, никелид титана, гидроксиапатиты.
Преимуществами данных телозамещающих изделий является хорошая биосовместимость с костной тканью и способность к ее прорастанию в имплант благодаря высокой порозности, относительная дешевизна, легкость при моделировании необходимой формы и размера. Данные импланты по своим характеристикам и своиствам схожи с аутокостью, но лишены такого ее недостатка, как возможное рассасывание, но к сожалению некоторые импланты данного вида достаточно хрупки и при имплантации могут крошиться и трескаться, кроме того, как и в ситуации с аутокостью требуют использования дополнительных устройств для фиксации – пластин, транспедикулярных фиксаторов и т.д.
Клинический пример
В данной конкретной ситуации выполнена дискэктомия С5-С6 и межтеловой корпородез имплантом из гидроксиапатита производство Франции и пластиной.
Телескопические протезы тела позвонка
Традиционно в условиях российского рынка лидируют западноевропейские и американские производители телескопических протезов тел позвонков.
Сами по себе данные устройства имеют огромное количество преимуществ перед своими конструктивными предшественниками:
1. Существует большое количество типов и размеров имплантов, прилагается высоко технологичный инструментарий для качественной установки.
2. Благодаря концевым площадкам с различными кифотическими и лордозными углами моделируют естественные изгибы позвоночника.
3. С помощью раздвижного телескопического устройства плотно фиксируются в своем ложе.
4. При необходимости легко демонтируются.
5. Имеют возможность малоинвазивной эндоскопической установки (протез тела позвонка Obelisk, Ulrich, Германия в комбинации с боковой пластиной Golden Gate) и т д и т п Но, к сожалению высокая стоимость часто лимитирует использование данных устройств в российской практической медицине. Кроме того, телескопические протезы тела позвонка так же требуют дополнительной фиксации с помощью пластин или транспедикулярных устройств для придания ротационной стабильности.
Клинический пример
Перелом тела первого поясничного позвонка
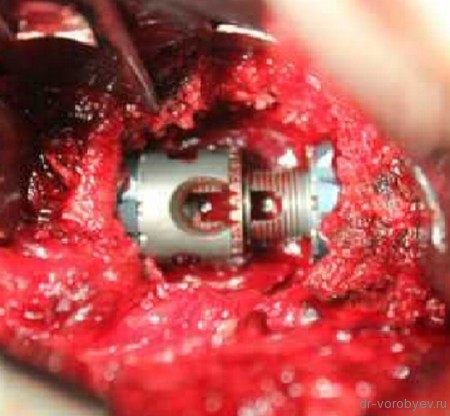
Вид операционной раны. На место удаленного тела позвонка, после декомпрессии установлен протез тела позвонка Obelisk, Ulrich, Германия
Протез дополнительно фиксирован тораколюмбальной пластиной.
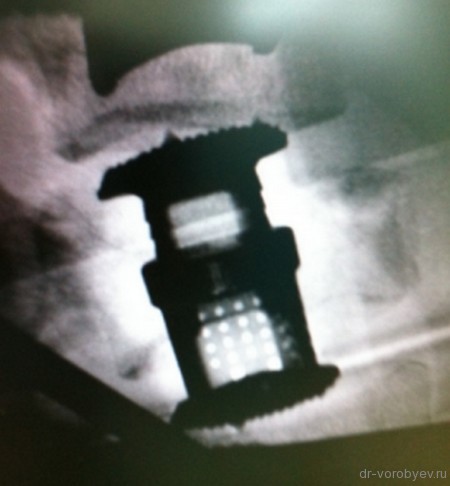
Рентгенологический контроль после операции.
Клинический пример
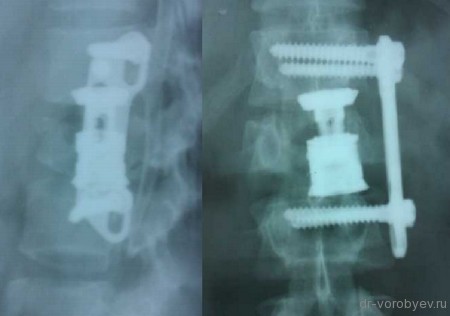
Передний корпородез с использованием телескопического протеза тела позвонка Synex, фирма Synthes, США.
Внешний вид импланта
Протез помещен между телами смежных позвонков.
Интраоперационный рентгенологический контроль.
Вопросы о необходимости операции с использованием импланта можно задать по телефону +7-903-526-78-77
Спондилодез – что это такое?
Спондилодез
– хирургическая процедура, применямая для решения проблем с небольшими костями позвоночника – позвонками. По существу это процесс “сварки”. Основная идея – срастить вместе болезненный сегмент из двух или более позвонков в одну цельную кость.
Хирургия позвоночника обычно используется в тех случаях, когда источник боли четко определен и консервативные методы лечения неэффективны. Чтобы определиться с показаниями к хирургии, используются различные методы визуализации, такие как рентгенография, компьютерная томография (КТ) и магнито-резонансная томография (МРТ).
Хирургия позвоночника является эффективным решением для таких состояний как:
Стеноз позвоночного канала
Описание
Спондилодез исключает возможность подвижности между двумя позвонками. Также это предотвращает растяжение нервов и окружающих связок и мышц. Когда движение – источник боли. Смысл в том, что если позвонки, вызывающие боль, не двигаются – они не вызывают боль.
Если вдобавок к боли в пояснице пациент страдает от боли в ноге, хирург также выполняет декомпрессию – ламинэктомию. Эта процедура заключает в себе удаление костных структур и других вовлеченных в болезнь тканей, давящих на нервные корешки.
Спондилодез ограничивает гибкость позвоночника, однако большинство вмешательств вовлекают лишь небольшие сегменты и не сильно ограничивают подвижность в целом.
Чтобы помочь понять основные термины и сокращения, можно обратиться к небольшому словарику: Спондилодез
Операция
Поясничный спондилодез выполняется уже десятилетия. Существует несколько техник, используемых для сращения позвонков друг с другом. Также существует несколько хирургических “доступов”, используемых для этой операции.
анимация создана Visual Health Solutions Inc.
Ваш хирург может использовать “передний доступ” к позвоночнику, требующий разреза внизу живота (Anterior Lumbar Interbody Fusion)
Задний доступ выполняется со стороны спины. Или же сбоку, в данном случае это называется “боковой доступ”
(“Posterolateral Interbody Fusion” и “Posterior Lumbar Interbody Fusion and Transforaminal Interbody Fusion”)
Также были разработаны минимально-инвазивные методики. Они позволяют добиться того же результата, выполнив операцию через гораздо меньшие разрезы и с меньшим повреждением окружающих мягких тканей.
Выбор метода зависит от диагноза и локализации процесса.
Пересадка кости
При любом типе спондилодеза используется тот или иной тип костного материала, для улучшения и ускорения результата. Обычно, небольшие кусочки кости размещаются между позвонками, чтобы стать частью общего костного массива.
Пересадка кости первоначально использовалась, чтобы стимулировать процесс сращения. Это ускоряет рост кости и помогает позвонкам срастись в одну цельную кость. Иногда более крупные целые куски кости используются чтобы обеспечить структурную поддержку позвонка.
В прошлом, костный трансплантат забирался из бедра пациента и это был единственный способ достичь спондилодеза. Эта методика называлась “аутотрансплантация”. Забор кости требует дополнительного доступа и фактически дополнительной операции, удлиняющей общее время вмешательства и усиливающей болевой синдром в послеоперационном периоде. Чаще всего “аутокость” забиралась из бедра или переднего гребня подвздошной кости.
В настоящее время в большинстве случаев используются искусственные биоматериалы.
Деминерализированная костная матрица (DBM). Кальций удаляется из трупной кости, чтобы создать DBM. Без минерала, кость может принять форму пасты или гелеобразной субстанции. DBM обычно используется с другими материалами и может содержать специальные белки, чтобы ускорить процесс сращения.
Морфогенные костные протеины (BMP). Это очень мощные синтетические белки, формирующие кость и обеспечивающие ускорение сращения. В случае использования BMP в заборе аутокости нет необходимости.
Керамика. Синтетические кальций-фосфатные материалы, похожие по форме и содержанию на натуральную кость.
Использование того или иного типа трансплантата зависит от того, что именно будет лучше работать в конкретном клиническом случае.
Иммобилизация
После пересадки кости позвонки нуждаются в фиксации, чтобы помочь процессу формирования спондилодеза. Ранее, в послеоперационном периоде использовались корсеты. В современной хирургии позвоночника в большинстве случаев хирурги используют пластины, винты и стержни, чтобы обеспечить неподвижность сегмента. Это называется “внутренняя фиксация”, которая многократно увеличивает частоту успешных результатов лечения и позволяет добиться много большей стабильности фиксации. При этом большинство пациентов начинают процесс реабилитации практически в первые же дни после хирургического вмешательства.
Аутокость в позвоночнике что
Успех многих вмешательств на позвоночнике определяется качеством формируемого костного блока с использованием того или иного метода костной пластики. Стабилизация позвоночника металлоконструкциями сразу обеспечивает достаточно ригидную фиксацию позвоночника, однако с тем, чтобы эта фиксация продолжала оставаться ригидной в долгосрочной перспективе, должен сформироваться костный блок. Вне зависимости от того, какая для пластики используется кость — собственная кость пациента (аутотрансплантат) или трупная аллокость, задачей этой пластики является формирование живого костного блока.
а) Выбор костного трансплантата. Тип используемого костного трансплантата зависит от характера хирургического вмешательства, предпочтений хирурга и, реже, от предпочтений пациента. Костный аутотрансплантат может быть кортикальным, губчатым или смешанным — кортикально-губчатым. Кортикальная кость является наиболее прочным типом костного аутотрансплантата и обычно используется в случаях, когда необходимо создание опоры, например, при спондилодезе после передних корпорэктомий. По сравнению с губчатой костью кортикальная кость отличается меньшим числом клеточных элементов и меньшей площадью поверхности. Губчатая аутокость характеризуется лишь 60% прочности кортикальной кости, однако обеспечивает очень высокую частоту формирования костного блока.
Губчатая кость являет собой идеальную комбинацию остеогенных, остеоиндуктивных и остеокондуктивных характеристик, что определяется наличием здесь большого количества живых клеток, белков костной матрицы и особой архитектоники. Губчатая кость в чистом виде обычно используется при задних спондилодезах, где не требуется, чтобы трансплантат противостоял компрессионным нагрузкам. Кортикально-губчатые трансплантаты состоят из обеих типов костной ткани и обладают преимуществами и тех и других. Эти трансплантаты прочней губчатой кости и сохраняют многие из ее преимуществ. Наиболее часто используемым примером такого трансплантата является трикортикальный трансплантат из гребня подвздошной кости.
Аутотрансплантаты остаются золотым стандартом создания оптимальных условий для формирования качественного костного блока, однако и они не лишены недостатков. Осложнения, связанные с забором костного трансплантата, могут варьировать от наличия дополнительного источника болевого синдрома до более серьезных проблем. Качество и количество аутокости зачастую оказываются недостаточными. Одной из альтернатив аутокости является трупная аллокость. В отличие от аутокости, которая является живой, нереактогенной и генетически идентичной, аллокость — это неживая кость.
По сравнению с аутокостью васкуляризация аллокости происходит медленней. Скорость формирования костного блока также ниже, а риски резорбции трансплантата, его отторжения и инфекционных осложнений — выше. Очевидное преимущество аллокости в сравнении с аутокостью — это отсутствие проблем, связанных с зоной забора трансплантата. Точно так же нет таких проблем и при использовании относительно новой категории трансплантатов — костных заместителей, который также достаточно эффективны в отношении формирования костного блока, хотя напрямую и не связаны с ауто- или аллокостью.
б) Техники забора костного трансплантата. Вне зависимости от типа костного трансплантата шансы на формирование качественного костного блока можно увеличить за счет тщательного соблюдения техники вмешательства и адекватной обработки как самого трансплантата, так и костного ложа для него. Все это в сочетании с ригидной внутренней фиксацией обеспечивает максимальные шансы на формирование прочного костного блока. Операционная травма мягких тканей в области предполагаемого костного блока должна быть минимальной с тем, чтобы максимально сохранить васкуляризацию костного ложа. Отказ от использования монополярного коагулятора и обильное орошение рабочей зоны в ходе обработки костного ложа бором позволяет минимизировать риск термического повреждения костной ткани.
Костный трансплантат и формируемое для него костное ложе должны быть тщательно освобождены от надкостницы и других мягких тканей, в противном случае в зоне контакта будем сформирован фиброзный блок, а не костный. Обычно с целью создания условий для формирования костного блока в области костного ложа для трансплантата выполняется декортикация кости. Костному трансплантату необходимо придать такую форму, чтобы он точно соответствовал форме подготовленного для него костного ложа, а площадь контакта между ними была максимальной. В области формируемого костного блока не должно оставаться свободного пространства, в пери- и послеоперационном периоде следует избегать применения любых нестероидных противовоспалительных препаратов.
1. Забор костного трансплантата из переднего отдела подвздошной кости (гребня). Исторически так сложилось, что костные трансплантаты из переднего отдела подвздошного гребня наиболее часто использовались при передних вмешательствах на шейном отделе позвоночника, когда требовалась кортикально-губчатая аутокость. В последующем было показано, что шансы на формирование костного блока в этой конкретной ситуации достаточно высоки и при использовании аллокости, поэтому использовать аутокость при этих вмешательствах стали реже. Однако костные трансплантаты из переднего отдела подвздошного гребня могут использоваться при передних спондилодезах шейного отдела позвоночника у пациентов с высоким риском несращения, а также их все еще так или иначе используют при передних корпородезах поясничного отдела позвоночника.
Забор костного трансплантата из переднего отдела подвздошного гребня проводят через линейный разрез кожи, параллельный гребню, непосредственно над зоной забора трансплантата. Забор во избежание повреждения паховой связки и отрывного перелома следует начинать по крайней мере на 3 см позади передней верхней подвздошной ости. Для облегчения доступа к соответствующему подвздошному гребню под соответствующую ягодицу можно подложить подушку.
Вслед за кожей рассекается подкожная клетчатка до фасции. Края раны разводятся ретракторами и фасция рассекается непосредственно по ходу гребня, после чего гребень выделяется поднадкостнично. Фасциальная манжета и надкостница должны оставаться интактными для последующего закрытия раны. Для забора трикор-тикального трансплантата на необходимом протяжении поднадкостнично выделяются внутренняя и наружная стенки гребня. При выделении внутренней стенки следует соблюдать известную осторожность. Работать здесь во избежание повреждения брюшины или подвздошно-подчревного, подвздошно-пахового и латерального кожного нерва бедра следует строго поднадкостнично. Во избежание повреждения нервов действовать электроножом следует крайне аккуратно.
Клинки ретракторов вводятся глубже, открывая хороший доступ ко всем поверхностям гребня, после чего с помощью осциллирующих пил или остеотомов выполняется собственно забор трансплантата. Если трансплантат будет выполнять опорную функцию, предпочтительно использование пилы, поскольку использование остеотомов приводит к формированию микропереломов стенок трансплантата, что снижает его прочность. Некоторые хирурги во время забора трансплантата во избежание повреждения мышц и брюшины временно тампонируют участки раны кнутри и кнаружи от подвздошного гребня.
После забора трансплантата с помощью костного воска или гемостатической губки Gelfoam, пропитанной тромбином, выполняют гемостаз донорского ложа. Дренирование здесь обычно не требуется, и рана ушивается послойно, начиная с надкостницы и фасции, которые ушиваются отдельными узловыми швами.
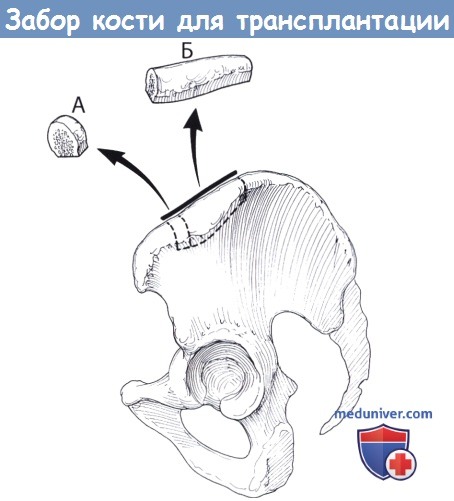
Трикортикальные костные блоки могут использоваться для одноуровневого межтелового спондилодеза (А) или для многоуровневых реконструкций (Б). 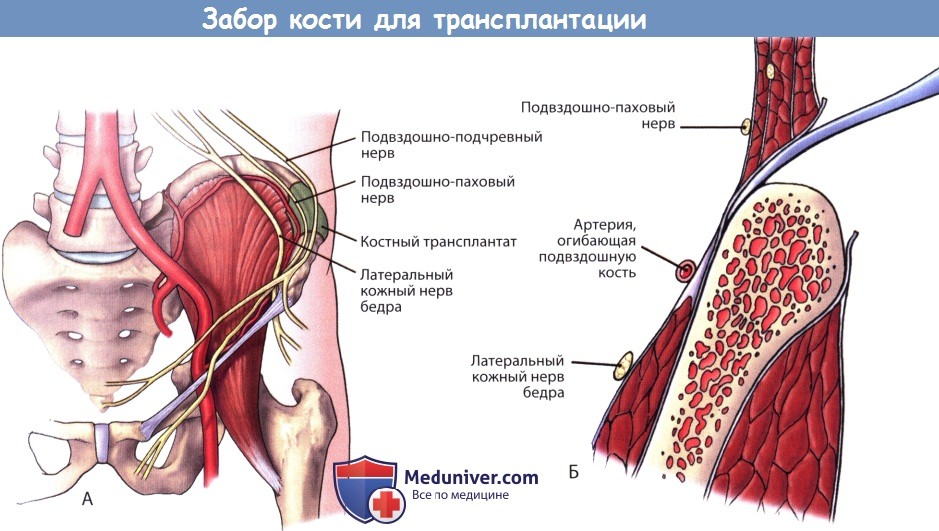
Б. Во избежание повреждения подвздошно-подчревного, подвздошно-пахового и латерального кожного нерва бедра работать в этой зоне следует строго поднадкостнично, от использования электроножа лучше воздержаться.
2. Забор костного трансплантата из заднего отдела подвздошного гребня. Задний отдел подвздошного гребня может использоваться для получения трикортикальных трансплантатов, кортикальных чипсов, кортикально-губчатых пластинок и губчатых костных чипсов. Костный материал забирается непосредственно из области гребня или из поверхности крыла ниже гребня. Если планируется забор трикортикального костного трансплантата, то во избежание повреждения крестцово-подвздошного сочленения и седалищной вырезки осуществляется это в области задней верхней подвздошной ости (ЗВПО) или латеральней нее. Трансплантаты, однако, не следует забирать далее 8 см от подвздошной ости, поскольку в противном случае существует риск повреждения верхних нервов ягодиц, что приведет к нарушению чувствительности ягодичной области и может стать причиной формирования болезненных невром.
Это позволяет избежать также ранения мочеточника, который располагается в забрюшинной клетчатке.
Костный материал забирается с использованием осциллирующей пилы, остеотомов, костных долот и ложек. Гемостаз осуществляется с использованием костного воска или губки Gelfoam, пропитанной тромбином. Необходимость в дренировании раны возникает редко, рана ушивается послойно, при этом сначала отдельными узловыми швами восстанавливают надкостницу и фасцию. Послойно ушивание раны очень важно для предотвращения формирования послеоперационных грыж.
Если в трикортикальном трансплантате необходимости нет, можно прибегнуть к альтернативной методике, известной как подгребневый доступ, используемый для забора монокортикальной или губчатой кости. В этом случае разрез проводится сразу кнаружи от задней верхней подвздошной кости. Ягодичная фасция отделяется от кости кнаружи от ЗВПО так, чтобы в зоне ее прикрепления оставалась достаточная мягкотканная манжетка для последующего восстановления фасции. Мобилизация тканей осуществляется вдали от большой седалищной вырезки, которую здесь легко можно пропальпировать. После достаточной мобилизации мягких тканей для увеличения доступа можно воспользоваться ретрактором Тейлора. С помощью прямого остеотома в кортикальной стенке подвздошной кости формируется окошко. Если необходимо дополнительное количество губчатой кости, его легко можно забрать с помощью костного долота.
Внутренняя кортикальная стенка подвздошной кости должна оставаться интактной. Губчатая кость и кортикально-губчатые чипсы идеальны для задних окципитоспондилодезов. По завершении забора трансплантата выполняют гемостаз с использованием костного воска или губки Gelfoam, ягодичная фасция для предотвращения нарушений походки должна быть рефиксирована к надкостнице. Операционная рана ушивается стандартным образом послойно, во избежание формирования абдоминальных грыж опять же отдельно необходимо восстановить надкостницу и фасцию.
3. Альтернативные зоны забора аутокости для трансплантации. В большинстве случаев предпочтительным местом забора аутокости является гребень подвздошной кости, однако источником костного материала также могут служить ребра, малоберцовая кость и свод черепа. Ребра отличаются относительно тонкой кортикальной пластинкой и не способны механически противостоять компрессирующим нагрузкам, кроме того объем костного материала при использовании ребра относительно невелик. Иногда они, однако, являются неплохой альтернативой, в частности когда другие зоны забора трансплантата недоступны. Ввиду своей ограниченной механической прочности ребра не следует использовать при расширенных реконструкциях по поводу деформаций позвоночника без дополнительной стабилизации металлоконструкциями.
Для забора фрагмента ребра выполняют линейный разрез кожи непосредственно по ходу ребра. Путем разреза и мобилизации окружающих мышц и надкостницы обнажается наружная поверхность ребра. Для отделения межреберных мышц и париетальной плевры от внутренней поверхности ребра используют реберный диссектор Дуайена. При выделении ребра следует соблюдать известную осторожность во избежание повреждения расположенного вдоль нижнего края каждого ребра сосудисто-нервного пучка. Необходимый фрагмент ребра забирается с помощью реберных кусачек или осциллирующей пилы. В большинстве случаев мы отдаем предпочтение пиле, поскольку реберные кусачки раздавливают, ломают и снижают прочность концов фрагмента ребра.
Оставшиеся края ребра закругляют и обрабатывают воском для предотвращения перфорации ими плевры и развития пневмоторакса. По завершении забора ребра выполняется гемостаз и рана ушивается послойно. После операции обычно назначается рентгенография легких для исключения пневмоторакса.
Трансплантаты из малоберцовой кости во избежание повреждения малоберцового нерва в области головки или сохранения нормальной функции голеностопного сустава забираются в области средней трети ее диафиза. Функциональных нарушений вследствие забора малоберцовой кости обычно не наступает. Разрез кожи выполняется параллельно малоберцовой кости по наружной поверхности средней трети голени. В большинстве случаев забирают неваскуляризированный трансплантат, для чего необходимый участок малоберцовой кости выделяют поднадкостнично по всей окружности. Трансплантат из малоберцовой кости отличается наличием прочной плотной кортикальной кости и идеален для реконструкций в тех случаях, когда к трансплантату предъявляются повышенные механические требования. Однако ввиду того, что губчатой кости здесь достаточно мало, формирование костного блока будет происходить относительно медленно.
Иногда предпочтение отдают васкуляризированному трансплантату, для чего вокруг него оставляют манжетку мышц с питающими сосудами. Мышцы и фасция пересекаются на уровне концов трансплантата, при этом сохраняют питающие малоберцовые артерию и вену. Кость перепиливается проксимально и дистально с помощью пилы Джигли или осциллирующей пилы. По завершении гемостаза рана ушивается послойно стандартным образом.
Пластический материал из костей свода черепа применяется при спондилодезах у маленьких детей, поскольку малоберцовая кость и гребень подвздошной кости еще не оссифицированы. Вариантами здесь являются полнослойный трансплантат из центральной части затылочной кости или расщепленный трансплантат из теменных костей. Для забора трансплантата из подзатылочной области выполняют линейный разрез кожи и поднадкостнично обнажают подзатылочную поверхность свода черепа, в затылочной кости формируют 1-2 фрезевых отверстия до твердой мозговой оболочки и отсекают от края большого затылочного отверстия атланто-затылочную мембрану. Костный трансплантат забирают стандартным образом с помощью высокоскоростного бора. При необходимости забора расщепленного трансплантата выполняют поперечный или С-образный разрез в теменной области для доступа к парамедианной части теменной кости.
Если планируется забор трансплантата с обеих сторон, то срединная часть обеих теменных костей, под которой расположен верхний сагиттальный синус, оставляется интактной. Для отделения наружной компактной пластинки от внутренней используется реципроктная пила, после чего наружная пластинка имплантируется на свое исходное место и фиксируется к черепу минипластинами. Забранному таким образом трансплантату можно придать необходимую форму и использовать для спондилодеза.
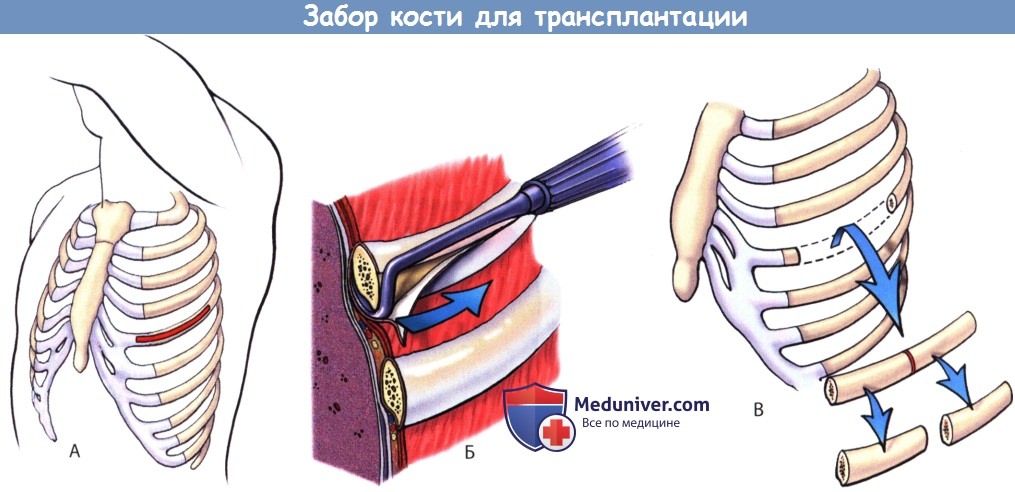
Б. С помощью периостального элеватора Дуайена экстраплеврально фрагмент ребра освобождается от прикрепляющихся к нему мышц и расположенного снизу сосудисто-нервного пучка.
В. Ребро рассекается остро с помощью того или иного режущего инструмента. 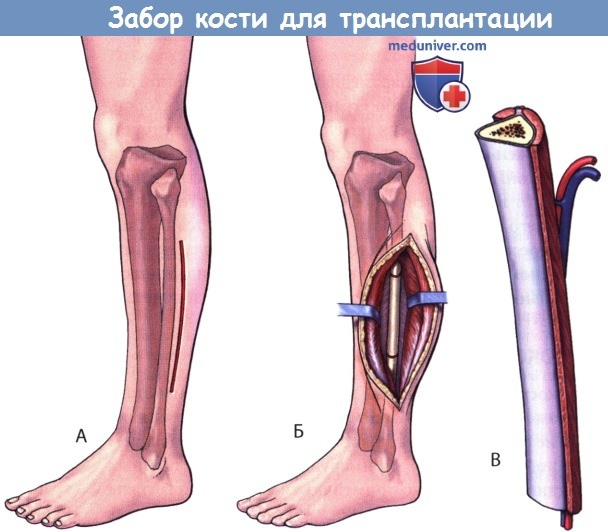
Б. Для забора неваскуляризированного трансплантата необходимый участок малоберцовой кости выделяют поднадкостнично по всей окружности.
В. Иногда предпочтение отдают васкуляризированному трансплантату, для чего вокруг него оставляют манжетку мышц с питающими сосудами. 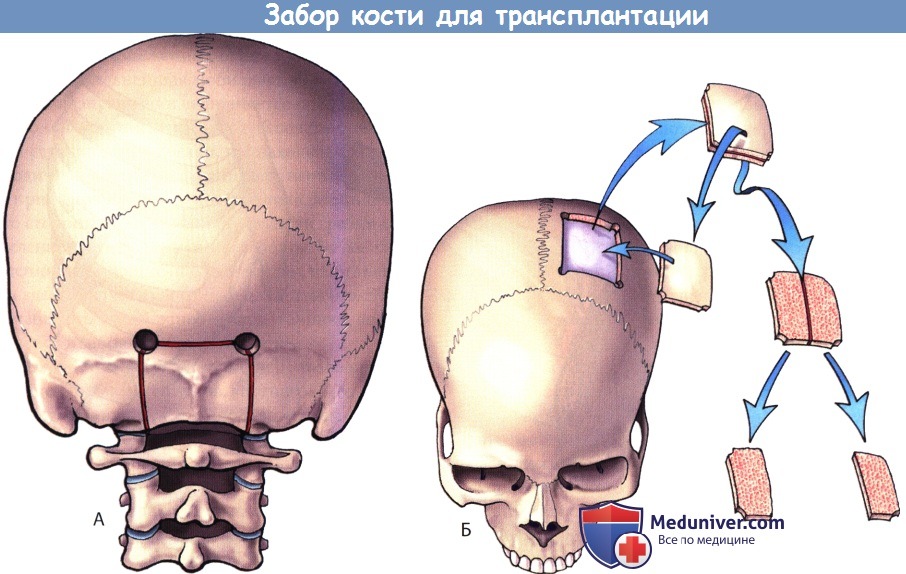
А. Забор подзатылочного полнослойного прямоугольного трансплантата.
Б. Забор расщепленного костного трансплантата из теменной кости. Вначале забирается полнослойный фрагмент, который затем реципроктной пилой расщепляется на две пластинки.
Наружная компактная пластинка фиксируется обратно в донорское ложе мини-пластинами.
в) Аллокость и костные заменители. Аутокость на сегодняшний день остается золотым стандартом костной пластики при спондилодезах, однако многие операции сейчас выполняются с использованием трупной аллокости. К примеру, при передних шейных спондилодезах обычно применяются аллотрансплантаты из малоберцовой кости. Иногда опорные трансплантаты из малоберцовой, большеберцовой или бедренной аллокости используются при вмешательствах на грудном и поясничном отделах позвоночника. При одноуровневых дискэктомиях на шейном уровне аутокость и аллокость характеризуются одинаковой частотой формирования костного блока. При многоуровневых вмешательствах или при спондилодезах у пациентов с курением в анамнезе, использование аутокости по сравнению с аллокостью характеризуется несколько более высокой частотой формирования костного блока.
Аллокость заготавливается специальными учреждениями — банками кости — по специально утвержденным протоколам. Забор материала обычно проводится в стерильных условиях, после чего кость подвергается обработке, сушке при низких температурах либо обрабатывается уже в замороженном состоянии. С целью минимизации риска заражения инфекциями донора предварительно обследуют. Риск заражения вирусом иммунодефицита человека (ВИЧ) через трупную аллокость составляет 1 на 1000000. С целью минимизации риска развития у реципиента иммуногенных реакций аллокость обрабатывается этиленоксидом, замораживается или высушивается при сверхнизких температурах. После такой обработки перед моделированием или нарезкой кость должна помещаться в стерильный физиологической раствор.
С тем, чтобы максимально увеличить шансы на формирование костного блока, внутренний полый канал аллокостного трансплантата можно заполнить аутокостью, полученной, например, при резекции костных элементов позвонков.
Иногда вместо костного трансплантата или формирования костного блока используется метилметакрилат (ММА). ММА, однако, не ведет к образованию костного блока, поскольку он не обладает остеокондуктивными, остеоиндуктивными или остеогенными свойствами. Он способен противостоять компрессирующим воздействиям, однако не состоятелен в отношении противостояния растягивающим силам, поэтому его всегда необходимо фиксировать к кости. Также ММА может вызывать реакции отторжения инородного тела. Поэтому ММА используется только в случаях, когда механические требования к заместительному материалу минимальны, либо когда ожидаемая продолжительность жизни пациента невелика.
На сегодняшний день существует ряд относительно новых методик, которые позволяют увеличить частоту формирования костного блока. Так, в многочисленных исследованиях было показано, что костное сращение, особенно длинных трубчатых костей, способно стимулировать пульсирующее электрическое или электромагнитное поле. Эффектам этих полей в отношении стимуляции формирования позвоночного блока посвящено гораздо меньше исследований, хотя похоже и здесь эффект от их применения есть. Технология эта, однако, достаточно дорогая, немаловажное значение здесь имеет отбор пациентов, а частота формирования костного блока без использования этих полей и так относительно высока.
Другие современные методики стимуляции костного сращения при спондилодезах относятся уже к сфере молекулярной биологии. Добиться увеличения качества и прочности костного сращения можно за счет применения целого ряда остеокондуктивных белков, известных как костные морфогенные протеины (BMP), которые позволяют значительно увеличить шансы на формирование костного блока даже при использовании в комбинации с аллокостью. Кроме того, использование BMP с аллокостью теоретически избавляет от необходимости применения аутокости. Согласно данным последних исследований, использование BMP с ауто- или аллокостными трансплантатами характеризуется очень высокой частотой формирования костного блока.
г) Резюме. Качественное костное сращение является обязательной составляющей любой инструментальной стабилизации позвоночника. Вероятность формирования костного блока можно увеличить за счет аккуратного обращения с мягкими тканями, соблюдения техники забора и обработки костного трансплантата, подготовки костного ложа и отказа от использования любых нестероидных противовоспалительных препаратов в пери- и послеоперационном периоде. Использование аутокости по сравнению с аллокостью характеризуется более высокой частотой формирования костного блока, однако при использовании аутокости всегда следует тщательно соотнести пользу и возможные риски, связанные с забором такого трансплантата. При необходимости использования именно аутокости риск осложнений можно минимизировать путем тщательного соблюдения техники ее забора и четкого понимания анатомии донорской области.
Новые перспективы в этом вопросе открылись перед нами благодаря современным достижениям в молекулярной биологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021