Аутологическая трансплантация что это такое
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
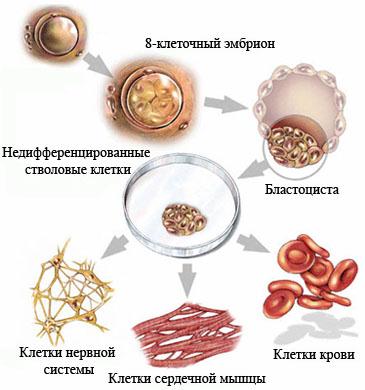
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 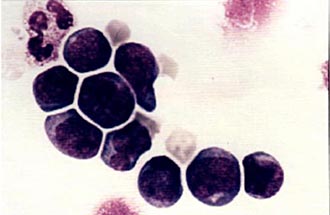 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
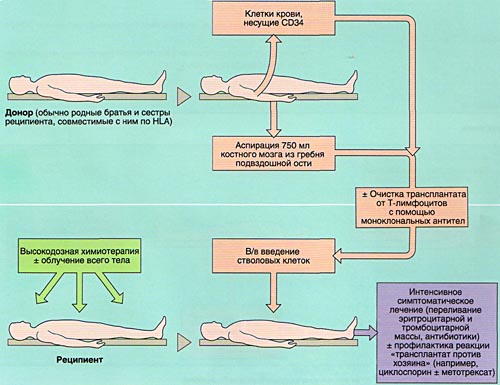
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Высокодозная химиотерапия и трансплантация костного мозга у взрослых больных
Трансплантация стволовых гемопоэтических клеток нашла применение в различных областях онкологии.
Эти клетки используются после высокодозной химиотерапии для снижения длительности депрессии (угнетения) костного мозга и сокращения риска инфекционных осложнений и кровотечений.
Стволовые клетки для трансплантации получают как от самого пациента (аутологичная трансплантация), так и от иммунологически совместимого родственного или неродственного донора (аллогенная трансплантация). Непосредственным источником стволовых гемопоэтических стволовых клеток может быть костный мозг, периферическая или пуповинная кровь.
Одним из наиболее частых показаний для применения стволовых клеток в онкологии является уменьшении длительности периода угнетения кроветворения после противоопухолевой терапии.
Применение современных противоопухолевых препаратов позволяет излечить или продлить жизнь значительному количеству больных со злокачественными новообразованиями.
Однако в ряде случаев проведение стандартной химиотерапии не приводит к длительному противоопухолевому эффекту, что связано с исходной или приобретенной резистентностью (устойчивостью) опухоли к цитостатикам.
Одним из путей ее преодоления является увеличение дозы препаратов. Это увеличивает проникновение противоопухолевых препаратов в раковую клетку и позволяет преодолеть устойчивость к химиотерапии.
Резкое увеличение дозы препаратов приводит к значительному повреждению кроветворных клеток костного мозга и выключению функции кроветворения на много месяцев, что требует применения методик защиты кроветворения.
Основным методом, позволяющим преодолеть токсичность химиотерапии на кроветворение, является трансплантация кроветворной ткани. При этом стволовые клетки, полученные от донора или у самого больного, вводят после окончания химиотерапии, когда препараты полностью вывелись из организма или разрушились, что позволяет быстро восстановить кроветворение.
При пересадке аллогенного костного мозга возможно длительное приживление трансплантата только при совпадении донора и реципиента по антигенам главного комплекса гистосовместимости (иммунологической совместимости).
В противном случае развивается выраженная иммунологическая реакция «трансплантат против хозяина» (РТПХ), способная привести к гибели больного.
Наименьшее количество осложнений встречается у совместимых сибсов (родных братьев и сестер).
В то же время сибсы имеют вероятность совпасть иммунологически только в 25% случаев, что указывает на серьезную проблему подбора доноров для пересадки костного мозга. Последние годы отмечены крупные успехи в подборе неродственных доноров.
Следует отметить, что даже полная совместимость не дает абсолютной гарантии отсутствия развития РТПХ, и до 25% больных погибает от осложнений, связанных с трансплантацией.
Важно иметь в виду, что РТПХ способна оказывать и лечебное действие, когда иммунная система донора начинает распознавать опухолевые клетки хозяина и бороться с ними, т.е. проявляется реакция трансплантат против опухоли (РТПО).
При ряде заболеваний (хронический миелолейкоз, острый нелимфобластный лейкоз и др.) наличие этой реакции в значительной степени определяет общий успех лечения.
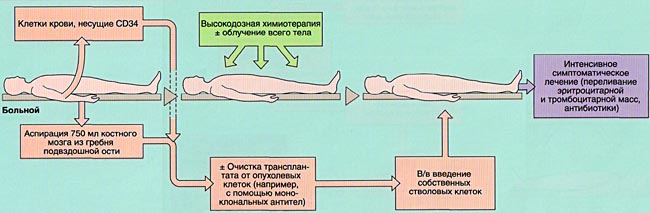
Трансплантация аутологичной (своей собственной) гемопоэтической ткани позволяет избежать возникновения РТПХ и технических сложностей, связанных с подбором донора. С другой стороны, аутологичная трансплантация не сопровождается РТПО и несет чисто вспомогательную функцию поддержки кроветворения после высокодозной химиотерапии.
В настоящее время имеется возможность сохранять собственные кроветворные клетки в жизнеспособном состоянии при низких температурах (замораживании) в течение длительного периода времени.
Долгие годы основным источником стволовых кроветворных клеток был костный мозг. Метод его получения состоит в многократных пункциях плоских костей (в основном тазовых) и получении 1-1,5 литров костно-мозговой взвеси. Такая процедура требует, как правило, общего обезболивания (наркоза).
Нужно отметить, что при опухолевом и лучевом поражении костей таза забор костного мозга может оказаться неудачным.
Костный мозг не является единственным источником кроветворных клеток.
Во взрослом организме небольшая часть стволовых клеток, как и зрелые клетки, выходит в периферическое сосудистое русло. Эти стволовые клетки способны восстанавливать полноценное кроветворение после повреждения его химиотерапией и облучением. Современная аппаратура (сепараторы крови) позволяет эффективно собирать клетки кроветворения из периферической крови даже при их низком содержании. При этом необходимость наркоза отпадает.
В условиях нормального кроветворения для получения достаточного количества стволовых клеток необходимо, как правило, 6 процедур. При каждой такой процедуре обрабатывается 10-12 литров крови.
Проблема низкого количества клеток кроветворения в периферической крови оставалась главным ограничением при использовании данного вида трансплантата. Затем было показано, что после однократного введения некоторых противоопухолевых препаратов (циклофосфамид, этопозид, фторурацил) отмечается значительное увеличение числа стволовых клеток в периферической крови. К недостаткам данного метода относятся: снижение числа лейкоцитов и тромбоцитов, значительные различия в сроках начала роста содержания стволовых клеток в периферической крови у различных больных.
Введение некоторых гемопоэтических факторов роста (нейпоген, лейкомакс и др.) вызывает значительно увеличение поступления клеток кроветворения из костного мозга в периферическую кровь.
Применение аллогенной трансплантации костного мозга
В настоящее время основными показаниями для аллогенной трансплантации стволовых клеток являются
Изучаются возможности применения данного метода у больных
Острые нелимфобластные лейкозы (ОНЛЛ)
Применение стандартной химиотерапии в первой полной ремиссии позволяет добиться длительной выживаемости в 25-35% случаев по сравнению с 45-60% при использовании аллогенной трансплантации стволовых клеток. Применение трансплантации во второй ремиссии сопровождается длительной ремиссией лишь в 20-30% случаев.
Использование аллогенной трансплантации стволовых клеток с первично резистентным (устойчивым к лечению) течением ОНЛЛ позволяет добиться длительной ремиссии в 10-20% случаев.
Острые лимфобластные лейкозы (олл)
Проведение аллогенной трансплантации стволовых клеток в первой полной ремиссии у пациентов с неблагоприятными прогностическими факторами (возраст старше 60 лет, высокий лейкоцитоз и т.д.) позволяет достичь длительной безрецидивной выживаемости в 40-60% случаев.
При отсутствии неблагоприятных факторов аллогенная трансплантация стволовых клеток обычно рекомендуется во второй полной ремиссии.
Хронический миелолейкоз
ХМЛ характеризуется несколькими фазами развития. В ранней (хронической) фазе, длящейся несколько лет, состояние больного может сохраняться относительно удовлетворительным. В фазе акселерации (обострения) в течение нескольких месяцев нарастают гематологические изменения (увеличение числа лейкоцитов, малокровие), и она переходит в фатальную (смертельную) фазу бластного криза.
Стандартные методы лечения могут вызывать длительные ремиссии у части больных, однако единственным излечивающим методом лечения в настоящее время является аллогенная трансплантация стволовых клеток. Эффективность ее зависит от возраста больного, фазы заболевания, периода времени от момента диагноза до трансплантации. Множественные курсы предшествующего лечения значительно улучшают результаты высокодозной химиотерапии и трансплантации.
Наилучшие шансы на достижение длительной ремиссии имеют молодые больные, получившие трансплантацию в хронической фазе в течение 1 года от момента диагноза. Длительная выживаемость у них составляет 75-80% по сравнению с 10-20% у больных, которым трансплантация выполнена в фазе аскселерации.
Миелодиспластический синдром
Аллогенная трансплантация стволовых клеток является единственным методом, излечивающим больных МДС. Применение этого метода позволяет добиться длительной выживаемости в 30-50% случаев. Эти результаты зависят от возраста больных, длительности заболевания и количества опухолевых клеток в костном мозге перед трансплантацией.
Аллогенная минитрансплантация
Аллогенная минитрансплантация, или трансплантация после миелоаблативных (не разрушающих костномозговое кроветворение) режимов получила распространение лишь недавно. Ее применение связано с выявлением лечебной роли РТПО и появлением новых препаратов (флударабин, антитимоцитарный иммуноглобулин), вызывающих глубокую депрессию (угнетение) иммунной системы, но не вызывающих глубокой цитопении (снижение числа клеток крови).
Применение их в комбинации с умеренными дозами бусульфана или мелфалана позволяет эффективно пересаживать донорский костный мозг. При этом РТПО полностью сохраняется. Следует отметить, что эффективность этого метода зависит от массы остаточной опухоли, которая должна быть по возможности минимальной.
Предварительные результаты применения данной методики свидетельствуют о высокой эффективности минитрансплантации при значительно меньшей токсичности в сравнении с классическим методом.
Применение аутологичной трансплантации костного мозга
Основной ролью аутологичной трансплантации костного мозга является восстановление кроветворения после химиотерапии, что позволяет многократно увеличивать разовые дозы некоторых противоопухолевых препаратов. Это дает возможность усиливать противоопухолевый эффект и достигать более высокой безрецидивной выживаемости в сравнении с результатами стандартной химиотерапии.
Наиболее часто данный метод применяется при лечении больных с прогностически неблагоприятными вариантами течения неходжкинских лимфом (лимфосарком), болезни Ходжкина (лимфогранулематоза), множественной миеломы, рака молочной железы, рака яичка и пр.
Неходжкинские лимфомы (нхл)
Применение стандартной химиотерапии у больных с НХЛ высокой и промежуточной степени злокачественности позволяет достичь 40-60% полных ремиссий. Однако у 20-30% больных этой группы отмечаются рецидивы (возврат) болезни. Применение высокодозной химиотерапии в сочетании с аутологичной трансплантацией костного мозга дало возможность значительно улучшить показатели длительной выживаемости у таких больных.
Болезнь ходжкина
У 10-30% больных с распространенными стадиями болезни Ходжкина первичная химиотерапия оказывается неэффективной, а у 40% пациентов возникает рецидив заболевания. Результаты лечения больных, малочувствительных к первичной химиотерапии и с первым ранним рецидивом (в течение первого года), неудовлетворительные.
Применение других схем стандартной химиотерапии позволяет достичь полных ремиссий не более чем у 40-45% больных, однако при этом ремиссии бывают короткими, а выживаемость низкая.
Применение высокодозной химиотерапии в сочетании с аутологичной трансплантацией стволовых клеток позволяет почти в 2 раза увеличить частоту полных ремиссий, а значит, и надежду на увеличение выживаемости.
Множественная миелома
По данным Европейской организации по аутологичным трансплантациям костного мозга, безрецидивная и общая выживаемость 5500 больных множественной миеломой, получавших высокодозную химиотерапию в сочетании с аутологичной трансплантацией стволовых клеток, составила соответственно 28 и 48 месяцев, что превышает результаты стандартной химиотерапии.
Наилучший прогноз (исход) имеют больные моложе 60 лет с I-II стадиями заболевания и уровнем бета-2 микроглобулина менее 4.
Использование высокодозной химиотерапии при других опухолях (рак молочной железы, яичка и др.) находится на этапе изучения. При этом получены обнадеживающие результаты.
Таким образом, высокодозная химиотерапия с трансплантацией аутологичных или аллогенных стволовых кроветворных клеток за последние годы стала эффективным методом лечения многих опухолей. Прогресс в биологии и иммунологии клеток кроветворения позволяет надеяться на еще более эффективное применение этого метода в будущем, в том числе и при распространенных новообразованиях, резистентных (устойчивых) к химиотерапии.
Что такое аутотрансплантация зуба
Особенности восстановления кости челюсти аутотрансплантатом – как проводится операция, плюсы и минусы
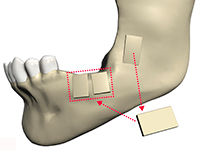
Общая информация о процедуре
Первая остеопластика или трансплантация кости челюсти произошла более 100 лет назад в 1900 году. Проводил ее хирург Зыков В.М. Причем использовался именно аутотрансплантат – то есть кусочек собственной кости пациента, который пересадили с нижней челюсти в ее передний отдел, восстановив область дефекта. На сегодняшний день врачи используют и участки других костей – из области зуба мудрости, подбородка, теменной, подвздошной или бедренной кости. Чаще всего пластике подвергается нижняя челюсть.
Имплантация даже при атрофии костной ткани. Гарантия на работу!
Сэкономьте 30 000р. по акции >>
Бесплатная консультация имплантолога +7 (495) 215-52-31 или напишите нам
Правильное название пересадки собственного костного блока звучит как «аутотрансплантация». Иногда можно услышать название «аутогенная», но оно не совсем верное, хоть и созвучное. Поскольку при трансплантации блока не происходит подсадки стволовых клеток в челюсть. Но названия «остеопластика», «костная пластика»[1] и «наращивание» тут вполне допустимы, однако в любом случае используется аутотрансплантат, а не какой-то иной вид материала.
Разновидности аутотрансплантации в стоматологии
Различают 2 вида остеопластики – первичную и вторичную. При первичной образовавшийся костный дефект восстанавливается сразу же после его образования. То есть подсадка костного блока происходит сразу после удаления опухоли, кисты, получения травмы, например. При вторичной остеопластика происходит через 6-8 месяцев после образования дефекта. После удаления зуба, кисты или остеотомии дефект сначала заживает самостоятельно, частично зарастает костной тканью, покрывается плотной кортикальной пластинкой. А только потом происходит подсадка аутотрансплантата.
Показания и противопоказания
Показанием к подсадке аутотрансплантата в стоматологии, и в имплантологии в частности, является нехватка костной ткани в области планируемой установки имплантов. При условии, что врач не сможет установить имплант в уже имеющийся объем ткани – например, вживить имплантат под наклоном. Также к показаниям относится следующее:
Противопоказаниями к подсадке аутотрансплантата в челюсть считаются следующие ситуации:
Подготовительный этап перед операцией
Перед тем, как проводить аутотрансплантацию кости, пациенту необходимо пройти осмотр у стоматолога, сделать компьютерную томографию челюсти – чтобы определить характер дефекта. Еще нужно будет подобрать участок-донор, для этого может потребоваться томография лицевых, подвздошной или других костей. Также нужно будет сдать анализы на выявление противопоказаний, к примеру, анализ на уровень глюкозы, кальция. Если пациент имеет хронические заболевания, то потребуется справка от лечащего врача, что остеопластика и имплантация зубов разрешены.
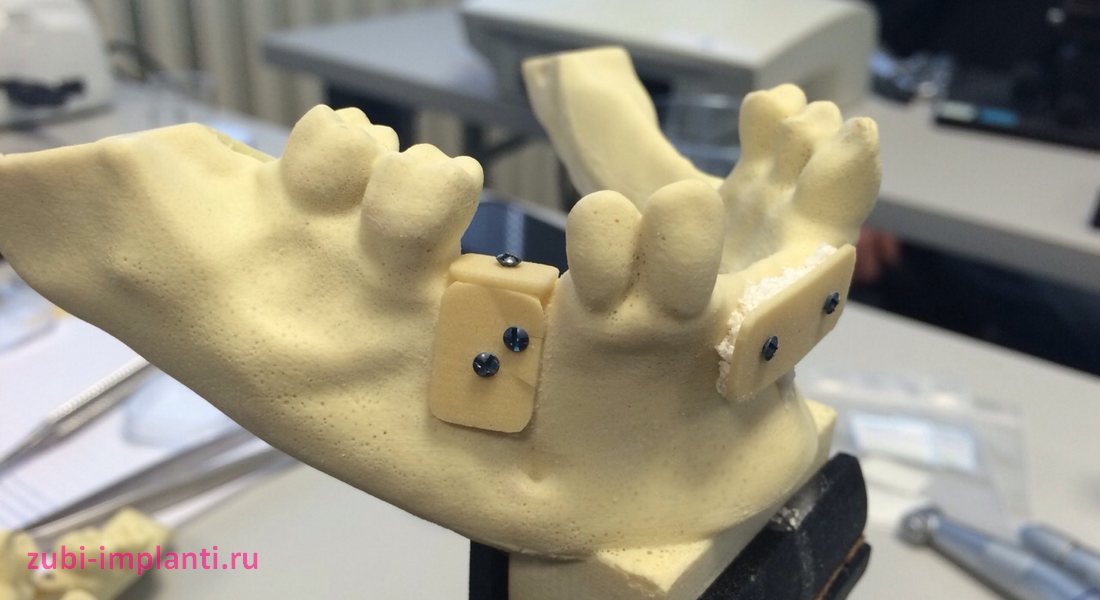
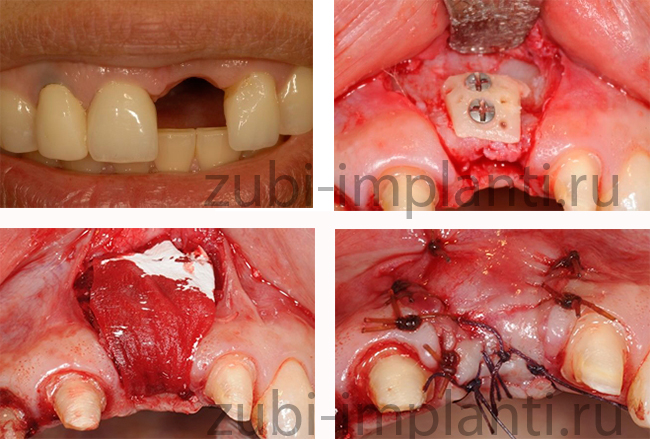
Как проходит аутотрансплантация костного блока: этапы
.jpg)
Далее пациент отправляется домой и соблюдает все рекомендации стоматолога для скорейшего восстановления. Пересадка костных блоков из тазовой кости проводится только в стационаре и под наркозом. После этого пациент на несколько дней остается под наблюдением врачей.
Преимущества и недостатки аутотрансплантации костного блока
Аутотрансплантация собственного костного блока считается достаточно травматичной операцией. Ведь заживление будет происходить одновременно в 2-х зонах – донорской (откуда взяли костный кусочек) и принимающей (куда проводится подсадка). Поэтому восстановление может идти дольше, плюс повышается риск осложнений в сравнении с ситуациями, когда используются заводские синтетические костные блоки и крошка. Все это относится к недостаткам операции.
«Мне делали наращивание для того, чтобы поставить имплант. Даже не знаю, как свои ощущения описать… Операция, конечно, нужная. Но если есть возможность обойтись без нее, то лучше так и сделать. Во время операции были не очень приятные ощущения, когда пилили кость. Потом дома появилась боль и отек большой. Дней через 5 синяк вылез. В общем, с лица все сошло за пару недель. Пришлось везде в маске ходить».
Alina, отзыв с сайта gidpozubam.ru
К преимуществам относится тот факт, что используется своя «родная» кость. То есть организм не будет ее отторгать, а, напротив, приживление будет происходить быстро и физиологично. Если операцию проводил опытный стоматолог-хирург, а пациент выполнял все рекомендации, то восстановление имеет благоприятный прогноз.
Рекомендации после операции
После проведения операции пациент несколько часов проводит под наблюдением врача: если операция прошла успешно, то пациент отправляется домой. Когда действие анестезии прекращается, возможно появление болезненных ощущений в области операции, отеки тканей, кровотечения из ранки. Для снижения дискомфорта после наращивания кости назначается прием противовоспалительных, антигистаминных и обезболивающих препаратов. Можно прикладывать холодные компрессы на 10 минус в течение 2-х часов подряд. Тепло прикладывать нельзя – усиливается кровоснабжение, что влечет за собой кровоточивость, увеличение отека, воспаления. По этой же причине не рекомендуется посещение бань, саун.
Пациенту запрещается курение в течение нескольких недель, совершать авиаперелеты, нырять, т.к. изменение давления в полости рта может сдвинуть швы и трансплантат. Необходимо также снизить физические нагрузки, отказаться от алкоголя (ухудшает заживление), слишком твердой пищи и обязательно уделять повышенное внимание гигиене полости рта. В первые 14 дней нельзя жевать на прооперированной стороне.
Актуальные альтернативные материалы
Заменить «аутотрансплантат» можно синтетическими и полусинтетическими костными препаратами c коллагеном (смешанными с очищенным костным материалом крупного рогатого скота). Например, препарат Bio-Oss от Geistlich, Maxresorb с гидроксиапатитом от Botiss и другие, в зависимости от показаний. Практикующие стоматологи чаще всего применяют именно заменители, т.к. восстановление пациента происходит быстрее. Но и натуральная собственная кость тоже используется, как правило, если нужно единовременно заменить большой участок челюсти.
Можно ли провести имплантацию без наращивания – альтернативы
Трансплантация требуется при атрофии костной ткани челюсти, чтобы можно было установиться импланты требуемой длины. Но сегодня стоматология в 97-99% обходится без наращивания перед имплантацией зубов. Существует несколько протоколов и способов установки имплантов, которые способны обойти кажущееся противопоказание – атрофию. К примеру, при атрофии по ширине подбираются узкие модели имплантов, по высоте – широки и короткие конструкции. Также импланты можно устанавливать под наклоном для контакта с максимальной площадью кости. По большей части это актуально для восстановления нескольких зубов подряд, а при одиночных реставрациях наращивание практикуется чаще.
Стоимость аутотрансплантации в стоматологии
Цена на процедуру складывается из двух составляющих – это забор костного блока и непосредственно его вживление. Также учитываются дополнительные материалы – например, барьерные и тромбоцитарные мембраны, биогели. Средняя стоимость составляет 40 тысяч рублей за все, но может быть выше исходя из уровня клиники и врача, а также сложности операции. Если пересадка осуществляется в стационаре, то цена будет выше, порядка 70 тысяч и даже 100 тысяч рублей.
Реальные фотографии этапов пересадки костных блоков до и после
[1] Альфаро Ф.Э., Ломакин М. Костная пластика в стоматологической имплантологии, 2006.
Что такое аутотрансплантация зуба фото и видео