Аутосомно доминантный тип наследования что это
Аутосомно доминантный тип наследования что это
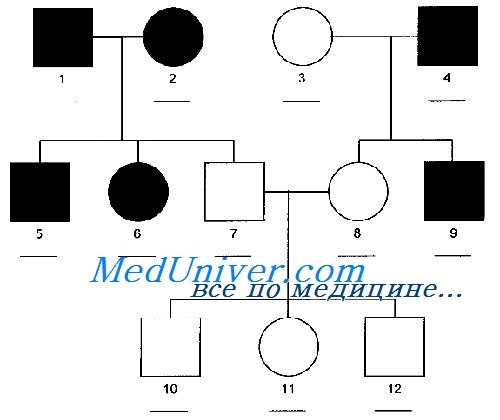
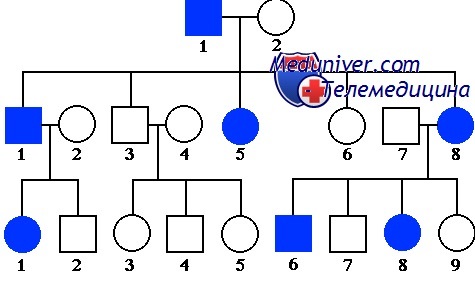
Заболевания с таким типом наследования, описанные Менделем в 1865 г., редко бывают спорадическими, они обычно многочисленны, с более чем 15 000 свойств одиночных генов или описанных заболеваний. Для многих заболеваний известно наследование по законам Менделя. Если диагноз состояния неизвестен, его характер наследования может быть очевиден при построении генеалогического древа семьи, которое является обязательной частью генетической консультации.
Аутосомно-доминантное наследование самый частый вид наследования по законам Менделя. Пациент является носителем патологического гена в гетерозиготном состоянии на одной из аутосом (хромосомы 1-22). Каждый потомок мужского или женского пола имеет один из двух (50%) шансов наследовать патологический ген от больного родителя. Это схематичное представление, осложняющие факторы перечислены ниже.
Примеры аутосомно-доминантных заболеваний:
• Ахондроплазия.
• Синдром Элерса-Данло.
• Семейная гиперхолестеринемия.
• Хорея Гентингтона.
• Синдром Марфана.
• Миодистрофия.
• НФ.
• Синдром Нунан.
• Несовершенный остеогенез.
• Отосклероз.
• Полипоз толстой кишки.
• Туберозный склероз.
Разнообразие проявлений аутосомно-доминантных наследований. В семье у некоторых больных членов заболевание может проявиться в лёгкой степени, у других — более тяжело. Например, у родителя с туберозным склерозом могут быть только умеренные кожные проявления, но его/её больной ребёнок может к тому же страдать эпилепсией и умственной отсталостью.
Вероятность непроявления гена. Обусловливает недостаток клинических симптомов у человека, который должен унаследовать патологический ген. Примером может служить отосклероз, при котором лишь у 40% носителей гена развивается глухота.
Отсутствие семейного анамнеза заболевания может быть в результате:
• новой мутации в одной из гамет, участвовавших в зачатии пациента (самая частая причина отсутствия семейного анамнеза при заболевании с доминантным типом наследования, например у 80% и более пациентов с ахондроплазией родители здоровы);
• мозаицизма гонад (очень редко у здорового родителя могут быть мутации только в некоторых половых клетках гонад, что может вызвать появление аутосомно-доминантного заболевания у потомства, рождённого у относительно здоровых родителей, как это было описано при врождённом несовершенном летальном остеогенезе);
• неустановленного отцовства — если зарегистрированный отец не является биологическим отцом ребёнка.
Гомозигота. В редких случаях, когда оба родителя поражены одним и тем же заболеванием с аутосомно-доминантным типом наследования. Риск того, что ребёнок будет гомозиготным по мутантному гену, составляет 1:4.
Аутосомно-доминантный тип наследования:
• Самый частый тип наследования по законам Менделя.
• Больной человек — носитель патологического гена по одной из пар аутосом.
• Риск наследования патологического гена от больного родителя составляет 1:2, но могут быть вариации в проявлении или непроявлении мутации, отсутствии семейного анамнеза (новая мутация, мозаицизм гонад, неродной отец) или гомозиготности (редко).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Аутосомно доминантный тип наследования что это
Более половины всех менделирующих заболеваний наследуется как аутосомно-доминантные признаки. Встречаемость некоторых аутосомно-доминантных болезней высокая, по крайней мере в специфических географических областях:
например, 1 на 500 для семейной гиперхолестеринемии в популяциях европейского или японского происхождения; 1 на 550 для миотонической дистрофии в северо-восточных областях Шарлевуа и Сагеней-Лак-Сен-Жан Квебека; и около 1 на 2500-3000 для нескольких заболеваний, например, болезни Гентингтона в популяциях Северной Европы, нейрофиброматоза и поликистоза почек.
Хотя многие аутосомно-доминантные заболевания по отдельности значительно менее часты, в совокупности они настолько многочисленны, что их общая встречаемость вполне ощутима. Бремя аутосомно-доминантных болезней повышается из-за их наследственной природы; когда они передаются в семье, становятся проблемой не только для больного, но также для целых семейств, часто через многие поколения. В некоторых случаях бремя складывается из социальных проблем, вызванных физической или умственной нетрудоспособностью.
Риск и тяжесть доминантно унаследованной болезни в потомстве зависят от того, один или оба родителя больны, и от того, является ли признак полно или неполно доминантным. Обозначая мутантный аллель как D, а нормальный аллель как d, браки, при которых рождаются дети с аутосомно-доминантной болезнью, могут быть между двумя гетерозиготами (D/d) по мутации или, чаще, между гетерозиготой по мутации (D/d) и гомозиготой по нормальному аллелю (d/d).
Каждый ребенок в браке D/d x d/d имеет вероятность 50% получить родительский аномальный аллель D и 50% — получить нормальный аллель d. В популяции в целом потомство D/d x d/d родителей распределяется приблизительно 50% D/d и 50% d/d.
Очевидно, что каждая беременность является независимым случаем, не управляемым результатами предшествующих беременностей. Таким образом, в пределах семьи распределение больных и здоровых детей может отличаться от теоретически ожидаемого соотношения 1:1, особенно если сиб-ство небольшое. Типичное аутосомно-доминантное наследование можно проследить в родословной семьи с доминантно наследуемой формой наследственной глухоты.
В медицинской практике гомозиготы по доминантным фенотипам встречаются нечасто, поскольку редки браки, которые могли бы произвести гомозиготное потомство. Пары, способные произвести D/D гомозиготы, теоретически могут быть D/d х D/d, D/D x D/d или D/D x D/D, или пациент может, в чрезвычайно редких случаях, получить новую мутацию от генетически здорового родителя. Фактически, тем не менее, нужно считаться только с браками двух гетерозигот, поскольку гомозиготы D/D очень редкие и обычно слишком тяжело больны, чтобы участвовать в репродукции (приспособленность равна 0).
В случае брака двух гетерозигот 3/4 потомства D/d x D/d больны и 1/4 здоровы. В теории, 3/4 больных имеют равную тяжесть заболевания, если оно полностью доминантное, или 1/3 гомозиготных больных поражены более сильно, чем D/d гетерозиготы, если заболевание неполно доминантное. Фактически, как упоминалось ранее, ни одно доминантное заболевание человека не оказалось полностью доминантным.
Даже болезнь Гентингтона, заболевание, наиболее часто описываемое, как чисто доминантное, поскольку болезнь обычно аналогична по тяжести и спектру симптомов у гетерозигот и гомозигот, оказывается, имеет отчасти ускоренное течение от начала болезни до смерти у гомозиготных больных по сравнению с гетерозиготами.
Характеристики аутосомно-доминантного наследования:
• Фенотип обычно появляется в каждом поколении, каждый больной имеет больного родителя. Исключения из этого правила в клинической генетике:
— случаи, вызванные новыми мутациями в гаметах фенотипически нормального родителя;
— случаи, когда заболевание не проявляется или слабо проявляется у человека, унаследовавшего мутантный аллель.
• Любой ребенок больного имеет 50% риск наследования признака.
• Это истинно для большинства семей, в которых второй родитель фенотипически нормален. Поскольку статистически каждый ребенок рассматривается как «независимый случай», в одной семье возможны значительные отклонения из ожидаемого соотношения 1:1.
• Фенотипически нормальные члены семьи не передают фенотип детям.
• Неполная пенетрантность или слабая экспрессивность болезни могут привести к исключениям из правила.
• Мужчины и женщины равновероятно передают фенотип детям любого пола. Конкретно возможна передача от отца к сыну и, наоборот, отцы могут иметь здоровых дочерей.
• Значимая часть изолированных случаев — следствие новой мутации. Чем меньше приспособленность, тем больше доля новой мутации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Научная электронная библиотека
Юров И. Ю., Воинова В. Ю., Ворсанова С. Г., Юров Ю. Б.,
4.1. Аутосомно-доминантное наследование
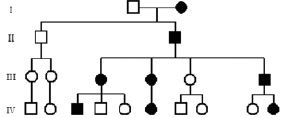
Аутосомно-доминантные признаки проявляются в гетерозиготном сотоянии, т.е. тогда, когда у индивидуума есть нормальный и мутантный аллели. Иногда доминантные признаки можно проследить во многих поколениях родословной по вертикали (рис. 10). Так, в Южной Африке частым заболеванием является порфирия – нарушение синтеза гема, приводящее к накоплению и повышенной экскреции порфиринов и их предшественников, которые окрашивают мочу в красный цвет, вызывая повышенную фоточувствительность кожи и неврологическую симптоматику. Передачу этого заболевания удалось проследить вплоть до 17 века и до единственной супружеской пары, которая приехала на континент.
Генетический риск при аутосомно-доминантном наследовании. Поскольку пораженный индивидуум имеет два типа гамет – с нормальным и мутантным аллелем, то риск передачи болезни его ребенку составляет 50 %.
Рис. 10. Родословная при аутосомно-доминантном наследовании
Вариабельная экспрессивность. Клиническая картина аутосомно-доминантных болезней обычно чрезвычайно варьирует даже внутри одной и той же семьи. Такие различия между индивидуумами называют вариабельной экспрессивностью. Этим феноменом объясняются легкие и тяжелые формы заболеваний.
Неполная пенетрантность. Пенетрантность – частота проявления доминантного мутантного аллеля среди его носителей. Пенетрантность составляет 100 %, если заболевают все носители мутации. У некоторых индивидуумов, гетерозиготных по мутациям, вызывающим аутосомно-доминантные болезни, может не быть всех клинических признаков. Это явление называют «неполной пенетрантностью», которая может быть результатом модифицирующих эффектов других генов либо влияния средовых факторов.
Неполную пенетрантность и вариабельную экспрессивность мутантного аллеля следует принимать во внимание при медико-генетическом консультировании.
Мутации de novo. Обычно при аутосомно-доминантных болезнях больной имеет пораженного родителя, но нередко наблюдаются исключения. Например, при ахондроплазии – одной из форм карликовости – родители обычно нормального роста, так как каждый случай заболевания является результатом новой мутации. Однако потомство больного будет поражено с риском 50 %. Появление новых доминантных мутаций связано с увеличением возраста отца вследствие большого числа митотических делений, которым подвергаются половые клетки мужчин в течение репродуктивного периода жизни.
Кодоминантность. Понятие кодоминантности используется для аллельных признаков, оба из которых выявляются в гетерозиготном состоянии. Примером может служить система групп крови у человека – АВ0: при группе крови IV (АВ) оба антигена А и В присутствуют в эритроцитах.
Доминантное наследование
Наша команда профессионалов ответит на ваши вопросы
Данная брошюра содержит информацию о том, что такое доминантный тип наследования и каким образом наследуются доминантные заболевания. Для того, чтобы лучше понять особенности доминантного наследования, вначале будет полезно узнать, что такое гены и хромосомы.
Гены и хромосомы
Наше тело состоит из миллионов клеток. Большинство клеток содержат полный набор генов. У человека тысячи генов. Гены можно сравнить с инструкциями, которые используются для контроля роста и согласованной работы всего организма. Гены отвечают за множество признаков нашего организма, например, за цвет глаз, группу крови или рост.
Гены расположены на нитевидных структурах, называемых хромосомами. В норме, в большинстве клеток организма содержится по 46 хромосом. Хромосомы передаются нам от родителей – 23 от мамы, и 23 от папы, поэтому мы похожи на своих родителей. Таким образом, у нас два набора по 23 хромосомы, или 23 пары хромосом. Так как на хромосомах расположены гены, мы наследуем по две копии каждого гена, по одной копии от каждого из родителей. Хромосомы (следовательно, и гены) состоят из химического соединения, называемого ДНК.
Иногда в одной копии гена возникает изменение (мутация), которое нарушает нормальную работу гена. Такая мутация может привести к развитию генетического (наследственного) заболевания, так как измененный ген не выполняет нужную для организма функцию.
Рисунок 1: Гены, хромосомы и ДНК
Что такое аутосомно-доминантное наследование?
Некоторые заболевания передаются в семье из поколения в поколение по доминантному типу. Это означает, что человек наследует одну нормальную и одну измененную копии гена. Однако измененная копия доминирует, «подавляет» нормальную копию. Это приводит к тому, что у человека развивается генетическое заболевание. От того, какая информация закодирована в измененном гене, зависят проявления заболевания.
Некоторые доминантные генетические заболевания проявляются сразу после рождения. Другие могут проявиться только во взрослом возрасте, такие заболевания называют «заболевания с поздним дебютом», или «с поздней манифестацией». Примерами таких заболеваний являются поликистозная болезнь почек у взрослых и хорея Гентингтона.
Каким образом наследуются доминантные заболевания?
Рисунок 2: Как доминантные заболевания передаются от родителя к ребенку
Если у одного из родителей присутствует измененная копия гена, то он может передать ребенку либо нормальную копию, либо измененную. Таким образом, каждый из детей такого родителя будет иметь вероятность 50% наследования измененной копии и, следовательно, иметь генетическое заболевание.
Оба возможных варианта (исхода) происходят случайным образом. Процент риска остается одним и тем же при каждой беременности и одинаков как для мальчиков, так и для девочек.
Почему иногда кажется, что заболевание передалось через поколение?
Некоторые доминантные наследственные заболевания могут проявляться у разных членов семьи очень по-разному. Это называется «вариабельная экспрессивность». На самом деле, доминантное заболевание присутствует в каждом поколении, но у некоторых людей проявления заболевания настолько незначительны, что они считают себя здоровыми. Они могут даже не знать о наличии у них заболевания.
При заболеваниях с поздним началом (проявляющимся уже во взрослом возрасте, например, наследственная форма рака груди или хорея Гентингтона) люди могут умереть раньше начала манифестации наследственного заболевания от совсем других причин, и наследственное заболевание не успевает проявить себя. Однако родители могли передать заболевание своим детям.
Что происходит в том случае, если пациент является первым в семье, у кого выявлено данное заболевание?
Иногда пациент с доминантным заболеванием может оказаться первым больным в семье. Это может объясняться тем, что в сперматозоиде или яйцеклетке, из которых развился данный ребенок, произошла новая мутация (изменение) в гене, впервые в поколениях семьи. Если такое происходит, то родители этого пациента здоровы. В этом случае вероятность рождения у этих родителей другого ребенка с таким же заболеванием очень мала, однако этот вопрос обязательно следует обсудить с врачом. Однако, больной ребенок (как сын, так и дочь), у которого появился измененный ген, в будущем может передать его своим детям.
Тесты во время беременности
Для некоторых доминантных генетических заболеваний возможно проведение теста во время беременности, который позволит выявить, унаследовал ли ребенок заболевание (более подробная информация об этих тестах приведена в брошюрах «Биопсия ворсин хориона» и «Амниоцентез»).
Другие члены семьи
Если у кого-либо в семье есть доминантное заболевание, возможно, Вы будете обсуждать это с другими членами семьи. Эта информация может помочь другим членам семьи для решения вопроса об обследовании и диагностике заболевания. Это может быть особенно важно для тех членов семьи, у которых уже есть или будут дети.
Некоторым людям может оказаться сложно обсуждать свое генетическое заболевание с другими членам семьи. Они могут бояться причинить беспокойство членам семьи. В некоторых семьях люди из-за этого испытывают сложности в общении и теряют взаимопонимание с родственниками. Врачи-генетики, как правило, имеют большой опыт в решении подобных семейных ситуаций и могут помочь Вам в обсуждении проблемы с другими членами семьи.
Аутосомно-доминантные заболевания
Издавна человека интересовало, каким образом устроены различные вещи в природе. В том числе, почему и как функционирует организм. Врачи древности изучали стихии, пытаясь объяснить их взаимодействием, нехваткой или неверным соотношением различные болезни. Однако оставалось загадкой то, почему дети могут быть похожими на родителей, унаследовать их черты, а могут резко отличаться или страдать от неизвестных заболеваний.
Только в 20 веке ученые смогли подобраться к разгадке этой тайны. Развитие науки позволило установить, что в организме человека существует механизм передачи наследственной информации. Ее носителем являются огромные спиральные молекулы ДНК, состоящие их большого числа базовых структурных единиц, называемых нуклеотидами. Определенные их последовательности отвечают за различные функции организма. Группа расположенных рядом нуклеотидов, обеспечивающая, к примеру, воспроизводство определенного белка, называется геном. Поскольку человек представляет собой очень сложную систему, количество генов весьма велико.
На более высоком уровне наследственный материал объединяется в структурные единицы – хромосомы. У человека в норме каждая клетка организма содержит 23 пары хромосом. В каждой паре наследственный материал дублируется. Естественным исключением из этого правила являются две хромосомы, сочетание которых определяет пол человека. Если они одинаковы и имеют большой размер (X-хромосомы, пара XX), то организм развивается по женскому пути. Если же одна из них отличается меньшим размером (Y-хромосома, генотип XY), развивается особь мужского пола.
Из-за высокого числа генов и влияния различных факторов нормальный процесс наследования может осложняться всевозможными нарушениями. В некоторых случаях отдельный ген подвергается мутации, что приводит к нарушению его функции. При этом в организме изменяется сложившийся за миллионы лет эволюционного развития баланс производства белков. В результате возникшего отклонения могут появиться различные патологии. Иногда влияние мутаций незначительно и приводит лишь к незначительным отличиям. В ряде случаев эффект от изменения генетического кода может даже обеспечить то или иное преимущество организму. Однако довольно часто мутантный ген не укладывается в слаженную картину взаимодействий и вызывает развитие заболевания. Подобные нарушения носят название генетических болезней.
Аномалии могут возникнуть и на следующем уровне. Дело в том, что в процессе клеточного деления каждая из клеток-потомков должна получить свою копию наследственного материала. Но иногда расхождение хромосом нарушается и возникают хромосомные аберрации. Если часть генетического материала при этом утрачивается, то говорят о делеции (удалении). В некоторых случаях ген может повториться несколько раз – тогда говорят об амплификации (усилении гена). Кроме того, хромосомные перестройки могут привести к тому, что хромосомы обменяются своими частями – то есть произойдет транслокация. Если при этом наследственный материал не утрачивается, то говорят о сбалансированной транслокации.
Возникшие аномалии могут передаваться детям вместе с генетическим материалом родителей. В некоторых случаях при этом может развиться опасная патология. Поэтому особенно важным становится изучение способов наследования заболеваний.
Доминантные и рецессивные мутации
По тому, каким образом в фенотипе проявляется мутация, определяется ее рецессивный или доминантный характер. Дело в том, что в норме в каждой паре хромосом ген присутствует в двух экземплярах. При возникновении в одной копии мутационного изменения вторая копия часто остается целой. Если при этом возможностей сохранившего оригинальную структуру гена достаточно для полноценного выполнения его функций (к примеру, экспрессии соответствующего белка), то подобная аномалия оказывает слабое влияние на баланс веществ в организме. В таком случае наличие одиночной копии мутантного гена может либо вообще не проявляться, либо проявляться незначительно. Подобный эффект от гена говорит о рецессивном характере мутации.
Другой вариант развития событий оказывается более заметным для организма. При некоторых мутациях измененный ген в состоянии подавить нормальную деятельность неизменной копии. В результате возникает дисбаланс в организме. В зависимости от важности кодируемой информации развивается легкая или тяжелая патология. Если наличия одной копии измененного гена достаточно для того, чтобы его эффект проявился, то говорят о доминантном характере мутации.
В некоторых случаях наличие в организме двух копий доминантного гена способно вызывать явление сверхдоминирования. При этом патологическое воздействие оказывается значительно сильнее, чем при одной копии мутантного гена.
Аутосомы и половые хромосомы
Принято отличать пару половых хромосом и все остальные пары. Те хромосомы, которые не зависят от пола, называются аутосомами. Они имеются у любого организма биологического вида. Поскольку у человека всего 23 пары, то аутосом выделяется 22 пары. Ученые договорились нумеровать их по размеру, при этом меньший номер соответствует самым большим хромосомам. Поскольку отдельные гены привязаны к определенной хромосоме, это позволяет точно классифицировать возникающие аномалии по номеру аутосомы.
Поскольку аутосом больше, чем половых хромосом, связанных с ними распространенных нарушений также больше. Из 94 распространенных хромосомных заболеваний 77 появляются вследствие мутаций в аутосомах.
Что такое аутосомно-доминантные заболевания?
Мутация, возникающая в аутосоме и имеющая при этом доминантный характер, будет проявляться в фенотипе. Возникающее при этом заболевание называется аутосомно-доминантным. Аналогичным образом существуют аутосомно-рецессивные заболевания, проявляющиеся при наличии в аутосоме двух копий мутантного гена (по одной на каждую хромосому из пары).
На текущий момент насчитывается свыше 3700 подобный заболеваний. В основной своей массе они возникают по одной из двух причин. Во-первых, из-за появления мутации может возникнуть дефект в структурном белке, в результате чего становится невозможным нормальное функционирование организма, поскольку его основной строительный материал изменяется. Во-вторых, может нарушиться регуляция экспрессии генов, то есть баланс выработки необходимых организму веществ.
Поскольку набор аутосом одинаков у мужчин и женщин, вероятность возникновения заболевания не зависит от пола. При этом аутосомно-доминантные болезни обычно характеризуются фенотипическим полиморфизмом, зависящим от степени выраженности мутантного гена в фенотипе.
Мутации доминантного характера могут произойти в половой клетке. В таком случае они практически всегда проявляются в первом же поколении потомков. По этой причине основным фактором, вызывающим развитие аутосомно-доминантных заболеваний, считаются новые мутации. Кроме того, на частоту возникновения некоторых болезней оказывает влияние возраст родителей, особенно отца.
При наследовании аутосомно-доминантные болезни обычно проявляются во всех поколениях. Это правило может нарушаться, если появление мутации приводит к летальным последствиям либо снижает способность к материнству (отцовству). В частности, может нарушаться процесс образования гамет. Другой причиной прекращения наследования становится повышенный риск гибели плода.
Какова вероятность унаследовать аутосомно-доминантное заболевание от родителей?
Доминантные заболевания проявляются всегда. Если в семье у одного из родителей (или у обоих) отмечаются симптомы наследственного заболевания, для точного определения риска передачи болезни по наследству необходимо пройти процедуру генетической диагностики.
Дело в том, что риск определяется тем, является ли носитель мутации (или носители) гомозиготным. Иными словами, имеется у него только одна копия мутантного гена или две. Если их две, то в процессе передачи генетической информации зародыш получит хромосому с мутацией. В таком случае вероятность рождения больного ребенка составляет 100 процентов. Существует теоретический шанс, что у ребенка произойдет обратная мутация и он родится здоровым. Однако вероятность такого события столь мала, что в реальности подобные случаи не наблюдаются. При этом неважно, каков генотип второго родителя – передача заболевания все равно происходит.
Оба родителя могут быть гетерозиготными по мутантному гену, то есть иметь по одной здоровой и одно нарушенной копии. В этом случае в точном соответствии с законами наследования вероятность рождения больного ребенка составит 75 процентов. При этом в трети случаев у ребенка будет гомозиготный набор мутантного гена со 100-процентной вероятностью передачи заболевания потомкам. Вероятность рождения ребенка без генетического дефекта составляет 25%.
Если же заболевание имеется только у одного из родителей, причем он по нему гетерозиготен, то существует только два возможных варианта: либо ребенок получит здоровый ген, либо мутантную версию. Поэтому вероятность передачи заболевания детям составит в этом случае 50%.
Стоит отметить, что наследование не зависит от того, какого пола ребенок будет рожден. Кроме того, на вероятность передачи заболевания детям не оказывает влияние тяжесть болезни у его родителя. Поэтому грамотные специалисты никогда не пытаются на основании фенотипа родителя предсказать потенциальную степень заболевания у потомков.
Отдельно рассматриваются случаи здоровых родителей, у которых родился ребенок с аутосомно-доминантной болезнью. В этом случае причина заключается в новой мутации, а не в генетическом материале родителей. Поэтому вероятность повторного появления этого заболевания у других детей в семье очень невелика.
Синдром Марфана
Одним из примеров аутосомно-доминантных заболеваний является синдром Марфана. Эта болезнь связана с передающейся по наследству патологией соединительной ткани. Ее причина заключается в возникновении мутантного гена, кодирующего синтез важного для организма вещества гликопротеина фибриллина-1. Степень выраженности симптомов в конкретном случае может отличаться.
При классическом развитии синдрома у человека искажается форма конечностей, они становятся вытянутыми, отмечается арахнодактилия (вытянутые пальцы). Кроме того, недостаточно развивается жировая клетчатка. Изменения касаются опорно-двигательного аппарата, вызывая удлинение костей, повышенную мобильность суставов. Также наблюдаются патологические изменения в глазах. Заболевание сопровождается поражением сердечно-сосудистой системы. Три признака – нарушения строения скелета, проблемы со зрением и заболевания сердца и сосудов – являются классическим набором симптомов этого отклонения.
При отсутствии лечения прогрессирующие нарушения в тканях сосудов приводят к смерти в возрасте 30-40 лет. Причиной смерти может стать аневризма аорты и застойная сердечная недостаточность. Если же вовремя начать терапию, то больные могут жить достаточно долго.
Первое описание признаков заболевания было сделано в конце девятнадцатого века. Французский ученый Антуан Марфан описал прогрессирующее развитие аномалий опорно-двигательного аппарата. Позднее было установлено, что заболевание не является редким. В среднем один человек из 5000 болеет им в той или иной форме.
Симптомы проявляются неравномерно. Основной признак – нарушение развития скелета – отмечается всегда. Наряду с классической арахнодактилией и долохостеномелией возможные формы включают различные деформации позвоночника, неверное формирование передней стенки грудной клетки, повышенную мобильность суставов, плоскостопие. Также может отмечаться низкий тонус мышц.
Примерно в 80 процентах случаев проблемы с сердечно-сосудистой системой связаны с пролапсом митрального клапана. Стенки клапана постепенно становятся толще. Прогрессирующие изменения у женщин происходят медленнее. Однако в любом случае при отсутствии лечения результат одинаков – расслаивающаяся аневризма аорты.
В органах зрения изменения могут затрагивать хрусталик. Так, около половины больных имеют подвывих хрусталика. Также возможно отслоение сетчатки, особенно если у человека выражена миопия.
Патология влияет на развитие прочих систем организма. Симптомы могут включать кистозные образования в почках и печени, сужение нервного канала (пояснично-крестцовый отдел), пневмотораксы и т.д. Затрагивается и центральная нервная система.
Кардинальных методов лечения на текущий момент не существует. Возможна лишь симптоматическая терапия, облегчающая состояние больного. Ежегодно больные должны посещать офтальмолога, ортопеда и кардиолога, чтобы отслеживать развитие изменений и при необходимости корректировать лечение.
Болезнь Хантингтона (хорея Гентингтона)
Другим ярким примером аутосомно доминантного заболевания является хорея Гентингтона. Для нее характерно поражение нервной системы, которое обычно проявляется в возрасте 30-50 лет. При этом отмечаются прогрессирующие психические расстройства.
Заболевание встречается достаточно редко. Среди коренных жителей Европы распространенность составляет около 3-7 случаев на 100 тысяч человек. Для жителей других частей света эта величина существенно меньше и составляет примерно 1 случай на миллион человек.
Основной причиной заболевания по данным ученых является умножение специфического кодона в гене IT-15. Сам ген отвечает за выработку белка хантингина, функция которого на текущий момент не установлена. В норме число повторов не должно превышать 36 раз. Если отмечается большее количество копий, то начинается развитие болезни. Произойти это может из-за мутации, приводящей к копированию генетического материала.
Мутантная форма белка хантингтина (обозначается mHtt, в отличие от нормальной Htt) обладает токсичным воздействием на клетки. Исследования показывают, что чем больше повторов кодона присутствует в хромосоме, тем сильнее проявляется болезнь. При числе кодонов порядка 36-40 развивается ослабленная форма. В таком случае заболевание дает о себе знать значительно позже и прогрессирует медленнее. Слабые симптомы могут так и не проявиться при жизни человека. При большом числе повторов болезнь появляется рано, до достижения 20-летнего возраста.
Точный механизм воздействия белка Htt на организм до сих пор не исследован. Сходным образом обстоит ситуация с его мутантной версией. Известно лишь, что mHtt оказывает токсичное воздействие на некоторые типы клеток. Особенно сильно это проявляется в ткани головного мозга. Повреждения чаще всего затрагивают полосатое тело, однако в процессе развития заболевания распространяются и на другие области. По этой причине первым проявлениям патологии обычно становится расстройство движений: человек начинает ошибаться при планировании действий или их коррекции.
Также белок Htt участвует во многих взаимодействиях в организме. В частности, он задействуется при внутриклеточном транспорте, передаче сигнала в клетку и в процессе транскрипции. Недостаток этого белка в эмбрионе вызывает гибель зародыша. Кроме того, белок выполняет анти-апоптозную роль, то есть предотвращает запрограммированную гибель клеток. При возрастании выработки нормальной формы белка Htt нервные клетки становятся более жизнеспособными, что приводит к снижению токсического воздействия mHtt. Стоит отметить, что если нормальный ген разрушается, то это не вызывает болезнь, поэтому причиной считается именно образование мутантного гена.
На клеточном уровне воздействие искаженной версии белка mHtt вызывает развитие нарушений. В частности, начинается формирование внутриклеточных телец включения на основе белка хантингтина. За счет этого осложняется движение нейромедиаторов через цитоскелет, что вызывает нарушение передачи сигналов в нейронах.
На макроскопическом уровне это вызывает поражение специфических областей мозга. Развитие патологии в полосатом теле приводит к нарушению координации движений. Также меняется поведение. Повреждаются базальные ганглии, которые по мнению ряда ученых входят в когнитивную исполнительную систему, отвечающую за генерацию специфических движений. При этой болезни ганглии не могут корректно обработать полученный от других отделов мозга сигнал, что выражается в неспособности человека начать движение или необходимости прикладывать дополнительные усилия для этого. Точно так же нарушается выполнение движения либо его произвольная остановка по желанию. Накопление таких повреждений вызывает появление комплекса характерных беспорядочных движений.
Обычно заболевание проявляется в возрасте от 35 до 45 лет. На ранней стадии отмечается незначительное изменение когнитивных способностей, некоторых физических навыков, а также личности. Как правило, сначала проявляются физические симптомы. Постепенное накопление нарушений в тканях мозга приводит к усилению психических и когнитивных искажений.
На начальном этапе при типичном развитии физические симптомы выражаются резкими внезапными движениями, которые трудно контролировать. В некоторых случаях наблюдается обратная картина: вместо нормального темпа больной начинает выполнять все действия очень медленно. Страдает и общая координация движений. Параллельно возникают нарушения речи, ее становится трудно понимать. С течением времени синдромы обостряются. Любые действия, требующие мышечного контроля, становятся трудновыполнимыми. На этом этапе больные начинают часто гримасничать, но могут нормально жевать пищу и проглатывать ее. Нарушается движение глаз, что приводит к нарушению сна.
В большинстве случаев при развитии синдрома человек проходит все фазы физического расстройства. А вот когнитивные искажения носят индивидуальный характер. Обычно страдает способность абстрактно мыслить. Выражается это в том, что человек не может спланировать свои действия, даже если они достаточно просты. Кроме того, затруднено следование правилам, осложняется оценка адекватности собственных поступков. Развитие поражения тканей мозга приводит к ухудшению памяти. На этом фоне также возникают депрессии, панические состояния, могут происходить выплески агрессии. Человек перестает узнавать своих знакомых. Усиливаются эгоцентричные черты характера, появляется тяга к вредным привычкам (курение, алкоголизм, игромания и т.д.).
Классический подход к диагностике предполагает обследование организма, в некоторых случаях проводится также и психологическое обследование. При помощи компьютерной и магнитно-резонансной томографии можно отслеживать нарушения в тканях мозга, однако этот способ применим лишь во время прогрессирования заболевания. Использование позитронно-эмиссионной томографии и методов функциональной нейровизуализации в определенной ситуации может применяться для обнаружения искажений в активности головного мозга до непосредственного появления физических симптомов.
Полноценная диагностика возможна путем генетического тестирования. Для этого у пациента берется образец крови, из которого выделяется генетический материал. После этого оба Htt гена проверяются на количество повторов кодона, отвечающего за развитие заболевания. При этом следует правильно относиться к результатам: наличие положительного ответа (то есть увеличенное по сравнению с нормальным число повторов) не является подтверждением диагноза. В общем случае генетические аномалии могут быть выявлены задолго до появления симптомов хореи Гентингтона. В то же время отрицательный результат, то есть укладывающееся в норму число повторов, указывает на невозможность развития болезни.
Допускается проведение генетического тестирования для эмбрионов, подготовленных в ходе экстракорпорального оплодотворения. Для этого используется диагностика до имплантации: на стадии 4-8 клеток одна из них забирается и используется для получения наследственного материала. Затем образец исследуют с целью установить наличие патологии. Результаты проверки могут использоваться для выбора наиболее подходящего эмбриона, который и будет имплантироваться матери.
Пренатальная диагностика также возможна. В этом случае используется забор околоплодных вод, ворсинок хориона, либо применяется неинвазивный метод тестирования. В частности, генетический материал плода можно получить из крови матери и использовать для проведения анализа.
Генетическая проверка позволяет также отличить хорею Гентингтона от сходных с ней заболеваний. По статистике, только в 90% случаев подтверждается наличие этой болезни. Стоит отметить, что причины аналогичных заболеваний в настоящее время неясны, поскольку они встречаются редко.
Лечение болезни Гентингтона невозможно (по крайней мере, на текущем уровне развития медицины). Есть лишь возможность облегчить ряд симптомов. Специфические соединения позволяют несколько ограничить развитие болезни. Однако они еще не прошли стадию исследования, поэтому говорить о широком использовании нельзя.
При классическом развитии болезни после первых симптомов человек живет обычно порядка 15-20 лет. После этого сопутствующие нарушения в работе систем организма приводят к заболеваниям сердца и дыхательной системы. Кроме того, возрастает риск суицида, поскольку человек перестает адекватно оценивать свои поступки и страдает от депрессий.
Генетическое исследование и аутосомно-доминантные заболевания
Из-за многообразия форм заболеваний и наличия сходных по симптомам болезней диагностика классическими методами не всегда оказывается эффективной. Точнее сказать, установленные ей диагнозы в некоторых случаях оказываются ошибочными. Достоверно подтвердить генетический характер заболевания можно только путем анализа наследственного материала. Для этого пациенту потребуется предоставить материал для проведения генетической диагностики (обычно это просто проба крови).
После этого проводится специальное исследование, позволяющее проанализировать наличие в генотипе человека указанных нарушений генетического материала. В связи с большим объемом исследуемой информации проверка может занять длительное время. Кроме того, следует учитывать тот факт, что в ряде случаев результаты теста не являются однозначным указанием на наличие того или иного наследственного заболевания.
По этой причине самостоятельный анализ результатов тестирования едва ли возможен. Для получения достоверной информации рекомендуется обращаться к специалистам по генетическому консультированию. Это врачи с соответствующим образованием, специализирующиеся на работе с наследственным материалом, обладающие достаточным опытом и умеющие рассчитывать вероятность возникновения генетических патологий на основании данных о родителях. Кроме того, генетический консультант поможет правильно настроиться на процесс тестирования, поскольку получение результатов может стать тяжелым испытанием для человека.
В любом случае нужно понимать, что полная и достоверная информация о состоянии здоровья может оказаться незаменимой. Кроме того, пренатальное исследование позволяет заранее убедиться, что на свет появится полноценный малыш без аномалий в генетическом материале.