Аутосомно рецессивный тип наследования отличается тем что
Рецессивное наследование
Наша команда профессионалов ответит на ваши вопросы
Данная брошюра содержит информацию о том, что такое рецессивный тип наследования, и каким образом наследуются рецессивные заболевания. Для того, чтобы лучше понять особенности рецессивного наследования, вначале будет полезно узнать, что такое гены и хромосомы.
Что такое гены и хромосомы?
Наше тело состоит из миллионов клеток. Большинство клеток содержат полный набор генов. У человека тысячи генов. Гены можно сравнить с инструкциями, которые используются для контроля роста и согласованной работы всего организма. Гены отвечают за множество признаков нашего организма, например, за цвет глаз, группу крови или рост.
Гены расположены на нитевидных структурах, называемых хромосомами. В норме, в большинстве клеток организма содержится по 46 хромосом. Хромосомы передаются нам от родителей – 23 от мамы, и 23 от папы, поэтому мы часто похожи на своих родителей. Таким образом, у нас два набора по 23 хромосомы, или 23 пары хромосом. Так как на хромосомах расположены гены, мы наследуем по две копии каждого гена, по одной копии от каждого из родителей. Хромосомы (следовательно, и гены) состоят из химического соединения, называемого ДНК.
Иногда в одной копии гена возникает изменение (мутация), которое нарушает нормальную работу гена. Если такая мутация происходит только в одной копии гена рецессивного заболевания, а вторая копия нормальная, то обычно это не приводит к развитию генетического (наследственного) заболевания.
Рисунок 1: Гены, хромосомы и ДНК
Что такое аутосомно-рецессивное наследование?
Некоторые наследственные заболевания наследуются как рецессивные. Это означает, что человек должен унаследовать две измененные копии одного и того же гена (по одной измененной копии от каждого из родителей), и только в этом случае человек будет болен. Если человек наследует только одну измененную копию и одну нормальную, то в подавляющем большинстве случаев такой человек будет являться «здоровым носителем», то есть у него не будет признаков заболевания, так как нормальная копия гена компенсирует функцию мутантной копии. «Быть носителем» означает, что человек не болен, но одна из копий данного гена у него изменена, для ткого человека повышен риск рождения ребенка, больного соответствубщим заболеванием. Примерами аутосомно-рецессивных заболеваний являются муковисцидоз, спинальная амиотрофия и фенилкетонурия.
Как наследуются рецессивные заболевания?
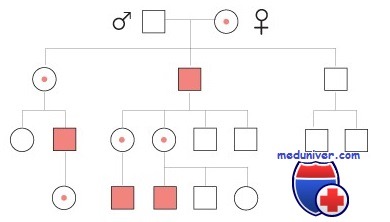
Рисунок 2: Как рецессивные заболевания передаются от родителя к ребенку
Если оба родителя являются носителями мутантной копии одного и того же гена, они могут предать своему ребенку как нормальную копию, так и измененную. Выбор происходит случайным образом.
Таким образом, каждый ребенок у родителей, которые являются носителями мутаций в одном и том же гене, имеет шанс, оцениваемый в 25% (1 из 4) унаследовать измененные копии гена от обоих родителей и, следовательно, оказаться больным. В то же самое время это означает, что существует шанс, оцениваемый в 75% (3 из 4), что ребенок не будет болен данным заболеванием. Оценка вероятности (25% или 75%) одна и та же для каждой новой беременности, и одинакова для мальчиков и для девочек.
Шанс унаследовать от родителей только одну копию измененного гена оценивается в 50% (2 из 4). Если такое происходит, ребенок будет здоровым носителем, как и его родители.
Наконец, существует шанс в 25% (1 из 4), что ребенок унаследует две нормальные копии гена, по одной от каждого из родителей. В этом случае у ребенка не будет заболевания, и он не будет являться носителем.
Процент риска остается одним и тем же при каждой беременности и одинаков как для мальчиков, так и для девочек.
Что происходит в том случае, если ребенок является первым в семье, у кого выявлено данное заболевание?
Иногда ребенок с рецессивным наследственным заболеванием может оказаться первым больным в семье. Несмотря на то, что во многих поколениях родственники могли быть носителями измененного гена, ребенок может оказаться единственным больным в семье, так как оба его родителя являются носителями, и он унаследовал измененные копии гена от обоих родителей.
Тест на определение носительства и пренатальная диагностика (тест во время беременности)
Для людей, у которых есть семейный анамнез рецессивного наследственного заболевания, существует несколько возможностей для обследования. Анализ на выявление носительства может быть проведен парам для выяснения, являются ли оба партнера носителями мутаций в определенном гене. Эта информация может оказаться полезной при планировании беременности. Для некоторых рецессивных заболеваний возможно проведение пренатальной диагностики (во время беременности) для определения, унаследовал ли будущий ребенок заболевание. Данная информация подробно обсуждается в брошюрах «Биопсия ворсин хориона» и «Аминиоцентез».
Другие члены семьи
Если кто-то в Вашей семье болен рецессивным заболеванием или является носителем, возможно, Вы захотите обсудить это с другими членами Вашей семьи. Это предоставит возможность Вашим родственникам, при желании, пройти обследование (специальный анализ крови) для выявления, является ли человек также носителем. Эта информация также может быть важна для родственников при диагностике заболевания. Это может быть особенно важно для тех родственников, у которых есть или будут дети. Подробно данная информация приведена в брощюре «Тестирование носителей»
Некоторым людям может оказаться сложно обсуждать свое генетическое заболевание с другими членам семьи. Они могут бояться причинить беспокойство членам семьи. В некоторых семьях люди из-за этого испытывают сложности в общении и теряют взаимопонимание с родственниками. Врачи-генетики, как правило, имеют большой опыт в решении подобных семейных ситуаций и могут помочь Вам в обсуждении проблемы с другими членами семьи.
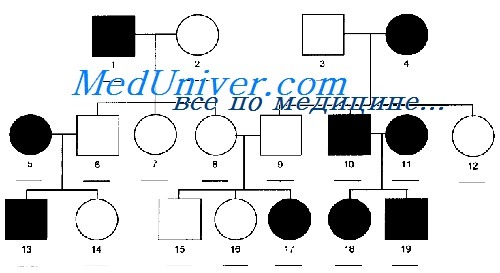
Аутосомно рецессивный тип наследования отличается тем что
Известны многие сотни заболеваний, возникающие в результате такого типа наследования. Больной человек — гомозигота по патологическому гену — получил по наследству патологический аллель от каждого родителя — гетерозиготного носителя. При носительстве обоих родителей риск рождения больного ребёнка (мужского или женского пола) составляет 1:4 (25%). Все потомки больных родителей будут носителями патологического гена.
Примеры аутосомно-рецессивных заболеваний:
• Врождённая гиперплазия коры надпочечников. MB.
• Атаксия Фридрейха.
• Галактоземия.
• Болезни накопления гликогена.
• Синдром Гурлера.
• Альбинизм.
• ФКУ.
• СКА.
• Болезнь Тея-Сакса.
• Талассемия.
• Болезнь Верднига-Гоффмана.
Близкородственный брак
Считается, что все мы носим как минимум один патологический рецессивный ген. К счастью, наши супруги обычно являются носителями совсем другого гена. Брак с двоюродным братом или другим родственником повышает шанс носительства обоими родителями одинакового патологического аутосомно-рецессивного гена, унаследованного от общего предка. Таким образом, если двоюродные брат и сестра состоят в браке, происходит небольшое повышение риска рождения ребёнка с заболеванием, наследуемым по рецессивному типу.
Частота рецессивных генов отличается у людей, принадлежащих к разным расам. Когда ген встречается сравнительно часто и сам ген или его проявление могут быть выявлены, можно провести тест носительства гена в популяции и предложить антенатальную диагностику при беременности с высоким риском.
К заболеваниям, которые могут быть выявлены таким образом, относят MB — в Северной Европе, СКА — у африканских негров и афроамериканцев, талассемию — в странах Средиземноморья и Азии и болезнь Тея-Сакса — у евреев ашкенази (немецких евреев).
Аутосомно рецессивный тип наследования:
• Больные дети гомозиготны по аномальному гену, каждый родитель — гетерозиготный носитель.
• Если оба родителя несут дефектный ген, риск рождения больного ребёнка 1:4.
• При близкородственных браках и внутри определённых этнических групп риск проявления наследственных заболеваний повышается.
• Часто затрагивает метаболические пути, в то время как при аутосомно-доминантных заболеваниях обычно повреждаются структурные белки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Аутосомно рецессивный тип наследования отличается тем что
Типы распределения моногенных заболеваний в родословных зависят в основном от двух показателей:
• является ли фенотип доминантным (проявляющимся, когда только одна хромосома из пары несет мутантный аллель, а другая хромосома имеет в этом локусе дикий тип аллеля) или рецессивным (проявляющимся, только когда обе хромосомы пары несут мутантные аллели в данном локусе);
• позиция гена на хромосоме, который может располагаться либо на аутосоме (хромосомы с 1 по 22), либо в половой хромосоме (Х- и Y-хромосомы).
Необходимо, тем не менее, различать гены, которые физически расположены в половых хромосомах (Х- или Y-синтения), и гены, которые наследуются сцепленно с Х- (или Y-) хромосомой. Большинство локусов на Х-хромосоме наследуются Х-сцепленно, поскольку они участвуют в мейотической рекомбинации только в женском гаметогенезе, когда есть две Х-хромосомы, и не могут рекомбинировать с Y-хромосомой в процессе мужского гаметогенеза.
Тем не менее есть несколько генов (названные псевдоаутосомными локусами, обсуждаемые далее в этой главе), располагающиеся в Х-хромосоме, но не проявляющие Х-сцепленного наследования, поскольку они могут рекомбинировать с аналогами в Y-хромосоме. Таким образом, выделяют четыре основных типа моногенного наследования (если объединить аутосомные и псевдоаутосомные типы вместе).
Кроме классических образцов родословных, наблюдаемых при патологии аллелей, расположенных в ядерных хромосомах, существует другой класс нарушений с отчетливым материнским типом наследования вследствие мутаций в митохондриальном геноме.
Аутосомное и Х-сцепленное наследование
Тот факт, находится ли аномальный ген в аутосоме или сцеплен с Х-хромосомой, имеет выраженное влияние на клиническое проявление болезни. Во-первых, аутосомные заболевания в основном влияют на мужчин и женщин одинаково.
Для Х-сцепленных болезней ситуация совсем другая. Мужчины имеют единственную Х-хромосому и, следовательно, гемизиготны по генам Х-хромосомы; мужчины 46,XY никогда не гетерозиготны по аллелям в локусах, расположенных на Х-хромосоме, тогда как женщины могут быть гетерозиготными или гомозиготными по данным локусам.
Во-вторых, чтобы компенсировать двойное количество генов Х-хромосомы у женщин, в каждой отдельной клетке аллели большинства Х-сцепленных генов экспрессируются только на одной из двух Х-хромосом.
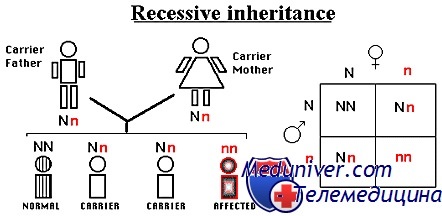
Рецессивное наследование
Классически считают, что фенотип, проявляющийся только у гомозигот (или, для признаков Х-сцепленных, у гемизиготных мужчин), но не у гетерозигот, — рецессивный. Большинство изученных к настоящему времени рецессивных заболеваний — следствие мутаций, снижающих или отключающих функцию продукта гена, так называемые мутации утраты функции.
Например, множество рецессивных болезней вызваны мутациями, которые нарушают функции ферментов. Они обычно наследуются как рецессивные болезни, поскольку гетерозиготы с функционирующим одним из пары аллелей производят достаточно продукта для нормальной физиологической функции (50% количества у гомозигот дикого типа), тем самым предотвращая болезнь.
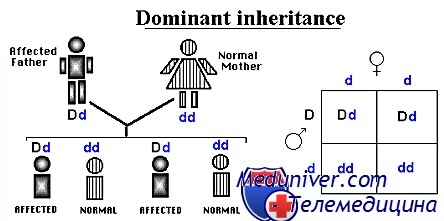
Доминантное наследование
В отличие от этого, фенотип, проявляющийся как у гомозигот, так и у гетерозигот для мутантного аллеля, наследуется доминантно. Доминантное заболевание развивается независимо от наличия нормального продукта гена, производимого благодаря существующему нормальному аллелю. При чисто доминантной болезни гомозиготы и гетерозиготы по мутантному аллелю поражены одинаково.
Чисто доминантные заболевания редки, если вообще существуют в медицинской генетике. Иногда одновременно фенотипически проявляются два различных аллеля в локусе, в этом случае такие два аллеля называют кодоминантными. Известный пример кодоминантной экспрессии — система групп крови АВО. Чаще всего доминантное заболевание более тяжелое у гомозигот, чем у гетерозигот, в этом случае болезнь называют неполно доминантной (или полудоминантной). Различные молекулярные механизмы, объясняющие, почему определенные мутации вызывают доминантно, а не рецессивно наследуемые болезни.
Строго говоря, наследуется фенотип, а не доминантный или рецессивный аллель. Тем не менее мутантные аллели часто называют доминантными или рецессивными, в зависимости от того, могут ли они вызывать изменения в фенотипе в гетерозиготном или гомозиготном состоянии соответственно. Следовательно, термины «доминантный» и «рецессивный» аллель или ген, хотя и неправильно, но широко используются.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Аутосомно-доминантные заболевания
Издавна человека интересовало, каким образом устроены различные вещи в природе. В том числе, почему и как функционирует организм. Врачи древности изучали стихии, пытаясь объяснить их взаимодействием, нехваткой или неверным соотношением различные болезни. Однако оставалось загадкой то, почему дети могут быть похожими на родителей, унаследовать их черты, а могут резко отличаться или страдать от неизвестных заболеваний.
Только в 20 веке ученые смогли подобраться к разгадке этой тайны. Развитие науки позволило установить, что в организме человека существует механизм передачи наследственной информации. Ее носителем являются огромные спиральные молекулы ДНК, состоящие их большого числа базовых структурных единиц, называемых нуклеотидами. Определенные их последовательности отвечают за различные функции организма. Группа расположенных рядом нуклеотидов, обеспечивающая, к примеру, воспроизводство определенного белка, называется геном. Поскольку человек представляет собой очень сложную систему, количество генов весьма велико.
На более высоком уровне наследственный материал объединяется в структурные единицы – хромосомы. У человека в норме каждая клетка организма содержит 23 пары хромосом. В каждой паре наследственный материал дублируется. Естественным исключением из этого правила являются две хромосомы, сочетание которых определяет пол человека. Если они одинаковы и имеют большой размер (X-хромосомы, пара XX), то организм развивается по женскому пути. Если же одна из них отличается меньшим размером (Y-хромосома, генотип XY), развивается особь мужского пола.
Из-за высокого числа генов и влияния различных факторов нормальный процесс наследования может осложняться всевозможными нарушениями. В некоторых случаях отдельный ген подвергается мутации, что приводит к нарушению его функции. При этом в организме изменяется сложившийся за миллионы лет эволюционного развития баланс производства белков. В результате возникшего отклонения могут появиться различные патологии. Иногда влияние мутаций незначительно и приводит лишь к незначительным отличиям. В ряде случаев эффект от изменения генетического кода может даже обеспечить то или иное преимущество организму. Однако довольно часто мутантный ген не укладывается в слаженную картину взаимодействий и вызывает развитие заболевания. Подобные нарушения носят название генетических болезней.
Аномалии могут возникнуть и на следующем уровне. Дело в том, что в процессе клеточного деления каждая из клеток-потомков должна получить свою копию наследственного материала. Но иногда расхождение хромосом нарушается и возникают хромосомные аберрации. Если часть генетического материала при этом утрачивается, то говорят о делеции (удалении). В некоторых случаях ген может повториться несколько раз – тогда говорят об амплификации (усилении гена). Кроме того, хромосомные перестройки могут привести к тому, что хромосомы обменяются своими частями – то есть произойдет транслокация. Если при этом наследственный материал не утрачивается, то говорят о сбалансированной транслокации.
Возникшие аномалии могут передаваться детям вместе с генетическим материалом родителей. В некоторых случаях при этом может развиться опасная патология. Поэтому особенно важным становится изучение способов наследования заболеваний.
Доминантные и рецессивные мутации
По тому, каким образом в фенотипе проявляется мутация, определяется ее рецессивный или доминантный характер. Дело в том, что в норме в каждой паре хромосом ген присутствует в двух экземплярах. При возникновении в одной копии мутационного изменения вторая копия часто остается целой. Если при этом возможностей сохранившего оригинальную структуру гена достаточно для полноценного выполнения его функций (к примеру, экспрессии соответствующего белка), то подобная аномалия оказывает слабое влияние на баланс веществ в организме. В таком случае наличие одиночной копии мутантного гена может либо вообще не проявляться, либо проявляться незначительно. Подобный эффект от гена говорит о рецессивном характере мутации.
Другой вариант развития событий оказывается более заметным для организма. При некоторых мутациях измененный ген в состоянии подавить нормальную деятельность неизменной копии. В результате возникает дисбаланс в организме. В зависимости от важности кодируемой информации развивается легкая или тяжелая патология. Если наличия одной копии измененного гена достаточно для того, чтобы его эффект проявился, то говорят о доминантном характере мутации.
В некоторых случаях наличие в организме двух копий доминантного гена способно вызывать явление сверхдоминирования. При этом патологическое воздействие оказывается значительно сильнее, чем при одной копии мутантного гена.
Аутосомы и половые хромосомы
Принято отличать пару половых хромосом и все остальные пары. Те хромосомы, которые не зависят от пола, называются аутосомами. Они имеются у любого организма биологического вида. Поскольку у человека всего 23 пары, то аутосом выделяется 22 пары. Ученые договорились нумеровать их по размеру, при этом меньший номер соответствует самым большим хромосомам. Поскольку отдельные гены привязаны к определенной хромосоме, это позволяет точно классифицировать возникающие аномалии по номеру аутосомы.
Поскольку аутосом больше, чем половых хромосом, связанных с ними распространенных нарушений также больше. Из 94 распространенных хромосомных заболеваний 77 появляются вследствие мутаций в аутосомах.
Что такое аутосомно-доминантные заболевания?
Мутация, возникающая в аутосоме и имеющая при этом доминантный характер, будет проявляться в фенотипе. Возникающее при этом заболевание называется аутосомно-доминантным. Аналогичным образом существуют аутосомно-рецессивные заболевания, проявляющиеся при наличии в аутосоме двух копий мутантного гена (по одной на каждую хромосому из пары).
На текущий момент насчитывается свыше 3700 подобный заболеваний. В основной своей массе они возникают по одной из двух причин. Во-первых, из-за появления мутации может возникнуть дефект в структурном белке, в результате чего становится невозможным нормальное функционирование организма, поскольку его основной строительный материал изменяется. Во-вторых, может нарушиться регуляция экспрессии генов, то есть баланс выработки необходимых организму веществ.
Поскольку набор аутосом одинаков у мужчин и женщин, вероятность возникновения заболевания не зависит от пола. При этом аутосомно-доминантные болезни обычно характеризуются фенотипическим полиморфизмом, зависящим от степени выраженности мутантного гена в фенотипе.
Мутации доминантного характера могут произойти в половой клетке. В таком случае они практически всегда проявляются в первом же поколении потомков. По этой причине основным фактором, вызывающим развитие аутосомно-доминантных заболеваний, считаются новые мутации. Кроме того, на частоту возникновения некоторых болезней оказывает влияние возраст родителей, особенно отца.
При наследовании аутосомно-доминантные болезни обычно проявляются во всех поколениях. Это правило может нарушаться, если появление мутации приводит к летальным последствиям либо снижает способность к материнству (отцовству). В частности, может нарушаться процесс образования гамет. Другой причиной прекращения наследования становится повышенный риск гибели плода.
Какова вероятность унаследовать аутосомно-доминантное заболевание от родителей?
Доминантные заболевания проявляются всегда. Если в семье у одного из родителей (или у обоих) отмечаются симптомы наследственного заболевания, для точного определения риска передачи болезни по наследству необходимо пройти процедуру генетической диагностики.
Дело в том, что риск определяется тем, является ли носитель мутации (или носители) гомозиготным. Иными словами, имеется у него только одна копия мутантного гена или две. Если их две, то в процессе передачи генетической информации зародыш получит хромосому с мутацией. В таком случае вероятность рождения больного ребенка составляет 100 процентов. Существует теоретический шанс, что у ребенка произойдет обратная мутация и он родится здоровым. Однако вероятность такого события столь мала, что в реальности подобные случаи не наблюдаются. При этом неважно, каков генотип второго родителя – передача заболевания все равно происходит.
Оба родителя могут быть гетерозиготными по мутантному гену, то есть иметь по одной здоровой и одно нарушенной копии. В этом случае в точном соответствии с законами наследования вероятность рождения больного ребенка составит 75 процентов. При этом в трети случаев у ребенка будет гомозиготный набор мутантного гена со 100-процентной вероятностью передачи заболевания потомкам. Вероятность рождения ребенка без генетического дефекта составляет 25%.
Если же заболевание имеется только у одного из родителей, причем он по нему гетерозиготен, то существует только два возможных варианта: либо ребенок получит здоровый ген, либо мутантную версию. Поэтому вероятность передачи заболевания детям составит в этом случае 50%.
Стоит отметить, что наследование не зависит от того, какого пола ребенок будет рожден. Кроме того, на вероятность передачи заболевания детям не оказывает влияние тяжесть болезни у его родителя. Поэтому грамотные специалисты никогда не пытаются на основании фенотипа родителя предсказать потенциальную степень заболевания у потомков.
Отдельно рассматриваются случаи здоровых родителей, у которых родился ребенок с аутосомно-доминантной болезнью. В этом случае причина заключается в новой мутации, а не в генетическом материале родителей. Поэтому вероятность повторного появления этого заболевания у других детей в семье очень невелика.
Синдром Марфана
Одним из примеров аутосомно-доминантных заболеваний является синдром Марфана. Эта болезнь связана с передающейся по наследству патологией соединительной ткани. Ее причина заключается в возникновении мутантного гена, кодирующего синтез важного для организма вещества гликопротеина фибриллина-1. Степень выраженности симптомов в конкретном случае может отличаться.
При классическом развитии синдрома у человека искажается форма конечностей, они становятся вытянутыми, отмечается арахнодактилия (вытянутые пальцы). Кроме того, недостаточно развивается жировая клетчатка. Изменения касаются опорно-двигательного аппарата, вызывая удлинение костей, повышенную мобильность суставов. Также наблюдаются патологические изменения в глазах. Заболевание сопровождается поражением сердечно-сосудистой системы. Три признака – нарушения строения скелета, проблемы со зрением и заболевания сердца и сосудов – являются классическим набором симптомов этого отклонения.
При отсутствии лечения прогрессирующие нарушения в тканях сосудов приводят к смерти в возрасте 30-40 лет. Причиной смерти может стать аневризма аорты и застойная сердечная недостаточность. Если же вовремя начать терапию, то больные могут жить достаточно долго.
Первое описание признаков заболевания было сделано в конце девятнадцатого века. Французский ученый Антуан Марфан описал прогрессирующее развитие аномалий опорно-двигательного аппарата. Позднее было установлено, что заболевание не является редким. В среднем один человек из 5000 болеет им в той или иной форме.
Симптомы проявляются неравномерно. Основной признак – нарушение развития скелета – отмечается всегда. Наряду с классической арахнодактилией и долохостеномелией возможные формы включают различные деформации позвоночника, неверное формирование передней стенки грудной клетки, повышенную мобильность суставов, плоскостопие. Также может отмечаться низкий тонус мышц.
Примерно в 80 процентах случаев проблемы с сердечно-сосудистой системой связаны с пролапсом митрального клапана. Стенки клапана постепенно становятся толще. Прогрессирующие изменения у женщин происходят медленнее. Однако в любом случае при отсутствии лечения результат одинаков – расслаивающаяся аневризма аорты.
В органах зрения изменения могут затрагивать хрусталик. Так, около половины больных имеют подвывих хрусталика. Также возможно отслоение сетчатки, особенно если у человека выражена миопия.
Патология влияет на развитие прочих систем организма. Симптомы могут включать кистозные образования в почках и печени, сужение нервного канала (пояснично-крестцовый отдел), пневмотораксы и т.д. Затрагивается и центральная нервная система.
Кардинальных методов лечения на текущий момент не существует. Возможна лишь симптоматическая терапия, облегчающая состояние больного. Ежегодно больные должны посещать офтальмолога, ортопеда и кардиолога, чтобы отслеживать развитие изменений и при необходимости корректировать лечение.
Болезнь Хантингтона (хорея Гентингтона)
Другим ярким примером аутосомно доминантного заболевания является хорея Гентингтона. Для нее характерно поражение нервной системы, которое обычно проявляется в возрасте 30-50 лет. При этом отмечаются прогрессирующие психические расстройства.
Заболевание встречается достаточно редко. Среди коренных жителей Европы распространенность составляет около 3-7 случаев на 100 тысяч человек. Для жителей других частей света эта величина существенно меньше и составляет примерно 1 случай на миллион человек.
Основной причиной заболевания по данным ученых является умножение специфического кодона в гене IT-15. Сам ген отвечает за выработку белка хантингина, функция которого на текущий момент не установлена. В норме число повторов не должно превышать 36 раз. Если отмечается большее количество копий, то начинается развитие болезни. Произойти это может из-за мутации, приводящей к копированию генетического материала.
Мутантная форма белка хантингтина (обозначается mHtt, в отличие от нормальной Htt) обладает токсичным воздействием на клетки. Исследования показывают, что чем больше повторов кодона присутствует в хромосоме, тем сильнее проявляется болезнь. При числе кодонов порядка 36-40 развивается ослабленная форма. В таком случае заболевание дает о себе знать значительно позже и прогрессирует медленнее. Слабые симптомы могут так и не проявиться при жизни человека. При большом числе повторов болезнь появляется рано, до достижения 20-летнего возраста.
Точный механизм воздействия белка Htt на организм до сих пор не исследован. Сходным образом обстоит ситуация с его мутантной версией. Известно лишь, что mHtt оказывает токсичное воздействие на некоторые типы клеток. Особенно сильно это проявляется в ткани головного мозга. Повреждения чаще всего затрагивают полосатое тело, однако в процессе развития заболевания распространяются и на другие области. По этой причине первым проявлениям патологии обычно становится расстройство движений: человек начинает ошибаться при планировании действий или их коррекции.
Также белок Htt участвует во многих взаимодействиях в организме. В частности, он задействуется при внутриклеточном транспорте, передаче сигнала в клетку и в процессе транскрипции. Недостаток этого белка в эмбрионе вызывает гибель зародыша. Кроме того, белок выполняет анти-апоптозную роль, то есть предотвращает запрограммированную гибель клеток. При возрастании выработки нормальной формы белка Htt нервные клетки становятся более жизнеспособными, что приводит к снижению токсического воздействия mHtt. Стоит отметить, что если нормальный ген разрушается, то это не вызывает болезнь, поэтому причиной считается именно образование мутантного гена.
На клеточном уровне воздействие искаженной версии белка mHtt вызывает развитие нарушений. В частности, начинается формирование внутриклеточных телец включения на основе белка хантингтина. За счет этого осложняется движение нейромедиаторов через цитоскелет, что вызывает нарушение передачи сигналов в нейронах.
На макроскопическом уровне это вызывает поражение специфических областей мозга. Развитие патологии в полосатом теле приводит к нарушению координации движений. Также меняется поведение. Повреждаются базальные ганглии, которые по мнению ряда ученых входят в когнитивную исполнительную систему, отвечающую за генерацию специфических движений. При этой болезни ганглии не могут корректно обработать полученный от других отделов мозга сигнал, что выражается в неспособности человека начать движение или необходимости прикладывать дополнительные усилия для этого. Точно так же нарушается выполнение движения либо его произвольная остановка по желанию. Накопление таких повреждений вызывает появление комплекса характерных беспорядочных движений.
Обычно заболевание проявляется в возрасте от 35 до 45 лет. На ранней стадии отмечается незначительное изменение когнитивных способностей, некоторых физических навыков, а также личности. Как правило, сначала проявляются физические симптомы. Постепенное накопление нарушений в тканях мозга приводит к усилению психических и когнитивных искажений.
На начальном этапе при типичном развитии физические симптомы выражаются резкими внезапными движениями, которые трудно контролировать. В некоторых случаях наблюдается обратная картина: вместо нормального темпа больной начинает выполнять все действия очень медленно. Страдает и общая координация движений. Параллельно возникают нарушения речи, ее становится трудно понимать. С течением времени синдромы обостряются. Любые действия, требующие мышечного контроля, становятся трудновыполнимыми. На этом этапе больные начинают часто гримасничать, но могут нормально жевать пищу и проглатывать ее. Нарушается движение глаз, что приводит к нарушению сна.
В большинстве случаев при развитии синдрома человек проходит все фазы физического расстройства. А вот когнитивные искажения носят индивидуальный характер. Обычно страдает способность абстрактно мыслить. Выражается это в том, что человек не может спланировать свои действия, даже если они достаточно просты. Кроме того, затруднено следование правилам, осложняется оценка адекватности собственных поступков. Развитие поражения тканей мозга приводит к ухудшению памяти. На этом фоне также возникают депрессии, панические состояния, могут происходить выплески агрессии. Человек перестает узнавать своих знакомых. Усиливаются эгоцентричные черты характера, появляется тяга к вредным привычкам (курение, алкоголизм, игромания и т.д.).
Классический подход к диагностике предполагает обследование организма, в некоторых случаях проводится также и психологическое обследование. При помощи компьютерной и магнитно-резонансной томографии можно отслеживать нарушения в тканях мозга, однако этот способ применим лишь во время прогрессирования заболевания. Использование позитронно-эмиссионной томографии и методов функциональной нейровизуализации в определенной ситуации может применяться для обнаружения искажений в активности головного мозга до непосредственного появления физических симптомов.
Полноценная диагностика возможна путем генетического тестирования. Для этого у пациента берется образец крови, из которого выделяется генетический материал. После этого оба Htt гена проверяются на количество повторов кодона, отвечающего за развитие заболевания. При этом следует правильно относиться к результатам: наличие положительного ответа (то есть увеличенное по сравнению с нормальным число повторов) не является подтверждением диагноза. В общем случае генетические аномалии могут быть выявлены задолго до появления симптомов хореи Гентингтона. В то же время отрицательный результат, то есть укладывающееся в норму число повторов, указывает на невозможность развития болезни.
Допускается проведение генетического тестирования для эмбрионов, подготовленных в ходе экстракорпорального оплодотворения. Для этого используется диагностика до имплантации: на стадии 4-8 клеток одна из них забирается и используется для получения наследственного материала. Затем образец исследуют с целью установить наличие патологии. Результаты проверки могут использоваться для выбора наиболее подходящего эмбриона, который и будет имплантироваться матери.
Пренатальная диагностика также возможна. В этом случае используется забор околоплодных вод, ворсинок хориона, либо применяется неинвазивный метод тестирования. В частности, генетический материал плода можно получить из крови матери и использовать для проведения анализа.
Генетическая проверка позволяет также отличить хорею Гентингтона от сходных с ней заболеваний. По статистике, только в 90% случаев подтверждается наличие этой болезни. Стоит отметить, что причины аналогичных заболеваний в настоящее время неясны, поскольку они встречаются редко.
Лечение болезни Гентингтона невозможно (по крайней мере, на текущем уровне развития медицины). Есть лишь возможность облегчить ряд симптомов. Специфические соединения позволяют несколько ограничить развитие болезни. Однако они еще не прошли стадию исследования, поэтому говорить о широком использовании нельзя.
При классическом развитии болезни после первых симптомов человек живет обычно порядка 15-20 лет. После этого сопутствующие нарушения в работе систем организма приводят к заболеваниям сердца и дыхательной системы. Кроме того, возрастает риск суицида, поскольку человек перестает адекватно оценивать свои поступки и страдает от депрессий.
Генетическое исследование и аутосомно-доминантные заболевания
Из-за многообразия форм заболеваний и наличия сходных по симптомам болезней диагностика классическими методами не всегда оказывается эффективной. Точнее сказать, установленные ей диагнозы в некоторых случаях оказываются ошибочными. Достоверно подтвердить генетический характер заболевания можно только путем анализа наследственного материала. Для этого пациенту потребуется предоставить материал для проведения генетической диагностики (обычно это просто проба крови).
После этого проводится специальное исследование, позволяющее проанализировать наличие в генотипе человека указанных нарушений генетического материала. В связи с большим объемом исследуемой информации проверка может занять длительное время. Кроме того, следует учитывать тот факт, что в ряде случаев результаты теста не являются однозначным указанием на наличие того или иного наследственного заболевания.
По этой причине самостоятельный анализ результатов тестирования едва ли возможен. Для получения достоверной информации рекомендуется обращаться к специалистам по генетическому консультированию. Это врачи с соответствующим образованием, специализирующиеся на работе с наследственным материалом, обладающие достаточным опытом и умеющие рассчитывать вероятность возникновения генетических патологий на основании данных о родителях. Кроме того, генетический консультант поможет правильно настроиться на процесс тестирования, поскольку получение результатов может стать тяжелым испытанием для человека.
В любом случае нужно понимать, что полная и достоверная информация о состоянии здоровья может оказаться незаменимой. Кроме того, пренатальное исследование позволяет заранее убедиться, что на свет появится полноценный малыш без аномалий в генетическом материале.