азот в нашей жизни проект
Что такое азот и для чего используется?
Азот – это химический элемент с атомным номером 7. Является газом без запаха, вкуса и цвета.
Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии, круговорот азота
На Земле азот претерпевает ряд трансформаций, в которых участвуют и биотические (связанные с жизнью) и абиотические факторы. Из атмосферы и почвы азот поступает в растения, причем не напрямую, а через микроорганизмы. Азотфиксирующие бактерии удерживают и перерабатывают азот, превращая его в форму, легко усваиваемую растениями. В организме растений азот переходит в состав сложных соединений, в частности – белков.
По пищевой цепи эти вещества попадают в организмы травоядных, а затем – хищников. После гибели всего живого азот вновь попадает в почву, где подвергается разложению (аммонификации и денитрификации). Азот фиксируется в грунте, минералах, воде, попадает в атмосферу, и круг повторяется.
Применение азота
После открытия азота (это произошло в 18-м столетии), были хорошо изучены свойства самого вещества, его соединений, возможности использования в хозяйстве. Поскольку запасы азота на нашей планете огромны, данный элемент стал использоваться крайне активно.

Чистый азот применяется в жидком или газообразном виде. Жидкий азот имеет температуру минус 196 градусов по Цельсию и применяется в следующих областях:
– в медицине. Жидкий азот является хладагентом при процедурах криотерапии, то есть лечения холодом. Мгновенная заморозка применяется для удаления различных новообразований. В жидком азоте хранят образцы тканей и живые клетки (в частности – сперматозоиды и яйцеклетки). Низкая температура позволяет сохранить биоматериал в течение длительного времени, а затем разморозить и использовать.
Возможность хранить в жидком азоте целые живые организмы, а при необходимости размораживать их без всякого вреда высказана писателями-фантастами. Однако в реальности освоить эту технологию пока не удалось;
– в пищевой промышленности жидкий азот используется при розливе жидкостей для создания инертной среды в таре.
Вообще азот применяется в тех областях, где необходима газообразная среда без кислорода, например,
– в пожаротушении. Азот вытесняет кислород, без которого процессы горения не поддерживаются и огонь затухает.
Газообразный азот нашел применение в таких отраслях:
– производство продуктов питания. Азот используется как инертная газовая среда для сохранения свежести продуктов в упаковке;
– в нефтедобывающей промышленности и горном деле. Азотом продувают трубопроводы и резервуары, его нагнетают в шахты для формирования взрывобезопасной газовой среды;
– в самолетостроении азотом накачивают шины шасси.
Все вышесказанное относится к применению чистого азота, но не стоит забывать, что этот элемент является исходным сырьем для производства массы всевозможных соединений:
– аммиак. Чрезвычайно востребованное вещество с содержанием азота. Аммиак идет на производство удобрений, полимеров, соды, азотной кислоты. Сам по себе применяется в медицине, изготовлении холодильной техники;
– красители и т.д.

Азот – не только один из наиболее распространенных химических элементов, но и очень нужный компонент, применяемый во многих отраслях человеческой деятельности.
Азот в воде, пище и в организме человека
Описание презентации по отдельным слайдам:
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение Высшего образования «Саратовский аграрный университет имени Н.И. Вавилова» Финансово-технологический колледж Исследовательский проект: «Азот в воде, пище и в организме человека.» Выполнила работу Студентка 1 курса Специальность 19.02.08 Технология мяса и мясных продуктов Шенк В.В. Преподаватель Голубева Е.А. 2019, Саратов
В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный от углекислоты, не поддерживает горения и дыхания. Этот воздух он назвал «ядовитым воздухом». В том же году Пристли Дж. получив «ядовитый воздух» иным путем, назвал его «флогистированным» воздухом. В 1773 году К.В. Шиле установил, что воздух состоит из двух газов. Он назвал газ, не поддерживающий горения и дыхания «дурным» или «испорченным» воздухом. В 1776 г. Лавуазье, подробно исследуя «ядовитый», «флогистированный» и «дурной» воздух, установил тождество между ними. В 1787 г. Лавуазье предложил назвать этот газ «азотом» (от греч. Слова «а»- отрицание и «зоэ»-жизнь). История открытия азота:
Химические свойства азота
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода). Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87×1015 т. Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)×1015 т (причём в гумусе — порядка 6×1010т), а в мантии Земли — 1,3×1016 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов. Нахождение в природе
Жидкий азот применяется как хладагент и для криотерапии. Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре Применение азота
Опыт. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу нальем раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Сначала реакция идет медленно, затем ускоряется. Соберем выделяющийся азот в цилиндр. Это бесцветный газ, мало растворимый в воде. Горящая лучинка в атмосфере азота гаснет. Оставим цилиндр открытым, через некоторое время опять внесем зажженную лучинку в цилиндр. Лучинка продолжает гореть. Азот улетучился из цилиндра. Азот немного легче воздуха. NaNO2 + NH4Cl = NaCl + NH4NO2 NH4NO2 = N2 + 2H2O Оборудование: колба Вюрца, капельная воронка, газоотводная трубка, лучина, цилиндр стеклянный, кристаллизатор, стеклянная пластина, горелка, штатив. Практическая часть
Азот – жизненно важный элемент Основная часть молекулярного азота фиксируется биотическим путем (клубеньковые бактерии бобовых растений, сине-зеленые водоросли и др.) Азот в виде аммиака и соединений аммония окисляется до нитратов и нитритов (хорошо растворимых в воде). Затем попадают в Мировой океан, разлагаются и азот выделяется в атмосферу. Все основные части клеток тканей организма построены из белковых молекул, в состав которых входит азот. Заключение:
https://nsportal.ru/shkola/khimiya/library/2014/02/20/ https://videouroki.net/razrabotki/po-khimii-na-tiemu-azot.html https://nsportal.ru/shkola/khimiya/library/2017/08/25/azot https://yandex.ru/images/search?text=%20азот https://dpairgas.com.ua/?p=1217 Источники
Спасибо за внимание!
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
Онлайн-конференция для учителей, репетиторов и родителей
Формирование математических способностей у детей с разными образовательными потребностями с помощью ментальной арифметики и других современных методик
Международная дистанционная олимпиада Осень 2021
Номер материала: ДБ-988034
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Путин поручил актуализировать Концепцию психологической службы в школах
Время чтения: 1 минута
Екатерина Костылева из Тюменской области стала учителем года России – 2021
Время чтения: 1 минута
В пяти регионах России протестируют новую систему оплаты труда педагогов
Время чтения: 2 минуты
Московский международный салон образования начнется 6 октября
Время чтения: 1 минута
Минпросвещения не планирует массово закрывать школы из-за коронавируса
Время чтения: 1 минута
Минпросвещения опубликовало проект расписания сдачи ОГЭ и ЕГЭ в 2022 году
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Проектно-исследовательская работа по химии «Азот в нашей жизни»
В жизни человека важную роль играет азот. Например, азот входит в состав земной атмосферы в молекулярном виде, на него приходится 76% атмосферы по массе. В связанном состоянии элемент встречается в почве и воде в виде химических соединений. В живых организмах (растениях и животных) азот представлен в составе органических соединений, входит в аминокислоты в количестве от 15% до 18%. Так же азот используют: в металлургии, в лазерной резке металла, медицине и так далее. Целью работы является изучение полезных свойств азота.
Просмотр содержимого документа
«Проектно-исследовательская работа по химии «Азот в нашей жизни»»
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ШКОЛА № 59 «ПЕРСПЕКТИВА»
Проектно – исследовательская работа
Тема: «Азот в нашей жизни»
Выполнил учащийся 9В класса
Ф.И.О. Провоторов Василий Евгеньевич
Руководитель: Манаенкова Зоя Алексеевна
2. История открытия химического элемента азота…………………………………4
3. Физические свойства азота………………………………………………………..5
4. Химические свойства, строение молекулы………………………………………6
5. Способы получения азота (лабораторные и в промышленности)………………7
8. Библиографический список……………………………………………………. 10
В жизни человека важную роль играет азот. Например, азот входит в состав земной атмосферы в молекулярном виде, на него приходится 76% атмосферы по массе. В связанном состоянии элемент встречается в почве и воде в виде химических соединений. В живых организмах (растениях и животных) азот представлен в составе органических соединений, входит в аминокислоты в количестве от 15% до 18%. Так же азот используют: в металлургии, в лазерной резке металла, медицине и так далее. Целью работы является изучение полезных свойств азота.
Познакомиться с историей открытия такого химического элемента как азот.
Узнать о физических и химических свойствах азота и строении его молекулы.
Познакомится со способами получения азота
Исследовать полезное воздействие азотистых удобрений на рост растений.
Сделать вывод о пользе азота
Узнать больше информации об азоте
Изучить влияние азота на рост растений.
История открытия химического элемента азота
В 1772 году Генри Кавендиш провёл опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент), и описал его как мефитический воздух (от английского mephitic — ‘вредный’). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока, а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новый химический элемент — инертный газ – аргон.
Джозеф Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, также неверно истолковал полученные результаты — он решил, что выделил флогистированный воздух (то есть насыщенный флогистоном).
В сентябре 1772 года шотландский химик Даниэль Резерфорд опубликовал магистерскую диссертацию «О так называемом фиксируемом и мефитическом воздухе», в которой описал азот как вредный, ядовитый воздух и предположил, что это новый химический элемент, а также описал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Резерфорд также был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. Таким образом, чётко определить первооткрывателя азота невозможно
В то же время азот выделил Карл Шееле: летом 1772 года он получил азот по методу Кавендиша и исследовал его в течение пяти лет, затем опубликовал результаты своих исследований. В этой публикации Шееле первым описал воздух как смесь отдельных газов: «огненного воздуха» (кислорода) и «грязного воздуха» (азота). Из-за того, что Шееле задержался с публикацией своих исследований, до сих пор идут споры о первооткрывателе азота.
При нормальных условиях азот — это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100 г при 0 °C, 1,5 мл/100 г при 20 °C, 1,1 мл/100 г при 40 °C, 0,5 мл/100 г при 80 °C). Плотность азота составляет 1,2506 кг/м³ (при нормальных условиях).

Химические свойства, строение молекулы
Диссоциация молекул азота при нормальных условиях практически не происходит. Молекула азота неполярная и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен.
Даже при 3000 °C степень термической диссоциации N2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N2. В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разрежении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов, например, с ртутью.
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны (многие галогениды, азиды, оксиды), соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
В электрическом разряде реагирует с кислородом, образуя оксид азота(II) NO.
Описано несколько десятков комплексов с молекулярным азотом в науке.
Способы получения азота
Реакция внутримолекулярного окисления-восстановления при нагревании смеси растворов нитрита натрия и хлорида аммония при 80 °С:
Образующийся азот может быть загрязнен примесями оксида азота (II) и азотной кислоты, для удаления которых газ пропускают через подкисленный раствор бихромата калия.
Твердый нитрит аммония разлагается с взрывом:
Реакции окисления аммиака:
Реакции взаимодействия металлов с азотной кислотой:
Термическое разложение азида лития:
Чистый азот в промышленности наряду с кислородом и другими газами получают фракционной перегонкой жидкого воздуха. Этот процесс включает три стадии. На первой стадии из воздуха удаляют частицы пыли, пары воды и углекислый газ. Затем воздух сжижают, охлаждая его и сжимая до высоких давлений. На третьей стадии фракционной перегонкой жидкого воздуха разделяют азот, кислород и аргон. Первым отгоняется азот, затем кислород.
Для начала опыта я приобрёл:
1 кг карбамида (мочевины)
семена перца (красного, декоративного)
одноразовые стаканчики (тара)
Перцы предпочитают легкую рыхлую землю, имеющую пористую структуру. Грунт такого типа обеспечивает доступ влаги и воздуха. Для развития растений важно содержание в почве микроэлементов (азот, калий, фосфор, железо) и полезной микрофлоры. Поэтому я приобрёл грунт со всеми выше описанными микроэлементами.
Я взял два одноразовых пластиковых стакана, засыпал их грунтом, посадил семена перца. На первый стаканчик я приклеил надпись с номером 1, а на второй с номером 2. Таким образом, имею два стакана, засаженные семенами перца, №1 и №2. Растения в ёмкостях содержатся в одинаковых условиях ухода: в комнате, которая периодически проветривается, есть солнечный свет, растения поливаются с одинаковым интервалом отстоянной водой комнатной температуры и раствором при подкормках. Но в стакан №1 я не вносил удобрения, а в стакане №2 производил регулярные подкормки азотным удобрением, карбамидом (мочевиной).
Когда появляются первые всходы, то выполняется их обработка мочевиной. Для этого требуется водный раствор, содержащий мочевину (2,25 гр/л) Пульверизатором распыляют раствор на листья, а с помощью лейки в почву. Первая подкормка выполняется при появлении у перцев второго листа. Через 2 недели выполняется вторая подкормка, когда перцы выпустят по третьему листу.
Мочевины на овощные культуры (малую рассаду) приблизительно 15 г/10 л. Составив пропорцию (см приложение 3), я подсчитал, что на 1.5 л нужно 2,25 г карбамида.
Итак, я засыпал грунтом и посадил в оба стаканчика по семечку перца, полил.
Растение во втором стаканчике взошло быстрее, ведь польза азотного удобрения состоит в том, что удобряемое растение быстрее растёт и быстрее даёт плоды, ведь азот активизирует все важные обменные процессы, такие как синтез хлорофилла или усвоение витаминов, а так же влияет на метаболизм и является строительным материалом для формирования нуклеиновых кислот и других соединений.


В данной работе я познакомился с таким химическим элементом как азот, узнал о его физических и химических свойствах, узнал об истории его открытия.
По полученной информации я решил на опыте раскрыть полезное воздействие на рост растений азота, входящего в состав азотистых удобрений, и результат оправдал мои ожидания.
Из всей проделанной работы я узнал о способах получения азота, как в лаборатории, так и в промышленности, а так же раскрыл полезное свойство азота в удобрении.
О. С. Габриелян, “Химия 8 класс”, 2007 год, ООО “Дрофа”. 127018, Москва, Сущевский вал, 49.
А. А. Журин, “Химия 9 класс”, 2017 год, Акционерное общество “Издательство “Просвещение”. 127521, Москва, 3-й проезд Марьиной рощи, 41.
Одиссея азота
Азот — один из важнейших лимитирующих факторов жизни на Земле
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Живые организмы состоят всего из шести основных химических элементов: кислорода, углерода, водорода, азота, кальция и фосфора. В этой статье речь пойдет об элементе, стоящем на четвертом месте по массе в живых организмах — азоте. Всего азота в нашем организме около одного килограмма. Но какое большое значение имеет этот жалкий килограмм! Азот входит в состав аминокислот, азотистых оснований (образующих нуклеотиды), хлорофилла, гемоглобина и пр. Аминокислоты входят в состав белков, которые исполняют в клетке ферментативные функции, нуклеотиды составляют ДНК, а про значение гемоглобина и хлорофилла и говорить нечего!
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Что вообще такое азот? На Земле азот представлен своим двухатомным соединением в виде газа (N2) и составляет добрых 76% объема нашей атмосферы. Но, как это ни странно, живым организмам азот достается не так уж и просто. В чем же проблема? Она заключается в тройной ковалентной связи между двумя атомами азота, благодаря которой в нормальных земных условиях азот, можно сказать, инертный газ. Но давайте разбираться, как, откуда и зачем этот азот нам сдался.
Сценарий азота в жизни
Люди получают азот вместе с пищей, где он содержится в аминокислотах. Однако человек и большинство животных не могут сами синтезировать все необходимые аминокислоты. Часть из них (называемая незаменимыми аминокислотами) должна поступать вместе с пищей. И только автотрофным организмам (таким как растения и многие микроорганизмы) дано синтезировать органику из минеральных веществ. Но и им для этого требуется исходный материал.
Итак, перейдем к проблеме с азотом. Когда автотрофным организмам требуется «сырье», они берут его из окружающей среды (на то они и авто-). Но, как известно, у любого колодца есть дно, да и кушать-то всем хочется. Поэтому азотистые соединения из почвы уходят на ура. Но ведь мир растений как-то существовал и до появления и применения удобрений, которые сейчас используют для устранения дефицита азота. Всю идиллию разрушила (как обычно) человеческая цивилизация. Она всё росла и росла, из-за чего пришлось начать заниматься земледелием. Теперь надо было сажать и снимать урожай с одной и той же территории год за годом, из-за чего почва истощалась, ведь никто не возвращал ей минеральных веществ, отданных с урожаем. Перестало образовываться достаточное количество гумуса, из-за чего почвы становились не такими плодородными. Тогда-то люди и поняли, что пора что-то менять. В почву стали вносить удобрения в виде ила (добытого из Нила) или помета животных.
Но цивилизация не стоит на месте, да и удобрения тоже. Так вот. Азотистые соединения. В природе азот фиксируется био- и абиогенным путями (табл. 1). Биогенный способ фиксации азота осуществляется с помощью бактерий; абиогенный — во время грозы, когда на месте удара молнии температура может достигать 25 000 °С, в результате чего образуются оксиды азота. Далее они взаимодействуют с водой и образуют азотистую/азотную кислоту, которая потом прореагирует с солью и образует нитрат или же нитрит какого-либо металла. Но в современном мире этих двух пассивных способов не хватает.
Так в 1901 году был зарегистрирован патент на синтез аммиака из азота и водорода. Этот процесс был назван процессом Габера-Боша: N2 + 3H2 = 2NH3, он проходит при высоких температурах (около 500 °С), высоком давлении (до 1000 атм.) и наличии катализатора. В дальнейшем аммиак используют для получения оксидов азота, синильной кислоты и т.д. Что удивительно, этот «синтетический» процесс на 64% более выгоден по сравнению с биогенным. Так, например, клубеньковым бактериям для синтеза 1,1 грамма азота требуется окислить 10 граммов (!) глюкозы [1].
Как уже было сказано выше, азот — лимитирующий элемент всей жизни на Земле. Ежегодно около 2% всей вырабатываемой человечеством электроэнергии тратится на процесс Габера-Боша для создания азотных удобрений [1]!
| Тип фиксации | N2 фиксировано, млн. тонн в год |
|---|---|
| Абиотический | |
| Азотистые удобрения | 50 |
| Окисление в почве | 20 |
| Грозы | 10 |
| ВСЕГО | 80 |
| Биотический | |
| Агрокультуры | 90 |
| Леса и дикие растения | 50 |
| Море | 35 |
| ВСЕГО | 175 |
| Итого в мире | 255 |
Итак, перейдем к рассмотрению процессов, протекающих у прокариот для столь ресурсоемкой фиксации азота. Для начала стоит заметить, что существует всего несколько родов бактерий, фиксирующих атмосферный азот и выделяющих аммиак в окружающую среду (табл. 2). Всё это — клубеньковые бактерии, симбионты некоторых растений. Они и только они благодаря симбиотическим связям могут позволить себе такую роскошь, как постоянный синтез аммиака. У свободноживущих бактерий образование NH3 при участии специального фермента сопряжено с процессами клеточного биосинтеза, и аммиак практически не выделяется в окружающую среду. При наличии в окружающей среде связанного азота, например, в форме NH3 или NO2, которые могут служить источником этого элемента для ростовых процессов в клетке, гены, отвечающие за выработку фермента-фиксатора, «выключаются», и азот перестает синтезироваться.
| Свободноживущие | Симбионты растений | ||
|---|---|---|---|
| Аэробы | Анаэробы | Бобовые | Другие растения |
| Азотобактер Клебсиеллы(нек.) Цианобактерии | Клостридии Пурпурные серобактерии Пурпурные несерные бактерии Зелёные серобактерии | Клубеньковые бактерии | Франкии Азоспириллы |
Нитрогеназа, или как это сделано
Для биологической фиксации азота клетке необходимы:
Общая формула восстановления азота до аммиака выглядит следующим образом:
N2 + 8H + + 8e − + 16Mg·АТФ = 2NH3 + H2 + 16Mg·АДФ + 16Фн
Формула формулой, но давайте разбираться, как все происходит в жизни:
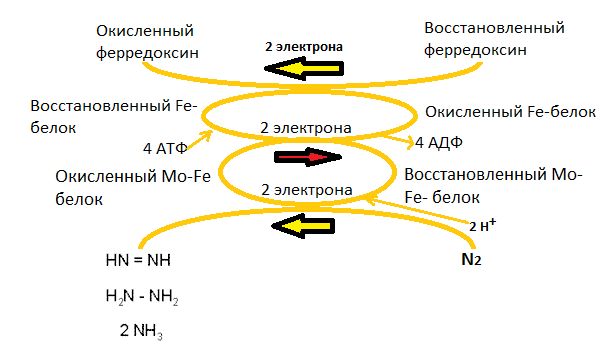
Хотя механизм фиксации азота нитрогеназой изучен пока недостаточно, есть основания полагать, что белок, содержащий молибден (Mo-Fe-белок), реагирует с потенциальными субстратами нитрогеназы, т.е. N2 и C2H2 (нитрогеназа без разбору восстанавливает все соединения с тройной связью), путем взаимодействия восстанавливаемого субстрата с атомами молибдена белка. Fe-бeлок с меньшей молекулярной массой связывает АТФ в виде мономагниевой соли и становится более мощным восстановителем, принимая электроны от физиологической электрон-донорной системы (рис. 1). Находясь в таком восстановленном состоянии, Fе-белок доводит до наиболее восстановленного состояния Mo-Fe-белок. Схематически процесс фиксации включает восстановление атомов Fe в железосодержащем белке с меньшей молекулярной массой, вследствие чего АТФ гидролизуется с образованием АДФ и фосфата (Фн). Электроны атомов железа в Mo-Fe-белке используется затем для восстановления связанного с азотом субстрата. Должно произойти несколько таких переносов электронов, прежде чем фермент высвободит конечный восстановленный продукт (NН3, если субстратом служит N2). При каждом переносе электрона от Fe-белка на Mo-Fe-бeлок АТФ гидролизуется до АДФ [2], [3]. Общая схема этого процесса восстановления показана на рисунке 1.
Рисунок 1. Донором электрона в реакции служит восстановленный ферредоксин. Электрон с затратой энергии АТФ переносится Fe-белком с донора на Mo-Fe-белок, который, в свою очередь, трижды отдает пару электронов двум атомам азота, восстанавливая связанную в активном центре молекулу N2 до двух NH3 через следующие стадии: азот → диамин → гидразин → аммиак.
Как известно, вечных двигателей не бывает. Так же и с нитрогеназой. При условиях, оптимальных для фиксации азота, только 75% доступных электронов действительно используются для этой цели. Остальные 25% расходуются на восстановление протонов до водорода в АТФ-зависимом процессе, катализируемом нитрогеназой, который, как и процесс восстановления азота, нуждается в Mg 2+ и восстановителе. Многие азотфиксирующие бактерии не могут избежать этой продуцирующей водород побочной реакции, которая и является причиной низкой эффективности фиксации азота этими клетками, ведь на восстановление протонов АТФ тратится впустую, а это до трети энергии, протекающей через нитрогеназу.
Как видно, нитрогеназа — очень невыгодный белок. Но нам известны целые семейства растений, которые принимают азотфиксирующих бактерий в качестве симбионтов. Давайте разберемся, как им удается делать это.
Проникновенные отношения
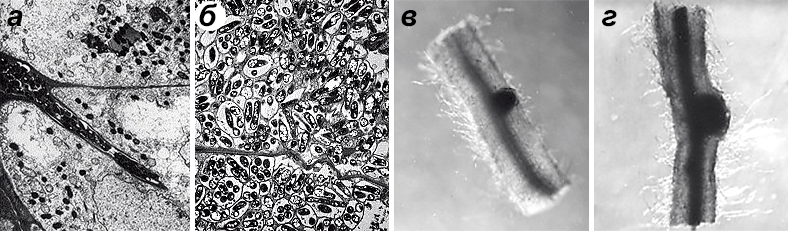
Заселение клеток корня растения-хозяина происходит после того, как корень натолкнется на симбиотических бактерий, оставшихся в почве с прошлого вегетационного периода. Бактерии подползают к корням, после чего разрушают клеточные стенки растения с помощью фермента пектиназы и размещаются в вакуолях (рис. 2). В результате растительная клетка оказывается переполненной бактериями, которые затем прекращают делиться, увеличиваются в размерах почти в 40 раз и одновременно изменяют свое строение и функцию, превращаясь в бактероиды, богатые нитрогеназой. Одновременно с вторжением бактерий в клетки растения-хозяина начинается активное деление инфицированной клетки и нескольких слоев соседних неинфицированных клеток. Это способствует распространению бактерий и приводит к образованию корневых клубеньков, столь характерных для этой симбиотической ассоциации.
Рисунок 2. Вторжение бактерий в клетки растения-хозяина. а — Бактерии проникли внутрь клеток корня растения. б — Образовавшиеся в корневых клетках бактероиды. в — Деление клеток, инфицированных бактериями-симбионтами. г — Рост клубенька.
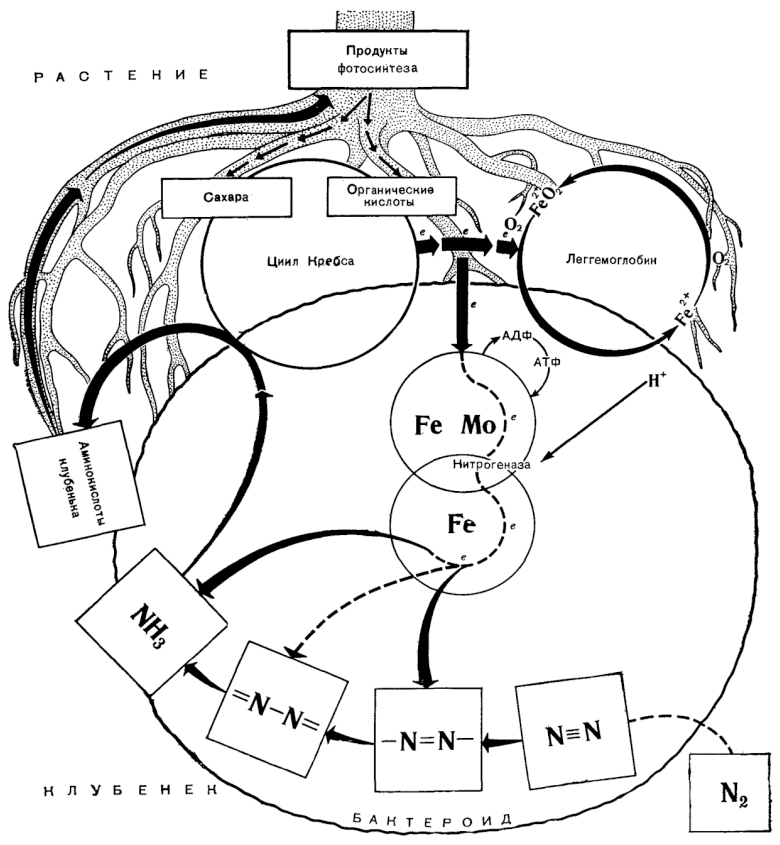
Внутренняя часть инфицированных и неинфицированных клеток клубенька окружена слоем незараженных клеток хозяина. Инфицированные клетки внутренней зоны зрелого корневого клубенька содержат один или несколько бактероидов (в зависимости от растения-хозяина), окруженных мембранной оболочкой, в которой, по-видимому, локализован красный пигментный белок — леггемоглобин, обусловливающий характерное окрашивание клубеньков, активно фиксирующих азот (рис. 3). Леггемоглобин образуется только в фиксирующих азот клубеньках и внутри таких клубеньков локализован только в инфицированных клетках, где составляет 25–30% всего растворимого белка клетки. По своим свойствам леггемоглобин сходен с миоглобином (мышечным белком, вероятной функцией которого является содействие диффузии кислорода в ткани и, возможно, «запасание» кислорода). Функции леггемоглобина в процессе фиксации азота будут рассмотрены позже.
Рисунок 3. Схематичное изображение симбиотических связей клубенькового растения.
Чтобы симбиотическая система могла фиксировать азот, она должна удовлетворять трем обязательным требованиям:
При выполнении этих условий фиксация азота будет продолжаться в течение всего жизненного цикла растения, обычно до формирования семян, когда клубеньки стареют, и фиксация азота прекращается. Некоторые бактероиды утрачивают способность к дальнейшему размножению, однако остальные сохраняют жизнеспособность, и после старения и отмирания растения-хозяина живут в почве до начала нового вегетационного периода [3].
Кислородный искуситель
Фермент нитрогеназа необратимо разрушается при контакте с кислородом, и поэтому микроорганизмы, фиксирующие азот на планете, атмосфера которой содержит аж 20% кислорода, нашли различные способы исключить его из зоны фиксации азота. Такая адаптация не понадобилась лишь облигатным анаэробам, которые решили эту проблему радикальным способом.
Клубеньковые вывернулись с помощью леггемоглобина, который обладает очень высоким сродством к кислороду. Бактерии-симбионты получают этот элемент в концентрации, безопасной для их нитрогеназы: кислород не накапливается в больших количествах, однако его достаточно для обеспечения дыхательного метаболизма бактерий.
Но помимо клубеньков, существуют и свободноживущие ассоциации бактерий. И им тоже надо защищать свою любимицу от «плохого» кислорода. Для этого природа придумала три способа защиты:
Синтез жизни
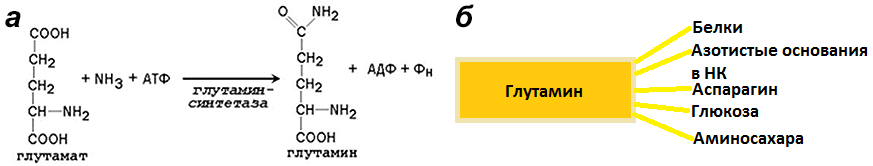
Хорошо, растение добыло себе аммиак, а что дальше? Дальше он включается в реакции синтеза аминокислот. Так из аспарагиновой кислоты синтезируется аспарагин, из глутамата — глутамин (рис. 4). В виде глутамина азот доставляется ко всем клеткам организма, где используется для синтеза азотсодержащих органических соединений [5].
Рисунок 4. Глутамин. а — Реакция превращения глутамата в глутамин. б — Функции глутамина.
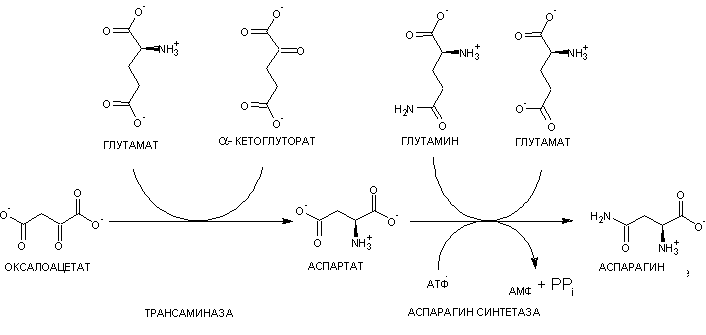
Аспарагин также синтезируется с участием аммиака (рис. 5) [6].
Рисунок 5. Реакции, проходящие у живых организмов для синтеза аспарагина — важного нейромедиатора. Оксалоацетат — название щавелевоуксусной кислоты (ЩУК). Тут она служит каркасом будущей аминокислоты. С глутамата «снимается» азот, в результате чего глутамат превращается в альфа-кетоглутарат, а аммиак переносится на ЩУК. Образуется аспартат, на который далее переносится H2N, и с затратой АТФ аспартат превращается в аспарагин.
Аспарагин — это очень распространенная заменимая аминокислота, которая включена в состав почти всех белков живых организмов. Глутамин также является «популярной» аминокислотой: в организмах животных с помощью него аммиак выводится из организма или используется повторно.
Побочные ветви цикла азота
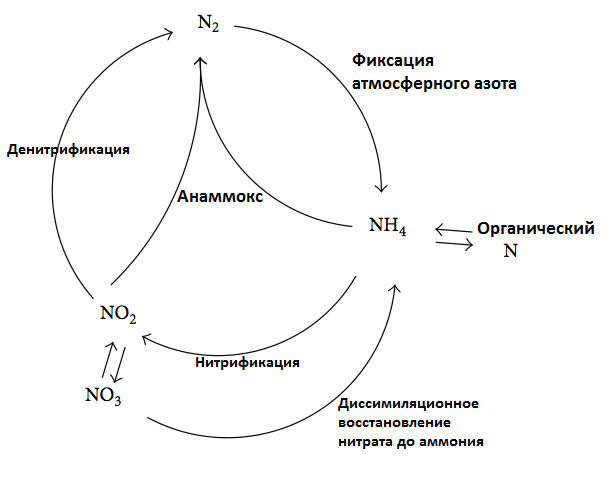
Мы полностью разобрали первую стадию цикла азота в природе (рис. 6) — стадию фиксации азота. Но если бы азот только фиксировался, он давно бы ушел из нашей атмосферы и отложился в виде органики. Несложно понять, что такого в действительности не происходит. Фиксацию азота компенсируют бактерии-денитрификаторы. Они занимаются восстановлением оксида азота до азота и кислорода. Но и до того, как уйти в атмосферу, азот должен «подготовиться». Из аммиака, в который азот перешел после фиксации, он должен превратиться в азотную кислоту (нитрат), пройдя при этом долгий путь через цитоплазмы бактерий нескольких видов, и только потом уплыть в воздушный океан Земли. Начальным этапом этого «подготовительного» процесса является нитрификация.
Рисунок 6. Цикл азота в природе.
Нитрификация — это процесс окисления аммиака до азотистой кислоты, а далее ее окисление до азотной. Сначала аммиак присваивается нитрозными бактериями, которые окисляют аммиак в три стадии:
Далее образованную азотистую кислоту перехватывают нитратные бактерии, которые доокисляют ее до азотной кислоты в ходе одной реакции:
Двумя этими процессами в почве (или водоеме) заняты различные бактерии. Но все они — хемолитоавтотрофы, то есть получают энергию при окислении аммиака и используют ее для окисления углекислого газа [7].
Только после того, как почвенные бактерии осуществили перечисленные выше процессы, в цикл могут включиться бактерии-денитрификаторы. В их цитоплазмах проходят следующие превращения:
Микробиологическая денитрификация в почве вызывает потерю зафиксированного в солях азота. Это очень распространенное в природе явление, в ходе которого каждый год в атмосферу Земли возвращается 270–330 млн. тонн азота. Поэтому часто денитрификацию рассматривают как невыгодный человечеству процесс и пытаются его избежать. Сами денитрификаторы получают почти 70% энергии, которую они получили бы при проведении реакций аэробного метаболизма. Отлично устроились.
Но, согласитесь, должна же быть у нитрифицирующих бактерий хоть какая-нибудь конкуренция. И, конечно, природа не преминула ее создать. Такие бактерии идут в обход нитрификации и денитрификации. В их цитоплазмах протекает гениально примитивная реакция:
Эта примитивная, но действенная реакция получила название анаммокс (рис. 7). В масштабах планеты этот процесс дает начало 30–50% азота, образующегося в океанах. Анаммокс представляет большой интерес для биотехнологов, так как промежуточным продуктом этой реакции является гидразин — ядовитое вещество, применяемое как топливо для ракет. Также бактерий, осуществляющих аноммокс, используют для освобождения водоемов от излишков аммиака [8].
Рисунок 7. Цикл азота в природе с учетом анаммокса. Диссимиляционное восстановление нитрата до аммония — такое «пафосное» название гниения.
Осталось разобрать последнюю ветвь цикла азота. Это гниение. Автотроф, потребляющий нитраты, рано или поздно погибнет. Тут-то в игру включатся различные бактерии-аммонификаторы. Они будут заниматься разложением сначала белков, а затем аминокислот.
Первая стадия разложения белков — гидролиз. Он осуществляется как микробными, так и собственными ферментами клеток погибшего организма, высвобождаемыми из лизосом в результате смерти клеток (аутолиз). Белки распадаются на аминокислоты, которые, в свою очередь, дезаминируются, в результате образуя аммоний и углекислый газ.
Вот так, например, происходит анаэробная аммонификация у некоторых представителей бактериального семейства клостридий:
На этом мы завершили рассмотрение цикла азота, и можно смело перейти к рассмотрению организмов, азот фиксирующих [9].
Бактериальные собственники
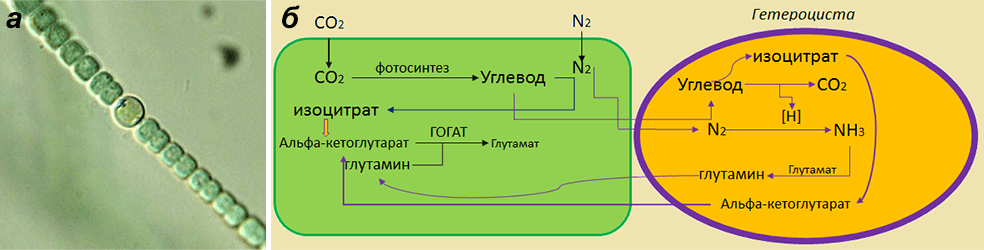
Не стоит думать, что только клубеньковые растения могут иметь бактерий-симбионтов, которые будут усваивать им азот. Неужели эволюция могла остановиться на каком-то жалком клубеньке? Конечно, нет. Так, например, нитчатые цианобактерии «заставляют» заниматься фиксацией азота одну или несколько клеток в своем звене. Этих отщепенцев они образуют только при недостатке азотных соединений в окружающей среде. Клетка такого типа имеет специальное название — гетероциста (рис. 8). В колонии она повторяется через каждые 9–15 клеток. Каждая гетероциста обладает следующими отличиями от остальных клеток в колонии:
Рисунок 8. Гетероциста. а — гетероциста в составе нитчатой водоросли; б — схематическое изображение процессов, протекающих в гетероцисте. В гетероцисте молекулярный азот с помощью нитрогеназы переводится в аммиак, затем при участии глутамин-синтазы аммоний с глутаматом превращаются в глутамин. Поскольку глутамат-синтаза (ГОГАТ) находится, в основном, в вегетативных клетках, образованный глутамин передается туда из гетероцист и посредством ГОГАТ превращается в глутамат. Глутамат поступает из вегетативной клетки обратно в гетероцисту, и цикл замыкается. Из глутамата и глутамина образуются остальные аминокислоты в вегетативных клетках. Связанный азот запасается в гранулах в виде аргинина и аспартата. Усваиваемый атмосферный углерод при фотосинтезе в вегетативных клетках переходит в органическую форму — глюкозу, которая может метаболизироваться до пирувата, а тот в изоцитрат в цикле Кребса. Углевод (глюкоза/сахароза), поступая в гетероцисту, окисляется в пентозофосфатном цикле до углекислоты. При этом образуются протоны и электроны, необходимые для синтеза аммония из молекулярного азота. В гетероцистах обнаружена инвертаза, разлагающая сахарозу на глюкозу и фруктозу. Изоцитрат с помощью изоцитратдегидрогеназы преобразуется в α-кетоглутарат.
сайт lasso.wikispaces.com (рисунок а)
Азотфиксирующих симбионтов имеют не только вышеперечисленные зеленые «овощи». Относительно недавно было выяснено, что азот фиксируют симбиотические симбионты термитов. Да-да, именно симбиотические симбионты! Видите ли, термиты питаются исключительно древесиной (целлюлозой), и для ее переваривания им нужна помощь. Она приходит в виде многожгутиковых простейших — гипермастигин. Но они, по сути, являются посредниками: внутри них живут бактерии, которые и занимаются расщеплением целлюлозы до глюкозы. Но где же тут про азот? Оказалось, эти бактерии еще и фиксируют азот, который так необходим термитам, питающимся бедной азотом древесиной [10].
Итак, в этой статье хоть и поверхностно, но охвачены все аспекты цикла азота, которые известны науке на сегодняшний день. Может быть, вскоре мы научимся использовать процессы, протекающие в бактериях, для чистой добычи азотных соединений, ведь у них огромный для этого потенциал. Надеюсь, что эта статья заинтересовала вас. Спасибо за прочтение!