Бактериальный понос чем лечить
Бактериальный понос чем лечить
Диарею инфекционного происхождения наблюдают достаточно часто. Она приводит к значительным экономическим потерям, связанным с временной нетрудоспособностью работников. Эта патология — одна из частых причин смерти детей в возрасте до пяти лет. Защита кишечника от патогенных микроорганизмов осуществляется при помощи желудочного сока, солей жёлчных кислот, иммунных факторов слизистой оболочки, а также веществ, выделяемых нормальной микрофлорой.
Заражение происходит посредством фекально-орального механизма, при употреблении контаминированной еды и воды. Для возникновения инфекции бывает достаточно всего десяти возбудителей (Shigella). Употребление некоторых продуктов питания (молока) или приём лекарственных препаратов (блокаторов Н2-рецепторов гистамина и ингибиторов протонного насоса) способствует снижению защитных свойств желудочного сока.
Бактерии попадают в пищу от инфицированных животных, а также в связи с несоблюдением санитарных норм на скотобойнях и при продаже мяса. Яйца инфицированных сальмонеллой кур также могут быть заражены бактериями. Неправильное хранение и приготовление пищи способствует выживанию и размножению микроорганизмов.
Передача инфекции облегчается в условиях антисанитарии, войн или миграции беженцев. В такой ситуации заболевание распространяется достаточно быстро и характеризуется высокой смертностью. Холера способна к быстрому распространению на территориях многих стран и континентов (пандемия).
Диарея путешественников обычно развивается не позднее 72 ч прибытия в новую страну. Наиболее высок риск развития заболевания в странах Латинской Америки, Африки и Азии. Жидкий водянистый стул наблюдают 2—4 раза в день, при этом кровь и слизь в кале обычно отсутствуют. В большинстве случаев причиной диареи становятся энтеротоксигенные и энтероадгезивные штаммы Escherichia coli.
Основную роль в лечении играет восстановление водно-электролитного баланса в организме, а также назначение антибактериальных препаратов (ко-тримоксазол или ципрофлоксацин).
Диарея, вызванная С. difficile, — одна из самых распространённых внутрибольничных инфекций.
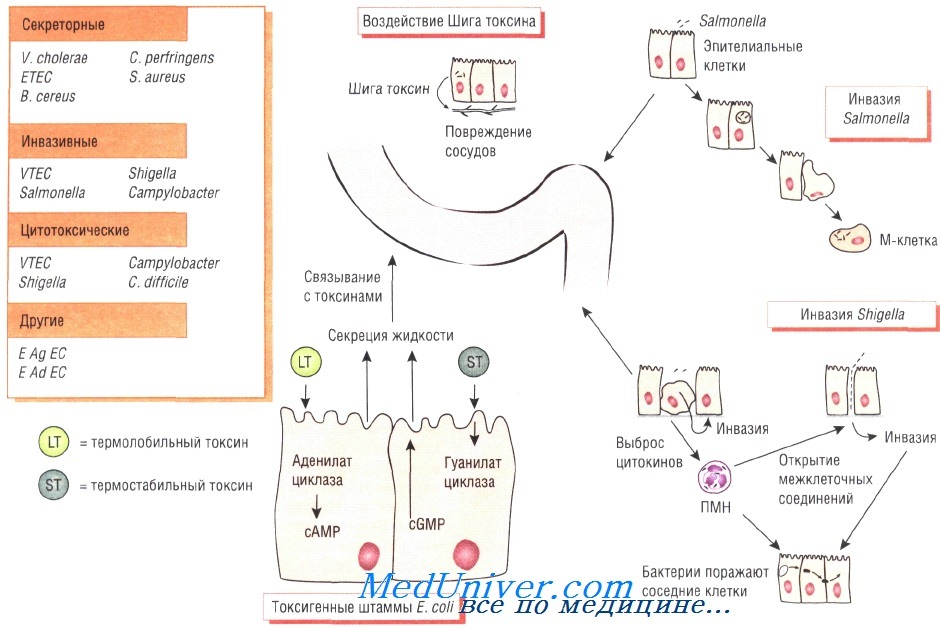
Патогенез бактериальной диареи
Симптомы инфекционной диареи обусловлены определёнными патофизиологическими механизмами, например токсической дисрегуляцией клеток кишечника, приводящей к повышению секреции жидкости или поражению кишечной стенки с последующим разрушением клеток.
Секреторная диарея характеризуется нечастым обильным стулом, возникающим в результате нарушения всасывающей способности кишечника. При дизентерии (шигеллёз) отмечают частый жидкий стул с примесью крови, что связано с расстройством функций кишечника вследствие воспалительного процесса.
Энтерогеморрагические штаммы Е. coli продуцируют Шига токсин, вызывающий кровавый понос и гемолитико-уремический синдром (причина почечной недостаточности у детей). Чаще всего выделяют серотип 0157:Н7. Мишенью для токсина служит эндотелий капилляров.
Клинические признаки бактериальной диареи (поноса)
Хотя термин «диарея» и может быть определён как увеличение частоты стула, но это весьма субъективный симптом. При этом отмечают как частый скудный жидкий (характерный признак инфекции толстой кишки), так и нечастый обильный стул (симптом поражения тонкой кишки). При поражении слизистой оболочки кишечника в кале обнаруживают примесь крови, а при нарушении всасывания — жирный стул с неприятным запахом.
Во время диареи достаточно быстро может происходить обезвоживание организма и нарушение электролитного баланса, представляющее серьёзную угрозу жизни пациента (например, при холере). Диарея иногда сопровождается спастическими болями в животе (при инфекции, вызванной представителями рода Campylobacter и Shigella), напоминающими острую хирургическую патологию (острый живот, аппендицит). Температура при диарее повышается не всегда.
В некоторых случаях при сальмонеллёзе развивается септицемия, редко наблюдающаяся при других бактериальных кишечных инфекциях. При кампилобактериозе возможна транзиторная бактериемия. Энтеротоксигенный штамм Escherichia coli 0157 вызывает геморрагический колит, осложняющийся впоследствии почечной недостаточностью и гемолитико-уремическим синдромом.
Снижение уровня кишечной лактазы приводит к развитию вторичной лактозной недостаточности и длительной диарее. Эти нарушения продолжаются в течение нескольких недель, а затем внезапно исчезают. Серьёзные трудности при лечении кишечных инфекций возникают у пациентов со сниженным иммунитетом. При недостаточности IgA часто развивается лямблиоз, а при слабом Т-клеточном иммунитете — сальмонеллёз и криптоспоридиоз.
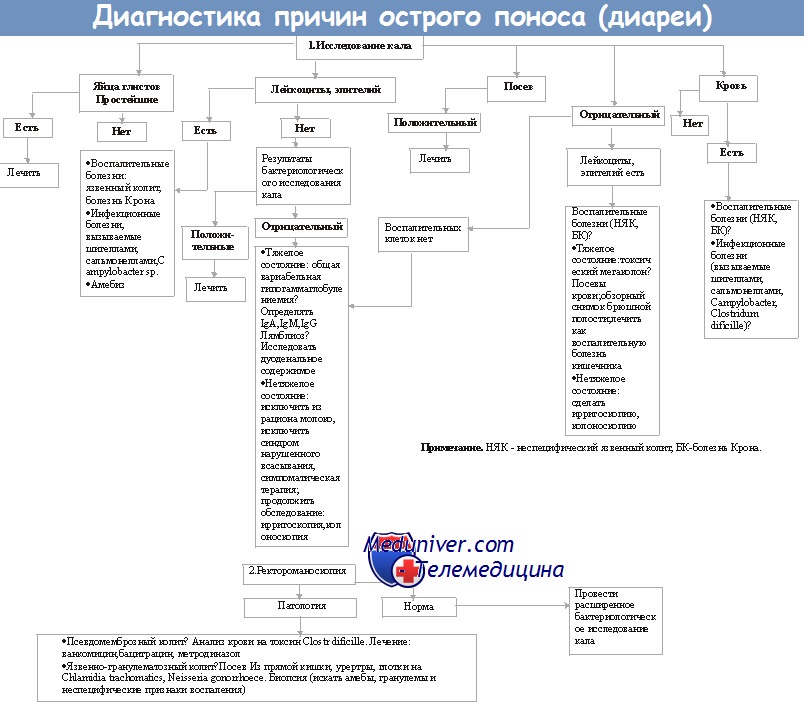
Диагностика причины диареи (поноса)
Для обнаружения простейших (например, Giardia lamblia) необходимо провести микроскопию образцов кала, а для идентификации микроспоридий и Cryptosporidium parvum — исследование мазков, окрашенных по Цилю—Нильсену.
Для выращивания патогенных микроорганизмов применяют селективные питательные среды, подавляющие рост непатогенной микрофлоры (например, сорбитолсодержащая среда МакКонки для культивирования штаммов Е. coli 0157, секретирующих веротоксин). Для выделения бактерий рода Campylobacter используют среды с содержанием определённых антибиотиков и (или) осуществляют культивирование при температуре 43 °С.
При подозрении на холеру образцы кала помещают в щелочной пептонный бульон (высокий уровень рН создаёт преимущества для роста Vibrio cholerae). Затем культура может быть пересеяна на специфические питательные среды с высоким значением рН, содержащие соли жёлчных кислот. Разработанную для определения вышеуказанных возбудителей сложную систему молекулярно-генетического метода пока не используют в повседневной клинической практике.
При эпидемиологических расследованиях определяют серотипы микроорганизмов. Когда микроорганизм имеет только один серотип (например, Shigella sonnet), в дальнейшем проводят уже молекулярное типирование для подтверждения вспышки заболевания.
Вирусы можно обнаружить с помощью прямой электронной микроскопии, выделения чистой культуры, молекулярногенетического метода и ИФА.
Токсины также могут быть определены в кале больного (например, токсины Clostridium difficile).
Лечение бактериальной диареи (поноса)
Лечение включает проведение адекватной регидратации и восстановление электролитного баланса. Несмотря на то что при секреторной диарее происходит выведение большого объёма жидкости, всё же абсорбция жидкости в кишечнике сохраняется.
Для оральной регидратации, проведение которой способствует заметному снижению смертности пациентов, обычно используют растворы, содержащие натрий (150—155 ммоль/л) и глюкозу (200—220 ммоль/л). Проведение внутривенной регидратации требуется достаточно редко.
Препараты, снижающие моторику кишечника, малоэффективны и, более того, могут быть опасны при назначении маленьким детям. Для уменьшения длительности заболевания при холере и тяжёлой водянистой диарее применяют антибиотики (тетрациклин или ципрофлоксацин).
Лечение тяжёлых форм дизентерии и сальмонеллёза включает назначение ципрофлоксацина или ко-тримоксазола. При развитии почечной недостаточности и гемолитико-уремического синдрома вследствие инфекции, вызванной Е. coli О157, необходимо лечение в условиях стационара.
Профилактика бактериальной диареи (поноса):
• Использование безопасных источников водоснабжения (отсутствие фекального загрязнения от животных и людей).
• Предотвращение попадания патогенных кишечных микроорганизмов от животных в пищевые продукты.
• Тщательная термическая обработка пищи.
• Хранение пищевых продуктов при низкой температуре (для предотвращения размножения возбудителей).
• Раздельное хранение готовой и сырой пищи для исключения перекрёстной контаминации (особенно важно для предприятий общественного питания, где единичное нарушение санитарно-гигиенических норм может привести к массовой вспышке заболевания).
• Тщательный выбор источников пищи и воды для профилактики диареи путешественников.
• Для создания кратковременного иммунитета применяют лицензированные вакцины для профилактики холеры (обладает коротким протективным эффектом) и брюшного тифа. В настоящее время используются 3 парентеральные инактивированные корпускулярные вакцины против брюшного тифа: термоинактивированная (феноловая), сухая, инактивированная ацетоном, и очищенная, содержащая Vi-полисахарид, а также для орального введения — Ту21а-вакцина.
Кроме того, разрабатываются новые (генно-инженерные или рекомбинантные) вакцины, например вакцина, содержащая Vi-антиген, которая во время испытаний продемонстрировала высокую иммуногенность, и живая аттенуированная вакцина (находится на ранней стадии исследования).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение кишечной инфекции: ничего лишнего!
Поделиться:
Летом проблема отравлений становится как никогда актуальной — жара создает благоприятные условия для размножения возбудителей заболевания. Какие же лекарства действительно помогают с минимальными последствиями выйти из неприятного состояния?
Для четкого представления о том, как работают (или не работают) лекарства при отравлениях, нужно понимать, что происходит с отравившимся организмом. В подавляющем большинстве случаев бактерии, а уж тем более паразиты совершенно ни при чем!
В основном кишечная инфекция развивается на фоне заражения вирусами: они несут ответственность за 70 % случаев инфекционной диареи у детей и почти 90 % — у взрослых.
Проникновение в организм возбудителей кишечной инфекции сопровождается выделением большого количества токсинов, которые и вызывают характерные симптомы. При этом воспаляется слизистая оболочка желудка и кишечника — развивается гастроэнтерит.
Однако, несмотря на порой мучительные проявления отравления, его возбудители обречены: все кишечные инфекции являются самоограниченными, т. е. бактерии или вирусы, их вызвавшие, погибают не потому, что на них воздействуют лекарствами, а потому что так задумано природой. В этом отношении почти любая кишечная инфекция сродни ОРВИ — лечи не лечи, а все равно выздоровеешь не раньше, чем достигнет конца своего развития возбудитель. И, к счастью, его век недолог: в течение 1–7 дней после манифестации заболевания, как правило, наступает выздоровление.

Мы привыкли глотать горсти таблеток по поводу и даже иногда без него. При отравлении в том числе. Но далеко не все препараты, которые мы считаем незаменимыми и жизненно необходимыми, действительно нужны. Вспомним всех поименно.
1. Регуляторы водно-электролитного баланса
Препараты этой группы возглавляют короткий перечень лекарств, действительно необходимых при отравлениях. К ним относятся комбинации декстрозы, калия и натрия хлорида, натрия цитрата (Регидрон, Тригидрон, Гидровит).
Диарея и рвота, основные спутники кишечной инфекции, способствуют потерям жидкости и нарушению кислотно-щелочного равновесия в организме. Это главная опасность отравления, которое при неадекватном восполнении образующегося дефицита приводит к обезвоживанию и нарушению электролитного баланса. Поэтому лечение прежде всего должно быть направлено на быстрое восстановление запасов.
Формула успеха проста: сколько жидкости вы потеряли с рвотой и диареей, столько должно поступить в организм с препаратами или, на крайний случай, с лечебной минеральной водой (разумеется, без газа). В случаях, когда прием регидрантов внутрь невозможен, необходимо внутривенное капельное введение жидкости, т. е. капельницы.
2. Антидиарейные препараты
Советская, да и постсоветская медицина зачастую направлена на ожесточенную борьбу с симптомами заболеваний, часто независимо от того, полезна ли для организма эта борьба. Температура? Жаропонижающие, несмотря на то что при этом снижается выработка интерферона и иммунный ответ. Диарея? Противодиарейные, невзирая на выведение с каловыми массами множества токсинов.
Современная тактика ведения больных с острыми кишечными инфекциями нацелена на сознательный подход к купированию симптомов:
Классическим антидиарейным препаратом является лоперамид, замедляющий перистальтику кишечника и увеличивающий время прохождения кишечного содержимого. Кроме того, противодиарейное действие оказывает диоктаэдрический смектит.
3. Адсорбенты
Необходимость в приеме адсорбентов при кишечной инфекции не совсем однозначна. Теоретически адсорбенты (активированный уголь, пектин, диоктаэдрический смектит и др.) связывают токсины, предотвращая их присоединение к мембранам кишечника.
Однако, чтобы препараты работали, они должны поступить в организм прежде, чем токсины прикрепятся к слизистой оболочке, чего достигнуть на практике удается далеко не всегда. И даже если адсорбенты введены вовремя, они, увы, не предотвращают обезвоживание организма, хотя и уменьшают частоту стула.
4. Пробиотики
Применение препаратов, содержащих полезные бактерии, нацелено на восстановление микрофлоры кишечника. Исследования свидетельствуют, что они и в самом деле могут нормализовать ее состав. Однако из всего немалого ассортимента полноценную доказательную базу имеют лишь средства, содержащие Lactobacillus casei GG (входят в состав некоторых БАДов, например, Максилак, Йогулакт) или сахаромицеты Буларди Saccharomyces boulardii (Энтерол). Их назначение помогает снизить интенсивность диареи и улучшить состояние больных.
5. Антибактериальные
Препараты, проявляющие антибактериальный эффект, работают только в случае бактериальной инфекции. При отравлении, вызванном вирусами, они бесполезны, а ведь именно эти возбудители чаще всего и становятся причиной заболевания.
Отличить вирусную и бактериальную инфекцию иногда можно по клиническим проявлениям. Так, первая чаще сопровождается головной, мышечной болью, слабостью и усталостью, а для второй характерно появление крови в стуле. Но чаще всего четко дифференцировать два вида отравления практически невозможно.

Однако даже при инфицировании бактериями целесообразность в приеме антибактериальных средств сомнительна: ведь как мы уже говорили, спустя несколько дней после манифестации болезни наступает самовыздоровление.
Исключение составляют тяжелые инфекции, сопровождаемые высокой температурой, появлением крови в стуле, обезвоживанием, но в подобных ситуациях решение должен принимать доктор. Кстати, в таких случаях может понадобиться и госпитализация.
Таким образом, из длинного списка препаратов, которые мы считаем чуть ли не панацеей при отравлениях, можно ограничиться всего двумя-тремя, а то и вовсе одним лекарством — регидрантом. При этом эффект лечения будет тем же, что и при приме горстей таблеток, а вот побочных эффектов точно гораздо меньше. Какой путь предпочесть — выбирать вам, ведь в конце концов ваше здоровье в ваших руках.
Товары по теме: [product strict=» регидрон»]( регидрон), [product strict=» лоперамид»]( лоперамид), [product strict=» диосмектит»]( диосмектит), [product strict=» смекта»]( смекта), [product strict=» уголь активированный»]( уголь активированный), [product strict=» пектин»]( пектин), [product strict=» энтерол»]( энтерол)
Дисбиоз кишечника и антибиотик-ассоциированная диарея, диагностика и лечение
Изучение микрофлоры кишечника началось в 1886 г., когда F. Escherich описал кишечную палочку (Bacterium coli communae). В 1908 году Нобелевский лауреат русский ученый Илья Ильич Мечников доказал необходимость кишечных бактерий для здоровья и долголетия. К
Изучение микрофлоры кишечника началось в 1886 г., когда F. Escherich описал кишечную палочку (Bacterium coli communae). В 1908 году Нобелевский лауреат русский ученый Илья Ильич Мечников доказал необходимость кишечных бактерий для здоровья и долголетия. К настоящему времени в кишечнике здорового человека установлено наличие 500 видов микробов. Нормальная микробная флора является одним из барьеров на пути бактерий, попадающих в кишечник. Она стимулирует иммунную защиту, увеличивает секрецию IgA в просвет кишки. Кишечные палочки, энтерококки, бифидобактерии, ацидофильные палочки обладают антагонистическими свойствами и способны подавлять рост патогенных микроорганизмов. Нарушение состава микрофлоры приводит к снижению сопротивляемости организма кишечным инфекциям.
Различают мукоидную микрофлору (М-микрофлора) — микроорганизмы, ассоциированные со слизистой оболочкой кишечника, и полостную микрофлору (П-микрофлору) — микроорганизмы, локализующиеся в просвете кишечника.
По отношению к макроорганизму представителей кишечного биоценоза делят на 4 группы:
При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями, улучшая трофику слизистой оболочки. Недостаточное количество клетчатки в диете ведет к снижению синтеза короткоцепочечных жирных кислот. В результате возникают дистрофические изменения эпителия и повышается проницаемость кишечного барьера для антигенов пищевого и микробного происхождения.
Под влиянием микробных ферментов в подвздошной кишке происходит деконъюгация желчных кислот (ЖК) и преобразование первичных ЖК во вторичные ЖК. В физиологических условиях 80–95% ЖК реабсорбируется, остальные выделяются с калом в виде метаболитов. Последние способствуют формированию каловых масс, тормозят всасывание воды, препятствуя излишней дегидратации кала. Избыточное бактериальное обсеменение тонкой кишки ведет к преждевременной деконъюгации ЖК и секреторной диарее.
Таким образом, морфологическое и функциональное состояние кишечника зависит от состава его микрофлоры.
В тощей кишке здоровых людей находится до 100 000 бактерий в 1 мл содержимого. Основную часть их составляют стрептококки, стафилококки, молочнокислые палочки. В дистальном отделе подвздошной кишки количество микробов увеличивается за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий.
Микробный состав кала не отражает полную картину кишечного биоценоза, не дает оперативной информации о составе микроорганизмов в кишечнике. На практике учитываются данные лишь о 15–20 видах микробов, содержащихся в кале. Обычно исследуют количество бифидобактерий, лактобацилл, энтеробактерий, кишечных палочек, протея, энтерококка, золотистого стафилококка, синегнойной палочки и кандид.
Дисбиоз кишечника — нарушение экологического равновесия микроорганизмов, характеризующееся изменением количественного соотношения и качественного состава индигенной микрофлоры в микробиоценозе. Термин «дисбактериоз» впервые ввел A. Nissle в 1916 г.
Степень тяжести дисбиоза определяется степенью снижения бифидобактерий и других облигатных микроорганизмов и повышения числа условно-патогенных и патогенных видов.
I степень — снижение количества облигатных представителей (бифидобактерий и/или лактобацилл) на 1–2 порядка, без увеличения условно-патогенной микрофлоры (УПМ), нарастание количества УПМ при нормальном числе бифидобактерий. II степень — умеренное или значительное снижение числа бифидобактерий, сочетающееся с выраженными изменениями аэробной микрофлоры (редукция лактобацилл, появление измененных форм кишечной палочки, УПМ в высоких количествах). III степень — большое количество УПМ как одного вида, так и в ассоциациях, выделение патогенных микроорганизмов (Мехтиев С. Н., Гриневич В. Б., Захаренко С. М.).
В клинике дисбиоза выделяют следующие ключевые синдромы:
Новые подходы в диагностике дисбиоза
Альтернативу рутинным бактериологическим исследованиям составляют химические методы дифференциации микроорганизмов и, в частности, газовая хроматография (ГХ) в сочетании с масс-спектрометрией (ГХ-МС). Метод основан на определении компонентов бактериальных клеток, появляющихся в результате их естественного отмирания или атаки иммунной системы. В качестве маркеров используют минорные липидные компоненты мембран микробов. По их содержанию можно в течение нескольких часов определить до 170 видов бактерий и грибов в различных биосредах.
Почти 50% биомассы пристеночной микрофлоры составляют актиномицеты, занимающие промежуточное положение между бактериями и грибами. Около 25% микробной флоры представлено аэробными кокками (стафилококки, стрептококки, энтерококки и коринеформные бактерии). Число бифидо- и лактобацилл колеблется от 20 до 30%. Другие анаэробы (пептострептококки, бактероиды, клостридии, пропионобактерии) составляют около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной численности микрофлоры слизистой оболочки.
Дисбиоз не является самостоятельным заболеванием. Его появлению способствуют нарушения кишечного пищеварения, моторики, местного иммунитета, антибиотики, антациды и другие лекарственные средства. Необходимо установить причину, вызвавшую дисбиоз, а не пытаться «вылечить» микрофлору кишечника, основываясь на его бактериологическом анализе кала.
Свойства микробов, населяющих кишечник, не всегда учитываются при назначении антибиотиков. Антибактериальные препараты подавляют рост не только патогенных микроорганизмов, но и нормальную микрофлору. В результате размножаются сапрофитные микробы с высокой устойчивостью к лекарственным препаратам, приобретающие патогенные свойства.
Диарея, ассоциированная с применением антибиотиков
Антибиотик-ассоциированную диарею наиболее часто вызывают линкомицин, ампициллин, клиндамицин, бензилпенициллин, цефалоспорины, тетрациклины, эритромицин. Способ введения антибиотика не имеет большого значения. При приеме внутрь помимо эрадикации микроорганизмов происходит воздействие антибиотика на слизистую оболочку тонкой кишки. При парентеральном введении антибиотики воздействуют на биоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишок.
Симптомы ААД у большинства больных обычно появляются во время лечения, а у 30% — в пределах 7–10 дней после его прекращения.
Этиологическим фактором ААД большинство исследователей считают клостридии, в частности Cl. difficile. Среди взрослого населения уровень ее носительства низкий и равен 2–3%. Условиями размножения Cl. difficile являются анаэробная среда и угнетение нормальной микрофлоры кишечника.
Клинические проявления ААД варьируют от легкой диареи до тяжелого псевдомембранозного колита (ПМК). ПМК — острое заболевание кишечника, являющееся осложнением антибактериальной терапии. Установлено, что его вызывает Cl. difficile.
Симптоматика
Основным симптомом ААД является обильная водянистая диарея, началу которой предшествует назначение антибиотиков в течение нескольких дней и более. Затем появляются схваткообразные боли в животе, стихающие после стула. В случаях, когда возникает лихорадка, в крови нарастает лейкоцитоз, а в кале появляются лейкоциты, нужно заподозрить ПМК.
После отмены антибиотика у ряда больных симптомы быстро исчезают. При ПМК, несмотря на прекращение антибиотикотерапии, в большинстве случаев частота стула растет, появляются дегидратация и гипопротеинемия. В тяжелых случаях быстро наступает обезвоживание, развиваются токсическое расширение и перфорация толстой кишки, возможен летальный исход.
Диагноз
Диагноз ААД устанавливают на основании связи диареи с применением антибиотиков. Диагноз ПМК подтверждается бактериологическим исследованием кала и определением в нем токсина Cl. difficile. Частота обнаружения токсина в кале больных с ААД не превышает 15%.
У больных диареей, ассоциированной с Cl. difficile, наблюдается значительный лейкоцитоз. Имеются данные, что у больных с лейкоцитозом 15800 и выше высока вероятность развития ПМК, вызванного Cl. difficile. Это объясняется тем, что токсин А, выделяемый Cl. difficile, вызывает воспаление, секрецию жидкости, лихорадку и судороги. Поэтому у всех больных с ААД, протекающей с интоксикацией и лейкоцитозом 15800 и выше, следует считать причиной диареи Cl. difficile.
Парфенов А. И., Осипов Г. А., Богомолов П. О применили метод ГХ-МС для оценки состава микробной флоры тонкой кишки у 30 больных ААД и установили, что диарея может быть связана не только с инфекционным агентом (Cl. difficile), но с существенным изменением нормальной микрофлоры в сторону увеличения численности от 7 до 30 из 50 контролируемых микроорганизмов. При этом общая колонизация тонкой кишки увеличивается в 2–5 раз по сравнению с нормой.
У больных ААД чаще всего морфологические изменения толстой кишки отсутствуют. В тяжелых случаях при эндоскопии выявляют 3 типа изменений: 1) катаральное воспаление (отек и гиперемия) слизистой оболочки; 2) эрозивно-геморрагическое поражение; 3) псевдомембранозное поражение.
Эндоскопическая картина ПМК характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечна, но не изъязвлена. При гистологическом исследовании — субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки образуются инфильтраты. Эпителиальный слой приподнимается и местами отсутствует: оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. В поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Дифференциальный диагноз
Связь диареи с антибиотикотерапией обычно не создает трудностей в диагностике ААД. В тяжелых случаях картина ПМК может напоминать холеру или фульминантную форму язвенного колита, болезнь Крона. Однако для последних характерна более или менее выраженная кровавая диарея, нехарактерная для ПМК. Тем не менее возможность развития эрозивно-геморрагических изменений слизистой оболочки при ААД не исключает появления кровянистых выделений из прямой кишки у некоторых больных.
Лечение ААД
Этиотропной терапией ААД и ПМК, вызванных Cl. difficile, большинство авторов считает назначение ванкомицина и метронидазола (трихопола, метрогила).
Немедленно отменяют антибиотик, вызвавший диарею. Назначают ванкомицин в начальной дозе 125 мг внутрь 4 раза в сутки, при необходимости дозу увеличивают до 500 мг 4 раза в сутки. Лечение продолжают в течение 7–10 сут. Метронидазол дают по 0,5 г внутрь 2 раза в сутки (или по 0,25 г 4 раза в сутки).
Применяют также бацитрацин по 25 тыс. ME внутрь 4 раза в сутки. Лечение проводят в течение 7–10 сут. Бацитрацин почти не всасывается, в связи с чем в толстой кишке создается высокая концентрация препарата. При обезвоживании применяют инфузионную терапию и оральную регидратацию (Регидрон, Цитроглюкосолан). Для связывания токсина А назначают Холестирамин.
Есть сообщения о возможности лечения ААД также большими дозами пробиотиков. S. Perskyp и L. Brandt (2000) установили, что нормальная человеческая микрофлора способна устранить поносы, вызванные Cl. difficile. Бактерицидное действие нормальной микрофлоры обеспечивает выздоровление более чем 95% больных ААД, ассоциированной с Cl. difficile. Она предупреждает появление хронической клостридиальной и другой инфекции, которая может вызвать у части больных хронические желудочно-кишечные расстройства. Терапию пробиотиками при ААД и ПМК нужно начинать как можно раньше, не дожидаясь подтверждения диагноза.
Поскольку количество микробов, обеспечивающих лечебный эффект, на несколько порядков превышает дозы обычных бакпрепаратов, обсуждается вопрос о локальной доставке пробиотиков в кишечник. Это можно делать с помощью клизм на основе солевых растворов, через назодуоденальный зонд или колоноскоп. Привлекает внимание последний способ, т. к. как при этом пробиотики вводятся непосредственно в проксимальный отдел ободочной кишки.
Одним из основных пробиотических препаратов, применяемых для лечения ААД, является Линекс. Это комбинированный препарат, содержащий компоненты естественной микрофлоры из разных отделов кишечника. Входящие в состав бифидобактерии, лактобациллы и нетоксигенный молочнокислый энтерококк поддерживают равновесие кишечной микрофлоры и обеспечивают ее физиологические функции: создают неблагоприятные условия для размножения и жизнедеятельности патогенных микроорганизмов; участвуют в синтезе витаминов В1, В2, РР, фолиевой кислоты, витаминов К и Е, аскорбиновой кислоты, обеспечивают потребность организма в витаминах В6, В12 и биотине; продуцируя молочную кислоту и снижая рН кишечного содержимого, создают благоприятные условия для всасывания железа, кальция, витамина D. Молочнокислые бактерии осуществляют ферментативное расщепление белков, жиров и сложных углеводов, не всосавшиеся в тонкой кишке углеводы и белки подвергаются более глубокому расщеплению в толстой кишке анаэробами (в т. ч. бифидобактериями). Бактерии, входящие в состав препарата, участвуют в метаболизме желчных кислот.
Линекс содержит молочнокислые бактерии, резистентные к действию антибиотиков. Взрослым и детям старше 12 лет назначают по 2 капсулы 3 раза/сут после еды, запивая небольшим количеством жидкости. Длительность лечения составляет в среднем 1–2 мес. При применении препарата в рекомендуемых дозах побочное действие не отмечено. Противопоказания — повышенная чувствительность к компонентам препарата или молочным продуктам. Проведенные исследования не выявили наличия у Линекса тератогенного действия, не сообщалось об отрицательном влиянии препарата при беременности и в период лактации. Для сохранения жизнеспособности компонентов препарата не рекомендуется запивать Линекс горячими напитками, следует воздерживаться от употребления алкоголя.
Клинические проявления аллергии на молочнокислые бактерии сходны с проявлениями аллергии на молочные продукты, поэтому при появлении симптомов аллергии прием препарата следует прекратить для выяснения ее причин. О случаях передозировки Линекса не сообщалось. Не отмечено его нежелательного взаимодействия с другими препаратами. Состав препарата Линекс позволяет принимать его одновременно с антибактериальными средствами.
Лечение собственно дисбиоза
Стандартная терапия дисбиоза нацелена на устранение избыточного бактериального обсеменения тонкой кишки, восстановление нормальной микрофлоры, улучшение кишечного пищеварения и всасывания, восстановление моторики кишечника и повышение иммунореактивности организма.
Антибактериальные препараты применяют по показаниям для подавления роста патогенной микрофлоры в тонкой кишке. Обычно назначают антибиотики из группы фторхинолонов, пенициллинов, цефалоспорины, тетрациклины или метронидазол. Препараты принимают внутрь в обычных дозах в течение 7–10 дней.
Оптимальным является использование средств, оказывающих минимальное влияние на симбионтную микрофлору и подавляющих рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов. К ним относятся антисептики: Интетрикс, Энтерол, Бактисубтил, Нифуроксазид и др. При тяжелых формах стафилококкового дисбиоза применяют антибиотики: офлоксацин, оксациллин, амоксициллин. Их назначают на срок 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение натамицина, флуконазола и иных микостатиков.
Бактериальные препараты (пробиотики) можно назначать без предварительной антибактериальной терапии или после нее. Применяют Бифидумбактерин, Пробифор, Бификол, Лактобактерин, Линекс, Бифиформ, Нормофлорины Л, Д, Б, Полибактерин, Наринэ, Аципол, Нутролин В, Тревис.
Еще один способ лечения дисбиоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов (пребиотиками). Один из таких препаратов — Хилак-форте, стерильный концентрат продуктов обмена веществ нормальной микрофлоры: молочная кислота, лактоза, аминокислоты и жирные кислоты. Эти вещества способствуют восстановлению биологической среды в кишечнике, необходимой для существования нормальной микрофлоры, подавляют рост патогенных бактерий, улучшают трофику и функцию эпителиоцитов и колоноцитов. Один миллилитр препарата содержит биологически активные вещества 100 миллиардов нормальных микроорганизмов. Хилак-форте назначают по 60 капель 3 раза в день на срок 4 нед в сочетании с антибактериальными препаратами или после их применения.
Кроме того, применяется сироп лактулозы (Дюфалак, Порталак), подкисляющий кишечный сок и угнетающий рост патогенной микрофлоры. Активное вещество — синтетический дисахарид, который не гидролизуется в тонкой кишке и поступает в ободочную кишку в неизмененном виде, где расщепляется под действием флоры толстой кишки с образованием низкомолекулярных органических кислот, что приводит к снижению рН содержимого кишечника.
Под действием препарата увеличивается поглощение аммиака толстой кишкой и выведение его из организма, стимулируется рост ацидофильных бактерий (в т. ч. лактобактерий), подавляется размножение протеолитических бактерий и уменьшается образование азотсодержащих токсических веществ. Клинический эффект наступает через 2 дня лечения. Препарат в форме сиропа для приема внутрь назначают взрослым в дозе 15–45 мл/сут, поддерживающая доза равна 10–25 мл/сут. Препарат следует принимать 1 раз/сут утром во время еды, с водой, любой другой жидкостью или пищей.
Побочное действие со стороны пищеварительной системы: в первые дни — метеоризм (проходящий самостоятельно через 2 дня); при длительном применении в высоких дозах возможны боли в области живота, диарея. Противопоказания: галактоземия; непроходимость кишечника; повышенная чувствительность к компонентам препарата. Лактулозу можно применять при беременности и в период лактации по показаниям. Препарат следует с осторожностью назначать больным сахарным диабетом.
Из других пребиотиков нужно отметить кальция пантотенат (участвует в процессах ацетилирования и окисления в клетках, углеводном и жировом обмене, синтезе ацетилхолина, утилизируется бифидобактериями и способствует увеличению их массы), аминометилбензойную кислоту (Памба, Амбен) — ингибитор фибринолиза, подавляет протеолитические ферменты условно-патогенных бактерий, стимулируя рост нормальной микрофлоры, лизоцим (обладает бифидогенным, иммуномодулирующим, противовоспалительным действием, улучшает пищеварение, подавляет патогенную флору).
В лечении дисбиоза рекомендуется использовать фитопрепараты. Они являются кишечными антисептиками, подавляют патогенную и сохраняют сапрофитную микрофлору. Фитосборы нормализуют аппетит, улучшают пищеварение, моторику кишечника, оказывают противомикробное и иммуномодулирующее действие, способствуют регенерации слизистой оболочки. Выраженный бактерицидный эффект дают зверобой, календула, эвкалипт, тысячелистник, лапчатка, шалфей, душица, брусника, подорожник. Иммунокорригирующее действие оказывают крапива, мелисса, мать-и-мачеха, подорожник, фиалка трехцветная, череда. Богаты витаминами брусника, крапива, малина, смородина, рябина, шиповник.
Больным с нарушенным полостным пищеварением назначают панкреатические ферменты (Креон, Панцитрат). С целью улучшения функции всасывания используют Эссенциале форте Н, лоперамид (Имодиум) и тримебутин.
Для повышения реактивности организма ослабленным больным при тяжелом дисбиозе целесообразно назначать Анаферон, Иммунал, Ликопид и другие иммуномодуляторы. Курс лечения должен продолжаться в среднем 4 нед. Одновременно назначают витаминно-минеральные комплексы (Витаминерал, Алфавит и др.).
По вопросам литературы обращайтесь в редакцию.
В. В. Скворцов, доктор медицинских наук
ВолГМУ, Волгоград