Бактериостатические антибиотики это что
Бактериостатические антибиотики это что
Синтез белка представляет собой реализацию генетической информации, т. е. построение пептидной цепи с помощью мРНК. Сборка цепи из аминокислот (АК) происходит на рибосоме. В доставке аминокислот к мРНК участвуют разные транспортные молекулы РНК (тРНК), каждая из которых связывает конкретную АК.
Каждая тРНК несет антикодон триплета нуклеотидных оснований, которые комплементарны определенной кодирующей единице мРНК к(одон, состоит из трех нуклеиновых оснований).
Синтез белка состоит из следующих этапов:
1. Первый этап, инициация, включает сборку аппарата для синтеза белка из мРНК, малой и большой рибосомных единиц и инициирующего комплекса тРНК-АК. За этим следуют этапы удлинения.
2. Рибосома фокусируется на двух кодонах мРНК. Один (слева) связывает комплекс тРНК-АК, а АК уже добавлена к пептидной цепи. Другой (справа) готов принять следующий комплекс тРНК-АК.
3. После последнего присоединения аминокислоты двух смежных комплексов связываются в результате воздействия рибосомной пептидсинтетазы (пептидилтрансферазы). Она является рибозимом, т. е. ферментом, каталитическая функция которого обеспечивается рибосомной РНК. Одновременно отсоединяется левый комплекс тРНК-АК.
4. Левая тРНК отсоединяется от мРНК. Рибосома двигается вдоль нити мРНК и фокусируется на следующем кодоне.
5. Затем правый комплекс тРНК-АК перемещается влево, что дает возможность связать справа следующий комплекс.
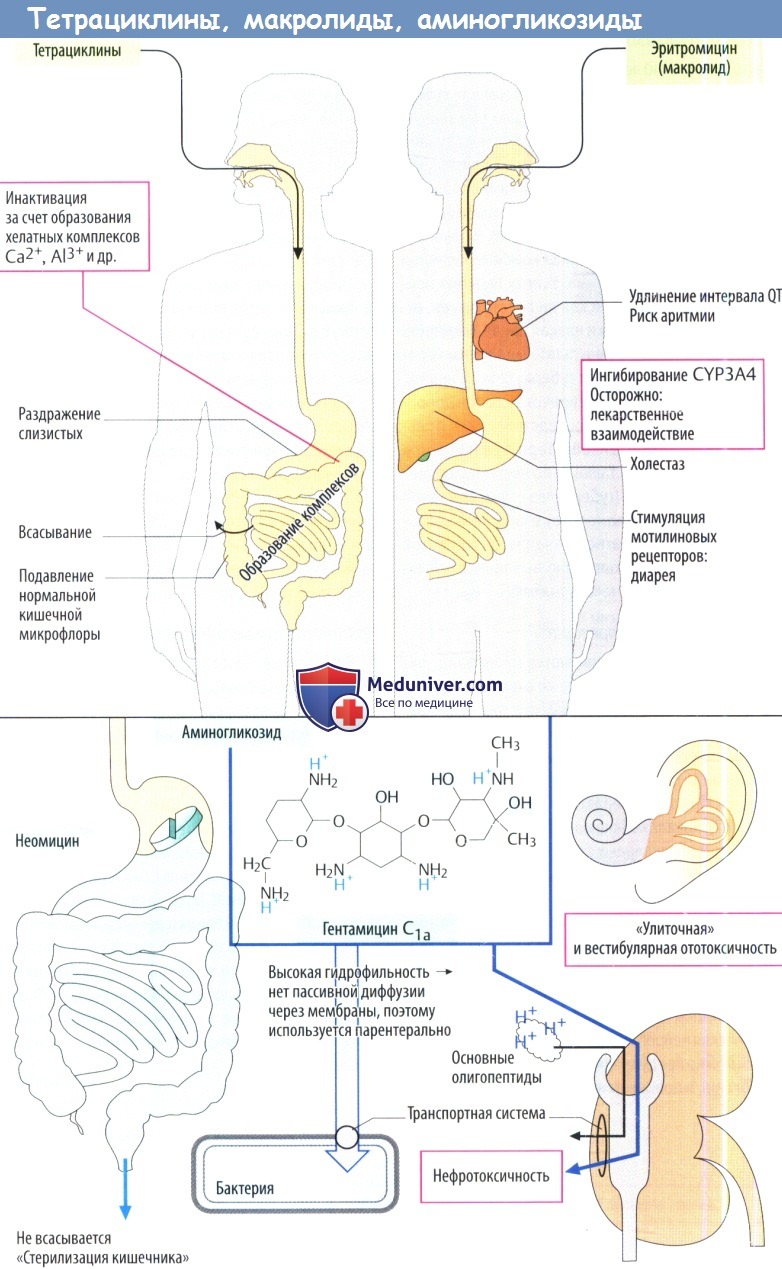
Эти отдельные этапы могут ингибироваться антибактериальными препаратами. В отличие от линезолида, который продуцируется синтетически путем, все антибиотики, указанные на рисунке ниже, получают преимущественно из Streptomyces spp. Ниже обсуждаются группы препаратов в соответствии с этапами синтеза белков.
В классификации, построенной по принципу терапевтической важности, имеются градации. Во главе стоят макролиды и тетрациклины, которые имеют значение при амбулаторном лечении. За ними следуют аминогликозиды, вводимые парентерально и поэтому предназначенные для стационарного лечения, и в конце — линезолид (резервный препарат) и хлорамфеникол, который в настоящее время почти не используется.
В результате происходит необратимое желто-коричневое окрашивание зубов и обратимое торможение роста костей. Исходя из этих нежелательных реакций, тетрациклины не следует применять после 2-го месяца беременности и назначать детям в возрасте до 8 лет. К другим побочным эффектам относятся повышенная фоточувствительность кожи и повреждение печени в основном после в/в введения.
Тигециклин — производное тетрациклина с измененной структурой (глицилциклин). Это резервный препарат при тяжелых инфекциях, эффективен также против тетрациклин-резистентных бактерий.
2b. Аминогликозиды вызывают образование аномальных комплексов тРНК-АК, что приводит к появлению ошибок при синтезе белка. Аминогликозиды являются бактерицидными средствами. Их спектр активности охватывает в основном грамотрицательные организмы. Стрептомицин и канамицин используются преимущественно при лечении туберкулеза.
Аминогликозиды состоят из аминосахаров, соединенных гликозидной связью с агликоновым фрагментом (см. гентамицин С1а, компонент смеси гентамицина). Они содержат несколько гидроксильных групп и аминогруппы, которые связывают белки. Следовательно, эти вещества имеют высокую полярность, плохо проникают через мембраны и плохо всасываются в кишечнике. Неомицин используется только местно накожно и для нанесения на слизистые оболочки.
Аминогликозиды для системного лечения серьезных инфекций вводят в виде инъекций (гентамицин, тобрамицин, амикацин, нетилмицин). Аминогликозиды проникают внутрь бактерий за счет бактериальных транспортных систем. В почках они проникают в клетки проксимальных канальцев посредством системы захвата олигопептидов. Канальцевые клетки чувствительны к повреждающему действию аминогликозидов (в основном обратимая нефротоксичность). Во внутреннем ухе могут повреждаться чувствительные клетки вестибулярного аппарата и спирального органа (в некоторых случаях развивается необратимая ототоксичность).
3. Хлорамфеникол ингибирует пептидсинтетазу. Он обладает бактериостатическим свойством против широкого спектра возбудителей, полностью всасывается после приема внутрь и легко преодолевает диффузионныебарьеры, например ГЭБ. Несмотря на эти благоприятные свойства, хлорамфеникол используется только в редких случаях (при инфекции ЦНС) из-за риска повреждения костного мозга.
4. Макролиды подавляют синтез белка на рибосомах. Они оказывают преимущественно бактериостатическое действие, которое направлено главным образом против грамлоложительных бактерий. Кроме того, поражаются внутриклеточные бактерии, например, хламидии и микоплазмы. Макролиды эффективны при введении внутрь. Прототипом препаратов этой группы является эритромицин, который также применяется как резервный препарат при аллергии или резистентности к пенициллину. Кларитромицин, рокситромицин и азитромицин являются производными эритромицина с одинаковой активностью, тем не менее они медленно выводятся, что позволяет снизить дозу и вводить их менее часто.
Макролиды обычно хорошо переносятся. Они вызывают желудочно-кишечные расстройства, возможно, из-за стимуляции рецепторов эндогенного посредника мотилина, который активирует перистальтику.
Эритромицин и другие макролиды ингибируют реполяризацию миокарда, в результате чего возникает риск сердечных аритмий у пациентов с уже имеющимся удлинением интервала ОТ на ЭКГ или у пациентов получающих одновременно другие препараты, удлиняющие интервал ОТ. Вследствие ингибирования изоферментов CYP, например CYP3A4, появляется риск неблагоприятных лекарственных взаимодействий. Длительное использование приводит к повреждению печени с холестазом.
Телитромицин — синтетический макролид с измененной структурой («кетолид»). Он обладает другим видом резистентности, которая связана со взаимодействием с дополнительным местом связывания рибосомы.
5. Линкозамиды. Клиндамицин обладает такой же антибактериальной активностью, как и эритромицин. Он оказывает бактериостатическое действие в основном на грамположительные аэробы, а также на анаэробные возбудители. Клиндамицин хорошо всасывается после приема внутрь и достигает эффективных концентраций даже в костной ткани, поэтому он используется при лечении стафилококкового остеомиелита.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антибиотик благодетель, враг и беззащитное создание.
Антибиотик: благодетель, враг и беззащитное создание.
Победитель грозной инфекции
Прежде всего, нужно отметить, что антибиотики бывают бактерицидные и бактериостатические. Обе группы важны, но бактерицидные антибиотики имеют значительно большее значение, так как уничтожение возбудителя заболевания способствует наиболее скорому выздоровлению человека. Бактериостатические же антибиотики лишь задерживают деление микробной клетки, выздоровление происходит под влиянием иммунной системы организма. Если иммунные системы ослаблены, то после исчезновения антибиотиков возбудители заболевания опять начинают размножаться, проводя к возникновению рецидива. К бактерицидным относятся две группы антибиотиков:
Первая группа бактерицидных антибиотиков нарушает образование микробной стенки: пенициллины, цефалоспорины, карбапенемы, монобактамы, фосфомицин, гликопептидные. В момент деления микроба появляются две дочерней клетки, каждая из которых должна быть окружена вновь образующей микробной стенкой, выполняющей структурную и обменную функции. Если микробная стенка не покроет дочерние клетки, то они погибнут.
Вторая группа бактерицидных антибиотиков (полимиксины, отчасти аминогликозидные, полиеновые-антигрибковые антибиотики) нарушают функцию внутренней цитоплазматической мембраны микроорганизмов. Эта мембрана выполняет функцию транспорта ионов и различных метаболитов и, нужно заметить, что подобная структура полностью отсутствует у человека. Так вот, в результате действия антибиотиков, клетка теряет ионы калия, фосфаты, нуклеиновые кислоты и другие жизненно важные вещества и в результате микроб гибнет. Эти антибиотики влияют как на делящуюся, так и на покоящуюся клетку.
Третья группа антибиотиков – бактериостатические. Её представители нарушают синтез белков, нуклеиновых кислот внутри микробных клеток, преимущественно останавливая их деление. К этой группе антибиотиков относят макролиды, линкозамиды, аминогликозидные антибиотики, левомицетин, тетрациклины, рифампицин, фузидин.
Останавливая деление микробов, антибиотики третьей группы подавляют влияние на них антибиотиков первой группы, так как они воздействуют только на делящиеся микроорганизмы. То есть между антибиотиками первой и третьей групп существует антагонизм, и их совместное применение в подавляющем большинстве случаев не способствует возникновению лечебного эффекта и нередко может привести к ухудшению состояния больного.
Враг повержен и вот – поле брани…
Долгое время, да и сейчас тоже, антибиотики считались панацеей от всех бед и назначались при малейших признаках любой инфекции. Сегодня уже доказано, что их действие у нас в организме сродни эффекту «выжженной земли». Помимо сильнейших аллергических реакций, антибиотики оказывают губительное воздействие на жизнь и здоровье пациентов, пользующихся ими.
Вот лишь отдельные примеры коварного воздействия антибиотиков:
— стрептомицин может вызвать глухоту, головокружение
— биомицин даёт осложнения на органы пищеварения
— левомицетин тормозит кроветворение, что крайне опасно для жизни человека, когда его организм и так подвержен инфекции
— антибиотики активно угнетают жизненные функции клеток, которые производят протеин (белковый строительный материал зародыша), потому некоторые матери, употреблявшие в период беременности антибиотики, производили на свет нежизнеспособных младенцев или уродов.
Уже родившийся младенец также может пострадать, получая антибиотики с материнским молоком. Как выяснилось, на мать и ребёнка оказывают вредное воздействие все без исключения препараты этой группы. Вот лишь несколько примеров:
-дети, чьи матери применяли циклофсатин, страдают нарушением структуры костей, их размягчением
— аминоглюкозиды и тетрециклины повреждают кости малышей и их зубы: им угрожают болезни дёсен, кариесы (50 % таких людей к 30-ти годам будут вынуждены вставлять искусственные зубы)
— «популярный» антибиотик стрептомицин, относящийся к той же категории, действует на мозговую деятельность малыша и надолго дестабилизирует речевые функции
— септран вызывает постепенное увеличение билирубина в кишечнике новорожденного, что может привести к тяжёлому кишечному расстройству, нарушению деятельности органов пищеварения и угрожает жизни младенца
— пенициллин вызывает сильнейшую аллергию у 16 % новорожденных, а также нарушает деятельность кишечника.
Хочется отметить, что весь спектр «вредоносного» действия антибиотиков ещё до конца не изучен, и вполне вероятно, что в ближайшем времени мы узнаем о ещё каких-либо опасных для здоровья человека характеристиках антибиотиков.
Но, как бы там, ни было, пока без антибиотиков обойтись вряд ли удастся. И если их использовать, то нужно делать это грамотно.
Побеждает сильнейший
Все живое, в том числе и бактерии быстро приспосабливаются к неблагоприятным условиям внешней среды. Выработка устойчивости к антибиотикам – один из наиболее ярких примеров такого приспособления. Можно утверждать, что рано или поздно любой вид бактерий сможет выработать устойчивость к любому антибактериальному препарату. Выработка устойчивости происходит тем быстрее, чем в большем объеме применяется данное вещество. По мере того, как бактерии вырабатывают устойчивость к антибиотикам, человечество вынуждено изобретать все новые препараты. Поэтому можно предположить, что если сегодня мы будем бесконтрольно назначать антибактериальные препараты всем детям, то завтра внуков нам лечить будет просто нечем.
Применение антибиотиков можно считать обоснованным, когда речь идёт о действительно серьёзной, угрожающей жизни инфекции. Во всех остальных случаях желательно использовать другие средства.
К сожалению, вошло в моду при любых недомоганиях (насморке, кашле, головной боли) применять антибиотики. Стоит ли говорить, какой вред это наносит организму человека? При такого рода заболеваниях лучше не хватать первый попавшийся антибиотик, а обратиться к препаратам, произведённым на растительной основе. Эти лекарства широкого спектра действия повышают иммунитет организма и в то же время подавляют инфекции. Ещё лучше предусмотрительно прививаться от опасных инфекций и вести здоровый образ жизни, и тогда уж точно об антибиотиках можно забыть.
При работе с микроорганизмами микробиологи Карачаево-Черкесской Республики сталкиваются с тем, что на территории нашей республики от больных выделяются:
— S. aureus(стафилококки), являющиеся причиной воспалительных заболеваний ушей, глаз, бронхов, устойчивые (нечувствительные) к пенициллину и ампицилллину
— S. flexneri(шигеллы) – возбудители дизентерии, устойчивые к левомицетину и тетрациклину
— P. аeruginosa(синегнойная палочка), вызывающая гнойные осложнения после операций, заболевания мочевого пузыря, почек, устойчивая к цефтриаксону, цефтазидиму, гентамицину, офлоксацину.
Поэтому для выбора препарата для лечения, врачу необходимо знать, не только каким возбудителем вызвана инфекция, но и то, к какому препарату этот возбудитель чувствителен. Казалось бы, что эта проблема легко решается при проведении лабораторных исследований. Но, увы, при применении современных методов исследований ответ может быть получен лишь через 2 – 3 суток. Вследствие этого, в реальной жизни антибиотики назначают эмпирически, т.е. на основании имеющегося практического опыта. Но даже самый блестящий врач не может самостоятельно накопить опыт по применению всех возможных антибиотиков и уверенно сказать, что препарат А лучше чем препарат Б. К тому же необходимо учитывать насколько широко в конкретном географическом регионе среди бактерий распространена устойчивость к конкретному препарату. Врачу неизбежно приходится опираться на результаты специальных исследований, их критический анализ, мировой и национальный опыт, а также на рекомендации по стандартам лечения, разработанные экспертами.
Назначение антибиотиков детямне должно заменять назначение «валерьянки» родителям
Рассмотрим некоторые ситуации, которые без сомнения интересует всех родителей. Антибиотики при инфекции дыхательных путей. В этой ситуации, прежде всего родители должны четко представлять, что естественная частота инфекций дыхательных путей у детей дошкольного возраста составляет 6 – 10 эпизодов в год и назначение антибиотиков при каждом эпизоде инфекции – непомерная нагрузка на организм ребенка.
Надежных внешних признаков или простых и дешевых лабораторных методов, позволяющих различать вирусную и бактериальную природу инфекций дыхательных путей, к сожалению, нет. В то же время известно, что острый ринит (насморк) и острый бронхит (воспаление слизистой оболочки бронхов) практически всегда вызываются вирусами, а ангина (воспаление небных миндалин и глотки), острый отит (воспаление уха) и синусит (воспаление слизистой оболочки околоносовых пазух) в значительной части случаев – бактериями. Естественно предположить, что подходы к антибактериальной терапии отдельных острых инфекций верхних дыхательных путей должны несколько различаться.
При остром рините (насморке) и бронхите антибиотики не показаны. На практике все происходит по-другому: один – два дня повышенной температуры и кашля у ребенка родители, как правило, достаточно легко выдерживают без дачи малышу антибиотиков. Но в последующем напряжение возрастает, больше всего родителей беспокоит вопрос, не осложнится ли бронхит пневмонией. Здесь стоит отметить, что развитие такого осложнения возможно, но его частота практически не зависит от предшествовавшего приема антибиотиков. Основными признаками развития осложнения служит ухудшение состояния (дальнейшее повышение температуры тела, усиление кашля, появление одышки), в такой ситуации надо немедленно вызывать врача, который и решит, надо ли корректировать лечение. Если же состояние не ухудшается, но и существенно не улучшается, то очевидной причины для назначения антибиотиков нет, тем не менее, именно в этот период некоторые родители не выдерживают и начинают давать препараты детям «на всякий случай». Что можно сказать в этом случае? Назначение антибиотиков детям не должно заменять назначение «валерьянки» родителям!
Таким образом, беглого взгляда на особенности антибактериальной терапии достаточно для выделения основных принципов антибактериальной терапии: быстрое назначение наиболее эффективных препаратов в тех случаях, когда их эффект доказан и максимальное сокращение применения антибиотиков во всех других случаях. Применение антибиотиков можно считать обоснованным, когда речь идёт о действительно серьёзной, угрожающей жизни инфекции. Во всех остальных случаях желательно использовать другие средства.
Итак, антибиотики, конечно же, могут вызывать вполне определенные нежелательные реакции. Но вдобавок к их истинным грехам иногда приходится слышать и явно незаслуженные обвинения. Достаточно часто не только в научно-популярных, но и в специальных статьях как о чем-то совершенно очевидном говорят о способности антибиотиков угнетать иммунитет. Подобные утверждения абсолютно ничем не подтверждены. Многочисленными исследованиями однозначно установлено, что ни один из разрешенных к применению в медицинской практике антибиотиков при использовании в лечебных дозах не угнетает систему иммунитета.
В заключение необходимо еще раз подчеркнуть, что антибактериальные препараты являются единственными эффективными средствами лечения инфекционных болезней. Но, к сожалению, быстрое формирование бактериями устойчивости к антибиотикам, обусловленное нерациональным использованием бактериальных препаратов, приводит к быстрой утрате эффективности последних. Поэтому наряду с поиском препаратов с принципиально новыми механизмами действия необходимы совместные усилия врачей, фармацевтов и пациентов по упорядочению использования антибиотиков и сохранению их для будущего.
пресс-секретарь Управления Роспотребнадзора по КЧР
Антибиотики
История

Зальман Ваксман — один из отцов антибиотико в
Антибиотики — вещества природного или полусинтетического происхождения, подавляющие рост живых клеток. Термин был введен в обращение З. Ваксманом — американским микробиологом, получившим в 1952 году Нобелевскую премию за открытие стрептомицина. Сам термин «антибиос» был придуман Л. Пастером и нес определенный смысл — «жизнь против жизни».
Первым антибиотиком был пенициллин, выделенный из грибка Penicillum notatum. Наблюдения за взаимоотношениями культуры стрептококка и грибка были начаты Флемингом в одной из лондонских больниц в 20-х годах прошлого века. Однако его выступление на втором Международном конгрессе микробиологов не произвело впечатления на публику (возможно, из-за того, что он был не слишком искусным оратором). Дальнейшая же история изучения пенициллина связана с именами членов «Оксфордской группы» — Говардом Флори и Эрнстом Чейном. Чейн занимался выделением пенициллина, а Флори — испытанием его на животных. Первое испытание пенициллина состоялось в 1941 году на умирающем от сепсиса лондонском полицейском. Ученым удалось добиться улучшения его состояния, но запасы препарата были слишком малы, и больной погиб. 
Та самая чашка Петри с культурой Staphylococcus sp., в которой Александр Флеминг (Alexander Fleming), вернувшись из отпуска, обнаружил вместо бактериальных колоний плесень Penicillium notatum. 1928 г.
В 1945 году Флеминг, Чейн и Флори были удостоены Нобелевской премии. Пенициллин же, оптимально сочетая в себе высокую антибактериальную активность и безопасность для человека, с успехом используется до сих пор.
Не заставило долго себя ждать открытие антибиотиков и других групп: в 1939 году был выделен грамицидин, в 1942 — стрептомицин, в 1945 — хлортетрациклин, в 1947 —левомицетин (хлорамфеникол), а уже к 1950 году было описано более 100 антибиотиков. Со временем выяснилось, что существующие антибиотики недостаточно активны в отношении микроорганизмов: это и послужило поводом для начала химических исследований и создания полусинтетических антибиотиков. С тех пор были открыты различные группы антибактериальных средств. Так, в России на сегодняшний день используется около 30 групп антибиотиков. Среди них различают препараты с антибактериальным, противопаразитарным, противогрибковым и противоопухолевым действиями. Также были сформированы и постулаты антибиотикотерапии.
Основные правила антибактериальной терапии можно сформулировать следующим образом:
1. Установить возбудителя заболевания;
2. Определить препараты, к которым возбудитель наиболее чувствителен;
3. При неизвестном возбудителе использовать либо препарат с широким спектром действия, либо комбинацию двух препаратов, суммарный спектр которых включает вероятных возбудителей;
4. Начинать лечение надо как можно раньше;
5. Дозы препаратов должны быть достаточными для того, чтобы обеспечить в клетках и тканях препятствующие размножению (бактериостатические) или уничтожающие бактерии (бактерицидные) концентрации;
6. Продолжительность лечения должна быть достаточной; снижение температуры тела и ослабление других симптомов не являются основанием для прекращения лечения;
7. Значительную роль играет выбор рациональных путей введения препаратов, учитывая, что некоторые из них не полностью всасываются из желудочно-кишечного тракта, плохо проникают через гематоэнцефалический барьер и т. д.;
8. Комбинированное применение антибактериальных средств должно быть обоснованным, так как при неправильном сочетании может как ослабляться суммарная активность, так и суммироваться их токсические эффекты.
Рассмотрим сами антибактериальные препараты с точки зрения характера, спектра и механизма их действия.
Бактериостатические препараты тормозят рост и размножение микроорганизмов. Они не вызывают их гибели. При этом допускается, что механизмы имунной защиты в состоянии самостоятельно справиться с уничтожением и элиминацией микробов. К бактериостатическим препаратам относятся макролиды, клиндамицин, стрептограмины, хлорамфеникол, тетрациклины;
Бактерицидные препараты приводят к гибели микроорганизмов, и организму необходимо лишь обеспечить их выведение. К ним относятся бета-лактамные антибиотики, аминогликозиды, фторхинолоны, гликопептиды и другие (триметоприм, метронидазол, рифампицин и т. д).
Каким же образом происходит обезвреживание микроорганизмов? Существует несколько механизмов действия антибиотиков:
Нарушение функционирования мембран из-за нарушения их целостности, образования ионных каналов, связывания ионов в комплексы, растворимые в липидах и нарушения их транспортировки (нистатин, грамицидины, полимиксины);
Подавление синтеза нуклеиновых кислот : ДНК (стрептомицин, гризеофульвин, рифампицин, рифамицин, ванкомицин) и РНК (брунеомицин, рубомицин, оливомицин);
Нарушение синтеза белка клеткой (тетрациклины, макролиды);
Нарушение синтеза пуринов и пиримидинов (азасерин, саркомицин);
Для удобства в применении принято классифицировать антибиотики и по спектрам антимикробного действия:
Ценность антибиотиков как лекарств, несомненно, очень высока. Открытие этих препаратов позволило избавиться от множества ранее смертельных инфекций. Но микроорганизмы достаточно быстро адаптируются к изменяющимся условиям среды, в том числе и приобретая устойчивость к антибиотикам.
Выделяют несколько «основных» механизмов резистентности :
1. Изменение мишени действия;
2. Ферментативная инактивация антимикробного препарата;
3. Активное выведение антимикробного препарата из микробной клетки (эффлюкс);
4. Нарушение проницаемости микробной клетки для антимикробного препарата;
5. Формирование метаболических «шунтов».

Метициллин-резистентный золотистый стафилококк
Появление антибиотикорезистентных штаммов бактерий, несомненно, опасно и для того человека, у которого они выделены, и для многих других людей. Рост устойчивости приводит к утяжелению течения инфекционных заболеваний, повышению смертности, увеличению расходов на здравоохранение.
Рассмотрим самые популярные классы антибиотиков:
Пенициллины
Старейшая, но не теряющая своей актуальности группа. Пенициллины являются β-лактамными антибиотиками и имеют в своей структуре четырехчленное β-лактамное кольцо. В свою очередь они делятся на природные (биосинтетические), выделяемые определенными штаммами плесневых грибов, и полусинтетические, получаемые путем лабораторной модификации. По механизму действия все пенициллины являются бактерицидными: они блокируют финальные этапы синтеза пептидогликана и тем самым приводят к гибели бактерий. Это в свою очередь и объясняет низкую токсичность пенициллинов для человека, для клеток которого не характерен синтез пептидогликана. Для воздействия на бактерии, которые приобрели устойчивость путем синтеза ферментов β-лактамаз, были созданы препараты, комбинированные с клавулановой кислотой (ингибитором β-лактамаз). По классическим источникам, они имеют достаточно широкий спектр действия, а полусинтетические пенициллины благодаря своей кислотоустойчивости и защищенности от β-лактамаз расширяют его в разы. Но ввиду растущей резистентности микроорганизмов пенициллины не всегда производят достаточный лекарственный эффект.
Классификация
Лекарственные взаимодействия
Цефалоспорины

Общая структура цефалоспоринов
Также относятся к β-лактамным антибиотикам, являются одним из самых многочисленных и часто назначаемых классов ввиду их низкой токсичности. По механизму действия сходны с пенициллинами, имеют 4 поколения, каждое из которых по спектру действия опережает предыдущее.
I поколение:
1) Парентеральные (цефазолин);
2) Пероральные (цефалексин, цефадроксил).
Антибиотики активны в отношении Streptococcus spp. (S.pyogenes, S. pneumoniae) и метициллиночувствительных Staphylococcus spp. По уровню антипневмококковой активности цефалоспорины I поколения уступают аминопенициллинам и большинству более поздних цефалоспоринов. Цефалоспорины I поколения обладают узким спектром действия и невысоким уровнем активности в отношении грамотрицательных бактерий. Основными показаниями к применению цефалоспорина являются предоперационная профилактика в хирургии, а также лечение инфекций кожи и мягких тканей; к применению цефазолина — стрептококковый тонзиллофарингит, внебольничные инфекции кожи и мягких тканей легкой степени тяжести.
II поколение:
1) Парентеральные (цефуроксим);
2) Пероральные (цефаклор, цефуроксим аксетил).
При сходном антимикробном спектре цефуроксим более активен в отношении Streptococcus spp. и Staphylococcus spp. Спектр действия цефалоспоринов II поколения в отношении грамотрицательных микроорганизмов шире, чем у представителей I поколения; клиническое значение имеет активность цефуроксима в отношении гонококков. Благодаря устойчивости цефуроксима к β-лактамазам он активен в отношении M. catarrhalis, Haemophilus spp., E. coli, Shigella spp., Salmonella spp., P. mirabilis, Klebsiella spp., P. vulgaris, C. diversus. Основными показаниями к применению являются внебольничные инфекции верхних дыхательных путей, госпитализационная внебольничная пневмония, внебольничные инфекции кожи и мягких тканей, инфекции мочевыводящих путей, периоперационная подготовка в хирургии.
III поколение:
1) Парентеральные (цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефоперазон + сульбактам);
2) Пероральные (цефиксим, цефибутен).
Базовыми АБ в этой группе являются цефтриаксон и цефотаксим, которые обладают высокой активностью в отношении Streptococcus spp., золотистого стафилококка, коринебактерий, менингококка, гонококков, H. influenzae и M. catarrhalis, пенициллиноустойчивых пневмококка и зеленящего стрептококка. Обладают высокой активностью в отношении практически всего семейства Enterobacteriaceae. Цефтазидим и цефоперазон обладают также активностью в отношении P. aeruginosа, но существенно меньшей активностью в отношении стрептококков. Цефиксим и цефибутен малоактивны в отношении Streptococcus spp., семейства Enterobacteriaceae и пневмококков. Показаниями являются средней степени и тяжелые внебольничные и нозокомиальные инфекции нижних дыхательных путей, мочевыводящих путей, кожи, мягких тканей, костей, суставов, интраабдоминальные инфекции, инфекции органов малого таза, менингит, сепсис, инфекции на фоне иммунодефицита. Цефиксим и цефибутен также назначаются при пиелонефрите легкой и средней степени тяжести у детей, беременных и кормящих женщин.
IV поколение:
1) Парентеральные (цефепим).
Близок по параметрам к препаратам III поколения, но также имеет высокую активность в отношении P. aeruginosa, Enterobacter spp., C. freundii, Serratia spp., M. morganii, P. stuartii, P. rettgeri и неферментирующих микроорганизмов. Показаниями являются тяжелые инфекции нижних дыхательных путей, мочевыводящих путей, кожи, мягких тканей, костей, суставов, вызванные полирезистентной микрофлорой, а также сепсис. К частым побочным эффектам цефалоспоринов относятся аллергические реакции и нарушение функции ЖКТ; могут наблюдаться судороги со стороны ЦНС, холестаз и псевдохолелитиаз со стороны печени. Аллергия перекрестная ко всем цефалоспоринам, также может наблюдаться перекрестная аллергия и с пенициллинами. В связи с низкой экскрецией у детей и пожилых людей период полувыведения цефалоспоринов у них увеличивается. Сочетание с аминогликозидами или петлевыми диуретиками может вызвать нефротоксический эффект. Антациды уменьшают всасывание пероральных форм.
Карбапенемы

Общая структура карбапенемов
Относятся к β-лактамным антибиотикам, по сравнению с пенициллинами и цефалоспоринами более устойчивы к действию β-лактамаз. К ним относятся импинем и меропенем. Механизм действия сходен с таковым у пенициллинов и цефалоспоринов. Обладают более широким спектром активности, действуя на многие Гр+ и Гр– бактерии. К ним чувствительны стафилококки, стрептококки, включая пневмококки, гонококки, менингококки, бактерии семейства Enterobacteriaceae, спорообразующие и неспорообразующие анаэробы.
Показания:
1. Вызванные полирезистентной и смешанной микрофлорой тяжелые инфекции нижних дыхательных путей, мочевыводящих путей, интраабдоминальные, органов малого таза, кожи и мягких тканей, сепсис;
2. Эндокардит, инфекции костей и суставов — только импинем;
3. Менингит — только меропенем.
Частые побочные эффекты: аллергические, нарушение функции ЖКТ, со стороны ЦНС — головокружение, тремор, судороги. Аллергические реакции перекрестные со всеми карбапенемами, а у 50 % пациентов также с пенициллинами. Нельзя применять с другими β-лактамными антибиотиками ввиду их антагонизма.
Монобактамы

1 — пенициллины; 2 — цефалоспорины; β-лактамное кольцо выделено красным.
Относятся к β-лактамным антибиотикам, в клинической практике применяется азтреонам, имеющий узкий спектр антибактериальной активности. Азтреонам используется как препарат резерва для лечения инфекций, вызванных Гр– микрофлорой. Активен в отношении бактерий семейства Enterobacteriaceae, P. aeruginosa, в том числе в отношении штаммов, устойчивых к аминогликозидам, пенициллинам, цефалоспоринам. Учитывая узкий спектр действия азтреонама, его следует назначать в сочетании с АБ, активными в отношении Гр+ микрофлоры. Препарат редко вызывает аллергические реакции, но часты реакции и со стороны ЖКТ, печени, ЦНС, почек. У пациентов с почечной и печеночной недостаточностью доза корригируется. Азтреонам не следует сочетать с карбапенемами ввиду их лекарственного антагонизма.
Аминогликозиды

Стрептомицин
Препараты этого класса являются практически ровесниками пенициллинов: первые из них открыты в 1944 году. В настоящее время насчитывается три поколения аминогликозидов:
I поколение:
II поколение:
III поколение:
Обладают нефротоксическим и ототоксическим эффектами. Могут приводить к нарушениям вестибулярного аппарата, блокировать нервно-мышечную передачу. Аминогликозиды нельзя смешивать вместе с β-лактамами и гепарином ввиду их физико-химической несовместимости. Нефротоксичность и ототоксичность усиливается при комбинировании их с другими нефро- и ототоксичными препаратами: полимиксином В, амфотерецином В, этакриновой кислотой, фуросемидом, ванкомицином. Нервно-мышечная блокада усиливается при комбинации с препаратами для ингаляционного наркоза, опиоидными анальгетиками, сульфатом магния.
Тетрациклины

Базовая химическая структура тетрациклинов
Как и пенициллины, являются одним из самых ранних классов антибиотиков. Были открыты в 40-х годах прошлого века, в настоящее время их применение ограничено. Обладают бактериостатическим эффектом, связанным с нарушением синтеза белка в микробной клетке. В настоящее время многие микроорганизмы обрели резистентность к тетрациклинам, но препараты (природный тетрациклин и синтетический доксициклин) сохраняют свое значение при риккетсиозах, хламидийных инфекциях, тяжелой угревой сыпи.
Тетрациклины обладают большим количеством побочных эффектов. Они нарушают функции ЖКТ, воздействуют на ЦНС (головокружение, повышение внутричерепного давления), вызывают нарушения метаболизма (нарушение белкового обмена с преобладанием катаболизма, нарастание азотемии), ведут к нарушениям образования костной ткани, вызывают перекрестные ко всем тетрациклинам аллергические реакции. Тетрациклины обладают очень высоким гепатотоксическим эффектом, вплоть до развития жировой дистрофии или некроза печени. Факторами риска гепатотоксичности являются быстрое внутривенное введение препарата, исходные нарушения функции печени, беременность, почечная недостаточность. При приеме тетрациклинов внутрь одновременно с антацидами, содержащими кальций, алюминий и магний, с натрия гидрокарбонатом и холестирамином может снижаться их биодоступность вследствие образования невсасывающихся комплексов и повышения рН желудочного содержимого. Не рекомендуется сочетать тетрациклины с препаратами железа, поскольку при этом может нарушаться всасывание и тех, и других. Карбамазепин, фенитоин и барбитураты усиливают печеночный метаболизм доксициклина и уменьшают его концентрацию в крови, что может потребовать коррекции дозы данного препарата или замены его на тетрациклин. При сочетании с тетрациклинами возможно ослабление эффекта эстрогеносодержащих пероральных контрацептивов. Тетрациклины могут усиливать действие непрямых антикоагулянтов вследствие ингибирования их метаболизма в печени, что требует тщательного контроля протромбинового времени. Имеются сообщения о том, что при сочетании тетрациклинов с препаратами витамина А возрастает риск синдрома псевдоопухоли мозга.