Бактериостатическое и бактерицидное действие в чем разница
Газета «Новости медицины и фармации» Антимикробная терапия (343) 2010 (тематический номер)
Вернуться к номеру
Характеристика основных групп антибактериальных препаратов, применяемых в медицине критических состояний
Авторы: В.И. Черний, А.Н. Колесников, И.В. Кузнецова и соавт., Кафедра анестезиологии, интенсивной терапии и медицины неотложных состояний факультета последипломного образования Донецкого национального медицинского университета им. М. Горького
Версия для печати
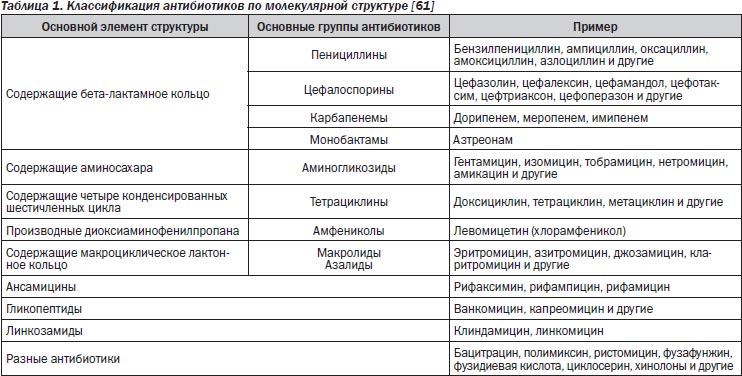
Антибиотики классифицируют по результату воздействия на микрофлору, химическому строению и механизму действия.
Основой классификации антибактериальных препаратов (АБП) является их химическое строение. Классификация антибиотиков в соответствии с их химическим строением приведена в табл. 1.
Формально под термином «антибиотики» понимают только те вещества, которые вырабатываются микробами. Следовательно, такие антибактериальные или противомикробные средства, как сульфаниламиды, хинолоны и триметоприм, строго говоря, не антибиотики.
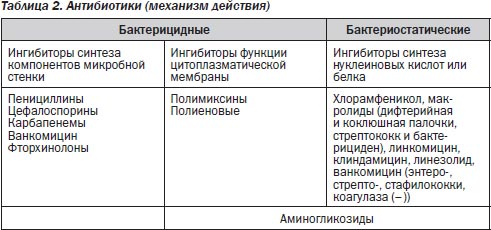
Если исходить из общетеоретических понятий бактерицидности и бактериостатичности, то эти понятия относительные, так как обе группы препаратов нарушают синтез белка в различных структурах клетки. Разница лишь в том, что бактерицидная активность зависит от величины концентрации препарата в биологических жидкостях, а бактериостатическая — не зависит или мало зависит от нее. По результату воздействия на микроорганизмы выделяют бактерицидные антибиотики — уничтожающие микробную клетку, и бактериостатические – подавляющие ее рост и размножение (табл. 2). Бактерицидные препараты используются при тяжелых острых инфекционных процессах. Острый инфекционный процесс обусловливается интенсивным делением клеток. Действие на делящиеся клетки с нарушением синтеза белка — процесс не длительный, поэтому препараты бактерицидного действия — недлительного применения, их используют до получения клинического эффекта.
Бактериостатические препараты — препараты длительного использования для лечения хронического течения или инфекций в стадии утихания острых процессов. Однако к макролидам, рифампицину, линкомицину, фузидину быстро развивается устойчивость, поэтому их рекомендуют применять короткими курсами до 5 дней. По механизму действия антибиотики, как правило, делят на 3 группы.
I группа — антибиотики, нарушающие синтез микробной стенки во время митоза: пенициллины, цефалоспорины (ЦС), карбапенемы, монобактамы (азтреонам), ристомицин, фосфомицин, гликопептидные препараты (ванкомицин, тейкопланин). По фармакологическому эффекту препараты этой группы являются бактерицидными антибиотиками.
II группа — антибиотики, нарушающие функцию цитоплазматической мембраны: полимиксины, полиеновые препараты (нистатин, леворин, амфотерицин В и др.).
По фармакологическому эффекту они также являются бактерицидными.
III группа — антибиотики, нарушающие синтез белков и нуклеиновых кислот: левомицетин, тетрациклины, линкозамиды (линкомицин, клиндамицин), макролиды (эритромицин, рокситромицин, азитромицин и др.), рифамицины, фузидин, гризеофульвин, аминогликозиды (АГ) (канамицин, гентамицин, нетилмицин и др.).
По фармакологическому эффекту они являются бактериостатическими. Исключение составляет амикацин, который действует бактерицидно независимо от концентрации.
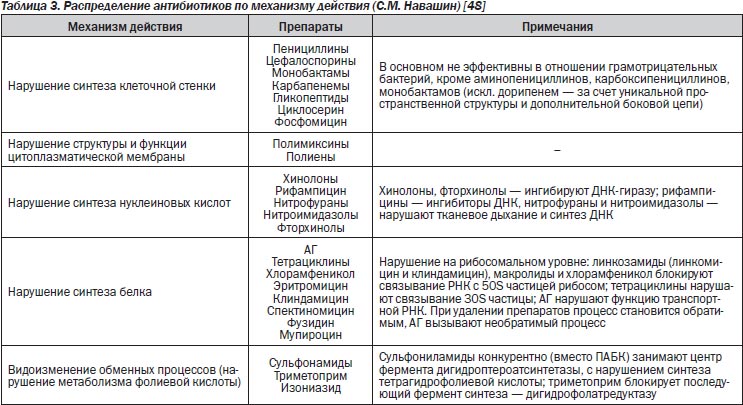
В последнее время принято разделение антибиотиков по механизму действия на 5 основных групп (табл. 3).
Характеристика основных групп АБП
С целью систематизации использования АБП существует перечень жизненно важных лекарственных средств ВОЗ (WHO Model List of essential Drugs) [11]. Представленный ВОЗ перечень является примерной моделью разработки такого списка в каждой стране с учетом особенностей местного здравоохранения. Как показывает практика, количество антимикробных препаратов примерно совпадает в разных странах. В своем обзоре мы хотим представить основные АБП, которые используются в медицине критических состояний.
Пенициллиназостабильные пенициллины. Спектр антимикробной активности оксациллина близок к природным пенициллинам (грамположительные бактерии), однако уровень активности против стрептококков и пневмококков в несколько раз ниже; не действует на энтерококки, гонококки и анаэробные бактерии. Основным отличием оксациллина от природных и других полусинтетических пенициллинов является устойчивость к стафилококковым бета-лактамазам — ферментам, разрушающим бета-лактамное кольцо пенициллинов.
Оксациллин — высокоактивное средство в отношении золотистого и коагулазонегативных стафилококков, однако не действует на стафилококки с другим механизмом устойчивости, так называемые метициллин- или оксациллинрезистентные стафилококки. Основные показания для оксациллина — инфекции, вызванные стафилококками, чувствительными к оксациллину, а также при предполагаемой стафилококковой этиологии (острый артрит, острый остеомиелит, неосложненные инфекции кожи и мягких тканей, эндокардит трикуспидального клапана). Адекватный режим дозирования оксациллина при госпитальных стафилококковых инфекциях — 2 г внутривенно с интервалом 4–6 ч. При пероральном приеме оксациллин плохо всасывается в пищеварительном тракте, поэтому предпочтительнее использовать клоксациллин или диклоксациллин.
Аминопенициллины обладают более широким спектром активности по сравнению с природными пенициллинами за счет некоторых грамотрицательных бактерий — E.coli, Shigella spp., Salmonella spp., Proteus mirabilis, Haemophilus influenzae (преимущественно внебольничные штаммы); препараты проявляют также активность в отношении анаэробных микроорганизмов, но уровень резистентности к ним высокий. В то же время аминопенициллины гидролизуются β-лактамазами стафилококков и грамотрицательных бактерий, поэтому не имеют в настоящее время существенного значения при лечении внутрибольничных инфекций.
Ампициллин применяется парентерально (при пероральном приеме низкая биодоступность) при внебольничной пневмонии, инфекционном эндокардите, менингите. Амоксициллин применяется при нетяжелых внебольничных респираторных инфекциях, а также может назначаться для замены ампициллина при ступенчатой терапии.
Ингибиторзащищенные аминопенициллины не разрушаются большинством бета-лактамаз грамотрицательных бактерий, в результате чего их спектр антимикробной активности по сравнению с незащищенными препаратами более широкий в отношении некоторых грамотрицательных бактерий (Klebsiella spp., Proteus vulgaris, Moraxella catarrhalis, Citrobacter diversus) и анаэробов (Bacteroides fragilis). Основное показание для применения ингибиторзащищенных пенициллинов в стационаре — интраоперационная профилактика послеоперационных гнойно-септических осложнений. С этой целью препарат вводится в однократной дозе за 30–60 мин до операции (амоксициллин/клавуланат 1,2 г (аугментин, амоксиклав), ампициллин/сульбактам (амписульбин) 3 г, уназин). Ингибиторзащищенные пенициллины высокоэффективны при абсцедирующей пневмонии и нетяжелых инфекциях малого таза. Амоксициллин/клавуланат (аугментин) также является базовым средством для лечения госпитализированных больных с внебольничной пневмонией среднетяжелого течения или обострением хронического бронхита. При госпитальных инфекциях (пневмония, перитонит, кожи и мягких тканей) значение этих препаратов невелико из-за существенного уровня резистентности основных возбудителей [4, 9, 14, 43, 45, 47, 48, 50, 52, 61, 83, 84, 91, 99].
Карбоксипенициллины и уреилопенициллины. Эти препараты обычно объединяют одним названием — антипсевдомонадные пенициллины. Они обладают более широким спектром активности по сравнению с аминопенициллинами (чувствительны к большинство бактерий семейства Enterobacteriaceae, Pseudomonas aeruginosa), однако эти препараты разрушаются β-лактамазами грамотрицательных бактерий и стафилококков, поэтому применение их в настоящее время ограничено. Основное показание — псевдомонадные инфекции, однако следует учитывать возросший уровень устойчивости P.aeruginosa к карбокси- и уреидопенициллинам. При псевдомонадной инфекции назначение этих препаратов (при установленной чувствительности!) следует комбинировать с аминогликозидами, использовать адекватные дозировки: карбенициллин внутривенно 4–5 г с интервалом 4 ч, пиперациллин внутривенно 2–4 г с интервалом 6–8 ч. При использовании антипсевдомонадных пенициллинов (особенно карбоксипенициллинов!) необходимо контролировать электролиты в крови и показатели свертываемости крови.
Защищенные антипсевдомонадные пенициллины. Имеют более широкие показания при внутрибольничных инфекциях, однако следует учитывать увеличившуюся в последние годы устойчивость грамотрицательных бактерий к этим препаратам. Тикарциллин/клавуланат (тиментин) и пиперациллин/тазобактам применяются в основном при смешанных аэробно-анаэробных инфекциях — интраабдоминальные и гинекологические инфекции, легочные нагноения. Целесообразно сочетание этих препаратов с аминогликозидами, особенно при тяжелых инфекциях. Режим дозирования тикарциллин/клавуланата составляет 3,2 г внутривенно с интервалом 6–8 ч, пиперациллин/тазобактама — 2,5–4,5 г с интервалом 8 ч. Наиболее интересен в клиническом плане тикарциллин/клавуланат (тиментин). Тикарциллин устойчив к действию цефалоспориназ, в т.ч. вырабатываемых бактериями семейства Enterobacteriacea. Клавулановая кислота (рис. 1) обеспечивает защиту тикарциллина от распада под действием β-лактамаз:
— хромосомных β-лактамаз грамотрицательных бактерий класса А;
— плазмидных β-лактамаз широкого и расширенного спектра.
Только тиментин активен в отношении Stenotrophomonas maltophilia, имеющей природную множественную лекарственную устойчивость, в том числе к карбапенемам.
Тиментин может быть использован в качестве средства стартовой монотерапии:
— при абдоминальных инфекциях;
— инфекциях кожи и мягких тканей;
— инфекциях костей и суставов;
— инфекциях дыхательных путей;
— инфекциях мочевыделительных путей;
— гинекологических инфекциях, эндометрите.
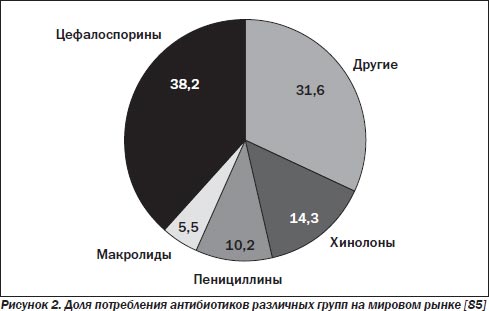
Цефалоспорины. Потребление цефалоспоринов «так резко возросло, что можно сравнить его с первоначальной реакцией на появление пенициллина» [85]. Они считаются самыми назначаемыми в отделениях интенсивной терапии (ОИТ) антибактериальными препаратами в мире (рис. 2).
В эту группу входят препараты с различным спектром антимикробной активности, поэтому в зависимости от спектра их разделяют на поколения. Общим для всех цефалоспоринов (кроме цефоперазон/сульбактама — сульперазон) является слабая активность в отношении анаэробных микроорганизмов (поэтому при смешанных инфекциях их следует комбинировать с метронидазолом или линкозамидами). Все ЦС не активны в отношении энтерококков, метициллинрезистентных стафилококков, листерий и атипичных микроорганизмов (легионелла, хламидии, микоплазма).
Цефалоспорины I поколения. Обладают преимущественной активностью в отношении грамположительных бактерий (стафилококки, стрептококки, пневмококки) и некоторых грамотрицательных — E.coli, Shigella spp., Salmonella spp., P.mirabilis. Однако в связи с широким распространением приобретенной устойчивости госпитальных штаммов грамотрицательных бактерий клиническое значение цефалоспоринов I поколения при этих инфекциях невелико. Основная область клинического применения цефазолина в стационаре — установленная стафилококковая инфекция различной локализации.
Цефалоспорины II поколения, представителем которых является цефуроксим (зинацеф, кимацеф), обладающие более широким спектром активности против грамотрицательных бактерий, находят более широкое применение при внутрибольничных инфекциях, однако в большинстве случаев их целесообразно сочетать с аминогликозидами. Цефуроксим эффективен при неосложненной внебольничной пневмонии. Препарат выбора для профилактики инфекционных осложнений после операций.
Цефалоспорины III поколения характеризуются высокой активностью в отношении грамотрицательных энтеробактерий, причем цефотаксим и цефтриаксон превосходят цефтазидим и цефоперазон. Принципиальное различие между этими препаратами заключается в действии на синегнойную палочку: цефотаксим и цефтриаксон не обладают значимой активностью против P.aeruginosa (их целесообразно выделить в подгруппу IIIа), цефтазидим и цефоперазон активны в отношении P.aeruginosa (цефтазидим несколько превосходит цефоперазон) — подгруппа IIIб. Соответственно различается и место этих цефалоспоринов при внутрибольничных инфекциях. Цефтазидим (фортум, цефтум) и цефоперазон (гепацеф, цефобид) являются базовыми препаратами при лечении установленных псевдомонадных инфекций или заболеваний с высоким риском наличия P.aeruginosa.
Одной из важнейших характеристик, определяющих эффективность антибактериальной терапии при гнойно-воспалительных заболеваниях, является резистентность возбудителей. Очевидно, что с ростом резиcтентности микроорганизмов к антибактериальным препаратам будет снижаться и эффективность стандартных режимов дозирования, что стимулирует разработку новых схем терапии.
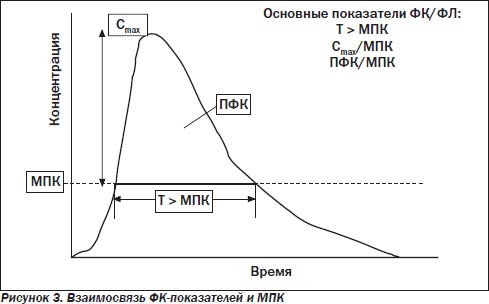
С современных позиций, чтобы понять зависимость между дозой АБП и его эффективностью, необходимо в совокупности рассматривать фармакокинетические — ФК (всасывание, распределение, метаболизм и экскреция АБП) и фармакодинамические — ФД (воздействие препарата на возбудителя в очаге инфекции, зависимость антимикробного эффекта от концентрации и времени воздействия АБП) показатели. Важнейшими из них в системе ФК/ФД, влияющими на исход лечения, являются:
— период времени (Т), в течение которого концентрация препарата в сыворотке крови превышает минимальную подавляющую концентрацию (МПК);
— отношение пиковой концентрации АБП (Сmax) и МПК;
— отношение площади под фармакокинетической кривой (ПФК) и МПК (рис. 3).
Среди многих классов АБП выделяют два основных типа антимикробной активности: времязависимый и концентрациязависимый.
К концентрациязависимым АБП относятся фторхинолоны (ФХ), аминогликозиды, кетолиды, азитромицин, метронидазол. Они обладают длительным постантибиотическим эффектом (ПАЭ), предотвращающим размножение микроорганизмов в течение некоторого времени после удаления АБП из среды, где растут бактерии. Основными ФК/ФД-показателями, определяющими клиническую и микробиологическую активность этих АБП, являются Сmax/МПК (наибольшая эффективность достигается при значениях > 10–12) и ПФК/МПК (хорошие результаты отмечены при значениях e = 25–30 у пациентов с нормальным функционированием иммунной системы и для Streptococcus pneumoniae, а при > 100–125 — у иммунокомпрометированных пациентов и для грамотрицательных бактерий).
Времязависимая активность характерна для β-лактамов (пенициллины, цефалоспорины, монобактамы, карбапенемы), макролидов (кроме азитромицина), гликопептидов, ко-тримоксазола, клиндамицина, тетрациклинов, линезолида.
Определяющий показатель ФК/ФД — время, в течение которого концентрация АБП превышает МПК. В опытах in vitro и на животных показано, что β-лактамы обладают максимальной антимикробной активностью при концентрациях, превышающих МПК возбудителя в 4–5 раз, а дальнейшее повышение концентрации не ведет к увеличению бактерицидного эффекта.
Разные классы β-лактамов имеют неодинаковый показатель Т > МПК, требуемый для достижения максимальной и поддерживающей бактерицидной концентрации. Его параметры зависят от вида возбудителя (киллинг Pseudomonas aeruginosa происходит при более высоких значениях временного интервала выше МПК), локализации очага инфекции (в тканях предстательной железы, костях создаются недостаточные концентрации β-лактамов), возраста пациентов (у пожилых больных на фоне угнетения экскреторных функций замедляется выведение из организма и возрастает концентрация АБП) и наличия или отсутствия у антибиотика ПАЭ в отношении конкретного микроорганизма. У пенициллинов и цефалоспоринов отсутствует ПАЭ на грамотрицательные бактерии.
У больных с иммунодефицитами для получения клинического эффекта необходимо стремиться, чтобы концентрация АБП превышала 5 МПК в течение 100 % длительности интервала дозирования.
Оптимальные процентные значения Т > МПК β-лактамов можно достигнуть за счет повышения (до известного предела) разовой дозы, уменьшения интервала между выделениями или увеличения продолжительности внутривенной инфузии суточной дозы антибиотика.
При стандартных режимах дозирования β-лактамов, основанных на интермиттирующем введении препарата с пиковыми подъемами и падениями концентраций в плазме соответственно выше и ниже МПК, может возобновляться размножение микроорганизмов с повышенной устойчивостью к антибиотику, который и осуществляет селекцию резистентных клеток в бактериальной популяции за счет возникающего после каждой инъекции «окна селекции резистентности», когда концентрация АБП в очаге выше уровня МПК чувствительных штаммов, но ниже концентрации, препятствующей селекции мутантных штаммов с повышенной резистентностью. Особое значение приобретает эффект инокулума, которому особенно подвержены антисинегнойные β-лактамы.
Режим продленной инфузии (ПИ) заключается в создании превышающей МПК концентрации β-лактама в плазме на постоянном уровне, что позволяет получить максимальный бактерицидный и клинический эффект и сократить «окно селекции», оставляя его только при первом и последнем введении антибиотика. Для достижения оптимальной концентрации > 4–5 МПК и снижения селекции резистентных штаммов в начале инфузии с первых минут терапии необходимо использовать нагрузочную дозу, которую вводят струйно (болюсно).
Во многих исследованиях было показано, что значения ФК/ФД-показателей сходны у разных видов животных и у человека, поэтому результаты экспериментов на животных моделях могут быть полезными при разработке режимов дозирования АБП в тех ситуациях, когда сложно собрать достаточное количество клинических данных, в частности при появлении нового антибиотикорезистентного штамма.
В исследованиях по изучению клинической эффективности β-лактамов при ПИ большинство работ посвящено цефтазидиму.
При выборе β-лактама для ПИ следует учитывать его стабильность в растворе при комнатной температуре в течение 12–24 ч, что чрезвычайно важно для сохранения активности препарата и снижения риска побочных эффектов, обусловленных продуктами распада антибиотика. Например, в растворе бензилпенициллина за 24 ч остается только 53 % активной формы антибиотика, а продукты его деградации при ПИ могут вызвать реакцию гиперчувствительности. Поэтому применение его в режиме ПИ возможно при условии приготовления раствора каждые 12 ч.
По той же причине для меропенема рекомендовано готовить свежие растворы каждые 8 ч.
Вследствие нестабильности растворов при комнатной температуре аминопенициллины и имипенем целесообразно назначать в интермиттирующем режиме.
Важное значение имеет физико-химическая совместимость β-лактама с параллельно назначаемыми препаратами других групп при комплексном лечении больного. К примеру, нельзя объединять их с аминогликозидами в одной инфузионной системе.
Преимущества ПИ более ощутимы для антибиотиков с коротким периодом полувыведения (у фортума 2 часа), требующим частого введения в течение суток, поэтому практически отсутствуют исследования по изучению цефтриаксона, у которого Т1/2 = 8,5 ч.
Суммируя преимущества ПИ, следует подчеркнуть, что в течение всего интервала дозирования можно поддерживать оптимальную плазменную концентрацию > 4–5 МПК, обеспечивающую лучшее проникновение антибиотика в очаг инфекции, которую при необходимости легче контролировать во избежание передозировки у пациентов с нарушением выделительных функций почек.
Клиническая эффективность ПИ не уступает назначению АБП в стандартном режиме, но при этом уменьшается риск селекции резистентных штаммов и снижается стоимость терапии в связи с более низкой суточной дозой препарата и сокращением трудовых затрат медперсонала, связанных с приготовлением растворов, выполнением инъекций и т.д.
Дозирование препарата фортум при назначении в режиме продленной инфузии: 1 г в/в в течение 30 мин в виде нагрузочной дозы, затем по 2 г в виде в/в инфузии в течение 12 часов 2 раза в сутки.
Цефоперазон, в высоких концентрациях проникающий в желчь, также показан для лечения инфекций желчевыводящих путей. Цефотаксим и цефтриаксон являются в настоящее время базовыми препаратами при лечении различных госпитальных инфекций. Уровень активности у этих цефалоспоринов одинаков, различия между ними связаны со скоростью элиминации: период полувыведения цефтриаксона составляет около 8 ч, поэтому препарат назначается в дозе 2 г с интервалом 24 ч, цефотаксим выводится быстрее, поэтому обычно дозируется 2 г с интервалом 6–8 ч.
Цефалоспорины IV поколения. Представлены в настоящее время одним препаратом — цефепимом (квадрицеф), обладающим наиболее широким и сбалансированным спектром антимикробной активности среди цефалоспориновых антибиотиков. Клинически важно, что цефепим может сохранять активность в отношении некоторых штаммов Enterobacteriaceae (прежде всего Enterobacter spp., Serratia spp., Morganella morganii, Providencia rettgeri, C.freundii, являющихся гиперпродуцентами хромосомных бета-лактамаз класса С), резистентных к цефалоспоринам III поколения. Цефепим проявляет активность в отношении некоторых штаммов Klebsiella spp., продуцирующих бета-лактамазы расширенного спектра, однако ряд штаммов устойчив. Основная область применения цефепима в клинике — тяжелые внутрибольничные инфекции, особенно в случае резистентных к цефалоспоринам III поколения энтеробактерий. Цефепим может применяться в клинике в схемах ротации, т.е. для временной замены в схемах эмпирической терапии цефалоспоринов III поколения в случае высокой к ним резистентности. Показано, что периодическая ротация цефалоспоринов III поколения на цефепим в отделениях реанимации и интенсивной терапии (ОРИТ) позволяет ограничить рост устойчивых штаммов микроорганизмов и даже восстановить чувствительность микробов к цефалоспоринам III поколения.
Ингибиторзащищенные цефалоспорины. Комбинация антипсевдомонадного цефалоспорина III поколения цефоперазона и ингибитора бета-лактамаз сульбактама — цефоперазон/сульбактам (сульперазон) — обладает более широким спектром действия, чем ЦС III поколения, за счет сохранения активности против энтеробактерий и анаэробов, продуцирующих β-лактамазы, в том числе расширенного спектра (ESBL), и разрушающих другие ЦС. Препарат применяется при лечении тяжелых госпитальных инфекций различной локализации, причем при смешанных аэробно-анаэробных инфекциях — в режиме монотерапии.
— достигает высоких терапевтических концентраций в различных тканях и жидкостях при в/в, в/м введении и сохраняет;
— нет данных об аккумулировании при многократном введении;
— может применяться у пожилых пациентов, детей и индивидуально у пациентов с умеренной и средневыраженной почечной недостаточностью;
— имеет низкий уровень взаимодействия с другими препаратами;
— сульбактам меньше индуцирует β-лактамазу, чем клавулановая кислота.
Цефоперазон/сульбактам обладает активностью против широкого спектра возбудителей:
— Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pneumoniae, Streptococcus pyogenes;
— Haemophilus influenzae, Moraxella catarrhalis, Enterobacteriaceae (Klebsiella pneumoniae, Enterobacter spp., Proteus spp., Escherichia coli);
— Bacteroides fragilis, Bacteroides spp., Fusobacterium и Peptostreptococcus spp.
Цефоперазон/сульбактам (сульперазон) подходит в качестве эмпирической терапии при многих инфекционных заболеваниях:
— инфекции дыхательных путей (верхних и нижних отделов);
— перитонит, холецистит, холангит и другие инфекции брюшной полости;
— инфекции кожи и мягких тканей;
— инфекции костей и суставов;
— воспалительные заболевания малого таза, эндометриты, гонорея и другие инфекции половых органов.
Карбапенемы [4]. На украинском фармрынке представлены четырьмя антибиотиками — имипенемом/циластатином (тиенам, ластинем, пропенем), меропенемом (меронем, ронем, мезонекс), дорипеном (дорибакс) и эртапенемом (инванз).
Характеризуются наиболее широким спектром антимикробной активности среди всех бета-лактамных антибиотиков — грамположительные и грамотрицательные аэробные бактерии, анаэробы. Из возбудителей внутрибольничных инфекций природную устойчивость к карбапенемам (но не к дорибаксу) проявляют только три микроорганизма: Enterococcus faecium, Stenotrophomonas maltophilia, а также метициллинрезистентные штаммы Staphylococcus spp. Клинически важно, что вторичная устойчивость госпитальных штаммов микроорганизмов к карбапенемам развивается крайне редко (исключение — P.aeruginosa). Резистентность P.aeruginosa к карбапенемам выше и в ОРИТ может достигать 15–20 % (исключение — дорибакс). Карбапенемы сохраняют активность в отношении штаммов Enterobacteriaceae, резистентных к цефалоспоринам III и IV поколений, аминогликозидам и фторхинолонам. Имипенем характеризуется несколько более высокой активностью in vitro в отношении грамположительных микроорганизмов, меропенем проявляет более высокую активность в отношении грамотрицательных бактерий (клинически эти различия, вероятно, не значимы); активность препаратов против анаэробов одинакова и превосходит таковую у метронидазола и линкозамидов. Новый карбапенем — эртапенем, MSD (инванз), характеризуется отсутствием действия на P.aeruginosa и назначается 1,0 г 1 раз в сутки; способ введения: внутримышечно и внутривенно. Уникальный карбапенем дорипенем (дорибакс) обладает высокой активностью как в отношении грамположительных, так и в отношении грамотрицательных микроорганизмов и в 2–4 раза активнее в отношении P.aeruginosa по сравнению с другими карбапенемами. Кроме того, дорибакс (дорипенем) имеет самый низкий потенциал развития резистентности со стороны патогенов нозокомиальных инфекций по сравнению с другими карбапенемами, что позволяет препарату оставаться эффективным длительное время.
Карбапенемы применяются для лечения тяжелых внутрибольничных инфекций, вызванных полирезистентной и смешанной микрофлорой, прежде всего при неэффективности препаратов первого ряда — цефалоспоринов или фторхинолонов. В контролируемых клинических исследованиях показано, что карбапенемы равноэффективны или превосходят стандартные комбинированные режимы антибактериальной терапии на основе цефалоспоринов (или полусинтетических пенициллинов) и аминогликозидов.
Основные показания для карбапенемов: интраабдоминальные инфекции, послеоперационные раневые инфекции, внутрибольничная пневмония, в том числе связанная с искусственной вентиляцией легких (ИВЛ), легочные нагноения (абсцесс, эмпиема), инфекции органов малого таза, осложненные инфекции мочевыводящих путей с сепсисом, остеомиелит, менингит (только меропенем). Следует подчеркнуть, что при жизнеугрожающих инфекциях карбапенемы следует рассматривать не как резервные средства, а как антибиотики первого ряда, так как прогноз у тяжелых больных может быть улучшен только в случае более раннего назначения адекватной антибактериальной терапии. К таким ситуациям прежде всего следует отнести инфекционные осложнения у больных в ОРИТ, находящихся на ИВЛ (особенно при APACHE II > 20), инфекции, вызванные P.aeruginosa и Acinetobacter spp., грамотрицательными бактериями (прежде всего Klebsiella spp., P.vulgaris), продуцирующими бета-лактамазы расширенного спектра, инфекции у больных с иммунодефицитом (фебрильная нейтропения), гнойный послеоперационный менингит, вызванный грамотрицательными бактериями или P.aeruginosa.
Аминогликозиды. Выделяют препараты трех поколений. АГ I поколения (стрептомицин, канамицин) в настоящее время применяются исключительно во фтизиатрии. АГ II поколения (гентамицин, тобрамицин) и III поколения (нетилмицин, амикацин (амикин, амицил)) широко применяются в клинической практике. АГ обладают широким спектром природной антимикробной активности, однако препараты слабо действуют на стрептококки и пневмококки и не активны в отношении анаэробных бактерий. Наиболее высокие значения МПК in vitro против грамотрицательных бактерий отмечаются у амикацина, однако это компенсируется более высокими дозами амикацина по сравнению с другими аминогликозидами и, соответственно, более высокими сывороточными концентрациями. Уровень приобретенной резистентности грамотрицательных бактерий существенно варьирует и различается между различными аминогликозидами. Устойчивость к аминогликозидам нарастает в следующем порядке: амикацин Список литературы