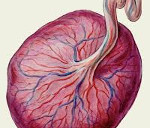
Базальный децидуит что это такое
Плацентит
Плацентит – это воспаление плаценты, которое возникает под действием неинфекционных и инфекционных факторов. Патология плаценты может проявиться на любом сроке, симптомы зависят от выраженности воспаления. Плацентит приводит к дисфункции фето-плацентарного комплекса, его исходом становятся плацентарная недостаточность, задержка развития плода, внутриутробное инфицирование. Значительно возрастает риск преждевременных родов и гибели новорожденного. Для диагностики используется УЗИ, которое позволяет заметить нарушение структуры плаценты, плацентарного кровотока. Лечение плацентита проводится антибиотиками, а также препаратами, улучшающими функцию плаценты.
МКБ-10
Общие сведения
Плацентит – инфекционно-воспалительное заболевание, чаще всего является результатом восходящего распространения инфекции. У 98% женщин приводит к неблагоприятному течению беременности и развитию осложнений. Угроза прерывания, ассоциированная с плацентитом, отмечается у 76% беременных. В большинстве случаев плод страдает от внутриутробной гипоксии, 9% детей рождается с признаками гипотрофии. Инфекция вызывает несвоевременное излитие вод у 38% беременных, у трети женщин это приводит к аномалиям родовой деятельности. Риск внутриутробного инфицирования существует у 6% детей, которые развиваются в условиях плацентита.
Причины плацентита
У всех беременных наблюдается физиологическая иммуносупрессия, вызванная повышением выработки прогестерона. При наличии очагов хронической или острой инфекции она может распространиться на плаценту. Чаще всего инфицирование происходит восходящим путем из влагалища через шейку матки. К плацентиту приводят различные виды микроорганизмов и действие неинфекционных факторов:
Патогенез
Воспаление может возникать в различных слоях плаценты. Воспалительная реакция сопровождается миграцией лейкоцитов и инфильтрацией тканей, нарушением кровообращения, которое вызвано микротромбозами межворсинчатого пространства, микроинфарктами, ишемией концевых ворсин. Также определяется полнокровие и отек стромы. В зависимости от вовлеченного слоя различают следующие формы плацентита:
Плацентит не всегда приводит к инфицированию плода, но может сказаться на состоянии эндометрия после родов и ухудшить прогнозы для следующих беременностей. Одновременно внутриутробная инфекция у ребенка может протекать без признаков плацентита. Такой вариант течения наблюдается при некоторых вирусных инфекциях. Для каждого типа возбудителя характерна своя гистологическая картина.
Симптомы плацентита
Патология может быть следствием острой либо хронической инфекции. У нее нет специфических проявлений, при латентном течении симптомы могут вовсе отсутствовать. Учитывая восходящий путь инфицирования, беременную могут беспокоить вагинальные выделения. Они могут быть белыми, с желтоватым или сероватым оттенком, с неприятным запахом или без него. При остром течении вагинита из-за близкого расположения мочеиспускательного канала появляются дизурические расстройства. Женщина жалуется на неприятные ощущения во время мочеиспускания, походы в туалет становятся чаще. Выделения сопровождаются зудом и жжением, покраснением половых губ.
Боль внизу живота является следствием воспаления. При плацентите и возникновении угрозы преждевременных родов боли появляются в нижней части матки. Они тянущие, ноющие, могут отдавать в промежность или поясницу. На появление угрозы прерывания беременности указывает тонус матки, схваткообразная боль. Плод реагирует на недостаток кислорода увеличением двигательной активности или снижением количества шевелений. Настороженность должны вызывать подтекание околоплодных вод или их дородовое излитие. Это повод срочно обратиться за медицинской помощью в гинекологическое отделение на сроке до 22 недель, а на более позднем сроке – в роддом.
Осложнения
Плацентит вызывает осложнения беременности, некоторых из них становятся показанием для досрочного родоразрешения. У каждой 5-ой беременной отмечается преждевременное излитие околоплодных вод. Для беременных с плацентитом характерна плацентарная недостаточность. При декомпенсации состояния у плода развивается острая гипоксия, которая может привести к антенатальной гибели или тяжелым повреждениям центральной нервной системы ребенка. Чем раньше возник плацентит, тем выше вероятность тяжелых осложнений. Течение беременности может осложниться гестозом, внутриутробной инфекцией ребенка, преждевременными родами.
Диагностика
При нарушении самочувствия, боли в животе, появлении выделений из половых путей беременной необходимо обратиться к врачу акушеру-гинекологу, у которого она состоит на учете. Объем диагностических процедур подбирается индивидуально, опираясь на клинические проявления, данные анамнеза и предыдущих исследований. Базовая диагностика плацентита проводится неинвазивными инструментальными методами:
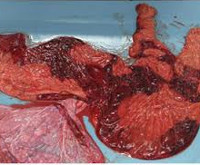
Подтверждается плацентит после родов. Плодное место с оболочками и пуповиной отправляется на гистологическое исследование. По его результатам можно предположить тип инфекции, если обследование не проводилось во время беременности. Для нормального восстановления в послеродовом периоде и профилактики эндометрита назначается лечение.
Лечение плацентита
Женщина с плацентитом госпитализируется для проведения качественного обследования, лечения и выбора акушерской тактики. Консервативная терапия оправдана при недоношенной беременности и признаках незрелого плода, но при сохранении его нормальной гемодинамики. При некупирующейся острой гипоксии плода и в других тяжелых случаях показано досрочное родоразрешение путем кесарева сечения. При плацентите проводится:
Прогноз и профилактика
При плацентите прогноз зависит от срока развития воспаления и способностей организма компенсировать сосудистые нарушения. Для плода плацентраная недостаточность увеличивает риск задержки развития, внутриутробного инфицирования и гипоксии, которая может завершиться внутриутробной гибелью. Профилактика плацентита заключается в прегравидарной подготовке, своевременном лечении хронических воспалительных процессов половых органов. Мазки на чистоту влагалища, которые берутся при постановке на учет, позволяют вовремя заметить воспалительные изменения, провести дополнительное обследование и лечение.
Исследование плода и плаценты при врожденных пороках развития, несовместимых с жизнью
Целью исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к индуцированному прерыванию беременности по медицинским показаниям, структурные изменения в последе при наличии пороков развития. Проведено ран
The aim of the study was to reveal the structure of fatal congenital malformations of the fetus, leading to the induced interruption of pregnancy due to medical indications, structural changes in the afterbirth in the presence of malformations. The randomized comparative study was conducted in 2 stages (retrospective and prospective).
Врожденные пороки развития (ВПР) плода считают важнейшей медицинской и социальной проблемой, поскольку они занимают ведущее место в структуре причин перинатальной, неонатальной и младенческой заболеваемости, смертности и инвалидности [1]. Также актуальной является проблема прерывания беременности в поздние сроки по медицинским показаниям со стороны плода, так как на ее долю приходится около 20% от общего числа абортов, а количество осложнений возрастает в 3–4 раза при прерывании беременности во втором триместре по сравнению с первым [2]. Согласно данным ВОЗ, ВПР отмечают у 4–6% детей. В России ежегодно более 50 000 детей рождаются с ВПР, число пациентов с ВПР превышает 1,5 млн человек. При наличии у плода ВПР, несовместимых с жизнью, или сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, женщине предоставляется информация о возможности искусственного прерывания беременности по медицинским показаниям [3]. При отказе женщины прервать беременность из-за наличия ВПР, несовместимых с жизнью, или иных сочетанных пороков беременность ведется в соответствии с разделом I настоящего порядка. Высокие затраты на лечение, уход и реабилитацию детей с ВПР обусловливают необходимость разработки и совершенствования не только методов контроля, диагностики и профилактики ВПР у детей, но и изучения патоморфологии плода и последа [4].
В последние десятилетия интенсивно изучаются многочисленные антенатальные факторы, приводящие к повреждению нервной системы плода — внутриутробные инфекции, генетические дефекты, проблемы резус-конфликта, воздействие на плод лекарственных веществ и целый ряд других факторов. Нередко причинами врожденных пороков развития плода и последа являются инфекционные причины: инфекционные фетопатии формируются с 16-й недели, когда происходит генерализация инфекции у плода, вследствие чего могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [5].
Большое количество работ посвящено методам прерывания беременности в позднем сроке по медицинским показаниям со стороны плода — врожденным порокам развития плода, реабилитации женщин после элиминации плода [6–11]. В то же время недостаточно описаны результаты патологоанатомического исследования плода и плаценты при врожденных пороках, несовместимых с жизнью. Наше исследование посвящено прерыванию беременности во втором триместре по медицинским показаниям со стороны плода. Данная публикация посвящена вопросам патологоанатомического исследования плода и последа.
Целью данного исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к прерыванию беременности по медицинским показаниям, их сочетания со структурными изменениями в последе.
Материалы и методы исследования
Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ МЗ РФ, Омск (№ 63 от 09.10.2014 г.) и выполнено на базе БУЗОО ГКПЦ, Омск. Прерывание беременности во II триместре по медицинским показаниям проводилось согласно Распоряжению Министерства здравоохранения Омской области № 308-р от 17.09.2013 г. в указанном учреждении, где был создан центр по прерыванию беременности второго триместра и женщине выдавалось заключение перинатального консилиума специалистами (акушер-гинеколог, перинатолог, неонатолог и др.). Гистологическое исследование элиминированных плодов и плацент проведено согласно рекомендациям А. П. Милованова и осуществлялось в патологоанатомическом отделении БУЗОО ОДКБ, Омск.
Основным показанием к прерыванию беременности на всех этапах являлись ВПР плода, несовместимые с жизнью. При наличии у плода ВПР, несовместимого с жизнью, или наличии сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, предоставлялась информация о возможности искусственного прерывания беременности по медицинским показаниям. Искусственное прерывание беременности проводилось при наличии информированного добровольного согласия женщины.
На первом ретроспективном этапе (до внедрения в практику регламентирующих документов [3, 12]) проведен анализ гистологического исследования плацент после прерывания беременности у 150 женщин, которые в зависимости от метода прерывания были разделены на две группы: группу А составили 75 женщин, которым проведено прерывание беременности в поздние сроки методом трансвагинального трансцервикального амниоцентеза: амниоинфузия 10% раствором хлорида натрия. Группу Б составили 75 женщин, которым с целью прерывания беременности в поздние сроки для возбуждения и стимуляции родовой деятельности использовали гель динопростон для эндоцервикального введения. Более подробно методы прерывания беременности, их эффективность и исходы описаны в наших предыдущих публикациях [13–15]. Критериями включения пациенток в группы А и Б были следующие: срок беременности 18–21 неделя 6 дней, возможность родоразрешения через естественные родовые пути и отсутствие противопоказаний к применению гипертонического раствора хлорида натрия (10% NaCl) и простагландинов. Пациентки обеих групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Все пациентки были консультированы в медико-генетическом отделе.
На втором этапе под проспективным наблюдением было 195 беременных, разделенных на две группы. Основную группу составили 98 женщин, которым проведено прерывание беременности в поздние сроки следующим комбинированным методом: мифепристон перорально и введение ламинарий в цервикальный канал. В группу сравнения были включены 97 женщин, прерывание беременности которым проводилось по схеме ВОЗ. Критерии включения в группы: пациентки, которым дано заключение консилиума врачей для прерывания беременности по медицинским показаниям со стороны плода в сроки гестации 18–21 неделя согласно приказам МЗСР РФ № 736 от 03 декабря 2007 г. [16] и № 572н от 01.11.2012 [3].
На проспективном этапе исследования материалом для изучения послужили результаты патоморфологического исследования плодов (аутопсийного материала) и последов (макроскопическое и микроскопическое). В работе использованы антропометрические, органометрические, гистологические методы. С целью уточнения гестационного возраста плода и дополнительных скрытых аномалий развития в соответствии с имеющимися стандартами использовали антропометрические и органометрические исследования [17–20]. Гистологические исследования органов плода, плодных оболочек, пуповины и плаценты проводили на парафиновых срезах, изготовленных по общепринятой методике и окрашенных гематоксилином и эозином, а также избирательно пикрофуксином по методу Ван Гизона. Для гистологического исследования предварительно материал фиксировали в 10% нейтральном формалине, после промывки и стандартной проводки заливали в парафин. Парафиновые срезы толщиной 3–5 мкм окрашивали гематоксилином и эозином. Элементы соединительной ткани определяли пикрофуксином по методу Ван-Гизона. Методы гистологического исследования выполнялись по прописям, изложенным в классических руководствах по гистологической технике и гистохимии. Обследование элиминированных плодов включало тщательную визуальную оценку имеющихся стигм эмбриогенеза, врожденных пороков. Для гистологического исследования отбирали фрагменты органов с целью изучения их гистоархитектоники [17].
Использовался способ статистической обработки результатов по критерию t таблиц Стьюдента, позволяющий вычислить степень достоверности различий при небольшом числе наблюдений. Перед каждым вычислением достоверности различий между количественными признаками, а также для выбора критерия корреляции оценивали нормальность их распределения по критерию Колмогорова–Смирнова. В случае ненормального распределения количественных признаков или неравенстве дисперсий применялся U-критерий Манна–Уитни. Для факторов, имеющих биноминальное распределение, дополнительно были рассчитаны 95% доверительные интервалы.
Результаты исследования
Пациентки всех групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Эффективность прерывания беременности в поздние сроки методом амниоцентеза составила 93,3%, при применении простагландинов — 92%, на проспективном этапе не имела достоверных различий и составила 99,0% в основной группе и 96,9% — в группе сравнения.
В структуре выявленных ВПР плода на первом месте в основной группе были врожденные пороки сердечно-сосудистой системы (34 наблюдения — 34,7%), на втором — пороки центральной нервной системы (ЦНС) (29 наблюдений — 29,6%), на третьем — множественные пороки развития (13–13,3%), на четвертом — пороки мочевыводящей системы (9–9,2%) (табл. 1). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (7–7,1%) и другие (6–6,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие. В группе сравнения на первом месте также были врожденные пороки сердечно-сосудистой системы (32 наблюдения — 33,0%), на втором — пороки ЦНС (30 наблюдений — 30,9%), на третьем — множественные пороки развития (15–15,5%), на четвертом — пороки мочевыводящей системы (10–10,3%). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (8–8,2%) и другие (2–2,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие.
Среди пороков сердечно-сосудистой системы в обеих группах чаще наблюдались транспозиция магистральных сосудов, дефекты межжелудочковой и межпредсердной перегородок, общий артериовенозный канал, тетрада Фалло, сочетанные пороки сердца, аномалии Эбштейна, гипоплазия левого отдела, прочие врожденные пороки сердечно-сосудистой системы.
В структуре пороков ЦНС чаще наблюдалась гидроцефалия, анэнцефалия, синдром Арнольда–Киари и Денди–Уокера, микроцефалия, агенезия мозолистого тела, акрания, spina bifida (спинномозговая грыжа). Гидроцефалия — заболевание, характеризующееся избыточным накоплением цереброспинальной жидкости в желудочках и подоболочечных пространствах головного мозга, сопровождающееся их расширением и атрофией мозгового вещества.
В ходе ретроспективной оценки исследования последов в группе А в подавляющем большинстве наблюдений (78,7%) определялись серозно-гнойный и гнойно-некротический децидуит и лишь в небольшом проценте случаев (21,3%) наблюдался серозный децидуит. Также в этой группе отмечалось наличие дисциркуляторных нарушений (выраженный отек стромы ворсин, тромбоз межворсинчатого пространства, ретроплацентарные гематомы). В группе Б серозный париетальный децидуит определялся в большинстве случаев (54,7%), воспалительные изменения не определялись в 38,7% наблюдений, серозно-гнойный париетальный децидуит обнаружен в 6,6% случаев.
На ретроспективном этапе при исследовании последа в большей степени были обнаружены патологическое строение и пороки развития пуповины, чем в плаценте. Так, на первом месте среди признаков патологического строения пуповины была тощая пуповина: 19 наблюдений в основной группе (19,4%) и 21 (21,6%) в группе сравнения (табл. 2). На втором месте определялись ложные узлы пуповины: 16 (16,3%) и 17 (17,5%) соответственно исследуемым группам, на третьем месте — истинные узлы пуповины: 14 (14,2%) и 15 (15,5%). Нередко в структуре патологических вариантов строения пуповины было оболочечное прикрепление пуповины: 12 (12,2%) и 9 (9,3%) соответственно. Реже были выявлены гипо- и гиперизвитая пуповина: 8 (8,2%) и 7 (7,2%) соответственно исследуемым группам; единственная артерия пуповины: 6 (6,1%) и 4 (4,1%); гематома пуповины: 1 (1,0%) в основной группе и 2 (2,1%) в группе сравнения. Всего при исследовании нарушения строения пуповины были выявлены в 76 случаях основной группы и в 75 — группы сравнения, в целом в исследовании — в 77,4% наблюдениях.
При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения (23 наблюдения — 23,5% в основной группе и 29–30,0% в группе сравнения). Серозный париетальный децидуит определялся в 17,3% наблюдений основной группы и 16,5% группы сравнения. Такие скудные изменения в плаценте, выявленные при исследовании, свидетельствуют о том, что ВПР плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с нарушениями строения и пороками развития плаценты. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Таким образом, в структуре выявленных ВПР плода, несовместимых с жизнью, в исследуемых группах на первом месте были врожденные пороки сердечно-сосудистой системы, на втором — пороки ЦНС, на третьем — множественные пороки развития, на четвертом — пороки мочевыводящей системы. В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата и другие: желудочно-кишечного тракта, дыхательной системы, шеи и лица, прочие.
При гистологическом исследовании плаценты ретроспективного этапа (до внедрения в акушерскую практику современных методов производства позднего индуцированного аборта) при проведении амниоинфузии гипертоническим раствором в подавляющем большинстве определялись серозно-гнойный и гнойно-некротический мембранит, при применении динопростона чаще наблюдался серозный париетальный децидуит. После внедрения в работу акушерско-гинекологической службы регламентирующего Приказа 572н при гистологическом исследовании плаценты у пациенток второго этапа обеих групп отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения.
При исследовании последа чаще встречались пороки развития пуповины, чем плаценты. На первом месте среди признаков патологического строения пуповины была тощая пуповина, на втором месте — ложные узлы пуповины, на третьем — истинные узлы. Реже определялось оболочечное прикрепление пуповины. Значительно реже были выявлены гипо- и гиперизвитая пуповина, единственная пупочная артерия; гематома пуповины. При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения. Скудные изменения в плаценте (в сравнении с изменениями в пуповине), выявленные при исследовании, свидетельствуют о том, что врожденные пороки развития плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с плацентарными пороками. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Литература
* ФГБОУ ВО ОмГМУ МЗ РФ, Омск
** БУЗОО ОДКБ, Омск
Взаимодействие возбудителей инфекции с организмом беременной как фактор риска внутриутробного инфицирования плода
Опубликовано в журнале:
Российский Вестник Акушера Гинеколога »» том 4, №5б 2005
Е.И. БОРОВКОВА
Кафедра акушерства и гинекологии (зав. — член-корр. РАМН проф. И.С. Сидорова) ФППОВ ММА им. И.М. Сеченова
Interactions of infecting agents with pregnant host as a risk factor of intrauterine fetal infection
Большая часть заболеваний беременных, приводящих к внутриутробному инфицированию плода, протекает в субклинической форме, что значительно затрудняет диагностику данной патологии в антенатальном периоде. Опубликованная статистика свидетельствует, что от 27 до 36% детей, рожденных живыми, в числе которых более 2 /3 недоношенных, внутриутробно инфицированы. В структуре смертности новорожденных инфекционная патология является определяющей причиной, обусловливая от 11 до 45%, мертворо-ждаемость достигает 16%.
В результате инфекционной патологии половых путей у беременных в 13 раз увеличивается частота самопроизвольных выкидышей, в 6 раз — преждевременных родов, в 3 раза — хориоамнионита, в 4—5 раз — эндометрита. При этом проведение специфической терапии, направленной на элиминацию возбудителя из организма, зачастую оказывается неэффективным или дающим временный эффект, приводя к рецидиву заболевания в 30—50% случаев.
Особенности клинического течения внутриутробной инфекции плода объясняют трудности постановки диагноза в антенатальном периоде и определения прогноза для новорожденного. Внутриутробное инфицирование как проблема обусловливается полиэтио-логичностью патологии; трудностью антенатальной диагностики; многофакторным (специфическим и неспецифическим) воздействием инфекционного агента на плод, отсутствием четких корреляций между тяжестью инфекционно-воспалительного заболевания матери и степенью поражения плода; неоднозначным подходом к проведению лечебно-профилактических мероприятий у беременных и новорожденных. В развитии инфекционного заболевания у плода, в тяжести поражения, локализации патологического процесса, темпах реализации и проявления возникшей патологии имеют значение вид возбудителя, его вирулентность, пути проникновения микроорганизмов от матери к плоду, тропизм возбудителя к органам и тканям плода, защитные резервы матери и способность плода к иммунному ответу.
Поскольку спектр возбудителей, способных привести к внутриутробному инфицированию плода, весьма широк, была выделена группа инфекций, распространенных в популяции и имеющих сходные клинические проявления и вызывающих у плода стойкие структурные дефекты различных систем и органов. Эта группа была объединена и обозначена аббревиатурой «TORCH», где Т — toxoplasmosis (токсоплазмоз), О — other (другие инфекции, среди которых абсолютные — сифилис, хламидиоз, энтеровирусы, гепатит А, В, гонорея, листериоз; вероятные — корь, паротит и гипотетические — грипп А, папилломавирусная инфекция), R — rubeola (краснуха), С — cytomegalia (ЦМВ), Н — herpes (герпесвирусная инфекция).
Общепринято различать четыре пути внутриутробного инфицирования, получивших определения восходящего, гематогенного, нисходящего и контактного (часто разделяемого на интранатальный и трансму-ральный). В 89% случаях инфекция реализуется путем восходящего распространения наружной уроге-нитальной инфекции (бактериальной и вирусной), что может произойти при любых видах инициирующих агентов. Показана зависимость этого процесса от состояния местного иммунитета и анатомо-физиологи-ческих свойств шейки матки. Предрасполагающими факторами развития внутриутробного инфицирования восходящим путем при наличии наружной уро-генитальной инфекции являются срок беременности (гравидарная стадия), изменение барьерных свойств плодовых оболочек, нарушение анатомо-физиологи-ческих свойств шейки матки, частичный разрыв плодных оболочек, длительный безводный промежуток, проведение инструментальных методов диагностики. Гематогенный путь инфицирования характерен в основном для вирусных заболеваний, а также нередко отмечается при латентном носительстве токсоплазм. Нисходящий путь возможен у женщин с очагами хронического воспаления в яичниках и маточных трубах. Контактное инфицирование плода нередко развивается в ходе родов при непосредственном контакте с инфицированными тканями родового канала или трансдецидуально, при имеющейся инфекционной патологии матки.
Существование единой биологической системы «мать—плацента—плод» служит основанием для выделения в патогенезе внутриутробного инфицирования «материнской», «последовой» и «плодной» стадий развития. Стадийность определяется не только этапами распространения патологического процесса из урогенитальной системы матери к тканям плода, но и очередностью включения в процесс защитно-приспособительных систем. «Материнская» стадия отражает начальный этап инфекционной агрессии, формально ограниченной пределами наружных отделов урогенитальной системы беременной женщины. Характерной особенностью «материнской» стадии является нередко латентное течение урогенитальных инфекций, которое в определенной мере зависит от эффективности местных иммуноклеточных реакций в репродуктивной системе беременных, в первую очередь в шейке матки.
Выделены возможные факторы риска развития внутриутробного инфицирования:
1. Обострение хронической инфекции, имеющейся у беременной (хронические заболевания органов ды хания, пищеварения, кариес, тонзиллит). Урогениталь- ные инфекции (пиелонефрит, бактериурия, кольпит, эндоцервицит, ИППП). Дисбактериоз кишечника и бактериальный вагиноз.
2. Осложнения беременности: анемия, гестоз, ист- мико-цервикальная недостаточность, обострение хро нических заболеваний и ОРВИ, перенесенные во вто рой половине беременности.
3. ОРВИ в родах, дородовое излитие околоплодных вод, патология родовой деятельности, применение аку шерских пособий.
Установлено, что у беременных из группы риска бактериальный вагиноз в I триместре выявляется в 90%, во II триместре — в 64,1%, в III триместре — в 48,6%.
«Последовая» стадия служит продолжением прогрессирующего воспалительного процесса в мочеполовой системе беременной или возникает при общих инфекционных заболеваниях, сопровождающихся ви-русемией или бактериемией. Послед обладает высокой антибактериальной устойчивостью в связи с накоплением в амниотической жидкости и плодных оболочках лизоцима, трансферрина, р-лизина, опсони-нов, пероксидазы, IgG и наличием клеточных защитных факторов, таких как лейкоциты и макрофаги. При восходящем инфицировании значение имеет состояние фильтрационных свойств плодных оболочек, а также те лейкотропные вещества, которые по мере размножения бактерий накапливаются в околоплодной жидкости и выступают в качестве первичных медиаторов воспалительной реакции. Эпителий амниона способен адсорбировать на своей поверхности бактерии, в том числе хламидии. В тканях амниотической оболочки находятся подвижные клетки Кащенко— Гофбауэра, обладающие функциями макрофагов. Эти клетки появляются впервые в конце 4-й недели гес-тации и к 9—10-й неделе приобретают выраженную макрофагальную активность. Антимикробная активность околоплодных вод в отношении многих видов условно-патогенных микроорганизмов выражена слабо и может задерживать их рост в течение нескольких часов (от 3 до 12ч), но не подавлять. Плодовые оболочки, особенно при максимальном их растяжении в конце беременности, проницаемы для многих условно-патогенных микроорганизмов, поэтому заражение плода может происходить и при целом плодном пузыре. Возбудитель беспрепятственно проникает в околоплодные воды, где происходит его интенсивное размножение и накопление. Ответная реакция на инфицирование околоплодных вод отсрочена по времени и возникает со стороны материнского организма после накопления в околоплодных водах определенного количества микробных токсинов и метаболитов.
«Плодная» стадия означает распространение инфекционного агента на органы плода, что свидетельствует о несостоятельности не только маточно-пла-центарного, но и плацентарно-плодового антимикробного барьера. Неполнота воспалительной реакции в раннем онтогенезе определяется несовершенством функциональной системы «мать—плацента—зародыш (эмбрион, плод)».
Важнейшим фактором развития внутриутробного инфицирования является период беременности, в котором происходит инфицирование беременной женщины. Так, в I триместре беременности риск инфицирования составляет 15%, во II триместре — 45%, а в III — 70%. Тяжесть заболевания у новорожденного имеет обратную зависимость. Выделены эмбриональный, фетальный и антенатальный этапы развития беременности. В эмбриональный этап беременности (I триместр) возникновение любого инфекционного процесса в организме матери является серьезной угрозой. В связи с незавершенным формированием маточно-плацентарного барьера эта угроза может реализоваться путем восходящего или гематогенного инфицирования плодного пузыря, что ведет к тяжелым воспалительным осложнениям и раннему выкидышу, или лежит в основе дальнейшей патологии беременности, обусловленной различными эмбриопатиями и пороками развития плода. При этом в первом случае в качестве этиологического фактора обычно выступает различная бактериальная инфекция, а во втором — вирусные агенты. Существование в ранние сроки беременности в формирующейся плаценте выраженного слоя цитотрофобласта препятствует проникновению к плоду некоторых возбудителей, в частности спирохет.
В III триместре беременности сохраняется высокая опасность трансплацентарного распространения многих бактериальных и особенно вирусных агентов, что обусловлено инволюционными изменениями и повышением проницаемости фетоплацентарного барьера. Отмеченная опасность многократно возрастает, если инфекционная патология плаценты берет начало в более ранние сроки беременности.
Таким образом, своевременное выявление и направленное лечение инфекционной патологии половых путей, может служить одним из путей снижения частоты неблагоприятных перинатальных исходов в результате внутриутробной инфекции.
Нами было проведено оригинальное исследование, позволившее выявить прогностические критерии угрозы выкидыша инфекционной природы в I триместре беременности, которые по данным клинико-мик-робиологического исследования могли бы быть определены как прогностические, необходимые и достаточные. Для подтверждения влияния факторов риска на течение и исход беременности наша работа выполнялась в 3 этапа. На 1-м этапе мы проанализировали все случаи рождения детей с признаками внутриутробной инфекции. При этом из выборки были исключены пациентки, перенесшие во время беременности острые или обострение хронических инфекций урогенитальной и экстрагенитальной локализации, а также имеющие патологическое течение родов. В рамках 1-го этапа было выявлено, что каждая вторая беременная, родившая ребенка с признаками внутриутробной инфекции, в I триместре перенесла угрозу прерывания. Обобщение данных 1-го этапа позволило сформировать основную и контрольную группы и провести второй этап исследования. В основную группу вошли 80 беременных с клиникой начавшегося самопроизвольного выкидыша. Контрольная группа была сформирована из 80 клинически здоровых беременных, поступивших в клинику для прерывания беременности. На 3-м этапе изначально сформированные группы были рандомизированы на две подгруппы для проведения более углубленного обследования. Таким образом, объем исследования на 2-м этапе составил 160 человек, на 3-м этапе — 80 человек.
Выборки пациенток были сопоставимы по возрасту. Средний возраст беременных 1-го этапа составил 25,6 года, второго и третьего этапов 27,2—28 лет.
При поступлении в клинику у большинства пациенток с начавшимся выкидышем были выявлены жалобы на тянущие боли внизу живота и кровянистые выделения из половых путей (76%). На 1-м этапе отмечено преобладание в структуре экстрагенитальной патологии у пациенток хронических инфекционных заболеваний органов дыхания (16,2%) и мочевыделения (21,6%). В ходе 2-го и 3-го этапов было обнаружено, что среди пациенток с начавшимся выкидышем в 3 раза чаще встречались заболевания сердечно-сосудистой системы, в 6 раз чаще регистрировались заболевания органов желудочно-кишечного тракта, в 5 раз чаще выявлялись хронические заболевания органов дыхания, а среди заболеваний органов мочевыде-лительной системы каждая восьмая беременная страдала хроническим пиелонефритом. Выявленная в группе беременных с начавшимся выкидышем частота экстрагенитальной патологии создает неблагоприятный фон и влияет на течение беременности. Полученные результаты подтверждают актуальность проведения общеоздоровительных мероприятий и пре-гравидарной подготовки среди женщин репродуктивного возраста. Высокая частота инфекционной и соматической патологии приводит к выраженным изменениям иммунного статуса, что, возможно, способствует активации условно-патогенных мироорганиз-мов и перемещению их в несвойственные места обитания.
Предыдущие беременности закончились самопроизвольным выкидышем или артифициальным абортом у 27% родильниц 1-го этапа. На 2-м и 3-м этапах преобладали повторнобеременные — 61 (76%) и 64 (80%) соответственно группам. Общее число беременностей у пациенток основной группы в 1,7 раз превышало таковое в контрольной группе, а среди исходов беременностей артифициальные аборты встречались примерно в каждом втором случае в основной и контрольной группах. Самопроизвольное прерывание беременности в 3 раза чаще регистрировалось у пациенток основной группы. Физиологическими родами закончились предыдущие беременности у 20 (25%) обследованных основной и 36 (45%) контрольной группы.
Течение I триместра у пациенток 1-го этапа и беременных с начавшимся выкидышем осложнялось угрозой прерывания (48,6% и 100%) и ранним токсикозом (29,7% и 41%). В контрольной группе чаще имел место ранний токсикоз (26%). Сочетание 2—3 осложнений беременности в I триместре отмечено у 37,5% пациенток основной группы.
Таким образом, представители выборочных совокупностей были сопоставимы по возрасту, частота регистрируемой экстрагенитальной и гинекологической патологии отмечалась в достоверно большем проценте случаев среди пациенток с начавшимся выкидышем. Полученные данные, даже без применения специальных методов исследования, свидетельствуют о том, что наличие у беременных в I триместре гинекологической и экстрагенитальной патологии существенно повышает риск развития прерывания беременности. Более углубленное обследование в основной и контрольной подгруппах на третьем этапе включало бактериологическое, иммунологическое, ультразвуковое исследование. Из специальных методов диагностики, используемых в работе, ведущим являлось бактериологическое исследование с изучением про-светного и пристеночного биоценозов влагалища и шеечного канала, а также элементов хориона. Помимо стандартной методики забора материала из влагалища и шейки матки, мы использовали цитощетки, позволяющие получить неотторгнутые эпителиальные клетки, и таким образом оценить состояние пристеночного микробиоценоза. Необходимо отметить, что характер локализации микроорганизмов косвенно свидетельствует об их активности и способности вызывать инфекционную патологию. В нашей работе мы доказали принципиальную необходимость исследования именно пристеночной микрофлоры, так как постановка диагноза только на основании просветного компонента микробиоценоза зачастую является неполной или ошибочной.
Иммунологическое исследование включало в себя определение концентраций иммуноглобулинов класса А, М, G и секреторного IgA в слизистом секрете цервикального канала и влагалища. Оценку показателей производили с помощью диагностических моно-рецепторных антисывороток к иммуноглобулинам человека класса А, М, G, используя набор для реакций радиальной иммунодиффузии по Манчини.
Результаты ультразвукового исследования показали, что большинство беременных основной и контрольной подгрупп (60% и 62,5%) находились в сроке беременности от 9 до 12 нед. В результате нашей работы было подтверждено, что к ультразвуковым признакам внутриутробной инфекции относятся:
У беременных с начавшимся выкидышем выявлялись повышение тонуса миометрия и деформация плодного яйца в 90% и наличие ретрохориальной гематомы в 60%. Только у пациенток основной подгруппы была выявлена патология экстраэмбриональных структур, выражающаяся в гипоплазии хориона (15%) и гипоплазии амниона (10%). Кроме того, у пациенток с начавшимся выкидышем достоверно чаще определялась патология экстраэмбриональных структур, подозрительная в отношении внутриутробного инфицирования плода: гипоплазия желточного мешка (10%), увеличение размеров желточного мешка (17,5%), ам-ниотические тяжи (7,5%), раннее маловодие (10%). Неразвивающаяся беременность диагностировалась в 4 раза чаще у беременных основной подгруппы (у 12 — 30% и у 3 — 7,5% соответственно).
Микробиологическое исследование показало, что пристеночная микрофлора влагалища и шеечного канала у беременных не идентична просветной флоре по количественному и качественному составу. Пристеночный слой влагалищного микробиоценоза в большем количестве состоял из коринебактерий (с 3,5 до 5,5 lg КОЕ/мл), бацилл (с 5 до 6 lg КОЕ/мл), прево-телл и актиномицет (с 0 до 7,5 lg КОЕ/мл). У пациенток с начавшимся выкидышем отсутствовали бифи-добактерии как в просветных, так и в пристеночных слоях. У беременных с начавшимся самопроизвольным выкидышем количественные различия микробиоценоза цервикального канала выражаются в увеличении в пристеночной флоре количества пропио-нибактерий (с 2,5 до 3,3 lg КОЕ/мл), бацилл (с 4,5 до 5,5 lg КОЕ/мл), грибов кандида (с 3 до 4 lg КОЕ/мл). В качественном составе изменения проявлялись в исчезновении в пристеночной флоре энтеробактерий, появлении псевдомонад и отсутствии бифидобактерий.
У пациенток с физиологическим течением беременности по мере приближения к каналу шейки матки состав микроорганизмов количественно и качественно снижался, характеризуясь уменьшением от просветной к пристеночной флоре количества лактобак-терий (с 7 до 5,8 lg КОЕ/мл), бифидобактерий (с 5 до 3,7 lg КОЕ/мл), коринебактерий (с 7 до 4,5 lg КОЕ/мл), стрептококков (с 4 до 2 lg КОЕ/мл), пептострептококков (с 5,1 до 4,1 lg КОЕ/мл). В пристеночной флоре влагалища появлялись актиномицеты (4,5 lg КОЕ/мл).
Анализ частоты выделения микроорганизмов у беременных с начавшимся выкидышем показал увеличение в пристеночной флоре влагалища стрептококков с 20 до 35%, стафилококков с 45 до 75%, пеп-тострептококков с 50 до 60%, превотелл с 0 до 5%, актиномицет с 0 до 5%. Из пристеночной флоры цервикального канала чаще выделяются стрептококки с 7,5 до 25%; стафилококки с 35 до 50%; превотеллы с 5 до 10%; бациллы с 5 до 10%; бактероиды с 10 до 25%.
У пациенток с физиологическим течением беременности практически все микроорганизмы из отделяемого влагалища высеваются с меньшей или с одинаковой частотой. Из слизи цервикального канала все микроорганизмы высеваются реже, чем из содержимого как просветной, так и пристеночной частей влагалища.
Таким образом, беременные с начавшимся самопроизвольным выкидышем имеют более инфицированные половые пути как за счет увеличения числа и интенсивности колонизации микроорганизмами, так и за счет увеличения частоты их выделения. Выявленные различия просветного и пристеночного слоев микрофлоры в половых путях подтверждают необходимость изучения пристеночного микробиоценоза, а также его ведущего значения в развитии воспалительных процессов, так как пристеночно могут быть локализованы микроорганизмы, обладающие выраженной активностью. У здоровых беременных общая обсеме-ненность половых путей микроорганизмами значительно ниже, а просветная и пристеночная микрофлора во влагалище и цервикальном канале не имеет выраженных качественных отличий.
В результате работы была выявлена зависимость клинического течения I триместра беременности от состояния микробиоценоза половых путей. У 65% пациенток с начавшимся выкидышем выявлен дисбиоз влагалища различной степени выраженности. Пролонгирование беременности отмечено только у пациенток с нормоценозом и промежуточным типом микробиоценоза. Неразвивающаяся беременность выявлена у 56% пациенток с дисбактериозом II степени и у 100% пациенток с дисбактериозом III степени. У каждой пятой беременной с клиникой начавшегося выкидыша выявлен кандидозный кольпит.
У 70% пациенток с неосложненным течением беременности преобладал нормоценоз влагалища, а промежуточный тип встречался у каждой 4-й пациентки. Кандидозный кольпит не был выявлен ни в одном случае.
Таким образом, среди пациенток с клиникой начавшегося самопроизвольного выкидыша в 13 раз чаще выявляется дисбактериоз влагалища, а кандидозный кольпит диагностируется у каждой 5-й пациентки по сравнению с беременными с неосложненным течением гестационного процесса. Промежуточный тип микробиоценоза влагалища диагностируется с равной частотой у беременных обеих подгрупп.
Одним из показателей защищенности организма от внешних факторов является состояние колонизационной резистентности (КР) слизистых, обеспечиваемое флорой Додерлейна (в которую входят лакто-бактерии, бифидобактерии и пептострептококки) и факторами местного иммунитета. При оценке состояния колонизационной резистентности слизистых у 70% беременных с начавшимся выкидышем были выявлены низкие показатели КР. Только у 30% пациенток показатели КР были расценены как высокие. От уровня колонизационной резистентности практически не зависит уровень колонизации влагалища беременных дрожжеподобными грибами рода Candida, численность которых у пациенток с высокой КР также высока, но они высеваются в 1,2 раза реже, чем у беременных с низкой КР. У пациенток с физиологическим течением беременности слизистые оболочки влагалища в 73% имеют высокие показатели КР. Ни у одной пациентки с физиологическим течением беременности не был диагностирован кандидозный кольпит.
При изучении показателей местного иммунитета половых путей было выявлено, что у пациенток с начавшимся выкидышем имеет место сдвиг в локальном иммунном статусе, выражающийся в снижении количества IgG (0,059 мг/мл) и в увеличении количества IgA (0,038 мг/мл) в слизистой пробке церви-кального канала. Количество IgM и slgA находилось в пределах нормальных значений.
С целью верификации роли условно-патогенных микроорганизмов в развитии прерывания беременности при проведении морфологического исследования были изучены элементы ворсинчатого хориона, плодного яйца и децидуальной оболочки, полученные при выскабливании стенок полости матки у 18 (45%) пациенток основной подгруппы и 40 (100%) беременных контрольной подгруппы. По данным литературы морфологическими маркерами неспецифической внутриутробной инфекции являются признаки острого экссудативного и продуктивного воспаления децидуальной оболочки и ворсин хориона, экссудатив-но-некротический мембранит, очаговый или диффузный фибринозно-десквамативный интервиллузит. При этом продуктивные воспалительные реакции характерны для гематогенного пути распространения возбудителей, а экссудативные — для восходящего. В 83% материалов, полученных от пациенток с начавшимся выкидышем, были выявлены признаки острого экссудативного децидуита, что является свидетельством восходящего пути инфицирования. Признаки продуктивного децидуита, свидетельствующие о возможном гематогенном пути распространения инфекционного агента, были выявлены в 17% образцов. При исследовании материала, полученного при выскабливании стенок полости матки у пациенток контрольной подгруппы, острый экссудативный децидуит был выявлен в 2 (5%) случаях. Данные морфологического ис-ледования были сопоставимы с ультразвуковыми и микробиологическими находками. Все случаи неразвивающейся беременности были подтверждены морфологически, а большинство пациенток с начавшимся выкидышем и дисбактериозом влагалища различной степени выраженности имели признаки восходящего инфицирования полости матки, что свидетельствует о ведущей роли инфекционных агентов в развитии прерывания беременности в I триместре ее развития.В группе здоровых пациенток в 93% случаев стадийность гравидарного процесса была определена как прогрессирующая маточная беременность. Неразвивающаяся беременность и пустые зародышевые мешки выявлялись в 5 и 2,5% случаев соответственно. В материалах 5% пациенток с физиологическим течением беременности был выявлен экссудативный децидуит.
Доказанное влияние условно-патогенной флоры на течение и исходы беременности в I триместре, восходящее инфицирование плодного яйца и эмбриона являются показанием для проведения лекарственной терапии. Существующий постулат о недопустимости лекарственной терапии в I триместре в настоящее время подвергается сомнению. Однако арсенал медикаментозных средств, разрешенных для применения в первые недели беременности, крайне узок. Среди них: бетадин, гексикон (раствор хлоргексидина), пимафу-цин, раствор молочной кислоты, но даже после проведения полных курсов терапии рецидивы заболевания отмечаются в 50—80% случаев, что требует поиска более эффективных и безопасных препаратов, уместных для применения в I триместре беременности. Таким препаратом является тержинан, комбинированный препарат, предложенный французской лабораторией «Бушара Рекордати», который может быть использован с 10-й недели беременности. В состав препарата входят тернидазол (200 мг), неомицина сульфат (100 мг), нистатин (100 000 ЕД), преднизолон (3 мг), масло гвоздики и герани в составе эксципиента. Тернидазол, относящийся к группе нитроимидазолов, обладает противопротозойным действием, подавляет развитие трихомонад, бактероидов, фузобактерий и др. Эффективен в отношении облигатных анаэробов. Нистатин активно воздействует на дрожжеподобные грибки рода Candida albicans. Неомицина сульфат — антибиотик широкого спектра действия, высокоактивен в отношении грамотрицательных микроорганизмов (сине-гнойной палочки, кишечной палочки, клебсиеллы, эн-теробактера и др.), а также грамположительных микроорганизмов (стафилококков, стрептококков). Преднизолон — глюкокортикоид, обладающий выраженным противовоспалительным, противоаллергическим, им-муносупрессивным, антиэкссудативным и противозуд-ным действием, снижает проницаемость капилляров, улучшает микроциркуляцию. На сегодняшний день тержинан — один из немногих препаратов, обладающий широким спектром действия за счет удачно подобранной комбинации составных частей.
Таким образом, в результате нашего исследования было доказано, что нарушение микробиоценоза половых путей является прогностическим критерием, позволяющим выделить беременных в I триместре в группу риска по развитию угрозы выкидыша и внутриутробного инфицирования плода. Ведущее значение в инфицировании плода имеет пристеночная микрофлора, которая не идентична просветной по количественному и качественному составу. При выявлении дисбиоза половых путей необходимо проводить санацию влагалища, начиная с I триместра беременности. Для беременных с угрозой выкидыша характерен дисбаланс в местном иммунном статусе, выражающийся в снижении уровня IgG и увеличении количества IgA.
_575.gif)