Базовый риск хромосомных болезней у плода что это
Если при ультразвуковом исследовании найдены маркеры хромосомной патологии плода
Если при ультразвуковом исследовании были найдены маркеры (признаки) хромосомной патологии плода, то это еще не означает, что у плода есть хромосомная патология, и надо обязательно прерывать беременность. Всем женщинам, у которых были найдены ультразвуковые маркеры хромосомной патологии плода, предлагается инвазивная пренатальная диагностика – хорионбиопсия/плацентобиопсия с целью взятия клеток плода и их тонкого микроскопического анализа.
Хорионбиопсия – это взятие нескольких ворсинок из хориона плода под ультразвуковым контролем и подсчет количества хромосом в его клетках. Хорион – орган плода, из которого потом образуется плацента. Его клетки идентичны клеткам плода. Поэтому если количество и структура хромосом в клетках хориона нормальны, то хромосомные болезни у плода исключаются с вероятностью более 99%.
Как проводится хорионбиопсия
Тонкой иглой через переднюю брюшную стенку делается укол, игла проходит в хорион и в нее попадает несколько ворсинок хориона. Процедура проводится в амбулаторных условиях, используются одноразовые перчатки и стерильные иглы, поэтому риск инфицирования во время процедуры практически отсутствует.
Каковы риски проведения хорионбиопсии
Любая процедура, даже простейший анализ крови, имеет риск осложнений. При проведении хорионбиопсии тоже есть риск – риск прерывания беременности. Однако, при соблюдении всех правил проведения процедуры этот риск не превышает 1%. Поэтому в тех случаях, когда индивидуальный риск хромосомной патологии плода достаточно высок, должна быть выполнена эта процедура.
На сегодняшний день в мире не разработано другого метода, позволяющего получить для исследования клетки плода, не выполняя внутриматочного вмешательства. В то же самое время, исключить или подтвердить диагноз болезни Дауна или другой хромосомной патологии можно только при исследовании клеток плода, которые были получены при внутриматочном вмешательстве.
Когда проводится хорионбиопсия
Хорионбиопсия выполняется до 14 недель беременности, после этого срока на месте хориона образуется плацента и тогда проводится уже плацентобиопсия. Техника выполнения и риск при плацентобиопсии принципиально не отличаются от хорионбиопсии.
Мы надеемся, что эта информация поможет Вам лучше понять, для чего мы проводим эти исследования, и преодолеть тот естественный страх перед процедурой, который вызывает неизвестность и те непрофессиональные сведения, которые иногда печатаются в немедицинских источниках.
В нашем центре вы можете пройти инвазивную диагностику хромосомных болезней плода и получить полный ответ уже через 3-4 дня (в некоторых случаях – через 24 часа).
Пренатальный скрининг; хромосомные аномалии
Частота врожденных пороков развития составляет 2-3%, еще 5% новорожденных имеют так называемые малые аномалии. Причинные факторы их являются гетерогенными и включают хромосомные аномалии, моногенные заболевания, влияние тератогенов, материнские заболевания (инсулинзависимый сахарный диабет, фенилкетонурия), инфекции (краснуха, цитомегалия и др). Но большинство врожденных аномалий развития является мультифакториальными, т.е. зависят от комбинации генетических факторов и воздействия агрессивных факторов внешней среды.
Что такое пренатальный скрининг
Пренатальный скрининг, диагностика и лечение является относительно новой проблемой в акушерстве. Началом пренатального скрининга была, возможно, эра ультразвуковой диагностики в акушерстве, которая началась около двух десятилетий назад. С открытием новых генов и их фенотипов становится все более возможным пренатальный генетический диагноз. Следует различать понятия скрининга и диагностики.
Пренатальный скрининг позволяет выявить индивидов высокого риска осложнений среди популяции индивидов с низким риском осложнений. Специфичность и чувствительность скрининговых тестов очень важны, учитывая возможность ложноположительных и ложноотрицательных результатов скрининга.
Пренатальная диагностика, конечно, более специфическая, чем скрининг (например, амниоцентез или биопсия хориона), но имеет и больший риск осложнений. Первым шагом по определению риска для плода является скрининг матери о наличии определенных состояний или заболеваний.
Нередко возникает вопрос о вероятности роста частоты врожденных пороков у потомков семейных пар, которые получали лечение по поводу бесплодия. Тяжелая олигоспермия и азооспермия ассоциируются со сбалансированными транслокациями хромосом (3-5%), синдромом Кляйнфельтера (47, ХХУ), аномалиями и микроделеции У-хромосомы.
Аномалии Х-хромосомы (ХХУ, ХХХ, Х-мозаицизм при синдроме Тернера) ассоциируются с пониженной фертильностью (субфертильностью), а также увеличением риска хромосомных аномалий у потомков. В 2/3 пациентов с врожденным отсутствием семявыносящих протоков имеет место хотя бы одна мутация гена, который отвечает за развитие кистозного фиброза. Итак, эти пациенты подлежат скринингу на наличие кистозного фиброза. Таким пациентам обычно показана интрацитоплазматическая инъекция сперматозоида в яйцеклетку, хотя наличие мутантного гена по кистозному фиброзу может влиять на репродуктивные намерения.
Хромосомные аномалии
Старший возраст матери является фактором риска хромосомных аномалий в связи с увеличением возможности нерасхождения хромосом в процессе мейоза. Фертилизация гаметы с одной лишней хромосомой приводит к образованию продукта оплодотворения с 47 хромосомами. Следовательно, растет частота анеуплоидии — количества хромосом в продукте оплодотворения, большей или меньшей 46. Нерасхождение хромосом может иметь место в аутосомах (трисомия 21, 13, 18) или половых хромосомах (моносомия 45, Х, или трисомия 47, ХVV, 47, ХХХ и др). Несбалансированные транслокации хромосом сопровождаются аномальным количеством хромосомного материала (целой хромосомы или ее части). Риск для ребенка зависит от типа транслокации.
Факторы риска рождения детей с хромосомными аномалиями
Частота хромосомных аномалий у живых новорожденных составляет 0,5%, у мертворожденных — 5%, у абортусов при самопроизвольных выкидышах — 50%. Частой хромосомной аномалией является анеуплоидия — увеличение или недостаток одной хромосомы. У рожденных живыми наиболее часто встречаются такие хромосомные аномалии, как трисомия 21 (1: 800), трисомия 18 и трисомия 13.
Трисомия 16 наиболее часто приводит к самопроизвольным выкидышам, а в случае трисомии 18 в большинстве случаев имеет место мертворождение. При наличии в анамнезе трисомии у плода риск рецидива при повторной беременности составляет 1%. В случае триплоидии обычно имеет место самопроизвольный аборт или гестационная трофобластическая болезнь. В редких случаях ребенок может родиться с триплоидией, но продолжительность жизни не превышает 1 года.
Хромосомные аномалии часто сопровождаются выраженными фенотипическими проявлениями и врожденными пороками развития, хотя их не всегда можно обнаружить при ультразвуковом скрининге.
Наиболее точным методом диагностики хромосомных аномалий является исследование кариотипа плода. Для некоторых хромосомных синдромов (синдром Дауна) существуют скрининговые тесты, например тройной тест:
1) уровень а-фетопротеина;
3) уровень в-субъединицы ХГЧ в сыворотке крови матери.
Синдром Дауна
Трисомия 21 или избыточная 21 хромосома, вызывает синдром Дауна. Наличие такого кариотипа часто является причиной самопроизвольного выкидыша или мертворождения. Но, несмотря на «пренатальные фильтры», ежегодно рождаются несколько тысяч детей с синдромом Дауна. Риск этого заболевания имеет значительную зависимость от увеличения возраста родителей.
Типичный фенотип синдрома Дауна включает низкий рост, плоское лицо, эпикант, гипертелоризм, поперечную складку ладоней, задержку физического и умственного развития, хотя коэффициент интеллекта (10) может колебаться от 40 до 90. Ассоциированные аномалии представлены пороками развития сердца, дуоденальной атрезией или стенозом, короткими конечностями. В 50% случаев синдром Дауна можно заподозрить при ультразвуковом обследовании, но низкая чувствительность не позволяет использовать УЗИ как скрининговый метод. Современный скрининг синдрома Дауна заключается в использовании тройного теста: АФП (снижение), эстриол (снижение) и ХГЧ (повышение) в сроке 15-19 нед гестации.
Трисомия 18
Трисомия 18 (синдром Эдвардса) — вариант трисомии, который также может быть обнаружен при использовании тройного теста. Этот синдром является несовместимым с жизнью пациентов старше 2 лет и нередко является причиной антенатальной или неонатальной смерти. Синдром Эдвардса сопровождается многочисленными врожденными аномалиями, которые могут быть обнаружены при УЗИ, делает возможным ультразвуковой скрининг.
Типичными признаками синдрома Эдвардса есть сжатые кулаки, искривленные пальцы и др. Ассоциированные с этим синдромом врожденные аномалии включают пороки сердца (дефект межжелудочковой перегородки, тетрада Фалло), омфалоцеле, диафрагмальную грыжу, дефекты нервной трубки, кисты хориоидного сплетения в боковых желудочках мозга и др.
Трисомия 13
Трисомия 13 (синдром Патау) имеет много черт, подобных трисомии 18. Около 85% этих детей умирают до 1 года жизни. Ассоциированные аномалии включают голопрозэнцефалию, щель губы и неба, кистозный гигром, аномальную форму или отсутствие носа, омфалоцеле, гипоплазию левых отделов сердца, аномалии конечностей (сжатые кулаки и согнуты ступни), полидактилию, чрезмерное сгибание пальцев.
В случае синдрома Патау тройной тест не всегда является чувствительным, но эта аномалия обычно может быть диагностирована при рутинном ультразвуковом скрининге.
Робертсоновские транслокации — это соединение между двумя акроцентрическими хромосомами (13, 14, 15, 21, 22) в области их центромеры, что создает новую хромосому. Носители таких хромосом обычно генетически сбалансированными, но существует риск несбалансированных транслокаций у потомков, а также риск самопроизвольных выкидышей. Робертсоновские транслокации хромосомы 21 приводит к развитию синдрома Дауна (риск составляет 10-15%, если носителем транслокации является мать, и 1-2% — если отец).
Реципрокные транслокации возникают при разрыве хромосом и обмене сегментами между двумя различными хромосомами. Сбалансированные носители имеют нормальное количество хромосом (46), тогда как в их потомков увеличивается риск несбалансированных транслокаций, делеций и дупликаций хромосомного материала, что приводит к аномальному фенотипу.
Микроделеции хромосом — субмикроскопические делеции хромосом, которые в некоторых случаях могут быть обнаружены только при использовании молекулярной диагностики и РИ8Н-анализа, но иногда приводят к развитию выраженных клинических синдромов. Скрининг таких состояний рекомендуется при наличии в анамнезе рождения детей с микроделецией хромосом.
Цитологическая диагностика
Флюоресцентная гибридизация используется с целью выявления субмикроскопических делеций и дупликаций хромосом, которые являются слишком маленькими для идентификации методами конвенциональной цитогенетики. Ее также используют для идентификации «мягких» транслокаций и маркерных хромосом. РИ8Н-анализ выполняется на препарате метафазных хромосом, выделенных из культивируемых лимфоцитов, амниоцитов, ворсинок хориона, интерфазных ядер из крови, тканей, ворсинок хориона, амниотической жидкости при пренатальном выявлении аномалий развития плода и необходимости скрининга на анеуплоидии (трисомия 21 и т.д.). РИ8Н-анализ применяется с целью преимплантационной генетической диагностики по выявлению сбалансированных транслокаций или делеций. РИ8Н-метод предоставляет информацию по анализу специфической хромосомы или нескольких хромосом, но не выполняется для определения кариотипа.
Аномалии половых хромосом
Наиболее частыми аномалиями половых хромосом является синдром Тернера (моносомия Х, или 45, Х0, мозаицизм) и синдром Кляйнфельтера (47, ХХУ). Это может быть обусловлено тем обстоятельством, что кариотипы 47, ХХХ и 47, ХVV не имеют выраженных фенотипических различий и поэтому идентифицируются реже.
Индивиды с синдромом Тернера имеют женский фенотип, дисгенезию гонад, низкий рост, первичные, отсутствие вторичных половых признаков, крыловидные складки шеи, низко расположенные уши, низкую заднюю границу роста волос, дискообразную грудную клетку с широкой расстоянием между сосками, аномалии почек, лимфедему конечностей при рождении и кардиоваскулярные аномалии, чаще коарктацию аорты. Но при ультразвуковом исследовании может проявляться только одна аномалия — кистозная гигрома. Скрининг-теста синдромом Тернера еще не существует, и поэтому частота рецидивов не определена.
В случае синдрома Кляйнфельтера развитие яичек сначала является нормальным. Но присутствие не менее 1 лишней Х-хромосомы приводит к гибели зародышевых клеток на этапе их поступления в мейоз, что приводит к уменьшению яичек и гиалинизации семенных протоков. Итак, классические симптомы синдрома Кляйнфельтера включают бесплодие, гинекомастию, задержку умственного развития, повышения уровня гонадотропинов вследствие уменьшения уровня циркулирующих андрогенов. Скрининг-теста по выявлению синдрома Кляйнфельтера также не существует, следовательно, пренатальный диагноз этих хромосомных аномалий возможно только при использовании биопсии хориона или амниоцентеза.
Скрининг на генетические заболевания
Сегодня известно более 11 000 моногенных заболеваний, которые кодируются одним геном (генетически обусловленные) и передаются от родителей их потомкам. Механизм передачи многих генетических болезней объясняется принципами Менделя.
Аутосомно-доминантные моногенные синдромы встречаются с частотой 1: 200 индивидов; заболевание наблюдается у многих поколений, передается потомкам и рецидивирует с частотой 50%. Примерами аутосомно-доминантных моногенных расстройств могут быть:
Появление аутосомно-доминантных заболеваний у новорожденных от «здоровых» родителей может быть обусловлено следующими причинами:
1. Мозаицизм зародышевых клеток. Мутация может иметь место лишь в популяции зародышевых клеток. Итак, родители являются непораженными, но могут передавать мутацию потомкам.
2. Новые мутации. Рост возраста родителей ассоциируется с увеличением риска аутосомно-доминантных расстройств (ахондроплазии, танатофорной дисплазии, нейрофиброматоза, синдрома Аперта — краниосиностоз). Риск рецидивов у других детей не увеличивается.
3. Вариабельна экспрессия. Тяжесть заболевания может варьировать, и родители могут не распознать мягкие и субклинические мутации.
4. Уменьшенная пенетрантность. Родители могут иметь аномальный ген без клинических проявлений заболевания.
5. Неверное отцовство. Частота неверного отцовства достигает 15%.
Аутосомно-рецессивные моногенные заболевания проявляются в многочисленных родственников при наличии двух пораженных аллелей. Если оба родителя являются носителями пораженного гена, риск заболевания у потомства равен 25% при каждой беременности. Аутосомно-рецессивные заболевания включают кистозный фиброз, серповидно-клеточную анемию, фенилкетонурию, болезнь Тея-Сакса, Канавана и др.
При Х-сцепленных рецессивных синдромах (гемофилия и др.) мать-носитель пораженного гена передает его своим сыновьям. Итак, 50% сыновей могут быть больными и 50% дочерей будут носителями этого гена. Редкие Х-доминантные синдромы могут передаваться от каждого родителя каждому ребенку подобно аутосомно-доминантных синдромов. Фенотип может сильно варьировать, что связано со смешанной пенетрантностью, лионизацией (гетерохроматизацией) Х-хромосомы (синдром ломкой Х-хромосомы) и геномным импринтингом.
Экспансия тринуклеотидных повторов. Некоторые гены содержат участки тройных повторов (например, ССС). Такие участки являются нестабильными и могут увеличиваться в следующих генерациях, этот феномен получил название антиципации. Количество повторений определяет степень поражения индивида. Экспансия тринуклеотидных повторов составляет основу многочисленных генетических расстройств, таких как синдром ломкой (фрагильной) Х-хромосомы, миотоническая дистрофия и болезнь Хантингтона.
Синдром ломкой (фрагильной) Х-хромосомы является наиболее частой причиной семейной задержки умственного развития. Пораженные мужчины имеют типичные черты: большие уши, выступающая челюсть, большие яички, аутичное поведение, легкая или умеренная умственная отсталость. Женщины обычно менее поражены в связи с инактивацией Х-хромосомы.
Ген ломкой Х-хромосомы локализуется в Х-хромосоме и имеет три нуклеотидные повтора (ССС). Нормальные индивиды имеют 6-50 повторов, непораженные носители женского пола могут иметь 50-200 повторов, которые могут распространяться на мейоза до полной мутации при наличии более 200 повторов. Если имеет место полная мутация, ген инактивируется путем метилирования; плод будет пораженным. Тяжесть заболевания зависит от степени Х-инактивации у женщин, степени метилирования и мозаицизма размера повторов.
Женщины-носители премутации имеют 50%-й риск передачи гена с экспансией. Мужчины с премутациею фенотипически являются нормальными, но все их дочери будут носителями премутации. В случае трансмиссии мужчинам количество повторов остается стабильным. Тест на ломку Х-хромосому выполняется с целью выявления количества повторов и степени метилирования.
Показания для тестирования на ломкую Х-хромосому
Геномный импринтинг — процесс, при котором активация гена происходит преимущественно в материнской или преимущественно в родительской хромосоме, но не в обеих хромосомах. Нормальное развитие имеет место лишь в том случае, если присутствуют обе копии (материнская и отцовская) импринтинг-ген. Импринтинг-ген неактивен, значит, активный ген теряет (путем делеции) или получает мутацию, в таком случае плод будет пораженным. Лишь несколько генов могут испытывать импринтинга.
Примерами геномного импринтинга может быть синдром Ангельмана и полный пузырный занос (вариант гестационной трофобластической болезни).
Синдром Ангельмана характеризуется тяжелой задержкой умственного развития, атаксической походкой, типичным лицом, пароксизмами смеха и судорогами. Ген синдрома Ангельмана является активным только в материнской унаследованной хромосоме, следовательно, если происходит делеция материнской хромосомы 15 или материнская копия гена имеет мутацию, белковый продукт не образуется и плод будет пораженным.
Синдром Ангельмана также может развиться, если обе копии хромосомы 15 является унаследованными от отца (отсутствие материнской копии хромосомы 15). Это состояние получило название унипарентальной дисомии. Унипарентальная дисомия возникает чаще вследствие потери хромосомы у эмбриона с трисомией или добавления хромосомы у плода с моносомией по этой хромосомой. Каждая из хромосом может быть генетически различной (гетеродисомия) или идентичной (изодисомия), в зависимости от времени возникновения этого феномена — в течение первого или второго мейотического деления, соответственно.
Полный пузырный занос обычно является диплоидным (46, ХХ или Х ¥), но может иметь полностью отцовское происхождение, без материнского хромосомного материала. При таких условиях плод не может развиваться. Полный пузырный занос может сопровождать нормальную многоплодную беременность, но в этом случае возрастает риск материнских осложнений (гипертиреоидизм, преэклампсия, преждевременные роды). В отличие от полного пузырного заноса, частичный пузырный занос обычно является триплоидным (69, ХХХ, 69, ХVV), с дополнительным набором отцовских хромосом.
Триплоидия с дополнительным набором материнских хромосом имеет место при ЗВУР плода, врожденных пороках развития и маленькой плаценте.
Митохондриальное наследование
Митохондрии в цитоплазме яйцеклетки (но не сперматозоида) передаются от матери к ее потомкам. Митохондрия имеет собственную ДНК. Существует несколько генетических заболеваний, вызванных мутациями митохондриальной ДНК, — наследственная оптическая нейропатия Лебера, болезнь Ли (подострая некротизирующая энцефаломиелопатия), миоклоническая эпилепсия с «зазубренными красными волокнами». Экспрессия этих заболеваний является вариабельной.
Точность методов определения патологий плода на ранних сроках беременности
Клиническая картина хромосомных патологий:
Хромосомные аномалии одна из самых актуальных проблем здравоохранения, по данным ВОЗ:
По состоянию на 2021 год в России применяется несколько методов определения генетических патологий плода:
Ранний пренатальный скрининг
Инвазивная диагностика
Неинвазивное пренатальное тестирование
Ранний пренатальный скрининг
Или по другому комбинированный скрининг I триместра. В России широкое применение РПС по международному стандарту было инициировано Минздравсоцразвития России только в 2009 г. с поэтапным внедрением нового алгоритма диагностики хромосомных патологий плода в субъектах страны в период с 2010 по 2014 [1].
Данный вид диагностики был разработан фондом медицины плода (FMF) и подразумевает под собой проведение ультразвукового исследования и анализа сывороточных маркеров материнской крови (бетта-ХГЧ и PAPP-A). Расчет риска, с учетом индивидуальных особенностей беременной (возраст матери и срок беременности) происходит с помощью унифицированной программы “Astraia” (Астрайя).
Каждая беременная женщина, которая встает на учет знает, что данный вид скрининга предстоит ей в период с 11 до 14 недель. По результатам скрининга женщина может получить как низкий риск рождения ребенка с патологией, так и высокий (граница 1:100).
Какова же точность скрининга I триместра, который проводят каждой беременной женщине в России:
Стоит отметить что 20% детей рожденных с синдромом Дауна (с трисомией 21) были рождены в группе низкого риска. [3]
Также сравнительный анализ показал, что комбинированный скрининг эффективнее исследования только биохимических или ультразвуковых маркеров (87% вместо 71%) [4].
Инвазивная пренатальная диагностика
Данный вид диагностики включает в себя процедуру забора разного вида биоматериала (в зависимости от срока беременности) из полости матки с помощью пункции под контролем УЗИ. Среди беременных процедуру часто называют “прокол”, длительность процедуры (подготовки и самой пункции) от 5 до 7 минут.
У инвазивной пренатальной диагностики есть свои ограничения и риски осложнений [5]:
По данным FMF риски Скидка 50% на тест ДНК отцовство
ООО «Медикал Геномикс» Лицензия № ЛО-69-01-002086 от 06.10.2017
Юр. адрес: г. Тверь, ул. Желябова, 48
ООО «Лаб-Трейдинг», ИНН: 6950225035, ОГРН: 1186952017053, КПП:695001001
Юр. адрес: г. Тверь, ул. 1-Я За Линией Октябрьской Ж/Д, 2, оф. 22
В Центре иммунологии и репродукции уже много лет успешно работает программа пренатального скрининга. Наших специалистов приглашают читать лекции на специализированных конференциях, в других клиниках. Наша лаборатория получает стабильно хорошие оценки в системе контроля качества. Специально обученные специалисты проводят расчет рисков.
Содержание
Что такое пренатальная диагностика?
Слово «пренатальный» означает «дородовый». Поэтому термин «пренатальная диагностика» означает любые исследования, позволяющие уточнить состояние внутриутробного плода. Поскольку жизнь человека начинается с момента зачатия, различные проблемы со здоровьем могут быть не только после рождения, но и до рождения. Проблемы могут быть разными:
Для выяснения состояния здоровья внутриутробного плода используются методы пренатальной диагностики, к которым относятся ультразвуковое исследование, кардиотокография, различные биохимические исследования и пр. Все эти методы имеют разные возможности и ограничения. Некоторые методы вполне безопасны, как, например, ультразвуковое исследование. Некоторые сопряжены с определенным риском для внутриутробного плода, например, амниоцентез (проба околоплодных вод) или биопсия ворсинок хориона.
Понятно, что методы пренатальной диагностики, сопряженные с риском осложнений беременности, должны применяться только в том случае, когда для их использования имеются веские показания. Для того, чтобы максимально сузить круг пациенток, нуждающихся в инвазивных (т. е. связанных с вмешательством в организм) методах пренатальной диагностики, используется выделение групп риска развития тех или иных проблем у внутриутробного плода.
Что такое группы риска?
Группами риска являются такие группы пациенток, среди которых вероятность обнаружения той или иной патологии беременности выше, чем во всей популяции (среди всех женщин данного региона). Существуют группы риска по развитию невынашивания беременности, гестоза (позднего токсикоза), различных осложнений в родах и т. д. Если женщина в результате обследования оказывается в группе риска по той или иной патологии, это не означает, что данная патология обязательно разовьется. Это означает только то, что у данной пациентки тот или иной вид патологии может возникнуть с большей вероятностью, чем у остальных женщин. Таким образом, группа риска не тождественна диагнозу. Женщина может находиться в группе риска, но никаких проблем в течение беременности может не быть. И необорот, женщина может не находиться в группе риска, но проблема у нее возникнуть может. Диагноз же означает то, что у данной пациентки уже обнаружено то или иное патологическое состояние.
Зачем нужны группы риска?
Знание того, что пациентка входит в ту или иную группу риска, помогает врачу правильно спланировать тактику ведения беременности и родов. Выделение групп риска позволяет оградить пациенток, не входящих в группы риска, от ненужных медицинских вмешательств, и наоборот, позволяет обосновать назначение тех или иных процедур или исследований пациенткам, входящим в группы риска.
Что такое скрининг?
Слово скрининг означает «просеивание». В медицине под скринингом понимают проведение простых и безопасных исследований большим группам населения с целью выделения групп риска развития той или иной патологии. Пренатальным скринингом называются исследования, проводимые беременным женщинам с целью выявления групп риска осложнений беременности. Частным случаем пренатального скрининга является скрининг по выявлению групп риска развития врожденных пороков у плода. Скрининг не позволяет выявить всех женщин, у которых может быть та или иная проблема, но дает возможность выделить относительно небольшую группу пациенток, внутри которой будет сосредоточена бо́льшая часть лиц с данным видом патологии.
Зачем нужен скрининг пороков развития плода?
Некоторые виды врожденных пороков у плода встречаются довольно часто, например, синдром Дауна (трисомия по 21-й паре хромосом или трисомия 21) – в одном случае на 600 – 800 новорожденных. Это заболевание, так же как и некоторые другие врожденные заболевания, возникает в момент зачатия или на самых ранних стадиях развития зародыша и с помощью инвазивных методов пренатальной диагностики (биопсии ворсин хориона и амниоцентеза) может быть диагностировано на достаточно ранних сроках беременности. Однако такие методы сопряжены с риском целого ряда осложнений беременности: выкидыша, развития конфликта по резус-фактору и группе крови, инфицирования плода, развития тугоухости у ребенка и т. д. В частности, риск развития выкидыша после таких исследований составляет 1:200. Поэтому эти исследования следует назначать только женщинам высоких групп риска. К группам риска относятся женщины старше 35 и особенно старше 40 лет, а также пациентки с рождением детей с пороками развития в прошлом. Однако дети с синдром Дауна могут родиться и у совсем молодых женщин. Методы скрининга – совершенно безопасные исследования, проводимые в определенные сроки беременности, – позволяют с очень большой степенью вероятности выявить группы женщин с риском синдрома Дауна, которым может быть показано проведение биопсии ворсин хориона или амниоцентеза. Женщины, не попавшие в группы риска, не нуждаются в проведении дополнительных инвазивных исследований. Обнаружение повышенного риска развития пороков развития плода с помощью методов скрининга не является диагнозом. Диагноз может быть поставлен или отвергнут с помощью дополнительных тестов.
На какие виды врожденных пороков проводится скрининг?
В настоящее время рекомендуется проведение скрининга на следующие виды врожденных пороков у плода:
Какие виды исследований проводятся в рамках скрининга риска пороков развития у плода?
По видам исследований выделяют:
Общей тенденцией в развиитии пренатального скрининга является желание получать достоверную информацию о риске развития тех или иных нарушений на как можно ранних сроках беременности. Оказалось, что комбинированный скрининг в конце первого триместра беременности (сроки 10–13 недель) позволяет приблизиться к эффективности классического биохимического скрининга второго триместра беременности.
Ультразвуковой скрининг, используемый для математической обработки рисков аномалий плода, проводится только 1 раз: в конце первого триместра беременности.
Что касается биохимического скрининга, то набор показателей будет различным в разные сроки беременности. В сроки беременности 10-13 недель проверяются следующие показатели:
Расчет риска измерения аномалий плода, проведенный на основании измерения этих показателей, называется двойным биохимическим тестом первого триместра беременности.
С помощью двойного теста в I триместре рассчитываются риск обнаружения у плода синдрома Дауна (T21) и синдрома Эдвардса (T18), трисомии по 13 хромосоме (синдром Патау), триплоидии материнского происхождения, синдрома Шерешевского-Тернера без водянки. Риск дефектов нервной трубки с помощью двойного теста посчитать нельзя, поскольку ключевым показателем для определения этого риска является α-фетопротеин, который начинают определять только со второго триместра беременности.
Специальные компьютерные программы позволяют рассчитать комбинированный риск аномалий развития плода с учетом биохимических показателей, определяемых в двойном тесте первого триместра и результатов УЗИ, сделанного в сроки 10-13 недель беременности. Такой тест называется комбинированным с ТВП двойным тестом первого триместра беременности или тройным тестом первого триместра беременности. Результаты расчета рисков, полученные с помощью комбинированного двойного теста, гораздо точнее, чем расчеты риска только на основании биохимических показателей или только на основании УЗИ.
Если результаты теста в первом триместре указывают на группу риска хромосомных аномалий плода, для исключения диагноза хромосомных аномалий пациентке может быть проведена биопсия ворсин хориона.
По этим показателям рассчитываются следующие риски:
Такой тест называется четверным тестом второго триместра беременности или четверным биохимическим скринингом во втором триместре беременности. Усеченным вариантом теста является так называемый тройной или двойной тесты второго триместра, включающий в себя 2 или показателя: ХГЧ или свободная β-субъединица ХГЧ, АФП, свободный эстриол. Понятно, что точность двойного или двойного тестов II триместра ниже, чем точность четверного теста II триместра.
Еще одним вариантом биохимического пренатального скрининга является биохимический скрининг риска только дефектов нервной трубки во втором триместре беременности. При этом производится определение только одного биохимического маркера: α-фетопротеин
В какие сроки беременности проводится скрининг второго триместра?
В 14 – 20 недель беременности. Оптимальным сроком является 16 – 18 недель беременности.
Что такое четверной тест второго триместра беременности?
Основным вариантом биохимического скрининга второго триместра в ЦИР является так называемый четверной или квадрупл-тест, когда к определению трех вышеперечисленных показателей добавляется определение ингибина А.
Ультразвуковой скрининг в первом триместре беременности.
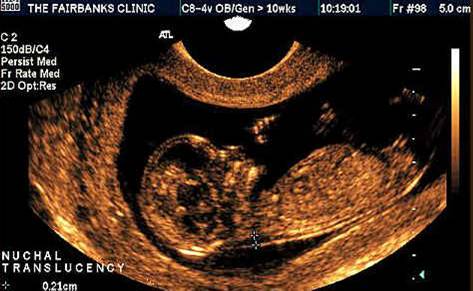
В первом триместре беременности главным размером, используемым при расчете рисков является ширина шейной прозрачности (англ. «nuchal translucency» (NT) », франц. «clarté nuchale»). В русском медицинском обиходе данный термин часто переводится как «воротниковое пространство» (ТВП) или «шейная складка». Шейная прозрачность, воротниковое пространство и шейная складка – полные синонимы, с которыми можно встретиться в разных медицинских текстах и обозначающие одно и то же.
Шейная прозрачность – определение
Измерение шейной прозрачности
Сроки беременности и копчико-теменной размер
Оптимальным сроком беременности для измерения ШП является срок от 11 недель до 13 недель 6 дней. Минимальный размер КТР – 45 мм, максимальный – 84 мм.
Имеются две причины для выбора срока в 11 недель в качестве самого раннего срока для измерения ШП:
Изображение и измерение
Для измерении ШП ультразвуковой аппарат должен иметь высокое разрешение с функцией видео-петли и калибраторами, которые могут измерять размер с точностью до десятых долей миллиметра. ШП можно измерить с помощью абдоминального датчика в 95% случаев, в случаях, когда это невозможно выполнить, следует использовать влагалищный датчик.
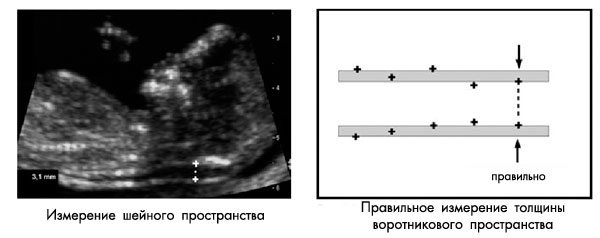
При измерении ШП в картинку должны попадать только голова и верхняя часть грудной клетки плода. Увеличение должно быть максимальным, так что небольшое смещение маркеров дает изменение в измерении не более чем на 0,1 мм. При увеличении картинки, до или после фиксации изображения, важно уменьшить гейн. Это позволяет избежать ошибки измерения, когда маркер попадает в размытую область и тем самым размер ШП будет недооценен.
Должен быть получен хороший саггитальный срез, такого же качества, как при измерении КТР. Измерение должно производиться в нейтральном положении головки плода: разгибание головки может увеличивать значение ТВП на 0,6 мм, сгибание головки – уменьшать показатель на 0,4 мм.
Важно не спутать кожу плода и амнион, поскольку в эти сроки беременности оба образования выглядят как тонкие мембраны. При сомнении следует дождаться момента, когда плод сделает движение и отойдет от амниона. Альтернативным способом является попросить беременную покашлять или легонько постучать по брюшной стенке беременной.
Замеряется наибольшее перпендикулярное расстояние между внутренними контурами шейной прозрачности (см. рисунок ниже). Замеры проводятся трижды, для расчета используется наибольшее значение размера. В 5-10% случаев обнаруживается обвитие пуповины вокруг шейки плода, что может значительно затруднить измерение. В таких случаях используется 2 измерения: выше и ниже места обвития пуповины, для расчета рисков используется среднее значение этих двух измерений.
Стандарты ультразвукового сканирования в конце первого триместра беременности разрабатываются базирующейся в Англии организацией Fetal Medicine Foundation (FMF). В группе компаний ЦИР УЗИ проводится по протоколу FMF.
Дополнительные ультразвуковые признаки риска синдрома Дауна
В последнее время дополнительно к измерению ШП для диагностики синдрома Дауна в конце первого триместра беременности использутся следующие ультразвуковые признаки:
Форма кровотока в аранциевом протоке при допплерометрии. Вверху: норма; внизу: при трисомии 21.
Не только синдром Дауна!
Во время УЗИ в конце первого триместра оценка контура плода поставляет выявить также следующие аномалии плода:
Каким образом рассчитываются риски?
Для вычисления рисков используется специальное программное обеспечение. Простое определение уровня показателей в крови недостаточно для того, чтобы решить, повышен риск аномалий развития, или нет. Программное обеспечение должно быть сертифицировано для использования с целью пренатального скрининга. На первом этапе компьютерного обсчета цифры показателей, полученные при лабораторной диагностике, переводятся в так называемые MoM (multiple of median, кратное медианы), характеризующие степень отклонения того или иного показателя от медианы. На следующем этапе расчета производится поправка MoM на различные факторы (масса тела женщины, расовая принадлежность, наличие некоторых заболеваний, курение, многоплодная беременность и т. д.). В результате получаются так называемые скорректированные MoM. На третьем этапе расчета скорректированные MoM используются для расчета рисков. Программное обеспечение специальным образом настраивается под используемые в лаборатории методы определения показателей и реактивы. Недопустимо рассчитывать риски с использованием анализов, сделанных в другой лаборатории. Наиболее точным расчет рисков аномалий плода бывает при использовании данных ультразвукового исследования, выполненного в 10-13 недель беременности.
Что такое MoM?
MoM – английская аббревиатура термина “multiple of median”, что в переводе означает “кратное медианы”. Это коэффициент, показывающий степень отклонения значения того или иного показателя пренатального скрининга от среднего значения для срока беременности (медианы). MoM расчитывается по следующей формуле:
MoM = [Значение показателя в сыворотке крови пациентки] / [Значение медианы показателя для срока беременности]
Поскольку значение показателя и медиана имеют одни и те же единицы измерения, значение MoM не имеет единиц измерения. Если значение MoM у пациентки близко к единице, то значение показателя близко к среднему в популяции, если выше единицы – выше среднего в популяции, если ниже единицы – ниже среднего в популяции. При врожденных пороках плода могут быть статистически значимые отклонения MoM маркеров. Однако в чистом виде MoM почти никогда не используются в расчете рисков аномалий плода. Дело в том, что при наличии целого ряда факторов, средние значения MoM отклоняются от средних в популяции. К таким факторам относятся масса тела пациентки, курение, расовая принадлежность, наступление беременности в результате ЭКО и др. Поэтому после получения значений MoM программа расчета рисков делает поправку на все эти факторы, в результате чего получается так называемое “скорригированное значение MoM”, которое и используется в формулах расчета рисков. Поэтому в бланках заключения по результатам анализа рядом с абсолютными значениями показателей указываются скорригированные значения MoM для каждого показателя.
Типичные профили MoM при патологии беременности
При различных аномалиях плода значения MoM сочетанно отклонены от нормы. Такие сочетания отклонений MoM называются профилями MoM при той или иной патологии. В таблицах ниже приведены типичные профили MoM при разных сроках беременности.
| Аномалия | PAPP-A | Своб. β-ХГЧ |
|---|---|---|
| Тр.21 (синдром Дауна) | 0,41 | 1,98 |
| Тр.18 (Синдром Эдвардса) | 0,16 | 0,34 |
| Триплоидия типа I/II | 0,75/0,06 | |
| Синдром Шерешевского-Тернера | 0,49 | 1,11 |
| Синдром Клайнфельтера | 0,88 | 1,07 |
| Аномалия | АФП | Общ. ХГЧ | Св. эстриол | Ингибин A |
|---|---|---|---|---|
| Тр.21 (синдром Дауна) | 0,75 | 2,32 | 0,82 | 1,79 |
| Тр.18 (синдром Эдвардса) | 0,65 | 0,36 | 0,43 | 0,88 |
| Триплоидия типа I/II | 6,97 | 13 | 0,69 | |
| Синдром Шерешевского-Тернера | 0,99 | 1,98 | 0,68 | |
| Синдром Клайнфельтера | 1,19 | 2,11 | 0,60 | 0,64-3,91 |
Показания к пренатальному скринингу I и II триместра на риск аномалий плода
В настоящее время пренатальный скрининг рекомендуется проводить всем беременным женщинам. Приказ Минздрава РФ от 2000 г. обязывает женские консультации проводить биохимический пренатальный скрининг всем беременным пациенткам во втором триместре беременности по двум показателям (АФП и ХГЧ).
Приказ № 457 от 28.12.2000 г. «О совершенствовании пренатальной диагностики в профилактике наследственных и врожденных заболеваний у детей»:
«В 16-20 недель производить забор крови у всех беременных для проведения исследований не менее двух сывороточных маркеров(АФП,ХГЧ)»
Важность проводить мониторинг врожденных заболеваний на постоянной основе в г.Москве рассматривается также в постановлении правительства Москвы об учреждении городской программы «Здоровье детей» на 2003-2005 годы.
Постановление Правительства Москвы от 23 июля 2002 г. № 572-ПП
«Целесообразно начать в Москве проведение генетического мониторинга врожденных пороков развития новорожденных, пренатального скрининга на болезнь Дауна и дефектов невральной трубки»
С другой стороны, пренатальный скрининг должен быть сугубо добровольным делом. В большинстве западных стран обязанностью врача является информирование пациентки о возможности проведения таких исследований и о целях, возможностях и ограничениях пренатального скрининга. Сама пациентка решает, делать ей анализы, или нет. Такой же точки зрения придерживается и группа компаний ЦИР. Главной проблемой является то, что никакого лечения обнаруженных аномалий не существует. В случае подтверждения наличия аномалий супружеская пара становится перед выбором: прервать беременность или сохранить ее. Это нелегкий выбор.
Что такое синдром Эдвардса?
Это состояние, обусловленное наличием в кариотипе лишней 18-й хромосомы (трисомия 18). Синдром характеризуется грубыми физическими аномалиями и умственной отсталостью. Это летальное состояние: 50% больных детей умирают в первые 2 месяца жизни, 95% – в течение первого года жизни. Девочки поражаются в 3-4 раза чаще, чем мальчики. Частота в популяции колеблется от 1 случая на 6000 родов до 1 случая на 10000 родов (примерно в 10 раз реже, чем синдром Дауна).
Что такое свободная β-субъединица ХГЧ?
Молекулы ряда гормонов гипофиза и плаценты (тиреотропного гормона (ТТГ), фолликул-стимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и хорионического гормона человека (ХГЧ)) имеют сходную структуру и состоят из α и β-субъединиц. Альфа-субъединицы этих гормонов очень сходны и основные различия между гормонами заключаются в строении β-субъединиц. ЛГ и ХГЧ являются очень сходными не только по строению α-субъединиц, но и по строению β-субъединиц. Вот почему они являются гормонами с одинаковым действием. Во время беременности выработка ЛГ гипофизом падает практически до нуля, а концентрации ХГЧ очень высоки. Плацента вырабатывает очень большие количества ХГЧ, и хотя в основном этот гормон поступает в кровь в собранном виде (димерная молекула, состоящая из обеих субъединиц), в небольшом количестве в кровь поступает также свободная (не связанная с α-субъединицей) β-субъединица ХГЧ. Концентрация ее в крови во много раз меньше, чем концентрация общего ХГЧ, но этот показатель гораздо надежнее может указывать на риск проблем у внутриутробного плода на ранних сроках беременности. Определение свободной β-субъединицы ХГЧ в крови имеет значение также для диагностики трофобластической болезни (пузырного заноса и хорионэпителиомы), некоторых опухолей яичка у мужчин, мониторинге успеха процедур экстракорпорального оплодотворения.
Какой показатель: общий ХГЧ или свободная β-субъединица ХГЧ – предпочтительнее использовать в тройном тесте второго триместра?
Использование определения свободной β-субъединицы ХГЧ по сравнению с определением общего ХГЧ дает более точный расчет риска синдрома Дауна, однако в классических статистических расчетах риска синдрома Эдвардса в популяции использовалось определение уровня общего ХГЧ в крови матери. Для β-субъединицы ХГЧ таких расчетов не проводилось. Поэтому нужно делать выбор между более точным вычислением риска синдрома Дауна (в случае β-субъединицы) и возможностью вычисления риска синдрома Эдвардса (в случае общего ХГЧ). Напомним, что в первом триместре для вычисления риска синдрома Эдвардса используется толко свободная β-субъединицы ХГЧ, но не общий ХГЧ. Синдром Эдвардса характеризуется низкими цифрами всех 3-х показателей тройного теста, поэтому в подобных случаях можно сделать оба варианта тройного теста (с общим ХГЧ и со свободной β-субъединицей).
Что такое PAPP-A?
Ассоциированный с беременностью плазменный протеин A (pregnancy-associated plasma protein-A, PAPP-A) впервые был описан в 1974 г. в виде высокомолекулярной белковой фракции в сыворотке крови женщин на поздних сроках беременности. Оказалось, что это большой цинк-содержащий металогликопротеин с молекулярной массой около 800 кДа. Во время беременности PAPP-A вырабатывается синцитиотрофобластом (тканью, являющейся наружным слоем плаценты) и экстраворсинным цитотрофобластом (островками клеток плода в толще слизистой оболочки матки) и поступает в кровоток матери
Биологическое значение этого белка не до конца изучено. Было показано, что он связывает гепарин и является ингибитором эластазы гранулоцитов (фермента, индуцируемого при воспалении), поэтому предполагается, что PAPP-A модулирует иммунный ответ материнского организма и является одним из факторов, который обеспечивает развитие и выживание плаценты. Кроме того, было установлено, что он является протеазой, расщепляющей протеин 4, связывающий инсулиноподобный фактор роста. Существуют серьезные основания полагать, что PAPP-A является одним из факторов паракринной регуляции не только в плаценте, но и в некоторых других тканях, в частности в атеросклеротических бляшках. Предлагается использовать данный маркер как один из факторов риска ишемической болезни сердца.
Концентрации PAPP-A в крови матери постоянно увеличиваются с увеличением срока беременности. Наибольший рост этого показателя отмечается в конце беременности.
В течение последних 15 лет PAPP-A изучался в качестве одного из трех маркеров риска трисомии 21 (синдром Дауна) (вместе со свободной β-субъединицей ХГЧ и толщиной воротникового пространства). Оказалось, что уровень этого маркера в конце первого триместра беременности (8-14 недель) значительно снижен при наличии у плода трисомии 21 или трисомии 18 (синдром Эдвардса). Уникальностью этого показателя является то, что значимость его как маркера синдрома Дауна исчезает после 14 недель беременности. Во втором триместре уровни его в материнской крови при наличии у плода трисомии 21 не отличаются от таковых у беременных со здоровым плодом. Если рассматривать PAPP-A в качестве изолированного маркера риска синдрома Дауна в первом триместре беременности, наиболее значимым было бы его определение в сроки 8–9 недель. Однако свободная β-субъединица ХГЧ является стабильным маркером риска синдрома Дауна в сроки 10–18 недель, т. е. позже PAPP-A. Поэтому оптимальным сроком сдачи крови для двойного теста первого триместра беременности – 10–12 недель.
Комбинация измерения уровня PAPP-A с определением концентрации свободной β-субъединицы ХГЧ в крови и определением ТВП с помощью УЗИ в конце первого триместра беременности позволяет выявить до 90% женщин с риском развития синдрома Дауна в старшей возрастной группе (после 35 лет). Вероятность ложноположительных результатов при этом составляет около 5%.
Кроме пренатального скрининга риска синдрома Дауна и синдрома Эдвардса, в акушерстве определение PAPP-A используется также при следующих видах патологии:
Диагностика риска остановки развития плода на малых сроках беременности явилось исторически первым клиническим приложением определения PAPP-A в сыворотке крови, предложенным в начале 1980-х годов. Было показано, что женщины с низкими уровнями PAPP-A на ранних сроках беременности попадают в группы риска последующей остановки развития беременности и тяжелых форм позднего токсикоза. Поэтому рекомендуется определение этого показателя в сроки 7–8 недель женщинам с тяжелыми осложнениями беременности в анамнезе.
Синдром Корнелии де Ланж – это редкая форма врожденных пороков развития плода, обнаруживаемая в 1 случае на 40 000 родов. Синдром характеризуется отставанием умственного и физического развития, пороками сердца и конечностей и характерными особенностями черт лица. Было показано, что при данном состоянии уровни PAPP-A в крови в сроки 20–35 недель значимо ниже нормы. Исследование группы Эйткена в 1999 г. показало, что данный маркер может использоваться для скрининга на синдром Корнелии де Ланж и во втором триместре беременности, поскольку уровни показателя у таких беременных в среднем были в 5 раз ниже нормы.
Реактивы, используемые для определения PAPP-A и свободной β-субъединицы ХГЧ, на порядок дороже реактивов, используемых для большинства гормональных показателей, что делает данный тест более дорогим исследованием по сравнению с определением большинства гормонов репродуктивной системы.
Что такое α-фетопротеин?
Это гликопротеин плода, вырабатываемый вначале в желточном мешке, а потом в печени и желудочно-кишечном тракте плода. Это транспортный белок в крови плода, связывающий целый ряд различных факторов (билирубин, жирные кислоты, стероидные гормоны). Это двойной регулятор роста внутриутробного плода. У взрослого человека никаких известных функций АФП не выполняет, хотя может повышаться в крови при заболеваниях печени (цирроз, гепатит) и при некоторых опухолях (гепатоклеточная карцинома и герминативная карцинома). В крови матери уровень АФП постепенно повышается с увеличением срока беременности и достигает максимума к 30 неделям. Уровень АФП в крови матери повышается при дефектах нервной трубки у плода и при многоплодной беременности, понижается – при синдроме Дауна и при синдроме Эдвардса.
Что такое свободный эстриол?
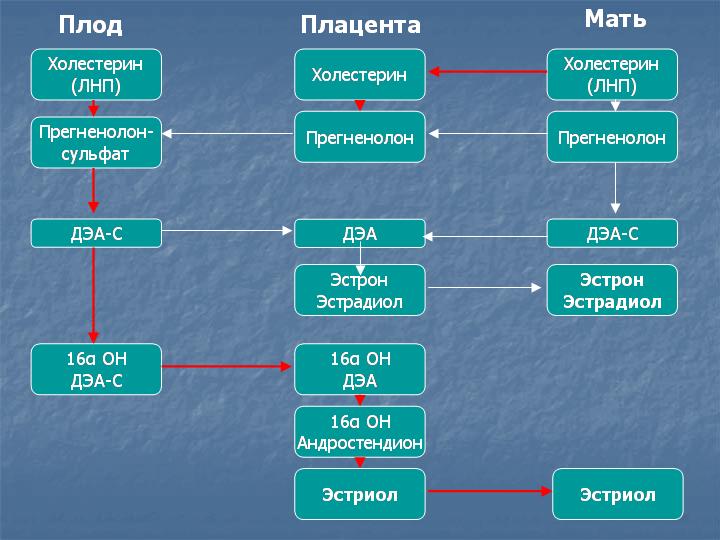
Эстриол синтезируется в плаценте из 16α-гидрокси-дегидроэпиантростерон-сульфата, поступающего со стороны плода. Главный источник предшественников эстриола – надпочечники плода. Эстриол является главным эстрогенным гормоном беременности и обеспечивает рост матки и подготовку молочных желез к лактации.
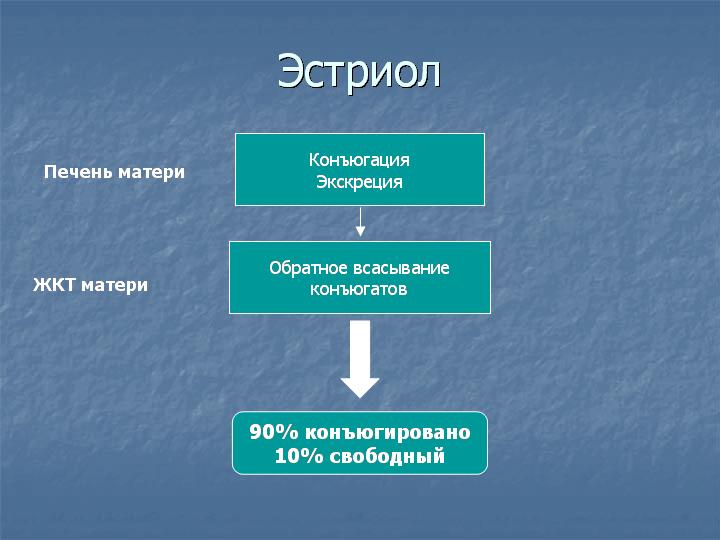
90% эстриола после 20 недель беременности образуются из ДЭА-С плода. Большой выход ДЭА-С из надпочечника плода связан с низкой активностью 3β-гидроксистероид-дегидрогеназы у плода. Протективным механизмом, защищающим плод от избытка андрогенной активности, является быстрая конъюгация стероидов с сульфатом. В сутки плод вырабатывает более 200 мг ДЭА-С в день, в 10 раз больше матери. В печени матери эстриол быстро подвергается конъюгации с кислотами, в основном с гиалуроновой кислотой, и таким образом инактивируется. Наиболее точным методом определения активности надпочечников плода является определение уровня свободного (неконъюгированного) эстриола.
Уровень свободного эстриола постепенно повышается по мере развития беременности и в третьем триместре беременности может использоваться для диагностики благополучия плода. При ухудшении состояния плода в третьем триместре беременности может наблюдаться резкое падение уровня свободного эстриола. Уровень свободного эстриола часто понижен при синдроме Дауна и при синдроме Эдвардса. Прием дексаметазона, преднизолона или метипреда при беременности подавляет функцию надпочечников плода, поэтому уровень свободного эстриола у таких пациенток часто снижается (снижение поступления эстриола со стороны плода). При приеме антибиотиков усиливается скорость конъюгации эстриола в печени матери и снижается обратное всасывание конъюгатов из кишечника, поэтому уровень эстриола тоже снижается, но уже за счет ускорения его инактивации в организме матери. Для точной интерпретации данных тройного теста очень важно, чтобы пациентка указала полный список лекарств, принимавшихся или принимаемых во время беременности с дозами и сроками приема.
Алгоритм проведения пренатального скрининга I и II триместра беременности.
1. Рассчитываем срок беременности, лучше после консультации с врачом или с помощью консультанта.
Скрининг I триместра имеет свои особенности. Он проводится в сроки 10 – 13 недель беременности и достаточно жестко ограничен по срокам. Если сдать кровь слишком рано или слишком поздно, если ошибиться в расчете сроков беременности на момент сдачи крови, точность расчета резко уменьшится. Сроки беременности в акушерстве обычно рассчитываются по первому дню последней менструации, хотя зачатие происходит в день овуляции, т. е. при 28-дневном цикле – через 2 недели после первого дня менструации. Поэтому сроки 10 – 13 недель по дню менструации соответствуют 8 – 11 неделям по зачатию.
Для вычисления срока беременности мы рекомендуем воспользоваться акушерским календарем, размещенном на нашем сайте. Сложности в расчете сроков беременности могут быть при нерегулярном менструальном цикле, при беременности, наступившей вскоре после родов, при цикле, более чем на неделю отклоняющегося от 28 дней. Поэтому лучше всего довериться профессионалам, и для расчета сроков беременности, проведения УЗИ и сдачи крови обратиться к врачу.
2. Делаем УЗИ.
Следующим этапом должно быть проведение УЗИ в сроки 10 – 13 недель беременности. Данные этого исследования будут использованы программой расчета рисков как в первом, так и во втором триместре. Начинать обследование нужно именно с УЗИ, поскольку в процессе исследования могут выявиться проблемы с развитием беременности (например, остановка или отставание в развитии), многоплодная беременность, будут достаточно точно рассчитаны сроки зачатия. Врач, проводящий УЗИ, поможет пациентке расчитать сроки сдачи крови для биохимического скрининга. Если УЗИ окажется сделанным слишком рано по срокам беременности, то, возможно, врач рекомендует повторить исследование спустя какое-то время.
Для расчета рисков будут использоваться следующие данные из заключения УЗИ: дата УЗИ, копчико-теменной размер (КТР) и толщина воротникового пространства (ТВП) (английские сокращения соответственно CRL и NT), а также визуализация носовых костей.
3. Сдаем кровь.
Имея результаты УЗИ и зная точный срок беременности можно приходить для сдачи крови. Взятие крови для анализа на пренатальный скрининг в группе компаний ЦИР проводится ежедневно, включая выходные дни. В будние дни взятие крови проводится с 7:45 до 21:00, в выходные и праздничные дни: с 8:45 до 17:00. Взятие крови проводится через 3-4 часа после последнего приема пищи.
4. Получаем результат.
Теперь нужно получить результаты анализа. Сроки готовности результатов анализа пренатального скрининга в группе компаний ЦИР составляют один рабочий день (кроме четверного теста). Это означает, что анализы, сданные с понедельника по пятницу будут готовы в тот же день, а сданные с субботы по воскресенье – в понедельник.
Заключения по результатам исследования выдаются пациентке на русском языке.
Тиблица. Объяснения терминов и сокращений
| Дата отчета | Дата компьютерной обработки результатов |
| Срок беременности | Недели + дни |
| Дата УЗИ | 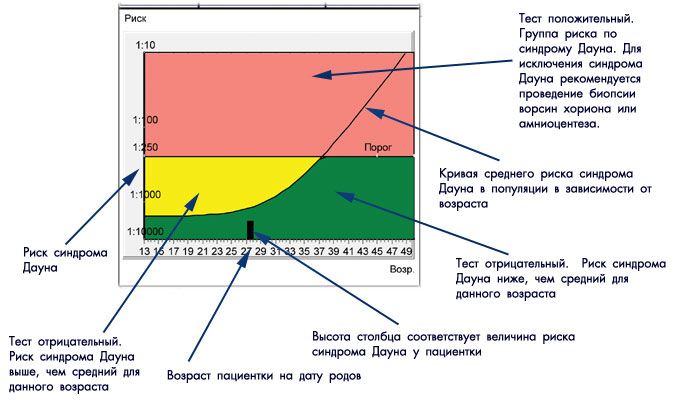 Дата проведения УЗИ. Обычно не совпадает с датой сдачи крови. Дата проведения УЗИ. Обычно не совпадает с датой сдачи крови. |
| Плоды | Количество плодов. 1 – одноплодная беременность; 2 – двойня; 3 – тройня |
| ЭКО | Беременность наступила в результате ЭКО |
| КТР | Копчико-теменной размер, определенный во время УЗИ |
| MoM | Кратное медианы (multiple of median), степень отклонения результата от среднего для данного срока беременности |
| Скорр. MoM | Скорригированное MoM. Значение MoM после коррекции по массе тела, возрасту, расовой принадлежности, количеству плодов, наличию диабета, курению, лечению бесплодия методом ЭКО. |
| NT | Толщина воротникового пространства (nuchal translucency). Синоним: шейная складка. В различных вариантах отчетов могут приводиться либо абсолютные значения в мм, либо степень отклонения от медианы (MoM) |
| Возрастной риск | Среднестатистический риск для данной возрастной группы. Не учитываются никакие факторы, кроме возраста. |
| Tr. 21 | Трисомия 21, синдром Дауна |
| Tr. 18 | Трисомия 18, синдром Эдвардса |
| Биохимический риск | Риск аномалий плода после компьютерной обработки данных анализа крови без учета данных УЗИ |
| Комбинированный риск | Риск аномалий плода после компьютерной обработки данных анализа крови с учетом данных УЗИ. Наиболее точный показатель степени риска. |
| fb-HCG | Свободная β-субъединица ХГЧ |
| ДПМ | Дата последней менструации |
| AFP | α-фетопротеин |
| HCG | Общий ХГЧ (human chorionic gonadotropin) |
| uE3 | Свободный эстриол (unconjugated estriol) |
| +NT | Расчет проводился с учетом данных УЗИ |
| mIU/ml | мМЕ/мл |
| ng/ml | нг/мл |
| IU/ml | МЕ/мл |
Дополнительная информация.
Информация для пациентов: обратите внимание, что если Вы планируете пройти пренатальный скрининг в группе компаний ЦИР, то данные УЗИ, сделанного в других учреждениях, будут приниматься в расчет только в случае наличия специального договора группы компаний ЦИР с этими учреждениями.
Информация для врачей
Уважаемые коллеги! В соответствии с Приказом Минздрава № 457 и Постановлением Правительства Москвы № 572 группа компаний ЦИР оказывает услуги другим лечебным учреждениям по проведению пренатального скрининга на риск хромосомных аномалий. Вы можете пригласить наших сотрудников приехать к вам с лекцией по данной программе. Для направления пациентки на скрининг лечащий врач должен заполнить специальное направление. Пациентка может приехать для сдачи крови самостоятельно, но возможно и взятие крови в других учреждениях с последующей доставкой в нашу лабораторию, в том числе и нашим курьером. Если вы хотите получать результаты двойных, тройных и четверных тестов первого и второго триместров беременности, комбинированных с данными УЗИ, пациентка должна приехать к нам для УЗИ, либо мы должны подписать с вашим учреждением специальный договор и включить в программу ваших специалистов УЗИ, но только после выезда нашего эксперта по функциональной диагностике в ваше учреждение и ознакомления с качеством аппаратуры и квалификацией специалистов.