е кадхерин что это
E-Cadherin
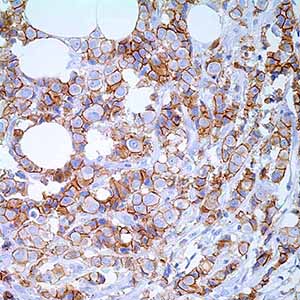
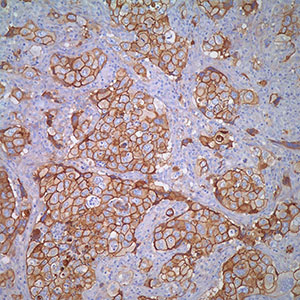
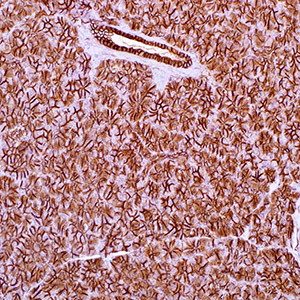
Е-кадгерин – это белок адгезии, экспрессирующийся в клетках эпителия. Антитела к Е-кадгерину окрашивают железистый эпителий, а также аденокарциномы легкого, желудочно-кишечного тракта и яичников. Также это антитело используется для дифференциации протокового (который окрашивается позитивно) и лобулярного рака молочных желез. Также отмечается положительная реакция антител к Е-кадгерину с некоторыми видами карциномы щитовидной железы. Потеря экспрессии Е-кадгерина рассматривается как неблагоприятный прогностический показатель при карциноме молочных желез и немелкоклеточной карциноме легкого.
Цена предоставляется по запросу
Наши преимущества:
Только качественные
официальные поставки
Минимально возможные
сроки поставок
Доставка по всей России с соблюдением температурного режима
Полный пакет документов
На данный момент мы сотрудничаем с ведущими зарубежными производителями лабораторных реактивов. Нашими клиентами являются как негосударственные, так и государственных учреждения, в том числе медицинские организации Москвы и других городов России. Для постоянных клиентов предусмотрена система скидок.
2003–2021 © ООО «Микротесты в биологии, медицине и ветеринарии». Официальный дистрибьютор ведущих производителей.
+7 (495) 969-98-26
E-кадгерин
| Обозначения | |
|---|---|
| Символы | CDH1 ; CD324, CAM 120/80, CDHE, UVO |
| Entrez Gene | 999 |
| HGNC | 1748 |
| OMIM | 192090 |
| RefSeq | NM_004360 |
| UniProt | P12830 |
| Другие данные | |
| Локус | 16-я хр., 16q22.1 |
E-кадгерин (эпителиальный кадгерин; кадгерин-1, 1-го типа; CDH1, CD324) — мембранный белок, гликопротеин из надсемейства кадгеринов, продукт гена CDH1. Ген был впервые клонирован в 1987 году. [1]
Содержание
Функции
E-кадгерин вместе с N- и P-кадгеринами относится к 1-му типу кадгеринов, кальций-зависимым белкам клеточной адгезии. Они вовлечены в гомофильные взаимодействия, образуя межклеточные контакты.
E-кадгерин вовлечён в механизмы регулировки межклеточной адгезии, клеточной подвижности и пролиферации эпителиальных клеток. Имеет потенциальную супрессорную роль в клеточной инвазивности. Является лигандом для интегринового рецептора альфа-E/бета-7.
Домен E-кадгерина CTF2 стимулируют неамилоидную деградацию предшественника амилоида-бета (APP) и ингибирует образование продуктов C99 и C83. [2]
Структура
E-кадгерин состоит из 728 аминокислот (после созревания), молекулярная масса белковой части — 97,5 кДа. Основной N-концевой участок (555 аминокислот) является внеклеточным, далее расположен единственный трансмембранный фрагмент и внутриклеточный фрагмент (152 аминокислота). Внеклеточный фрагмент включает 5 повторов кадгеринового домена и 4 участка N-гликозилирования. Цитозольный фрагмент содержит 3 участка фосфорилирования (по сериновому остатку).
Белок содержит 3 позиции, которые могут гидролизоваться под действием протеаз и образовывать активные фрагменты. Позиция 700-701 гидролизуется металлопротеазой с образованием фрагмента водного CTF1. Позиция 731-732 расщепляется гамма-секретазой/PS1 с образованием фрагмента CTF2. Связь 750-751 гидролизуется каспазой-3 с образованием CTF3.
Патология
Нарушения гена коррелируют с развитием карцином желудка, молочной железы, толстой кишки, вилочковой железы и яичников.
Комплекс E-cadherin / catenin: важный привратник в опухолегенезе рака молочной железы и злокачественная прогрессия
E-cadherin представляет собой клеточный адгезионный белок, который играет важную роль в эпителиальной дифференцировке. Данные из модельных систем показывают, что E-cadherin является мощным ингибитором инвазии / опухоли рака молочной железы. Было установлено, что в соответствии с этой ролью в прогрессировании рака молочной железы частичная или полная потеря экспрессии E-cadherin коррелирует с плохим прогнозом у пациентов с раком молочной железы. Ген E-cadherin (CDH1) расположен на хромосоме человека 16q22.1, регионе, который часто страдает от потери гетерозиготности при спорадическом раке молочной железы. Инвазивные лобулярные карциномы молочной железы, которые обычно полностью отрицательны к E-кадгерину, часто показывают инактивирующие мутации в сочетании с потерей гетерозиготности аллеля CDH1 дикого типа. Мутации были обнаружены на ранних неинвазивных стадиях, что связывание мутаций E-cadherin с потерей контроля роста клеток и определение CDH1 в качестве опухолевого супрессора для подтипа лобулярного рака молочной железы. Канальные раковые опухоли в целом показывают гетерогенную потерю экспрессии E-cadherin, связанную с эпигенетической транскрипционной регуляцией. Предполагается, что микроокружение на инвазивном фронте временно подавляет транскрипцию E-cadherin. Это может быть связано с индукцией неэпителиальных кадгеринов.
Злокачественный рак молочной железы — это заболевание, возникающее в проточном и лобулярном эпителии молочной железы. Межклеточные взаимодействия имеют решающее значение для процессов динамической дифференциации, периодически активируемых в течение жизни в нормальном грудном эпителии, а также для индукции и поддержания дифференцированных тканей у взрослых. В последние несколько лет наблюдается повышенный интерес к адгезии клеток-клеток, опосредованной E-кадгерином, и адгезии клеток-внеклеточных матриц в качестве основных медиаторов эпителиальной дифференцировки.
Грудь E-cadherin выражается у нормальных взрослых в эпителиальных клетках просвета, тогда как экспрессия P-кадгерина ограничивается миоэпителиальными клетками [9,10]. Временная подавление E-cadherin была обнаружена у почтенных дольков, вторгающихся в строму ткани груди [11]. Изменения в нормальной картине экспрессии комплекса E-cadherin / catenin были обнаружены при различных раковых заболеваниях человека. При раке молочной железы, вообще говоря, частичная или полная потеря экспрессии E-cadherin коррелирует с потерей характеристик дифференциации, приобретением инвазивности, увеличением степени опухоли, метастатическим поведением и плохими прогнозами [12,13,14,15]. Однако, принимая во внимание два основных гистологических подтипа рака молочной железы, были найдены различные способы модуляции экспрессии E-cadherin. В то время как инфильтрирующие протоковые раки молочной железы в основном не показывают или только гетерогенно уменьшенную экспрессию E-cadherin, инфильтративные дольковые карциномы молочной железы (ILC) в большинстве случаев (85%) полностью являются E-cadherin-negative [9,16,17,18,19 ]. Другими работниками сообщалось о значительно меньшем отношении E-кадгерин-отрицательных по сравнению с E-кадгерин-положительными образцами ILC [19,20]. Это расхождение может быть частично связано с диагностическим изменением применительно к лобулярным карциномам [21].
В дополнение к потере экспрессии E-кадгерина в ILC наблюдалась одновременная потеря экспрессии α-катенина и экспрессии β-катенина [22]. Интересно, что в меньшинстве (15%) случаев ILC сохраняется экспрессия E-cadherin и catenins. Однако в этих случаях экспрессия E-кадгерина является нетипичной, поскольку она неполяризована (то есть опухолевые клетки окрашиваются по всей поверхности), указывая на дисфункцию нормальных адгезионных свойств клеток [19,20,22]. Интригующим является вывод о том, что, хотя первичные протоковые и лобулярные раковые опухоли молочной железы могут проявлять частичную или полную потерю экспрессии E-кадгерина, их производные метастазы могут проявлять сильную экспрессию E-кадгерина [23, 24]. Это говорит о том, что переходные механизмы подавления E-кадгерина могут быть вовлечены в злокачественные раковые образования без необратимых мутаций гена E-cadherin. Наблюдаемые переключатели экспрессии кадгерина в клеточных линиях рака молочной железы и опухолях также важны [25, 26]. Высококачественные поражения протоковой молочной железы с уменьшенной экспрессией E-cadherin могут проявлять аномальную экспрессию P-кадгерина в люминальных клетках. Более того, снижение экспрессии E-кадгерина в клетках рака молочной железы часто связано с неправильной экспрессией N-кадгерина и кадгерина-11, которые обычно экспрессируются в мезенхимальных клетках. Принудительная экспрессия N-кадгерина в клетках рака молочной железы с положительным E-кадгерином коррелирует с инвазией и подвижностью, что указывает на то, что N-кадгерин играет важную роль в продвижении этих злокачественных признаков [26].
Усилия на аллелотип рака молочной железы показали одновременную потерю гетерозиготности (LOH) на множественных хромосомных участках, причем LOH при 16q является одним из наиболее распространенных событий (52,3%) при спорадическом раке молочной железы [27]. Это указывает на значительную роль генов в этой хромосомной области для создания спорадического рака молочной железы. Ген E-cadherin (CDH1) относится к хромосоме человека 16q22.1 [28]. Соматически приобретенные мутации в CDH1 были обнаружены у примерно 56% дольковых опухолей молочной железы, как правило (> 90%) в сочетании с потерей аллеля дикого типа, в то время как мутации в первичных карциномах грудной железы [28,29] не обнаружены. Большинство из этих соматических мутаций приводят к преждевременным стоп-кодонам в результате вставок, делеций и бессмысленных мутаций. По прогнозам, большинство этих мутаций сдвига рамки и бессмыслицы генерируют секретированные фрагменты E-кадгерина, функциональность этого основного белка клеточной клеточной клетки теряется. Другие связанные с раком мутации E-cadherin также приводят к повреждению белков. Отличительная инвазивная картина роста, характерная для лобулярного рака молочной железы, полностью совместима с этой функциональной инактивацией. Обнаружение того, что потеря иммунореактивности E-cadherin и соответствующих мутаций уже присутствует в ранних неинвазивных лобулярных карциномах in situ (LCIS), интригует [18]. Это указывает на подлинную роль супрессора опухоли для E-cadherin во время спорадического развития рака молочной железы, в дополнение к ранее описанной роли супрессора вторжения. Экспериментальное доказательство эффективности роли в контроле клеточной пролиферации происходит из экспериментов in vitro и in vivo с E-кадгерин-отрицательными клетками рака молочной железы. Принудительная экспрессия E-кадгерина в этих клетках приводила к значительному ингибированию роста как в клеточной культуре, так и в виде опухолей у мышей [4]. Эта уменьшенная способность к росту может быть связана с повышенной экспрессией ингибитора циклинзависимой киназы p27KIP1 [7].
Однако молекулярная основа смешанных типов проточных / лобулярных опухолей молочной железы остается загадочной. Такой смешанный тип рака молочной железы встречается как на стадии развития, так и на месте. Это может указывать на то, что лобулярный компонент в этих конкретных опухолях молочной железы может происходить из карциномы протоков (in situ или инфильтративные варианты) через инактивацию E-кадгерина. Это было бы полностью совместимо с более ранними результатами в карциномах со смешанными желудочками, где мутации E-cadherin наблюдались исключительно в диффузном компоненте опухолей [30].
Можно ожидать, что полная потеря экспрессии E-cadherin приведет к увеличению уровней свободного цитоплазматического или ядерного β-catenin. Ядерные формы β-катенина накапливаются в колоректальных раках из-за мутаций в сигнальном пути Wnt, в том числе мутации мутаций аденоматозного полипоза и стабилизации мутаций β-catenin [2]. Результатом является взаимодействие β-катенина с факторами транскрипции семейства фактора лимфоидного фактора-Т-клеточного фактора в ядре и модуляцией экспрессии генов. Сопутствующая потеря экспрессии α-катенина и экспрессия β-катенина в ILC с мутированным геном CDH1 [22], однако, исключает возможную активацию передачи сигналов Wnt путем накопления свободного цитоплазматического или ядерного β-катенина в этих конкретных случаях рака молочной железы. Действительно, в последнее время стало ясно, что клеточные линии либо лобулярного, либо протокового происхождения с потерей экспрессии E-cadherin не показывают усиленной передачи сигналов Wnt [31]. Тем не менее экспрессия стабилизированной транскрипционно-активной формы β-катенина в молочной железе трансгенных мышей приводила к дифференцировке нормальной железы и индуцировала легкорастущие аденокарциномы с избыточной экспрессией как c-Myc, так и cyclin D1 [32]. Удивительно, но для ILC с дефектным комплексом E-cadherin / catenin, но без детектируемых мутаций E-cadherin до сих пор не было найдено доказательств мутационной инактивации α-catenin или β-catenin [33]. В конфликте с мутационными данными из первичных опухолей также сообщается, что 20% (3/15) линий рака молочной железы протокового происхождения несут инактивирующие мутации E-cadherin в сочетании с LOH [31]. Причина этого расхождения в настоящее время неясна: это может быть отражением отклонения от гистопатологического диагноза или может быть обусловлено гетерогенностью опухолей в первичных карциномах протоков с едва заметным меньшим количеством клеток типа ILC с мутациями E-cadherin. Более того, существование клеточных линий рака молочной железы протоков с потерей функционального E-кадгерина может быть результатом клонирования in vitro клонирования из-за преимущества роста, обеспечиваемого инактивацией гена E-cadherin.
Для большинства первичных опухолей молочной железы и клеточных линий гистотипа протоков нельзя было идентифицировать мутации E-cadherin, несмотря на то, что эти опухоли часто демонстрируют поразительно уменьшенный ген E-cadherin и экспрессию белка. Возможные механизмы для объяснения этой сокращенной экспрессии включают перегруппировки хроматина, гиперметилирование и изменения в трансфакторном связывании [41, 42]. Было продемонстрировано, что гиперметилирование промотора CDH1 и перекрывающегося островка 5 CpG коррелирует с потерей экспрессии E-кадгерина на уровне транскрипции для различных линий рака молочной железы и первичных раковых опухолей молочной железы [43]. Кроме того, недавно было сообщено о нескольких инфильтративных дольковых раковых опухолях с метилированными промоторными последовательностями CDH1 [20]. Это могло бы служить вторым событием инактивации гена в сочетании с LOH или соматическими мутациями CDH1, хотя предполагалось также, что метилирование биаллелей также происходит. Лечение двух линий клеток рака молочной железы с помощью ингибитора метилирования ДНК 5-аза-2′-дезоксицитидина приводило к незначительной регуляции уровня мРНК и белка E-cadherin [43]. Интересно отметить, что гетерогенное метилирование этого 5′-CpG-острова, как сообщается, заметно возрастает при злокачественной прогрессии от карциномы протоков in situ до метастатических поражений [44]. Эти эпигенетические изменения кажутся динамическими, поскольку их можно имитировать in vitro в зависимости от микроэнвайронных условий, благоприятствующих либо гомотипической клеточной адгезии (рост как сфероиды), либо инвазии in vitro [45].
Однако пока неясно, можно ли экстраполировать прямое участие гиперметилирования в качестве преобладающего механизма в подавлении экспрессии гена E-cadherin для большинства случаев рака молочной железы, показывая промотор метилированного гена. Действительно, интригует, что экспрессия E-cadherin не может быть восстановлена в гибридах соматических клеток, возникающих в результате слияния между позитивными клеточными линиями E-cadherin и линиями клеток с метилированным неактивным промотором E-кадгерина [46]. Помимо этой доминантной репрессии была замечена невозможность реактивации экспрессии E-кадгерина обработкой 5-аза-2′-дезоксицитидином, что указывает на то, что потеря экспрессии мРНК E-кадгерина связана не только с гиперметилированием [47]. Поддержка механизма транспрессии действует недавно, идентифицируя транскрипционный фактор Snail, связывающийся непосредственно с E2-коробками в промоторе E-cadherin и сильно подавляющий его транскрипцию [48,49]. Улитка высоко экспрессируется в клеточных линиях рака молочной железы с отрицательной обратной связью с E-кадгерином, в том числе с метилированными островами 5 CpG. В этом контексте интересно отметить, что высокая экспрессия интегрин-связанной киназы в эпителиальных клетках молочной железы индуцировала эпителиальный → мезенхимальный переход, который был связан с потерей экспрессии E-кадгерина [50]. Недавно выяснилось, что связанная с интегрином киназа активирует промотор Унайла в клеточных линиях колоректального рака с мутациями аденоматозных полипозных коликов [51]. Более того, сообщалось, что транскрипция гена E-cadherin ингибируется в клетках рака молочной железы сверхэкспрессией erbB2, протоонкоген часто сверхэкспрессируется при раке молочной железы [52]. Трансформирующий фактор роста-β, который играет важную тормозную роль в лобулоальвеолярном развитии при сверхэкспрессии in vivo в молочной железе [53], также способен подавлять транскрипцию E-кадгерина в клетках молочной железы [54, 55]. Поэтому наиболее интересно, что двуручный белок SIP1 (ZEB2) с цинковым пальцем с двусторонним связыванием, который первоначально изолирован на основе его взаимодействия с трансформирующими β-регулируемыми белками Smad-фактора роста, может подавлять E-кадгерин и индуцировать инвазивность [ 56]. Различные E-cadherin-отрицательные линии рака молочной железы и толстой кишки выражают SIP1, в том числе с метилированным промотором E-кадгерина. Поэтому может оказаться целесообразным искать Улитки и SIP1-индуцирующие факторы в микроокружении инвазивных частей злокачественных опухолей молочной железы.
Сегодня, несомненно, инактивация E-cadherin играет важную роль в развитии части спорадического рака молочной железы. Высокий уровень полной и необратимой инактивации E-кадгерина в инфильтративном дольковом раке молочной железы свидетельствует о роли E-кадгерина в качестве подлинного опухолевого супрессора в этом специфическом гистологическом подклассе спорадических молочных желез. Это подтверждается также тем фактом, что E-cadherin уже инактивирован в раннем неинвазивном LCIS, что противоречит модели с ограниченной ролью E-cadherin как только подавителя вторжения. Гетерогенная потеря экспрессии E-кадгерина обычно наблюдается при раке молочной железы протоков. Это отрицательное регулирование, по-видимому, обратимо на уровне транскрипции, что позволяет повторно экспрессировать на вторичном метастатическом участке опухоли. По мере того, как основные механизмы и соответствующие ключевые молекулы становятся последовательно идентифицированными, это открывает возможность разработки противоопухолевых и анти-инвазионных стратегий, направленных на функциональное усиление E-кадгерина при раке молочной железы.
ILC = инфильтративные лобулярные карциномы молочной железы; LCIS = дольковая карцинома in situ; LOH = потеря гетерозиготности.
Е кадхерин что это
ГАУЗ СО «Институт медицинских клеточных технологий», Екатеринбург, Россия, 620026
ГБУЗ СО «Институт медицинских клеточных технологий»
ГБУЗ СО «Институт медицинских клеточных технологий», Екатеринбург
Роль кадгеринов в норме и при развитии рака молочной железы
Журнал: Архив патологии. 2015;77(3): 57-64
Засадкевич Ю. М., Бриллиант А. А., Сазонов С. В. Роль кадгеринов в норме и при развитии рака молочной железы. Архив патологии. 2015;77(3):57-64.
Zasadkevich Yu M, Brilliant A A, Sazonov S V. Role of cadherins in health and in developing breast cancer. Arkhiv Patologii. 2015;77(3):57-64.
https://doi.org/10.17116/patol201577357-64
ГАУЗ СО «Институт медицинских клеточных технологий», Екатеринбург, Россия, 620026
В обзоре приведены данные о строении молекул клеточной адгезии кадгеринов, их роли в развитии организма и при прогрессировании злокачественной опухоли. Описаны кадгерины, которые, как считают, играют наиболее важную роль в развитии опухолевого процесса: Е-, Р-, N-кадгерин, относящиеся к классическим кадгеринам I типа, а также VE-кадгерин, относящийся к кадгеринам II типа. Особое значение уделено сигнальным механизмам с участием кадгеринов и ассоциированных с кадгеринами молекул, реализующимся в организме в норме и при опухолевой трансформации клеток.
ГАУЗ СО «Институт медицинских клеточных технологий», Екатеринбург, Россия, 620026
ГБУЗ СО «Институт медицинских клеточных технологий»
ГБУЗ СО «Институт медицинских клеточных технологий», Екатеринбург
Кадгерины подразделяются на 3 типа в зависимости от своих структурных особенностей: I, II и III (атипичные кадгерины) [5, 6].
Особое значение при развитии организма в норме, а также при развитии злокачественной опухоли придают Е-кадгерину (эпителиальный), N-кадгерину (нейрональный) и Р-кадгерину (плацентарный), относящимся к семейству классических кадгеринов (I тип) и VE-кадгерину (сосудистый эндотелиальный), относящемуся к семейству кадгеринов II типа. Вышеуказанные белки получили свое название по локализации, в которой они впервые были обнаружены [3, 5, 7, 8].
Значение кадгеринов в онтогенезе человека
Развитие многоклеточного организма невозможно без динамической и должным образом регулируемой межклеточной адгезии. Адгезионные контакты обеспечивают формирование высокоорганизованных тканей и эффективное межклеточное взаимодействие, направленное на поддержание гомеостаза и необходимое для существования целого организма. Динамический баланс между межклеточной адгезией и миграцией является необходимым условием для таких уникальных процессов развития организма, как ранний эмбриогенез, тканевый морфогенез и органогенез. Важную роль в реализации вышеуказанных процессов играют кадгерин-катениновые комплексы, которые, кроме поддержания межклеточных связей, также участвуют в реализации некоторых сигнальных путей, контролирующих клеточное деление, дифференцировку и апоптоз [9].
Е-кадгерин
Е-кадгерин — одна из основных молекул клеточной адгезии в эпителиальных тканях. Он кодируется геном CDH1, расположенным на хромосоме 16q22.1 [10—12].
Е-кадгерин локализуется на поверхности эпителиальных клеток, участвуя в образовании адгезионных контактов, являющихся характерной особенностью эпителиальных тканей [13—16]. Е-кадгерин является полипептидом, состоящим из 728 аминокислотных остатков, включающим трансмембранный домен, цитоплазматический (внутриклеточный) домен и эктодомен (внеклеточный). Последний состоит из 5 повторяющихся доменов, 4 из которых имеют одинаковую структуру и называются «внеклеточные кадгериновые повторы» (EC1-EC4), в то время как пятый (EC5) имеет особую структуру, характеризующуюся наличием четырех цистеинов, и называется «мембранный проксимальный внеклеточный домен». Нарушение дисульфидных связей в этом домене влияет на формирование прочных межклеточных контактов [16, 17].
Важным компонентом Е-кадгерина является его цитоплазматический домен, состоящий из двух субдоменов: мембранного проксимального цитоплазматического домена, или, как его часто называют, юкстамембранного домена (ЮМД), и β-катенинсвязанного домена (БСД), каждый из которых имеет участок с аминокислотной последовательностью около 30—35 остатков, называющийся CH2 и CH3 соответственно («CH-кадгериновый гомологичный участок»). Е-кадгерин через БСД соединен с цитоскелетом посредством α-, β-, γ- и p120-катенина, формируя комплекс Е-кадгерин—β-катенин—α-катенин—актин, участвующий в запуске каскада сигнальных путей в клетке [5, 17] (рис. 1).

Формирование данного комплекса не только стабилизирует клеточную адгезию, но также активно стимулирует запуск ряда сигнальных путей, включающих сигнальный путь Wnt [18], сигнальные пути PI3K (фосфатидилиноситол 3-киназа), Rho ГТФазы, а также другие пути, которые будут рассмотрены ниже [8, 12, 19].
Вместе с другими классическими кадгеринами (главным образом N-кадгерином) Е-кадгерин играет важную роль в формировании тканей во время гаструляции, нейруляции, гисто- и органогенеза [12, 20—22].
Е-кадгерин начинает экспрессироваться в раннем эмбриогенезе на стадии двух бластомеров. Эпителиальная дифференциация появляется в раннем онтогенезе на стадии морулы, когда каждый бластомер поляризуется, что ведет к формированию эпителиально-подобного фенотипа. Е-кадгерин играет важную роль в адгезии бластомеров и ранней способности эмбриона к компактности. Е-кадгерин начинает экспрессироваться на мембране еще до того, как морула становится компактной, не выполняя при этом адгезивной функции. Механизм, который заставляет Е-кадгерин функционировать, до конца не ясен, но известно, что он связан с фосфорилированием протеина [12].
Контролируемый эпителиально-мезенхимальный переход (ЭМП) — наиболее важное событие, в котором принимает участие Е-кадгерин во время эмбрионального развития. Этот процесс был впервые описан E. Hay в 1980 г. как центральный механизм раннего эмбрионального морфогенеза [22—24]. Потеря эпителиальной адгезии и полярности происходит во время формирования мезодермы и обеспечивает клеткам морфологию и свойства мезенхимальных клеток [25—28]. Первым этапом ЭМП является снижение экспрессии эпителиальных маркеров, таких как Е-кадгерин, за счет подавления транскрипции и увеличение экспрессии мезенхимальных маркеров, таких как виментин [29—31].
Роль Е-кадгерина в реализации сигнальных путей
Проведенные исследования на мышах показали, что роль Е-кадгерина и катенинов заключается не только в поддержании межклеточной адгезии, но и в обеспечении клеточной пролиферации и дифференцировки. Несмотря на то что Е-кадгерин главным образом вовлечен в процесс поддержания эпидермальной целостности и защиты от апоптоза, связанные с ним катенины играют двоякую роль, участвуя в формировании межклеточных контактов, с одной стороны, и выступая как регуляторы клеточных сигнальных путей — с другой [9].
Адгезия, опосредованная Е-кадгерином, является динамическим процессом, который регулируется несколькими сигнальными путями [23, 34]. Подавление экспрессии Е-кадгерина, характерное для эмбриогенеза и развития эпителиальных опухолей, приводит не только к снижению прочности межклеточной гомофильной адгезии, способствующей увеличению клеточной подвижности, но и к дезинтеграции Е-кадгерин-катенинового комплекса, результатом которой служат высвобождение сигнальных молекул, таких как β-, р120-катенин, из комплекса и запуск ряда сигнальных путей [2, 34, 35].
Одним из главных сигнальных механизмов с участием Е-кадгерина и β-катенина является канонический сигнальный путь Wnt. При его активации белок Wnt связывается с рецептором Фрайзлед (Frizzled), что приводит к транскрипции генов, которые регулируют клеточный рост и дифференцировку. В основе данного сигнального пути лежит стабилизация цитозольной формы β-катенина. В норме Е-кадгерин связан с β-катенином и образует прочный Е-кадгерин—β-катениновый комплекс. При отсутствии экспрессии Е-кадгерина свободная цитозольная форма β-катенина связывается с аксином, фосфорилируется гликогенсинтазакиназой 3β (GSK-3β) сигнального комплекса APC—аксин—казеинкиназа I и впоследствии утилизируется при помощи убиквитин-протеосом. Активированный сигнальный путь Wnt блокирует активность GSK-3β, что приводит к транслокации β-катенина в ядро, его связыванию с семейством транскрипционных факторов TCF/LEF (Т-клеточный фактор/лимфоидный энхансерный фактор) и активации экспрессии таргетных генов, таких как c-myc, циклин D1/D2, фибронектин, MMP7 (матриксная металлопротеиназа 7), CD44 и других TCF/LEF-чувствительных генов, ответственных за пролиферацию клеток. Активация канонического сигнального пути характерна при развитии злокачественной опухоли, способствуя инвазии опухолевых клеток в соединительную ткань и последующей миграции [5, 19, 36] (рис. 2).

Е-кадгерин также принимает участие в реализации сигнального пути с участием RhоGTFаз, которые представляют собой семейство клеточных сигнальных белков, относящихся к семейству Ras. К ним относятся белки RhoA, Rac1 и Cdc42 [36]. Дестабилизация Е-кадгерин—β-катенинового комплекса приводит к цитоплазматической аккумуляции p120-катенина, который в норме плотно связан с ЮМД. Гиперэкспрессия р120-катенина приводит к дезактивации белка RhoA, регулирующего стабильность актинового цитоскелета, а также к активации белков Rac1 и Cdc42, отвечающих за выработку ламмелоподий и филлоподий соответственно. Актиновые филаменты, содержащиеся в указанных органеллах, обеспечивают подвижность клеток [23, 34, 37, 38].
β-Катенин комплекса Е-кадгерин—β-катенин связан с α-катенином, который в свою очередь взаимодействует с актиновым цитоскелетом, обеспечивая стабильность клеточной адгезии. Некоторые исследования показывают роль α-катенина в эмбриональном развитии и при развитии опухоли в его взаимодействии с сигнальным путем Ras-MAPK (митогенактивируемая протеинкиназа) [2, 39], приводящим к транслокации молекулы Erk (внеклеточная сигналрегулируемая киназа, относится к группе MAPK) в ядро, действующей как транскрипционный фактор, и активации пролиферации клетки [29]. Активированная молекула RAS также приводит к запуску сигнального пути PI3K/AKT, который обеспечивает антиапоптотичеcкую активность, рост и пролиферацию клеток [40].
N-кадгерин
N-кадгерин кодируется геном CDH2, его экспрессия отмечена на стадии гаструляции эмбриогенеза. В мезодермальных клетках, формирующихся на этой стадии, отмечается снижение экспрессии Е-кадгерина и повышение экспрессии N-кадгерина. Этот феномен был назван «переключение кадгеринов», при котором экспрессия одного кадгерина замещается экспрессией другого. N-кадгерин также участвует в формировании сердца, сосудистой и нервной систем на этапе органогенеза [9]. В тканях взрослого организма N-кадгерин является компонентом мезенхимальных тканей, эндотелия сосудов и нервной ткани, выполняя свои адгезионные функции [5]. N-кадгерин принимает участие в реализации ряда сигнальных путей, главным образом в сигнальном пути с участием рецепторов фактора роста фибробластов (FGFR). Показано, что N-кадгерин способствует димеризации FGFR и активации сигнала, не зависящего от участия факторов роста. Комплекс N-кадгерин—FGFR способствует росту числа нейритов в здоровых тканях, а также увеличению миграции и инвазии клеток благодаря запуску сигналов с участием MAPK и PI3K при развитии злокачественной опухоли [36, 41, 42] (рис. 3).

Р-кадгерин
Р-кадгерин кодируется геном CDH3, расположенным на хромосоме 16q22.1, в регионе, который содержит кластер нескольких генов кадгеринов, в 32 килобазах от гена, кодирующего Е-кадгерин. Р-кадгерин схож по строению с другими классическими кадгеринами и содержит три домена (внеклеточный, трансмембранный и внутриклеточный), необходимых для осуществления гомофильных взаимодействий. На клеточной мембране молекулы Р-кадгерина образуют латеральные димеры, которые взаимодействуют по типу молнии, соединяя соседние клетки [43].
Функция и сила Р-кадгеринассоциированной адгезии зависит от динамического взаимодействия с катенинами, которые связывают кадгериновый цитоплазматический конец с актиновым цитоскелетом и способствуют формированию кадгерин-катениновых комплексов [43, 44].
Во время эмбриогенеза наибольшая экспрессия Р-кадгерина выявляется в плаценте, как в материнской, так и в плодной частях, что объясняет название Р-кадгерина («плацентарный»). Экспрессия Р-кадгерина в матке начинается с появления децидуальной оболочки, в которую мигрируют экстраэмбриональные клетки имплантированного эмбриона, экспрессирующие Р-кадгерин для формирования связи мать—плод [45]. В отличие от Р-кадгерина экспрессия Е-кадгерина отмечена только в плодной части плаценты. Данные наблюдения свидетельствуют о роли Р- и Е-кадгерина в эмбриогенезе. Р-кадгерин необходим для связи эмбриональных и материнских тканей во время поздней стадии имплантации, в то время как Е-кадгерин предотвращает смешивание этих тканей [45].
Показано, что Е- и Р-кадгерин экспрессируются в эктоплацентарном конусе, эктодерме, некоторых энтодермальных тканях и ткани почечного канальца, в то время как Р- и N-кадгерин экспрессируются во всех клетках латеральной пластинки мезодермы, эндотелии роговицы и радужной оболочке [43].
В тканях взрослого организма экспрессия Р-кадгерина обнаружена главным образом в базальном слое некоторых эпителиальных структур, таких как кожа, шейка матки, простата и легкие [43].
VE-кадгерин
VE-кадгерин кодируется геном CDH5, расположенным на 16-й хромосоме. Экспрессия VE-кадгерина считается специфичной для эндотелиальных клеток. Роль VE-кадгерина заключается главным образом в контроле целостности и проницаемости сосудов [46]. Отмечено также существенное участие данной молекулы клеточной адгезии в ангиогенезе [47]. VE-кадгерин может связываться с рецептором эндотелиального фактора роста сосудов (VEGFR2) и модулировать сигнальный путь с его участием для обеспечения клеточной выживаемости и снижения пролиферации [46].
Роль кадгеринов в развитии рака молочной железы
Считается, что все четыре группы кадгеринов могут играть существенную роль в патологии, в том числе при развитии злокачественной опухоли и метастазировании опухолевых клеток [3, 7, 15, 21, 27] (см. таблицу).

Метастазирование является многоступенчатым процессом. Одной из наиболее значимых особенностей этого процесса является деформация адгезивных способностей неопластических клеток, опосредованная нарушением экспрессии кадгеринов [8, 30]. Другой важной особенностью этого процесса является реализация ЭМП. Этот процесс схож с таковым, осуществляемым во время эмбрионального развития, но его важной отличительной особенностью является неконтролируемость [17, 28, 48]. ЭМП реализуется в эпителиальных опухолях, обеспечивая способность к инвазии и метастазированию [31, 36, 49].
Ген Е-кадгерина CDH1 считается геном-супрессором опухоли [12, 50]. Его утрата или аномальная экспрессия способствует инвазии неопластических клеток. При раке молочной железы снижение уровня Е-кадгерина выявляется приблизительно в 50% случаев при инвазивной протоковой карциноме, в то время как при инвазивной дольковой карциноме — до 90%, в первую очередь в опухолях с тройным негативным фенотипом (отсутствием экспрессии мембранного рецептора HER-2/neu, а также ядерных рецепторов эстрогена — ER и прогестерона — PR) [14, 28]. Некоторые авторы отмечают, что аберрантная экспрессия Е-кадгерина связана с более поздней стадией опухолевого процесса и развитием метастазов, а также часто сочетается с отсутствием экспрессии ER [51].
Вышеуказанные сигнальные механизмы играют роль при развитии злокачественной опухоли и формировании отдаленных метастазов. Помимо них, при осуществлении процесса инвазии опухоли был продемонстрирован β-катенинзависимый (но не зависимый от транскрипционной активности TCF) регуляторный процесс, предполагающий вовлечение в регуляцию инвазии неопластических клеток неизученного сигнального механизма, включающего β-катенин. Кроме этого, отсутствие Е-кадгерина приводит к индукции множественных транскрипционных факторов, один из которых — Twist — также имеет существенное значение при запуске ЭМП, играющего важную роль при метастазировании [10, 37, 52]. По данным ряда авторов, также существует сигнальный путь с участием эстрогена, подавляющий экспрессию Е-кадгерина в опухолевых клетках рака молочной железы [53]. Изучение указанных механизмов требует проведения дальнейших исследований.
В литературе описаны данные о том, что опухолевые клетки могут реэкспрессировать Е-кадгерин [12, 51]. Механизм и биологическая роль этого процесса в метастазах до конца не изучены, но его связывают с механизмом, называемым «мезенхимально-эпителиальный переход» (МЭП), при котором происходит обратная смена фенотипа клеток метастазирующей опухоли с мезенхимального на эпителиальный в дистантном очаге с соответствующей экспрессией эпителиальных маркеров, таких как Е-кадгерин [51, 54]. Значительное увеличение реэкспрессии Е-кадгерина, а также α- и β-катенина наблюдается в метастазах дольковых карцином, в то время как в первичной опухоли сохраняется полная потеря экспрессии этих белков. Считается, что для таких карцином характерны мутации Е-кадгерина, проявляющиеся потерей локуса гена даже на самом раннем этапе канцерогенеза на стадии опухоли in situ [31, 54].
N-кадгерин в норме слабо экспрессируется в эпителии молочной железы, но часто его экспрессия увеличивается одновременно со снижением экспрессии Е-кадгерина. Переключение кадгеринов с эпителиального на мезенхимальный тип — важная особенность ЭМП. Известно, что утрата экспрессии Е-кадгерина препятствует адгезии клеток опухоли молочной железы (эпителиального происхождения) с другими эпителиальными клетками, в то время как увеличение экспрессии N-кадгерина и потенциально остальных мезенхимальных кадгеринов (кадгерин-11) способствует адгезии со стромальными клетками и последующей инвазии опухолевых клеток в строму. N-кадгерин стимулирует миграцию клеток и метастазирование, несмотря на экспрессию и функцию Е-кадгерина. Стимулирующий миграцию эффект N-кадгерина отмечен в четвертом внеклеточном кадгериновом домене, который необходим для взаимодействия с рецептором фактора роста фибробластов 1 (FGFR1). При раке молочной железы N-кадгерин взаимодействует с FGFR1 и ингибирует его интернализацию, что сопровождается стимуляцией FGF2 (фактор роста фибробластов 2) и затем активацией каскада сигнальных путей PLCγ, PI3K и MAPK. Сигнальный путь PLCγ/PI3K стимулирует миграцию опухолевых клеток, в то время как сигнальный путь MAPK увеличивает экспрессию MMP-9 (матриксная металлопротеиназа 9) и активацию ERK½, которые способствуют инвазии опухолевых клеток. Кроме экспрессии в эпителиальных опухолевых клетках, N-кадгерин также в большом количестве экспрессируется в клетках эндотелия сосудов. Через гомофильные взаимодействия N-кадгерин опухолевых клеток и клеток эндотелия сосудов взаимодействуют между собой, что приводит к сосудистой адгезии опухолевых клеток. В дальнейшем в эпителиальных клетках активируется сигнальный путь Src-киназы, что приводит к фосфорилированию β-катенина, который связан как с N-, так и E-кадгерином. Фосфорилирование β-катенина в клетках эндотелия подавляет межклеточное взаимодействие соседних эндотелиальных клеток и позволяет опухолевым клеткам проникать в сосудистое русло [4, 5, 8, 37] (рис. 4).

В нормальной ткани молочной железы Р-кадгерин экспрессируется в миоэпителиальных базальных клетках. При раке молочной железы его избыточная продукция обнаруживается как при инвазивных карциномах, так и при протоковых карциномах in situ [10, 43]. Клинический интерес к Р-кадгерину появился несколько лет назад, когда группа ученых исследовала серию случаев карциномы легких и обнаружила, что Е- и Р-кадгерин коэкспрессировались в каждом из них. Полученные данные позволили предположить, что экспрессия Р-кадгерина тесно связана с дифференцировкой карцином. В отличие от Е-кадгерина экспрессия Р-кадгерина, которая, как считается, обычно увеличивается при развитии опухоли, была снижена в более дифференцированных опухолевых клетках [10]. Аберрантная экспрессия Р-кадгерина считается негативным прогностическим фактором и часто связана с нарушениями в сигнализации пути эстрогенового рецептора α (Erα), а также повышенной экспрессией HER-2/neu и p53, ассоциированной с высокой пролиферацией клеток опухоли [10, 43].
Функция и прочность Р-кадгеринассоциированной адгезии зависит от взаимодействия Р-кадгерина с α-, β-, γ- и p120-катенином. Эти молекулы обеспечивают соединение кадгеринового цитоплазматического домена с актиновым цитоскелетом и способствуют формированию комплексов кадгерин—катенин. Этот домен содержит два главных участка, один из которых, катенинсвязанный, необходим для выполнения Р-кадгерином своей адгезионной функции, а второй, юкстамембранный, как предполагается, играет существенную роль в способности клеток к перемещению и инвазии [10].
Аберрантная экспрессия Р-кадгерина при раке молочной железы связана с дестабилизацией нормального комплекса кадгерин—катенин и цитоплазматической экспрессией р120-катенина [10, 55]. ЮМД цитоплазматического конца Р-кадгерина связывается с р120-катенином и способствует его накоплению в цитоплазме, стимулируя активацию RhoGTFаз, Rac1 и Cdc42, обеспечивая опухолевым клеткам повышенную подвижность и способность к инвазии [43].
Было также показано, что экспрессия Р-кадгерина связана с повышенной экспрессией ММР, которые ответственны за инвазию и являются критериями неблагоприятного прогноза при раке молочной железы. Повышение экспрессии Р-кадгерина индуцирует секрецию MMP1 и MMP2, которая приводит к высвобождению внеклеточного домена, обладающего проинвазивной активностью [8, 10, 43]. Кроме того, гиперэкспрессия Р-кадгерина стимулирует активацию GSK-3β, способствующую фосфорилированию молекулы Snail и ее цитоплазматической транслокации, что является одним из факторов, активирующих ЭМП [31, 56] (см. рис. 4).
VE-кадгерин является главной молекулой клеточной адгезии, ответственной за взаимосвязь эндотелиальных клеток, и играет ключевую роль в формировании целостности и проницаемости сосудов. В дополнение к выполнению адгезивной функции VE-кадгерин может связываться с VEGFR2 (рецептором сосудистого эндотелиального фактора роста 2) в ответ на стимуляцию VEGF, что, как было показано, является важным механизмом, участвующим как в ингибировании клеточной пролиферации, так и в повышении клеточной выживаемости [37].
При инвазивном раке молочной железы повышенная экспрессия VE-кадгерина обнаруживается как в эндотелиальных клетках, так и в опухолевых эпителиальных клетках, что приводит к адгезии между ними, проникновению опухолевых клеток в кровоток и их метастазированию. Полученные данные позволяют предположить, что VE-кадгерин имеет значение в метастазировании при раке молочной железы на стадии интравазации [5, 37].
Аберрантная экспрессия VE-кадгерина приводит к последующей активации сигнального пути TGF-β, что стимулирует клеточную пролиферацию (см. рис. 4). Также было показано, что выработка VE-кадгерина увеличивается в процессе ЭМП [10, 27].
Таким образом, VE-кадгерин имеет значение не только при ангиогенезе и интравазации в клетках эндотелия сосудов, но также играет роль в стимуляции опухолевых клеток к опухолевой прогрессии.
Заключение
Анализ данных литературы показал изученные механизмы участия основных групп кадгеринов в развитии злокачественной эпителиальной опухоли на примере рака молочной железы. Изучение кадгеринов и связанных с ними молекул, несомненно, является важным шагом в понимании механизмов опухолевой прогрессии и метастазирования.