единичные макрофаги в молочной железе что это такое
Обследование при мастопатии, болях в молочной железе и др.
МАСТОПАТИЯ
– разнородная группа заболеваний молочной железы, возникающая, чаще всего, на фоне гормональных нарушений.
Проявляется в двух формах:
диффузная мастопатия – болезненное уплотнение ткани всей молочной железы, иногда сопровождающееся выделениями из соска (белыми, желтыми либо зеленоватыми);
узловая мастопатия – единичные или множественные узлы в молочной железе неправильной формы, с четкими границами. Диагностируются при маммографическом, ультразвуковом исследованиях и пункции узлов.
При планировании эффективного лечения мастопатии важно проведение полноценного обследования органов внутренней секреции, в том числе щитовидной железы. Такое лечение может и должен проводить только опытный гинеколог-эндокринолог.
КИСТА МОЛОЧНОЙ ЖЕЛЕЗЫ
– тонкостенная полость, содержащая жидкость. Диагностируется при маммографическом и ультразвуковом исследованиях, лечится посредством проведения пункции кистозной полости – удаления жидкости.
ГАЛАКТОЦЕЛЕ
– разновидность кисты, возникающая при кормлении грудью в связи с закупоркой млечного протока.
ГАЛАКТОРЕЯ
– выделение молока или молозива из сосков, не связанное с грудным вскармливанием. Галакторея чаще всего вызвана гиперпролактинемией (повышением в крови гормона пролактина). Причиной также может стать повышение уровня эстрогенов (женских половых гормонов).
У многих больных с незлокачественными заболеваниями наблюдаются выделения из сосков. Как правило, выделения небольшие, могут быть самого разнообразного цвета.
Особую тревогу вызывают кровянистые выделения, связанные с внутрипротоковой папилломой или раком молочной железы. С точки зрения онкологической настороженности, необходимо проводить обязательное цитологическое исследование этих выделений.
Патоморфолог может указать на наличие молозивных телец при галакторее, воспалительных изменений либо опухолевых клеток при раке.
ФИБРОАДЕНОМА
– доброкачественная опухоль, возникающая из клеток ткани молочной железы. Диагностируется при маммографическом и ультразвуковом исследованиях, для подтверждения диагноза необходима пункция опухоли.
Показанием к хирургическому удалению опухоли является ее прогрессирующее увеличение в объеме.
Разновидность фиброаденом – листовидная фиброаденома подлежит обязательному удалению, так как она может превратиться в саркому.
ЛИПОМА
– единичное, либо множественное, мягко-эластичное доброкачественное новообразование, которое формируется из жировой ткани. Чаще всего опухоли данного вида появляются в подкожно-жировой клетчатке.
Диагноз не вызывает затруднений.
Лечение, как правило, проводится при больших размерах опухоли, вызывающих косметический дефект.
ВНУТРИПРОТОКОВАЯ ПАПИЛЛОМА
– доброкачественная опухоль из клеток стенки протока, растущая внутри протока. Симптомом внутрипротоковой папилломы является выделение из соска прозрачной, «янтарной» или кровянистой жидкости. Диагностируется при специальном рентгенологическом исследовании – дуктографии и исследовании выделений под микроскопом.
Внутрипротоковая папиллома подлежит обязательному хирургическому удалению, так как из нее может развиться злокачественная опухоль.
МАСТИТ
– инфекционное либо асептическое воспаление ткани молочной железы, дифференцируется с диффузными и воспалительными формами рака.
ЖИРОВОЙ НЕКРОЗ (ОЛЕОГРАНУЛЕМА)
– вариант завершения воспалительного процесса или травмы молочной железы (иногда возникает после хирургического лечения или проведения лучевой терапии). Плотное узловое образование неправильной формы, дающее симптомы, сходные с узловыми формами рака молочной железы.
ГИНЕКОМАСТИЯ
– увеличение грудных желез у мужчин из-за гипертрофии железистой ткани.
Развитие гинекомастии связано с избытком (превышением) эстрогенов по отношению к тестостерону.
От гинекомастии необходимо отличать избыточное развитие жировой ткани в области ареолы (ложная гинекомастия).
Для подтверждения диагноза гинекомастии используются маммография и ультразвуковое исследование.
Лечение необходимо проводить с учетом патогенетического механизма развития заболевания (лечение заболеваний печени, щитовидной железы, отмена медикаментов …). Больным с прогрессивно увеличивающейся гинекомастией, неподдающейся терапии эндокринных нарушений, показано хирургическое лечение – трансареолярная мастэктомия.
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
– злокачественная опухоль. Выделяют диффузные и узловые формы рака молочной железы.
Узловые формы рака при небольших размерах опухоли клинически похожи на любое узловое образование, чаще всего на узловую мастопатию.
Диффузные формы труднее при клинической диагностике.
К особым формам относятся маститоподобные, рожистые и отечно-инфильтративные формы.
РАК ПЕДЖЕТА
– локализуется в области ареолы и соска, по виду напоминает экзему.
При прогрессировании заболевания сосок разрушается и на его месте возникает язвенная поверхность.
Чем опасен рак молочной железы?
Если не лечить, опухоль увеличивается, прорастает в кожу и грудную стенку, поражает ближайшие лимфоузлы. В других органах (легких, печени, костях, головном мозге) могут появиться отдаленные метастазы.
Придя в кабинет врача-онколога, Вам нужно будет пройти клинический осмотр.
Сначала врач опросит Вас и уточнит необходимые данные из Вашего анамнеза – то есть из истории заболевания, в основном акцентируя внимание на факторах риска.
Затем врач проведет пальпацию, то есть ощупывание молочных желез. Во время клинического обследования врач попросит вас принять различные положения – поднять руки, положить их на плечи врачу. Это делает более доступными для пальпации грудь и подмышечную впадину. В ряде ситуаций необходимо проведение пальпации не только в положении стоя, но и лежа на кушетке.
Врач проверит состояние сосков и ареол, а также наличие выделений из сосков. При появлении выделений из сосков врач-онколог возьмет мазок этих выделений для цитологического исследования.
Врач-онколог выберет оптимальную для Вас комбинацию основных методов лучевой диагностики заболеваний молочной железы, то есть маммографии и УЗИ, оценив показания и противопоказания к каждому из них.
На повторном приеме врач-онколог сопоставит результаты лучевых методов исследования с клинической картиной и определит тактику дальнейшего наблюдения и лечения. При необходимости врач-онколог совместно с врачом-рентгенологом или врачом ультразвуковой диагностики проводит биопсию.
Тревожные симптомы
Заметили хотя бы один из вышеперечисленных признаков? Обратитесь к онкологу-маммологу. Если в Вашей поликлинике нет онколога-маммолога, обратитесь к терапевту, гинекологу или хирургу. Они проведут предварительный осмотр и дадут направление в онкологический диспансер или специализированную клинику.
Записаться на консультацию:
+7 (916) 757 80 54
Филиал №1 Клиники женского здоровья МКНЦ (г. Москва, ул. Гончарная, д. 23)
+7 (916) 757 80 05
Филиал №2 Клиники женского здоровья МКНЦ (г. Москва, Верхний Предтеченский пер., д. 8)
Результаты цитологического исследования молочной железы: что означают макрофаги?
Мастопатия, рак груди являются достаточно распространенными заболеваниями.
Для выявления наличия патологических процессов в молочных железах проводится ряд обследований, среди которых – цитологический анализ. Иногда результат показывает наличие моноцитов. Многих женщин это пугает и настораживает.
Важно понимать, что означают макрофаги в молочных железах.
Функционирование макрофагов

Они жизненно необходимы для стимуляции работы неспецифических защитных механизмов организма. Их активизация приводит к поглощению внутриклеточных патогенов: Listeria, Mycobacterium tuberculosis, Toxoplasma, Leishmania, Streptococcus pneumoniae и т.п.
Уничтожение таких болезнетворных агентов зависит от продукции оксида азота и перекиси водорода. Макрофаги присутствуют практических во всех тканях организма, в том числе и в молочных железах. Их главная роль заключается в очистке организма от поврежденных, раковых и мертвых клеток, элементов, бактерий и прочих патогенных тел.
Процесс, в ходе которого макрофаги поглощают и обезвреживают нездоровые ткани, называется фагоцитозом. Макрофаги принимают участие в поддержании адаптивного и клеточного иммунитета. Они получают информацию о чужеродных антигенах и передают ее лимфоцитам. Благодаря этому иммунной системе удается лучше справляться с патологическим процессом.
Также макрофаги принимают участие в следующих важных функциях организма:
Иммунные клетки способны находиться в спокойном или активированном виде, последнее состояние провоцирует:
Активированные макрофаги отличаются от пассивных по ряду морфологических признаков, например:
Диагностика
Для определения наличия и количества иммунных тел в молочных железах проводится цитологическое исследование. Этот вид диагностики направлен на оценку и изучение клеток. Он отличается высокой точностью, эффективностью. Материал для обследования получают путем пункционной биопсии.

Поэтому такой тип исследования дает возможность оценить эффективность проводимой терапии. Цитологический метод диагностики доступен в финансовом плане.
Благодаря этому сделать анализ может любая женщина, попавшая в группу риска появления рака и прочих патологий молочных желез. Задача лаборанта заключается не только в изучении добытого материала, но и в определении, анализе состава выявленных макрофагов.
В таких иммунных клетках обычно присутствуют остатки либо фрагменты перевариваемых либо переваренных патогенов. Если у лаборанта получается узнать, что находится внутри белых клеток крови, то это дает возможность специалисту сделать определенные выводы о типе и форме протекания болезни, имеющейся у женщины.
Наличие в иммунных клетках гемосидерина говорит о присутствии в женской груди полости с кровью. Это возможно при посттравматических изменениях. Также макрофаги с гемосидерином наблюдаются при определенных формах мастопатии.
При обнаружении большого количества макрофагов в груди проводится дополнительное обследование. Дифференциальная диагностика болезней молочных желез позволяет своевременно и правильно выявить тип и форму патологии.
Расшифровка
Важно не только правильно проведенное цитологическое исследование, но и грамотная расшифровка результатов. Трактовку анализов проводит врач. Самая благоприятная картина наблюдается при интерпретации результатов нормы. Исследуемые ткани молочных желез в этом случае не содержат аномальных клеток, воспаления, дополнительных включений.

Поражение характеризуется изменениями строения паренхимы, стромы, образованием кистозных элементов. Стимулом для развития патологического процесса выступает дисбаланс гормонов.
В результатах гистологического обследования при наличии фиброзно-кистозного мастита присутствуют такие изменения:
Норма или патология
Наличие макрофагов в цитологическом исследовании молочных желез может быть нормой и патологией. Все зависит от количества данных иммунных клеток и их состава.
Если же данных клеток очень много и их состав не соответствует норме, то это свидетельствует о протекании патологического процесса. Большое скопление макрофагов говорит о том, что присутствует болезнетворная микрофлора, организму есть с чем бороться.
Это может быть воспаление, доброкачественное либо злокачественное образование. Для постановки диагноза проводятся дополнительные обследования (например, УЗИ, КТ, МРТ и т.п).
Видео по теме
О диагностике заболеваний молочных желез в видео:
Таким образом, макрофаги – это иммунные клетки, которые призваны бороться с патологической микрофлорой и токсинами. При возникновении воспаления, рака и прочих нарушений данные тельца активизируются и начинают поглощать, уничтожать болезнетворные элементы.
Для выявления количества белых клеток в молочных железах, проводится цитологическое исследование материала взятого в ходе биопсии. Расшифровкой результата диагностики занимается врач. Важно помнить, что макрофаги присутствуют и у полностью здоровых пациенток. О наличии заболевания судят по количеству данных элементов и их составу.
Макрофаги в молочной и щитовидной железе
Осмотр и пальпация (ощупывание) щитовидной железы 
В молочной и щитовидной железе при этом можно определить уплотнения и другие изменения, которые могут быть признаком растущей опухоли. Однако не всегда узел в тканях говорит о раке. Также это может быть киста, доброкачественное новообразование и т.д. Чтобы сделать предположение о диагнозе и запланировать лечение, делают биопсию желез – добывают кусочек ткани и под микроскопом изучают его клеточный состав. Если речь идет о молочной железе, то женщинам также могут провести исследование выделений из соска. В зависимости от результатов микроскопии устанавливают, что у человека за болезнь и как ее лечить. Наличие определенных клеток во взятой пробе указывает на наличие конкретного заболевания.
В этом посте мы не будем детально описывать разные картины биоптата щитовидной и молочных желез, разберем лишь частный вопрос: присутствие в этих органах клеток-макрофагов.
Макрофаги в молочной железе:

Совершенно правильная логическая цепочка. Если в ткани молочной железы и выделениях из соска много фагоцитов, это говорит о патологии. Так, когда в препарате присутствуют нейтрофилы, макрофаги и гистиоциты (это разновидность макрофагов, находящаяся в норме в соединительной ткани), то это прямо указывает на наличие воспалительного процесса.
Перед лаборантом, изучающим добытый от пациента образец, стоит задача не только обнаружить, но и изучить строение найденных макрофагов. В них всегда немало всякого «мусора», который представляет собой остатки и фрагменты перевариваемых или уже переваренных ими агрессоров. Если удается распознать, что именно находится внутри макрофагов, это помогает понять, против чего боролись эти фагоциты, а значит, сделать вывод, что за болезнь у пациента.
Так, иногда встречаются макрофаги в молочной железе с включениями «обломков» эритроцитов и гемосидерина (гемосидерин – один из конечных продуктов разрушения гемоглобина). Если макрофаги с гемосидерином находят в препарате, это говорит о присутствии в железе полости, внутри которой находится кровь. Последнее встречается при посттравматических изменениях, при некоторых формах мастопатии.
Макрофаги в щитовидной железе:
Макрофаги и нейтрофилы в щитовидной железе также в большом количестве обнаруживаются при заболеваниях. Довольно распространена такая патология этого органа как киста. Сделав пункцию (прокол) кисты, специалисты получают жидкость. В ней мало клеток, среди них преобладают макрофаги с гемосидерином – их еще называют сидерофагами.
Также макрофаги в щитовидной железе могут встречаться при других заболеваниях, например, при воспалительном процессе. Однако при аутоиммунном тиреоидите, который является основным воспалительным заболеванием этого органа, таких фагоцитов в биоптате немного – в железе преобладают лимфоциты, а другие иммунные клетки встречаются реже.
Итак, присутствие большого количества макрофагов в описанных 
Кстати, когда речь идет о выздоровлении, важно не только непосредственно воздействовать на причину болезни (онкологический, воспалительный, дисгормональный процесс), но и уделять внимание поддержке иммунной системы, частью которой являются пресловутые макрофаги. Прием препарата Трансфер Фактор позволяет нормализовать деятельность иммунитета и помочь макрофагам в осуществлении их благого дела – борьбы с возбудителями заболеваний и другими вредоносными факторами.
Регулярная терапия этим средством может помочь выздороветь от большинства заболеваний молочной и щитовидной желез, а при профилактическом приеме предупредить их появление. При устойчивой и слаженной работе всех звеньев иммунитета, что достигается благодаря Трансфер Фактору, риск заболеть аутоиммунными, воспалительными и даже онкологическими процессами этих органов многократно уменьшается.
Функции макрофагов в различных условиях микроокружения опухоли
Связанные с опухолью макрофаги, как известно, стимулируют ключевые этапы прогрессирования опухоли. В этом обзоре рассказывается о многочисленных экспериментальных и клинических исследованиях, проведенных с целью изучения функций, регуляции и клинической значимости опухолевых макрофагов. В отношении клинической значимости наиболее интересны три участка инвазии раковых клеток: опухолевые гнезда, пограничная зона между стромой и опухолевыми клетками, а также области, близкие к сосудистой сети опухоли или удаленные от нее. Более полное понимание разнообразия опухолевых макрофагов может привести к разработке избирательных методов лечения, основанных на восстановлении противораковых функций этих клеток.
Вступление
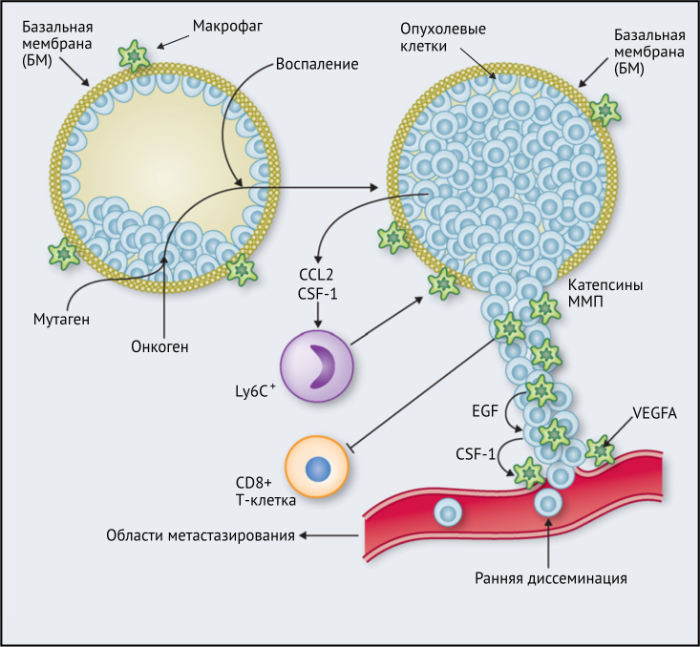
Опухолевые макрофаги (ОМ) изобилуют в большинстве типов злокачественных новообразований, способствуют опухолевому ангиогенезу, выходу раковых клеток из опухоли в кровоток, способствуют их выживанию и постоянному росту в метастатических колониях, подавлению противоопухолевых иммунных механизмов. В то же время ОМ могут подавлять, дополнять или опосредовать противоопухолевые эффекты цитотоксических агентов, лучевой терапии, антиангиогенных препаратов и ингибиторов контрольных точек.
Происхождение этих клеток в настоящее время является предметом обсуждения. Недавние исследования показали, что макрофаги во многих тканях происходят не из циркулирующих моноцитов, как первоначально предполагалось, а из эмбриональных макрофагов (особенно из макрофагов желточного мешка), которые закладываются в тканях во время развития. Эти предшественники остаются в тканях взрослого организма и размножаются, таким образом, сохраняясь независимо от гемопоэтической системы взрослого человека. В некоторых органах, например, в кишечнике, основные популяции макрофагов развиваются путем рекрутирования моноцитов. Выборочное истощение каждого из этих двух подтипов ОМ показало, что только эмбриональные макрофаги поддерживают опухолевый рост.
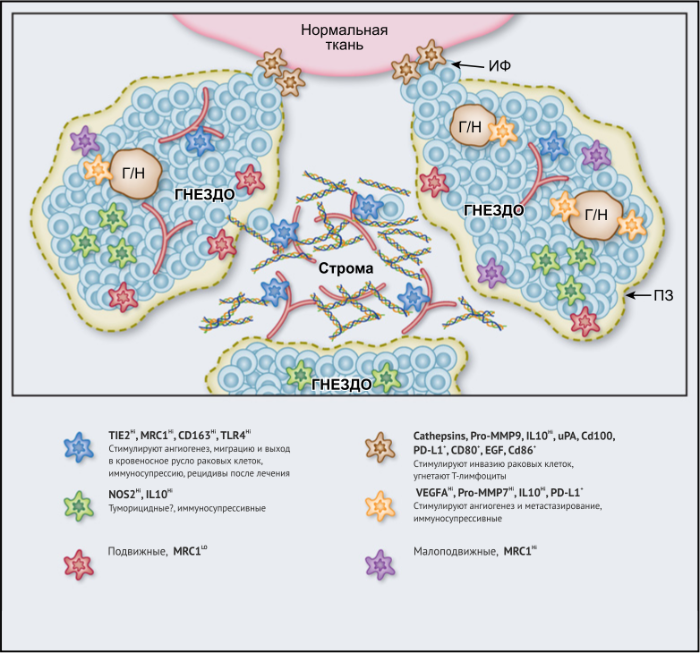
ОМ могут находиться в различных состояниях активации. Обычно они отклоняются от «классически» активированного, агрессивного по отношению к опухоли фенотипа (иногда называемого M1) в сторону «альтернативно» активированного опухолевого промотора (M2). Однако как и макрофаги во многих других тканях, ОM обладают замечательной функциональной пластичностью и часто экспрессируют маркеры, характерные для обоих состояний активации, что делает такой полярный подход к их классификации неточным. Предполагается, что функции ОМ могут, по крайней мере частично, регулироваться их расположением в опухоли; что они проявляют разные функции по меньшей мере в трех областях инвазии раковых клеток: области высокой плотности раковых клеток (так называемом «опухолевом гнезде»); периваскулярной (ПВ) нише; и плохо васкуляризованных гипоксических/некротических областях опухоли (Рис.1 и 2).
Области инвазии
Существует по крайней мере три основных локализации, в которых прогрессия опухоли была ассоциирована с повышенной инвазией клеток.
Результаты исследований, проведенных на мышах, показывают, что макрофаги способствуют развитию злокачественных опухолей различными способами: реконструируют внеклеточный матрикс, опосредуют разрушение базальной мембраны, увеличивают подвижность раковых клеток, и их способность к миграции, способствуют прогрессированию преинвазивных поражений, выделяют фактор роста эндотелия сосудов A (VEGF-A). Макрофаги вокруг преинвазивных поражений молочных желез у мышей высвобождают CXCR2-связывающие хемокины CXCL1 и CXCL5, которые способствуют миграции и инвазии соседних предростопластических (предраковых) эпителиальных клеток. В то же время подавление активности макрофагов вызывало замедление развития инвазии опухолевых клеток и развития опухоли в целом.
Недавнее исследование на модели рака легких Kras G12D показало, что нарушение регуляции онкогенов, таких как Myc, в раковых клетках вызывает трансформацию медленно прогрессирующей аденомы легкого в агрессивную аденокарциному. Это связано с тем, что изменения в Myc стимулировали увеличение экспрессии CCL9 и IL-23 эпителиальными клетками легких. CCL9 затем стимулировал накопление VEGFA + макрофагов и, следовательно, ангиогенез опухоли, а также PD-L1-зависимое вытеснение T- и B-клеток. Кроме того, IL-23 стимулировал гибель Т- и В-клеток и цитотоксических NK-клеток (Рис.1).
Следует отметить, что антитела против CD68 продолжают широко использоваться в качестве иммунных меток ОМ в опухолях (Таблица 1). Однако как и многие другие антитела, маркирующие отдельные типы клеток, человеческие анти-CD68 иногда маркируют клетки, отличные от ОM. Например, методом качественного анализа с помощью иммуноокрашивания удалось установить, что некоторые клетки CD68 + в опухолях молочной железы человека не экспрессируют рецептор к КСФ-1 (КСФ-1Р), CD45 или другие маркеры эпителиальных клеток, эндотелиальных клеток или клеток стенок сосудов (то есть гладкомышечных клеток, перицитов или фибробластов). Остается неизвестной как принадлежность этих клеток, так и то, маркируются ли они антителами к CD68 иного происхождения.
ОМ в ИФ опухоли поджелудочной железы RIP1-Tag2 мыши усиливают инвазивный потенциал раковых клеток посредством экспрессии катепсинов B и S, двух ферментов, регулируемых IL-4, высвобождаемым раковыми клетками и инфильтрирующими опухоль Т-клетками. Кроме того, было показано, что CD4 + Т-клетки в опухолях MMTV-PyMT увеличивают инвазивность раковых клеток благодаря IL-4, что затем стимулирует ОM экспрессировать эпидермальный фактора роста (EGF).
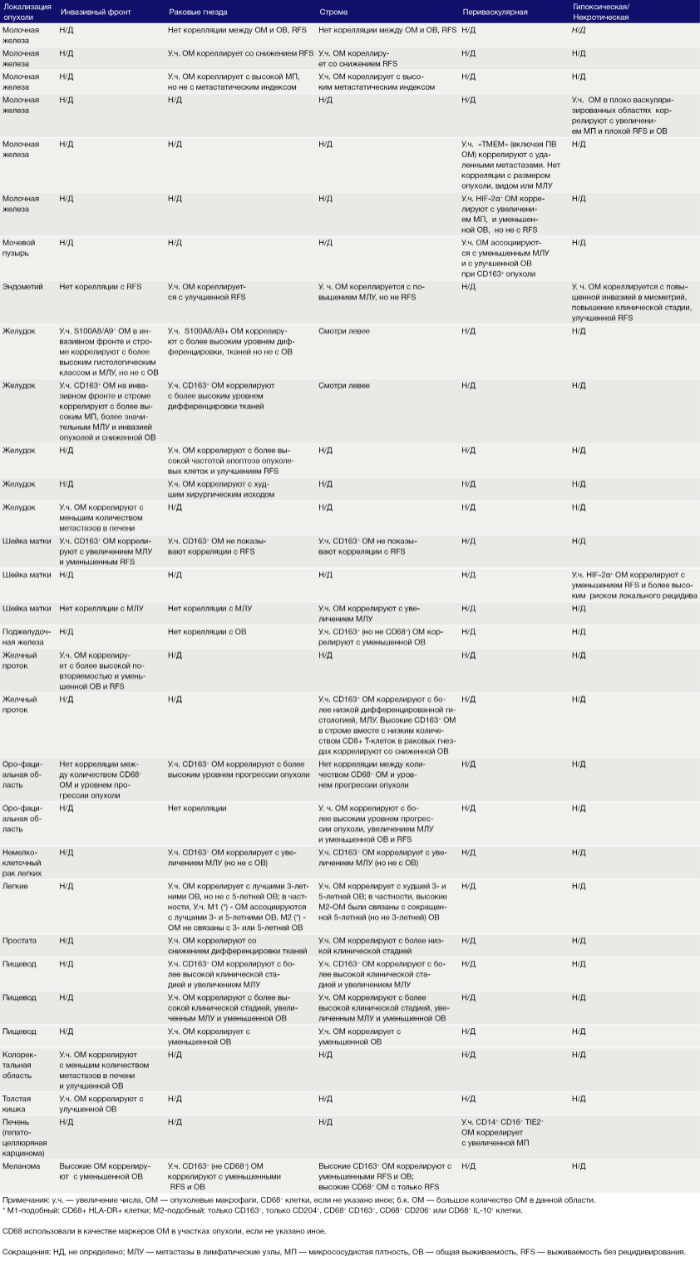
Эти экспериментальные данные хорошо согласуются с данными исследований, согласно которым ОM в ИФ опухолей желудка человека выделяют MMP9 — фермент, разрушающий матрикс, — и рецептор сериновых протеаз, урокиназный активатор плазминогена (УАП, урокиназа). Интересно, что ОМ вдоль ИФ первичной карциномы толстой кишки экспрессируют CD80 и CD86 (костимуляторные сигналы, необходимые для активации Т-клеток), что указывает на то, что они могут иметь потенциал для стимулирования противоопухолевого иммунитета при этом типе рака. Это может объяснить наблюдение, что повышенное количество CD68 + ОM в ИФ колоректальных опухолей человека коррелируют с более высокой выживаемостью без рецидива (RFS) (Таблица 1). Тем не менее, в ИФ опухолей могут присутствовать различные ОM-подмножества, причем некоторые из них являются иммуносупрессивными. Например, ОM в ИФ гепатоцеллюлярных карцином (ГЦК) экспрессируют более высокое количество лиганда иммуносупрессивной контрольной точки PD-L1, чем ОМ в других опухолевых гнездах, и связаны с плохой выживаемостью. Кроме того, было показано, что семафорин 4D (SEMA4D, CD100) — цитокин, экспрессия которого особенно выражена в ИФ опухоли толстой кишки Colon26, стимулирует ОM, которые экспрессируют иммуносупрессивный цитокин IL-10 в ИФ, и таким образом подавляют активированные CD8 + Т-клетки. Блокада антител SEMA4D подавляла ОМ в ИФ и повышала эффективность лечения ингибиторами контрольных анти-PD-1 и анти-CTLA4 (Рис.2).
Опухолевые гнезда
Возможные функции ОМ в непосредственной близости от раковых клеток в опухолевых «гнездах», по-видимому, варьируются в зависимости от типа опухоли. Например, ОM, экспрессирующие NOS2 — фермент, связанный с их цитотоксическим потенциалом, — обнаруживаются в тесном контакте с раковыми клетками в некоторых опухолях предстательной железы, а большое количество ОM в опухолевых гнездах коррелирует с улучшенным прогнозом при раке эндометрия, а также снижением количества рецидивов рака желудка (Таблица 1). Повышенное количество ОM коррелирует с уменьшенной общей выживаемостью и RFS при злокачественных меланомах, а также опухолях молочной железы и пищевода (Таблица 1). ОМ в гнездах ГЦК человека экспрессируют IL-10 и рекрутируют иммуносупрессивные клетки FoxP3 + Treg, хотя нет данных, что эти Treg влияют на исход заболевания (Рис. 2).
Интересно, что ОМ экспрессируют сигнальный регуляторный белок альфа (SIRP-α) на своей поверхности, который связывается с трансмембранным белком CD47 на злокачественных клетках. Когда это происходит, подавляется способность ОM обнаруживать и фагоцитировать опухолевые клетки. Различные исследования показали, что блокирование CD47 прерывает этот сигнал «не ешь меня» и вызывает разрушение опухолей при посредстве ОM у мышей, а высокая экспрессия CD47 обуславливает плохой прогноз рака мочевого пузыря, острого миелоидного лейкоза, неходжкинских лимфом и рака молочной железы. Так опухолевые клетки уклоняются от наблюдения ОМ.
Строма
В области стромы большинства солидных опухолей опухолевых клеток обычно мало либо нет вовсе. Она состоит из сложной сети макромолекул, формирующих внеклеточный матрикс(ВКМ), к которым относятся коллагеновые фибриллы, ламинин, фибронектин, тенасцин C и гиалуроновая кислоту (ГК). В нем часто находятся популяции различных клеток, включая фибробласты, эндотелиальные клетки, перициты, лимфоциты и миелоидные клетки. Ряд исследований показал, что компоненты ВКМ (и/или продукты его протеолиза), такие как фибронектин, ламинин-10, версикан (хондроитинсульфатсодержащий протеогликан) и фрагменты ГК, регулируют фенотип макрофагов. Пинто и его коллеги в исследованиях in vitro показали, что бесклеточный ВКМ, выделенный из колоректальных опухолей, стимулирует макрофаги экспрессировать IL-10, TGF-β и снижает экспрессию рецепторов хемокинов C-C 7 (CCR7), TNF-α и IL-6. Кроме того, повышенная экспрессия стромальными ОМ лигандов хемокинов C-C 18 (CCL18) связана с повышенным метастазированием и снижением выживаемости у пациентов при раке молочной железы. Это согласуется с рядом исследований, свидетельствующих о корреляции между большим количеством стромальных ОМ и низкой общей выживаемостью и RFS при опухолях молочной железы, пищевода, желудка, поджелудочной железы, орофациальных, кожных (Таблица 1). Существует зависимость от типа опухоли, поскольку такой корреляции при раке эндометрия, шейки матки и легких не выявлено, а при раке мочевого пузыря прослеживается уменьшение метастазирования в лимфатических узлах и улучшение выживаемости (Таблица 1).
Помимо описанных выше химических компонентов стромы опухоли, функции ОМ также регулируют ее биофизические свойства. Архитектоника и плотность ВКМ регулирует экспрессию различных провоспалительных генов макрофагами in vitro путем активации сигнальных путей TLR4 в этих клетках. Высокие уровни 22 общих составляющих матрикса («меток матрикса») положительно коррелируют как с плотностью опухоли, так и с инфильтрацией ОМ при метастазах рака яичников, хотя еще предстоит выяснить, есть ли причинно-следственная связь между инфильтрацией и структурой опухоли. Также следует отметить, что разные области стромы при данной опухоли могут различаться по своим химическим и биофизическим свойствам и влиять на ОМ по-разному (Рис. 2).
Периваскулярная ниша
Подмножество ОМ лежит близко или на поверхности кровеносных сосудов в опухолях мышей и человека. Эти клетки часто экспрессируют большое количество маркеров, связанных с M2: TIE2 (основной рецептор ангиопоэтина), MRC1 и CD163, — и играют ключевую роль в стимулировании ангиогенеза опухоли, метастазирования и рецидива после терапии первой линии. Из-за их относительно высокой экспрессии TIE2 эти клетки первоначально назывались «TIE2-экспрессирующие моноциты/макрофаги (TEM)». Частота TEM также положительно коррелирует с плотностью микрососудов (MVD) у некоторых типов опухолей человека (Табл. 1).
Генетическая делеция периваскулярных (ПВ) TIE2 + ОМ или фармакологическая блокада основного лиганда TIE2 — ангиопоэтина 2 (AGPT2), — продемонстрировали важную роль этого подмножества ОM в ангиогенезе опухоли и ее росте у различных мышиных моделей рака. Стимуляция экспрессии генов TEM, выделенных из опухолей мыши, привела к более высокой экспрессии ряда генов, способствующих развитию опухолей, включая Mmp9, Vegfa, Cxcl12, Tlr4 и Nrp1, чем TIE2- ОM из тех же опухолей.
ПВ TIE2 + ОM также участвовали в рецидиве первичных опухолей мыши после различных форм лечения. Они учащают рецидивы глиомы после местного облучения, а также при опухолях легких и молочной железы после химиотерапии. В такие моменты они экспрессируют большое количество CXCR4 и рекрутируются с помощью активированного CXCL12 в ПВ нише. Это подмножество ОМ затем стимулирует реваскуляризацию и рост опухоли посредством высвобождения VEGF-A. Позднее исследование подтвердило, что экспрессия TIE2 в ОМ необходима для стимуляции васкуляризации после химиотерапии у мышей. Кроме того, недавно рекрутированные моноциты также мигрируют вокруг опухолей, не подвергавшихся терапии, зависимым от CXCR4 образом. Меченые моноциты проникали в ПВ зону опухоли PyMT, где они затем подвергались воздействию TGFβ, выделяемого раковыми клетками, что стимулировало эти моноциты повышать свою экспрессию CXCR4 и мигрировать к CXCL12-экспрессирующим фибробластам вокруг опухолевых кровеносных сосудов в богатых коллагеном стромальных областях. Как только они примыкают к сосудам, моноциты дифференцируются в «метастаз-ассистирующие» ПВ ОM, участвующие в TMEM.
Наконец, в метастатических областях, таких, как легкие, подмножество макрофагов CCR2 + Ly6C + способствует выходу раковых клеток в кровеносное русло и образованию из них метастазов. Эти «метастаз-ассоциированные макрофаги» (MAM) были использованы в мышиных моделях опухолей, чтобы напрямую связать молекулу адгезии сосудистых клеток-1 (VCAM-1) с раковыми клетками через их α4-интегрины. Этот процесс впоследствии увеличивает выживаемость раковых клеток в таких метастатических областях. Кроме того, связывание CCL2 с CCR2 на MAM стимулирует высвобождение ими CCL3, который связывается с CCR1 на раковых клетках и облегчает их удержание в легких. Эти MAM также способствуют постоянному росту метастатических повреждений с помощью сигналов VEGFR1 и CSF-1R.
Гипоксические/некротические области
Гипоксия является отличительной чертой солидных опухолей и связана с увеличением инвазии и метастазов, сопротивлением терапии и плохим клиническим исходом. Гипоксические области обычно имеют парциальное давление кислорода (рО2) ниже 10 мм рт. ст. Они расположены более чем в 150 мкм от опухолевых кровеносных сосудов. Они образуются в опухолях, когда потребность клеток в кислороде опережает их снабжение плохо организованными опухолевыми сосудами. Эти области были идентифицированы в опухолевых срезах с использованием маркеров гипоксических клеток, например, пимонидазола, или иммуноблока для индуцируемой гипоксией альфа-субъединицы транскрипционных факторов HIF 1 и 2. Большое количество гипоксических ОМ ассоциируется с повышенным уровнем ангиогенеза опухолей, метастазами, сниженной RFS и/или снижением общей выживаемости при раке молочной железы, эндометрия и шейки матки (Таблица 1).
ОM в таких областях регулируют HIF 1 и 2 и различные гены-мишени HIF, такие как VEGF-A, GLUT1 и MMP7. Хемокины, усиливающие гипоксию, рекрутируют в гипоксические области ОМ, в том числе хемокин C-X-C 12 (CXCL12), полипептид-активирующий эндотелий-клеточный моноцит II (EMAP-II), эндотелин 2, VEGF-A и SEMA3A. Гипоксические ОМ иммобилизируются в этих областях прямым ингибирующим действием гипоксии на их подвижность и снижением экспрессии их рецепторов опухолевых хемокинов CCR2, CCR5 и NRP1.
Гипоксические ОМ способствуют ангиогенезу опухоли, уклонению от иммунитета и метастазированию в различных экспериментальных моделях. Например, они регулируют экспрессию большого количества проангиогенных и иммуносупрессивных цитокинов в гипоксических зонах опухоли, а когда их проникновение в гипоксические области опухолей затруднено сигнальной блокадой SEMA3A/NRP1, опухолевый ангиогенез заметно снижается и противоопухолевый иммунитет восстанавливается. Гипоксические ОМ также способны подавлять активацию Т-клеток различными способами, влияя на IL-10 и на контрольные точки, например, через лиганд PD-L1. Макрофаги, кокультивированные с клетками ГЦК в гипоксических условиях, увеличивают экспрессию индоламин 2,3-диоксигеназы (IDO), которая подавляет пролиферацию местных цитотоксических Т-клеток и увеличивает популяцию клеток Treg.
Хотя воздействие гипоксии само по себе не может изменить фенотип ОМ в отношении стимуляции роста опухоли, некоторые исследования показали, что низкий уровень рН и лактат (которые накапливаются в слабо васкуляризированных, гипоксических областях из-за плохого сосудистого питания) совместно индуцируют проангиогенный фенотип ОМ, который, в свою очередь, восстанавливает перфузию крови. Действительно, молочная кислота может стимулировать экспрессию VEGF-A макрофагами. Как упоминалось ранее, этот цитокин является не только проангиогенным в опухолях, но также способен стимулировать выход в сосуды раковых клеток.
Опухолевая гипоксия также может модулировать функции ОМ опосредованно, стимулируя раковые клетки выделить белок группы 1 с высокой подвижностью (HMGB1), который, в свою очередь, стимулирует продукцию IL-10 ОM. Гипоксия также индуцирует метаболические изменения в ОМ, которые затем непосредственно влияют на функции соседних клеток. Например, гипоксия стимулирует экспрессию REDD1, ингибитора mTOR и ключевого модулятора метаболизма в ответ на доступность питательных веществ и потребность в энергии. Ингибирование mTOR в ОM сильно снижает их поглощение глюкозы и активность гликолиза, оставляя больше глюкозы для соседних эндотелиальных клеток. Это повышает способность раковых клеток проникать в сосудистое русло, соответственно, приводит к формированию отдаленных метастазов.
Таблица 1. Опухолевые макрофаги в различных злокачественных новообразованиях человека: корреляция с клинико-патологическими проявлениями
Заключение
Ряд экспериментальных исследований на мышах подтвердил способность различных опухолевых популяций дифференцированно регулировать фенотип ОМ. Важность этого подчеркивается клиническими отчетами, показывающими, что число или фенотип ОМ в определенных областях опухоли коррелируют с RFS и выживаемостью (Таблица 1).
Имеются данные о роли подмножеств ОM в определенных областях опухолей, ограничивающих ответ опухолей на лечение. Например, облучение, сосудистые разрушающие агенты и цитотоксические препараты индуцируют пролиферацию ПВ ОM, что способствует ангиогенезу опухоли и рецидиву после терапии. Гипоксические ОМ также были вовлечены в устойчивость опухолей к противоопухолевой терапии и способствуют рецидиву.
Демонстрация того, что ОМ стимулируют ряд механизмов опухолеобразования на мышиных моделях опухолей, побудила к развитию терапевтических подходов к истощению или перепрограммированию ОМ. На сегодняшний день общие ингибиторы ОМ, включая те, которые нацелены на CSF-1-CSF-1R и CCL-CCR2, в значительной степени не показали эффективности в клинических испытаниях в качестве монотерапии рака, хотя они могут оказаться эффективными в сочетании с другими терапевтическими агентами. Ингибитор CSF-1-R PLX3397 показал значительную эффективность при лечении теносиновиальной гигантоклеточной опухоли, лечение также выявило побочное действие, вызванное долгосрочным истощением всех макрофагов.
Таргетная терапия в отношении определенных ОM-подмножеств в опухолях может стать отличным методом в качестве противоопухолевой терапии посредством истощения или перепрограммирования тех ОМ, которые способствуют с помощью различных механизмов опухолевой прогрессии, при этом она должна оставлять или усиливать те подмножества ОМ, которые способствуют противоопухолевому иммунитету. Прогресс в нашем понимании того, как фенотип подмножеств ОМ в различных областях опухоли зависит от их онтогенеза, статуса активации и сложного комплекса местных взаимодействий поможет разработать такой терапевтический подход. Раскрытие сложного массива влияний на поведение ОM потребует многогранного подхода к исследованиям, однако это может привести к появлению новых возможностей в лечении опухолевых заболеваний, появлению новых таргетных противоопухолевых препаратов.
Источник: Yang M. et al. Diverse Functions of Macrophages in Different Tumor Microenvironments //Cancer research. – 2018. – Т. 78. – №. 19. – С. 5492-5503.