едкий натр что это такое
Едкий натр
каустическая сода,
едкая щелочь
— 52,2 (20 °C) г/100 мл
Гидроксид натрия лат. Natrii hydroxidum ; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь. Самая распространенная щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкой щёлочи. Гидроксид натрия также используется для мойки пресс-форм автопокрышек, называется Mold Cleaner фирмы «NALCO». Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разьедать кожу, бумагу, стекло и вызывать сильные ожоги. До XVII века, щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
Физические свойства
ΔH 0 растворения для бесконечно разбавленного водного раствора —44,45 кДж/моль.
Из водных растворов при 12,3 — 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −734,96 кДж/моль), в интервале от —28 до —24°С — гептагидрат, от —24 до —17,7°С — пентагидрат, от —17,7 до —5,4°С —тетрагидрат (α-модификация), от —5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь)— сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочно-земельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкий калий), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдает электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в ряду электрохимической активности металлов, в котором за ноль принята активность водорода.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твердых веществ:
так и с растворами:
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
2. Обмена с солями в растворе:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.
например, с фосфором — с образованием гипофосфита натрия:
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
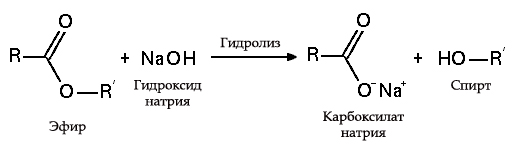
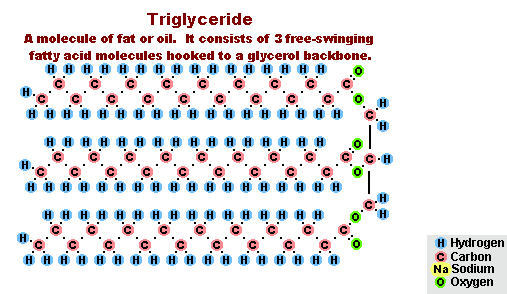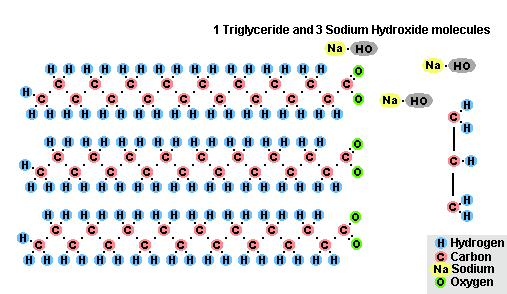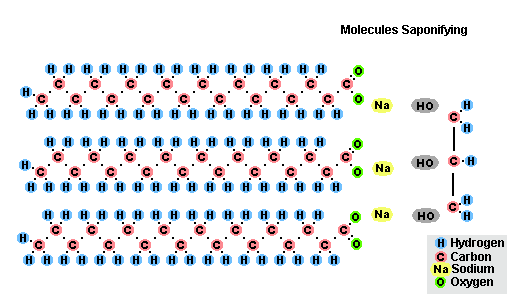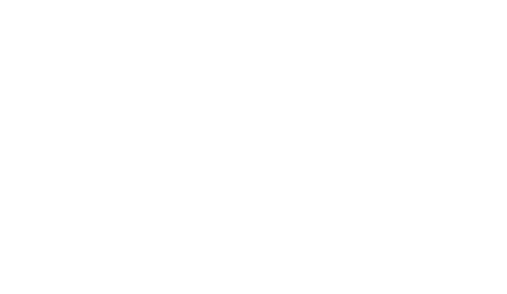
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
Качественное определение ионов натрия возможно несколькими способами
1. По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску:
2. С использованием специфических реакций на ионы натрия:
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- | ||
|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зеленый | желто-зеленый | белый | белый | бледно-жёлтый |
Способы получения
Промышленные способы получения
В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора:
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
1,8 NaCl + 0, 5 H2O + 2,8 МДж = 1,00 Cl2 + 1,10 NaOH + 0,03 H2,
Основные показатели различных методов производства даны в таблице:
Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод — Полость электролизёра с твёрдым катодом разделена пористой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом [1]. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды — водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42—50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Мембранный метод — аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама:
Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
(1) — процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Что такое натр едкий? Плотность натра едкого
В современном мире невозможна жизнь без химических реакций, которые протекают повсюду и носят как полезный, так и опасный характер. Согласно периодической таблице химических элементов Д. И. Менделеева, металлы 1 группы главной подгруппы, в число которых входит и натрий (Na), бурно реагируют с водой, образуя щелочи – химически активные вещества.
Понятие о щелочах
Растворимые в воде гидроксиды активных металлов – щелочи – едкие и довольно опасные химические вещества. По своей форме они твердые, белого цвета. Растворяясь в воде, эти основания выделяют тепло. Также щелочи способны разрушать кожу, древесину, ткани, в результате чего и получили тривиальное название «едкие», которое обычно применяется только к гидроксидам щелочных металлов. К наиболее известным щелочам относятся гидроксиды натрия (NaOH), калия (KOH), лития (LiOH), бария (Ba(OH)2), цезия (CsOH), кальция (Ca(OH)2) и некоторые другие.

Гидроксид натрия: характеристика
Едкий натр – это тривиальное название гидроксида натрия – одной из самых распространенных щелочей. Она относится к опасным химическим веществам, потому что легко разъедает кожу человека, поэтому нужно соблюдать необходимые меры безопасности при работе с ней. Также гидроксид натрия иногда называют каустической содой, или каустиком. Как и все остальные щелочи, он хорошо взаимодействует с водой с выделением тепла и представляет собой белое, гигроскопичное, то есть способное поглощать водяные пары из воздуха, соединение. Плотность едкого натра составляет 2,13 г/см³.
Реакционная способность
Раствор едкого натра может вступать в реакции разного типа, образуя другие вещества.
1. При взаимодействии этого соединения с кислотами всегда образуются соль и вода:
NaOH + HCl = NaCl2 + H2O.
2. Едкий натр способен реагировать с кислотными и амфотерными оксидами металлов (в растворе и при сплавлении), также образуя соответствующую соль и воду:
При взаимодействии гидроксида натрия с раствором амфотерного оксида образуется растворимая комплексная соль.
3. Реакция щелочи с амфотерными гидроксидами также приводит к образованию расплава или комплексной натриевой соли в зависимости от условий ее проведения.
4. Путем взаимодействия каустика с солями получают натриевые и соответствующий нерастворимый в воде гидроксид.
5. Гидроксид натрия способен реагировать и с неметаллами, например с серой или галогенами с образованием смеси натриевых солей, а также с амфотерными металлами с образованием комплексных солей, железом и медью.
6. Едкий натр способен вступать во взаимодействие и с органическими веществами, например: эфирами, амидами, многоатомными спиртами.
Получение
Существует несколько методов получения едкого натра в промышленности, основными из которых являются химические и электрохимические.
В основу первого метода входят несколько способов: пиролиз, известковый и ферритный.
1. Пиролиз проводится при прокаливании карбоната натрия при высокой температуре (не менее 1000 градусов) с образованием оксида натрия и углекислого газа. Далее полученный охлажденный оксид растворяют в воде, в результате чего и получается едкий натр.
Иногда вместо карбоната натрия используют его гидрокарбонат, и процесс, соответственно, проходит немного сложнее.
2. Известковый метод получения гидроксида натрия заключается во взаимодействии натриевой соли угольной кислоты с гидроксидом кальция (гашеной известью) при нагревании до температуры не менее 80 градусов. В результате такого взаимодействия получаются растворы щелочи и карбоната кальция (CaCO3), который затем отфильтровывается от основного раствора.
3. Ферритный метод проводится в два этапа: сначала осуществляется сплавление соды с оксидом железа III при температуре до 1200 градусов для получения феррита натрия, затем последний обрабатывают водой, в результате чего получается щелочь.
При электрохимическом методе получения едкого натра также применяются несколько способов: электролиз раствора поваренной соли (NaCl), диафрагменный, мембранный и ртутный метод с жидким катодом. Последние три способа являются более сложными по сравнению с первым, но все они связаны с пропусканием через раствор соответствующих солей электрического тока, то есть с электролизом.
Самый распространенный метод получения щелочи – электролиз раствора галита, состоящего из поваренной соли, в результате чего на аноде и катоде выделяются хлор и водород, и получается гидроксид натрия:
В лаборатории каустическую соду также получают химическими способами, но чаще всего используются диафрагменный и мембранный методы.
Применение
Едкий натр находит применение не только в различных отраслях промышленности, но и в быту. Его применяют:
Меры предосторожности
Гидроксид натрия (Е524)

Общая характеристика
Научное название добавки Е524 – гидроксид натрия или едкий натр. Это очень агрессивное вещество синтетического происхождения не имеет аналогов в природе. В естественных для себя условиях оно принимает вид белых чешуек или небольших гранул мыльных на ощупь.
В наше время широко используется в разных отраслях жизнедеятельности, в том числе медицине, фармакологии, пищевой индустрии. В сельском хозяйстве, например, каустическую соду используют для проверки коровьего молока на наличие примесей. Это вещество применяют в производстве разных видов бытовой химии (самые популярные – для прочистки водопроводных и канализационных труб). В косметологии едкий натр добавляют в шампуни, мыло, жидкости для снятия лака, кремы, а также в средства для избавления от ороговевшей кожи. Кроме того, гидроксид натрия – незаменимое вещество в нефтеперерабатывающей, целлюлозно-бумажной промышленности и в производстве дизельного топлива.
В пищевой промышленности гидроксид натрия используют для регуляции кислотности, как стабилизатор и эмульгатор. Несмотря на весьма агрессивные свойства и внушительный список побочных эффектов, каустическая сода в качестве пищевой добавки разрешена во всем мире.
Опасные свойства каустической соды
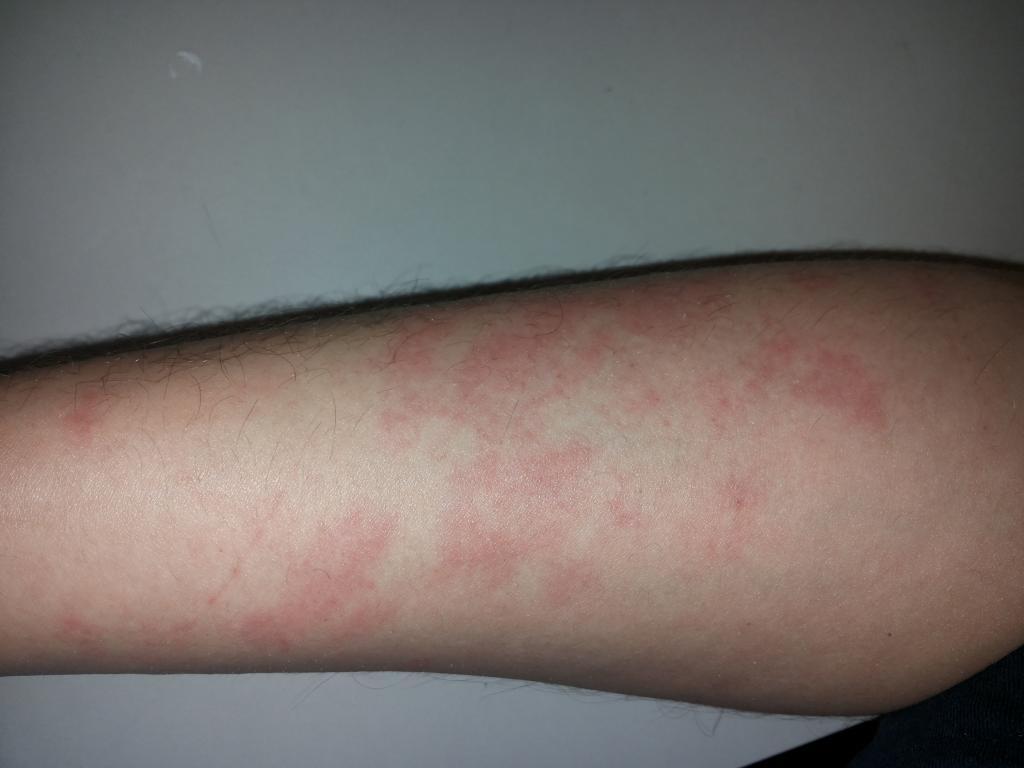
Каустическая сода – довольно опасное вещество. На коже и слизистых оболочках при контакте с ней образуются глубокие и очень болезненные раны. Очень опасен контакт каустической соды с глазами, так как вызывает атрофию зрительного нерва, что ведет к слепоте. Если случайно вдохнуть порошок едкого натра, начнется приступ сильного кашля, одышка, появится боль в горле и даже возможен отек дыхательных легких. И можно только представить себе, что это вещество способно делать с нашими внутренними органами. Если случайно проглотить каустическую соду, очень быстро в животе появится сильная боль и чувство жжения, возможен анафилактический шок. При малейшем подозрении на отравление гидроксидом натрия важно немедленно вызвать скорую помощь. Участки кожи, пораженные едким натром, следует промыть несильным раствором борной или уксусной кислоты, слизистые оболочки – чистой водой, глаза – сначала обработать очень слабым раствором борной кислоты, а затем водой.
Хоть в пищевой промышленности гидроксид натрия используют в микродозах, но при регулярном употреблении пищи, содержащей Е524, возможны побочные эффекты.
В чем может содержаться

Самая известная сдоба, приготовленная с использованием каустической соды – это немецкие рогалики. Черные консервированные оливки получают свой темный цвет и характерную консистенцию также благодаря добавке Е524. В изделиях из шоколада, какао, сливочного масла или других видов жиров гидроксид натрия ускоряет расщепление белков. Эта добавка приходит на помощь и тогда, когда необходимо быстро и без труда очистить плоды от кожицы. Для этого фрукты, ягоды или овощи просто обрабатывают каустической содой. Кроме того, регулятор кислотности Е524 используют в производстве кисломолочной продукции, маргаринов, мороженого, разных видов сладостей.
Гидроксид натрия – опасное химическое соединение. И хоть в пищевой промышленности Е524 используется в небольших дозах, которые обычно не представляют опасности для человека, излишняя осторожность не повредит. Если не желаете или не можете отказаться от Е-содержащей пищи сами, то постарайтесь хотя бы минимизировать количество «ешек» в рационе маленьких детей. А для этого не забывайте перед покупкой продукта проверять, из чего он состоит.