если не откачивать жидкость при асците что будет
Лапароцентез брюшной полости при асците
Асцитом называется избыточное скопление в брюшной полости жидкости. Обычно это является симптомом поражения печени (цирроза и др.) или развития злокачественных новообразований в органах брюшной полости, а также малого таза.
В большинстве случаев асцит сопровождается и другими клиническими проявлениями основного заболевания.
Существуют консервативные и хирургические методы лечения асцита. Лапароцентез относится к хирургическим методам.
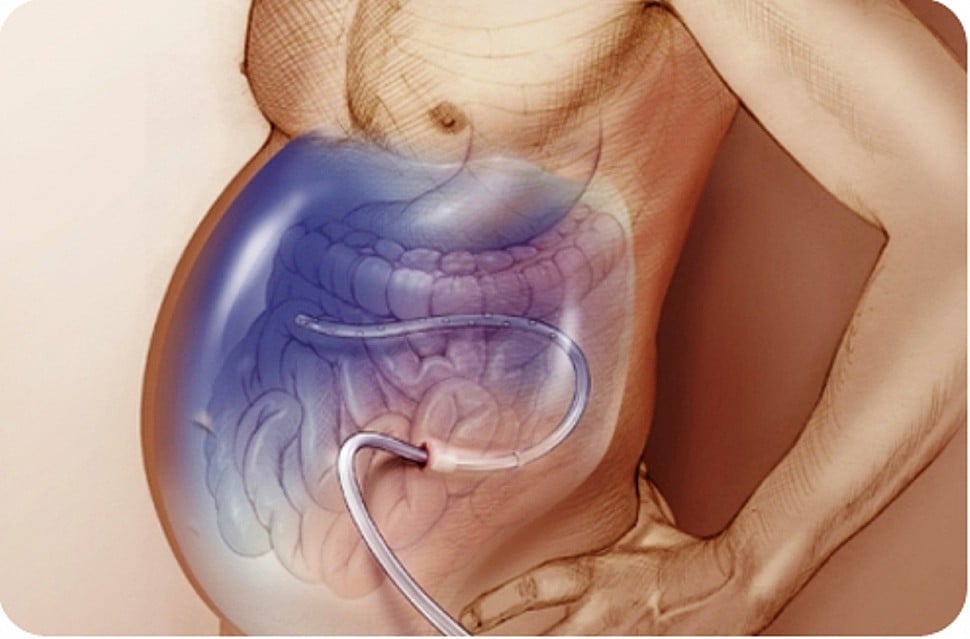
Лапароцентез (другое название – парацентез) – это процедура, при которой в брюшную полость через прокол в брюшной стенке вводится катетер.
Лапароцентез может быть лечебным и диагностическим. Лечебный лапароцентез предполагает эвакуацию значительного объема жидкости и применяется при выраженном асците, не поддающемся консервативному лечению. Диагностический лапароцентез производится для взятия образцов жидкости на анализ для выявления или причин асцита, часто используется при повторном его возникновении. Как правило, лечебный лапароцентез подразумевает и диагностическую составляющую.
Причины возникновения асцита
В норме жидкость в брюшной полости присутствует, но в небольших количествах. Накопление избыточной жидкости (асцит) может быть вызвано различными причинами, среди которых можно выделить три объемные группы.
Существуют и другие, реже встречающиеся, причины асцита:
В 65-75% всех случаев (по разным данным) причиной асцита является цирроз печени. В 15-20% он связан с сердечными болезнями и появлением злокачественных опухолей. На остальные причины приходится 5-10%.
Механизм развития асцита
При циррозе печени асцит возникает вследствие изменения структуры органа. Соединительная ткань заменяет нормальную, в рубцующихся участках происходит трансформация сосудистой сети. Из-за сдавления вен соединительнотканными узлами развивается ряд патологических процессов, приводящих, в частности, к повышению давления и сопротивления в воротной вене. При повышении давления в портальной системе начинает происходить усиленная фильтрация и пропотевание жидкой части крови в печеночную ткань. Это увеличивает объем лимфооттока из печени – лимфатическая система реагирует таким образом на увеличение объема тканевой жидкости. Однако, это не дает нужного эффекта при прогрессирующих цирротических процессах, и жидкость начинает пропотевать с поверхности органа в брюшную полость. Так появляется так называемая «плачущая печень». Листки брюшины могут всасывать лишь часть образовывающейся жидкости, и в итоге она накапливается в брюшной полости.
Кандидат медицинских наук
Опыт работы: Более 19 лет
Процесс формирования асцита при сердечных заболеваниях весьма сложен. Основную роль в этом случае играют застой в большом круге кровообращения и правожелудочковая недостаточность.
Асцит при онкологических заболеваниях
При раке желудка, толстой кишки, поджелудочной и молочной железы, матки, яичников, особенно на поздних стадиях, асцит является довольно распространенным осложнением.
Непосредственные причины развития могут быть разными:
Асцит, развившийся на фоне онкологии, не поддается консервативному лечению. В этих случаях могут помочь только хирургические методы – лапароцентез и перитонеальный дренаж. Иногда производятся дополнительные хирургические вмешательства, предотвращающие скопление жидкости в брюшной полости в дальнейшем.
Виды и клиническая картина
Выделяют минимальный, умеренный и выраженный асцит, или три его степени.
У асцита I степень отсутствуют клинические проявления. Он может быть диагностирован только с помощью УЗИ, КТ или лапароскопии. Количество жидкости в полости незначительно превышает норму.
Для II степени асцита характерно скопление большого количества жидкости и соответственно увеличение живота в размере, однако явного растяжения тканей не наблюдается.
При асците III степени живот становится огромным, а фигура – явно непропорциональной. Появляются затруднения в движениях и дыхании. Объем жидкости, скапливающейся в брюшной полости, может составлять 15-25 литров..
Способы лечения асцита
Как было упомянуто в начале статьи, существуют консервативные или хирургические методы лечения асцита.
При консервативном лечении назначается прием диуретиков, способствующих выведению из организма лишней жидкости. В обязательном порядке контролируется количество выпитой жидкости, суточного мочеиспускания и масса тела. Пациенту следует свести к минимуму потребление в пищу соли, так как она задерживает воду в организме.
Отправьте документы на почту cc@nacpp.ru. Возможность проведения лечения рассмотрит главный врач клиники.
Среди методов хирургического лечения наиболее распространен лапароцентез. Также применяются операции Кальба, Рюотта и др. Пути оттока жидкости в их случае формируются несколько иначе, но эти процедуры также подразумевают непосредственное удаление накопившейся жидкости.
Выбор метода лечения асцита зависит от его степени, причины возникновения, общего состояния пациента, дополнительных осложнений и т. д.
Как проводится лапароцентез?
Лапароцентез проводится под местной анестезией. Пациент находится в полусидячем или сидячем положении. С помощью специального инструмента (троакара), представляющего собой металлическую трубку и вставленную в нее трехгранную иглу, в брюшной стенке делается прокол. Затем иглу извлекают и по трубке эвакуируют скопившуюся жидкость. Количество жидкости, эвакуируемой за одну процедуру, определяет врач.
Чтобы избежать травмирования кишечник, лапароцентез проводится под контролем УЗИ. Либо используют особые приспособления, с помощью которых в брюшной полости создается пространство, свободное от петель кишечника.
Лапароцентез позволяет не только вывести жидкость из брюшной полости, но и, при необходимости, выяснить точную причину развития асцита через анализ состава жидкости.
Если необходимо длительное выведение жидкости, то для этой цели устанавливают дренажную трубку, соединенную со специальной емкостью, однако более современным решением являются перитониальные порт-системы. Это титановый резервуар, вшиваемый под кожу и соединенный с брюшной полостью катетером. Одна из стенок резервуара представляет собой мембрану из особого материала. Чтобы эвакуировать скопившуюся в резервуаре жидкость, достаточно проколоть иглой кожу и мембрану под ней. Таким образом, порт-система создает пациенту гораздо меньше неудобств, находясь полностью под кожей, и позволяет избежать регулярных процедур лапароцентеза.
Подготовка к лапароцентезу
Лапароцентезу предшествует стандартный набор исследований, включающий:
Может быть назначена компьютерная томография. Непосредственно перед процедурой ставится очистительная клизма, также необходимо опорожнить мочевой пузырь, чтобы избежать риска повредить его в процессе прокола брюшной стенки.
Если планируется выведение большого объема жидкости, делают инфузии физиологического раствора, чтобы наполнить жидкостью сосудистое русло.
Результаты диагностического лапароцентеза при асците
С помощью различных исследований образцов полученной при лапароцентезе жидкости из брюшной полости можно установить природу асцита. В частности, отличить воспалительную жидкость от отечной, обнаружить инфекцию, раковые клетки, предположить повреждение лимфатических сосудов или стенок кишечника и т. д.
Противопоказания
Почти все противопоказания для лапароцентеза являются относительными. При необходимой подготовке с коррекцией имеющихся у пациента осложнений или соблюдением условий с их учетом, процедура может быть проведена.
К таким противопоказаниям относятся:
Абсолютным противопоказанием для лапароцентеза является только острый живот, при котором необходимо проведение экстренной операции.
Возможные осложнения
После лапароцентеза могут оставаться гематомы на брюшной стенке и наблюдаться выделения из места прокола. В теории возможны
Однако, если процедура производится опытными специалистами при должной подготовке, осложнения при лапароцентезе возникают крайне редко.
Последние новости
Последние статьи
Рейтинг: 4.0/5 Голоса: 1
Асцит при онкологической патологии
Асцит (скопление жидкости в брюшной полости) определяют у 50% больных на ранних стадиях онкологических заболеваний и почти у всех пациентов, у которых раковый процесс находится на последней стадии.
Клиника онкологии Юсуповской больницы оснащена новейшей диагностической аппаратурой ведущих мировых производителей, с помощью которой онкологи выявляют ранние стадии онкологической патологии. Химиотерапевты, радиологи, онкологи проводят лечение пациентов с асцитом в соответствии с международными стандартами оказания медицинской помощи. В то же время врачи индивидуально подходят к выбору метода лечения каждого пациента.
Причины развития
Асцит является грозным осложнением рака желудка и толстой кишки, колоректального рака, злокачественных опухолей поджелудочной железы, онкологической патологии молочных желез, яичников и матки. При накоплении в брюшной полости большого объёма жидкости повышается внутрибрюшное давление, диафрагма смещается в грудную полость. Это приводит к нарушению работы сердца, лёгких. Происходит нарушение кровообращения по сосудам.
При наличии асцита организм пациента теряет большое количество белка. Нарушается обмен веществ, развивается сердечная недостаточность и другие расстройства равновесия внутренней среды организма, которые ухудшают течение основного заболевания.
В брюшной полости здорового человека всегда есть небольшое количество жидкости. Она предотвращает склеивание между собой листков брюшины. Выработанная внутрибрюшная жидкость обратно всасывается брюшиной.
При развитии онкологических заболеваний происходит нарушение нормального функционирования организма. Происходит сбой секреторной, резорбтивной и барьерной функции листков брюшины. При этом может наблюдаться либо избыточная продукция жидкости, либо нарушение процессов ее всасывания. В результате в брюшной полости накапливается большой объём экссудата. Он может достигать двадцати литров.
Основная причина поражения брюшины злокачественными клетками – её тесное соприкосновение с органами, которые поражены раковой опухолью. Асцит при наличии онкологической патологии развивается под воздействием следующих факторов:
Причиной асцита может быть химиотерапия. Скопление жидкости в брюшине происходит вследствие раковой интоксикации. Если печень поражается первичной раковой опухолью, метастазами злокачественных клеток из новообразований иной локализации, нарушается отток крови по её венозной системе, развивается портальная гипертензия – повышение давления внутри воротной вены. Просвет венозных сосудов увеличивается, из них пропотевает плазма и накапливается в брюшной полости.
Причиной асцита может быть канцероматоз брюшины. При наличии раковой опухоли органов брюшной полости на париетальном и висцеральном листах брюшины оседают атипичные клетки. Они блокируют резорбтивную функцию, в результате чего лимфатические сосуды плохо справляются с предназначенной нагрузкой, происходит нарушение оттока лимфы. Свободная жидкость постепенно накапливается в брюшной полости. Таков механизм развития канцероматозного асцита.
Стадии тяжести
Выделяют три стадии водянки брюшной полости в зависимости от количества скопившейся жидкости:
Симптомы
Основное проявление асцита – значительное увеличение размеров и патологическое вздутие живота. Признаки водянки брюшной полости могут нарастать стремительно или в течение нескольких месяцев. Асцит проявляется следующими клиническими симптомами:
Визуально у больного увеличивается живот, в горизонтальном положении он свисает и начинает «расплываться» по бокам. Пупок постепенно все более выпячивается, а на растянутых кожных покровах просматриваются кровеносные сосуды. По мере развития асцита пациенту становится тяжело наклоняться, появляется одышка.
Врачи клиники онкологии проводят оценку клинических проявлений заболевания и проводят дифференциальную диагностику рака с другими болезнями, проявлением которых является асцит.
Диагностика
Асцит врачи выявляют во время осмотра пациента. Онкологи Юсуповской больницы проводят комплексное обследование пациентов, которое позволяет выявить причину скопления жидкости в брюшной полости. Один из наиболее достоверных методов диагностики – ультразвуковое исследование. Во время процедуры врач не только чётко видит жидкость, но и высчитывает её объем.
При асците онкологи обязательно выполняют лапароцентез. После прокола передней брюшной стенки врач аспирирует жидкость из брюшной полости и отправляет в лабораторию для исследования. С помощью компьютерной томографии рентгенологии определяют наличие злокачественных новообразований в печени, которые вызывают портальную гипертензию.
Магнитно-резонансная томография дает возможность определить количество скопившейся жидкости и ее локализацию.
Лечение
Медикаментозная терапия асцита не проводится из-за низкой эффективности. Антагонисты альдостерона и диуретики нормализуют водно-солевой обмен и предотвращают избыточную секрецию перитонеальной жидкости. Онкологи Юсуповской больницы на поздних стадиях онкологического заболевания пациентам с асцитом предлагают выполнить паллиативную операцию:
Врачи клиники онкологии при асците проводят традиционную или внутриполостную химиотерапию – после удаления жидкости в брюшную полость вводят химиопрепарат. Для удаления жидкости выполняют лапароцентез. Процедуру не проводят при наличии следующих противопоказаний:
Лапароцентез назначают в случаях, когда прием диуретиков не приводит к положительному результату. Также процедура показана при резистентном асците.
Лапароцентез проводится в несколько этапов с применением местной анестезии:
Методом лапароцентеза можно вывести из организма больного до 10-ти литров жидкости. При этом может потребоваться введение альбуминов и других препаратов, чтобы предотвратить развитие почечной недостаточности.
При необходимости в брюшной полости могут быть установлены временные катетеры, по которым постепенно будет выводиться избыточная жидкость. Следует учесть, что применение катетеров может привести к снижению артериального давления и образованию спаек.
Выделяют также противопоказания к проведению лапароцентеза. Среди них:
Мочегонные средства назначают пациентам с развивающимся асцитом при раковых заболеваниях длительным курсом. Эффективность оказывают такие препараты, как «Фуросемид», «Диакарб» и «Верошпирон».
При приеме мочегонных средств в обязательном порядке назначают также препараты, содержащие калий. В противном случае высока вероятность развития нарушений водно-электролитного обмена.
Диетическое питание прежде всего подразумевает уменьшение количества потребляемой соли, задерживающей жидкость в организме. Также важно ограничить количество употребляемой жидкости. Рекомендуется включать в рацион больше продуктов, содержащих калий.
Пациентам после удаления жидкости из брюшной полости обеспечивают сбалансированное и калорийное питание. Это позволяет обеспечить потребность организма в белках, углеводах, витаминах и минералах. Потребление жиров сокращают.
Асцит неракового происхождения
Асцит – следствие различных нарушений, которые происходят в организме. Тактика лечения зависит от патологического процесса, который вызвал скопление жидкости в брюшной полости:
Для выведения жидкости из организма пациентам с асцитом назначают мочегонные препараты. Основной метод устранения асцита – удаление скопившейся жидкости посредством прокола брюшной стенки с последующей установкой дренажа. При устойчивом асците проводят реинфузию перитонеальной жидкости после её фильтрации. Перитонеовенозный шунт при асците брюшной полости обеспечивает поступление жидкости в общий кровоток. Для этого хирурги формируют конструкцию с клапаном, при помощи которой жидкость из брюшной полости во время вдоха поступает в систему верхней полой вены.
Оментогепатофренопексию при асците брюшной полости выполняют с целью снижения давления в венозной системе. Хирург подшивает сальник к диафрагме и печени. После чего во время дыхательных движений вены разгружаются от крови. В итоге уменьшается выход жидкости через стенку сосудов в брюшную полость. В результате деперитонизации (иссечения участков брюшины) создаются дополнительные пути оттока для перитонеальной жидкости.
Прогноз
Асцит при онкологическом заболевании в разы ухудшает общее самочувствие больного. Как правило, такое осложнение возникает на поздних стадиях онкологии, при которых прогноз выживаемости зависит от характера самой опухоли и ее распространенности по организму.
Продолжительность жизни при асците зависит от следующих факторов:
Развитие асцита может предотвратить опытный врач, наблюдающий пациента. Врачи Юсуповской больницы имеют огромный опыт борьбы с различного рода онкологическими заболеваниями. Квалификация медицинского персонала и новейшее оборудование позволяют провести точную диагностику и качественное, эффективное лечение согласно европейским стандартам.
Преимущества лечения асцита в Юсуповской больнице
Часто лечение асцита, вызванного раком, проводится в неспециализированных клиниках, где нет соответствующих условий и оборудования, не учитываются особенности онкологических больных.
Цель Юсуповской больницы — предоставить каждому пациенту максимально квалифицированную, эффективную помощь:
Наши усилия постоянно направлены на повышение эффективности лечения, улучшение качества жизни и прогнозов для каждого пациента.
Для того чтобы увеличить продолжительность и улучшить качество жизни пациента с асцитом, который развился вследствие онкологической патологии, обращайтесь к онкологам Юсуповской больницы. Врачи клиники онкологии проводят терапию, направленную на устранение причины накопления избыточного количества жидкости в брюшной полости, проводят симптоматическое лечение.
Патогенетические подходы к диуретической терапии асцита у больных циррозом печени
Асцит — одно из самых значимых осложнений цирроза печени, которое возникает примерно у 40–50% пациентов за 10-летний период от постановки диагноза. Развитие асцита считают важным неблагоприятным прогностическим признаком прогрессии заболевания
Асцит — одно из самых значимых осложнений цирроза печени, которое возникает примерно у 40–50% пациентов за 10-летний период от постановки диагноза. Развитие асцита считают важным неблагоприятным прогностическим признаком прогрессии заболевания, так как он связан с50% смертностью втечение двух ближайших лет [23, 26].
До настоящего времени механизмы формирования асцита при циррозе печени остаются недостаточно ясными. Каким образом накапливается жидкость в брюшной полости, в чем физиологическая сущность данного процесса, какова его связь с центральной гемодинамикой, состоянием почек и брюшины? Почему именно данный синдром является поворотным в жизни пациентов с циррозом и независимо от этиологии заболевания определяет дальнейшую выживаемость и качество жизни этих больных?
Кроме того, прогрессивный рост фармакологического рынка почти не заметен в гепатологии. Тогда как в других областях медицины, например в кардиологии, ежегодно принимаются согласительные документы по лечению пациентов с сердечной недостаточностью (СН), куда включаются новые мочегонные препараты, оптимизируются схемы и подходы к терапии. Лечение отечно-асцитического синдрома у кардиологического больного четко отработано, тогда как обсуждение принципов курации гепатологического пациента влечет за собой целый ряд споров и разногласий.
Эти и многие другие вопросы уже сегодня требуют своего разрешения, прежде всего для врачей-специалистов, ежедневно участвующих в лечении больных хроническими заболеваниями печени.
Механизмы возникновения асцита у больных циррозом печени
Развитие асцита обусловлено повышенной лимфопродукцией в печени в связи с блокадой оттока из нее венозной крови, однако его возникновение начинается с момента повреждения гепатоцитов, т. е. с этапа гепатита.
Основными механизмами развития отечно-асцитического синдрома являются (рис.):
Остановимся на более детальном рассмотрении данных положений.
Развитие синдрома печеночно-клеточной недостаточности (ПКН) у больных циррозом печени. Характеризуется:
Выброс вазодилятаторов и цитокинов поврежденными гепатоцитами. Нарушение детоксицирующей функции печени, развитие ПКН и порто-кавального шунтирования способствуют проникновению в кровь из поврежденных гепатоцитов вазодилятаторов, таких как глюкагон, оксид азота, простагландин E2α, предсердный натрий-уретический гормон, вазоинтестинальный пептид, простациклин, что приводит к генерализованной вазодилятации и снижению общего периферического сопротивления сосудов (ОПС). При этом в эндотелии сосудов печени, под влиянием эндотоксинов и цитокинов, синтезируются мощные вазоконстрикторы, в частности эндотелин-1, что вызывает спазм сосудов. То есть происходит разобщение местного и общего кровотока, связанное с дисбалансом вазодилятирующих и вазоконстриктивных веществ, что приводит:
Активация САС и РААС. Активированные САС и РААС воздействуют на основные мишени:
Основными факторами поражения ССС при циррозе печени являются шунтирование крови с прямым токсическим воздействием на миокард биологически активных веществ (адреналина, гистамина, серотонина), дисметаболические расстройства, связанные с нарушением печеночных функций, вегетативные нарушения, длительная гиперактивация САС и РААС [7, 35, 38]. Совокупность нарушений обмена биологически активных веществ приводит к развитию так называемой метаболической кардиомиопатии с дилятацией полостей сердца и СН. Данное состояние усугубляется хронической функциональной перегрузкой сердца на фоне гиперкинетического типа кровообращения [2, 4, 6]. То есть при развитии заболевания печени развивается системная реакция, которая реализуется через вовлечение в процесс ССС, формируя аналогичные СН способы компенсации и декомпенсации с возникновением отечно-асцитического синдрома [11, 12, 34].
Основными факторами поражения почек при циррозе печени являются:
Поражение почек развивается вследствие нарушения баланса между системной вазодилятацией и почечной вазоконстрикцией. Несмотря на характерную для цирроза печени системную вазодилятацию, в почках, как и в печени, происходит вазоконстрикция, что приводит к снижению скорости клубочковой фильтрации, уровень ренина в плазме при этом возрастает. Натрий компенсаторно усиленно реабсорбируется в почечных канальцах, что вызывает повышение осмолярности мочи. Происходит накопление жидкости в организме, несмотря на нормальный объем мочи, малосолевую диету и диуретическую терапию. Во внепочечных сосудах преобладает расширение артерий, и в результате снижается ОПС с развитием артериальной гипотензии. Сердечный выброс не изменяется или даже повышен, однако эффективный почечный кровоток уменьшается в результате перераспределения кровотока в селезенку, кожу и другие органы, таким образом происходит шунтирование коркового слоя почек. Наиболее ранним признаком включения почечного механизма при развитии асцита у больных циррозом печени является задержка натрия в организме, что проявляется снижением суточной экскреции натрия с мочой менее 78 ммоль/сут [8, 16].
Задержка натрия почками — это одна из вероятных причин асцита, предшествующая накоплению асцитической жидкости. На ранних этапах она является результатом блокады венозного оттока из печени и первичной вазодилятации.
Формирование ПГ. Развитие мощного дисбаланса вазоактивных веществ, вызывающего спазм синусоидов, а также способствующего активному фиброгенезу в печени, с формированием цирротических узлов, приводят к нарушению венозного русла печени и развитию ПГ.
Обратимость асцита определяется стадией ПГ. Асцит потенциально обратим, если имеется функциональная ПГ, и необратим, если произошли изменения сосудистого русла печени и сформировалась органическая ПГ [1, 11].
Функциональная (синусоидальная) ПГ определяется [19, 23, 38]:
Органическая ПГ формируется на фоне нарушения цитоархитектоники печени, она определяется [23]:
При этом важно отметить, что даже на этапе органической ПГ сохраняется ее функциональный компонент, который можно уменьшить, используя медикаментозную терапию, направленную на коррекцию состояния САС, РААС, реологию крови и другие патогенетические звенья.
Блокада венозного и лимфатического оттока от печени. Повышенное давление в портальной системе приводит к нарушению венозного оттока из печени и непарных органов брюшной полости, что сопровождается переполнением синусоидов, усилением продукции лимфы в печени.
У больных циррозом печени объем суточного лимфооттока через грудной лимфатический проток может увеличиваться до 20 литров. Лимфа из сосудов печени и непарных органов пропотевает в брюшную полость, формирует асцит, устанавливая динамическое равновесие с процессом всасывания ее в кишечные капилляры.
Таким образом, условно можно выделить несколько уровней формирования асцита, тесно взаимосвязанных между собой:
При этом обратимость указанных изменений зависит от стадии ПГ (функциональной или органической).
Классификация асцита
В зависимости от количества асцитической жидкости и эффективности терапии выделяют:
Критериями резистентного (рефрактерного) асцита являются отсутствие снижения или снижение массы тела менее 200 г/сут у больного в течение 7 дней на фоне низкосолевой диеты (5,2 г поваренной соли в сутки) и интенсивной диуретической терапии (спиронолактон по 400 мг/сут и фуросемид по 160 мг/сут), а также уменьшение экскреции натрия с мочой менее 78 ммоль в сутки [16, 25]. О резистентном асците говорят также в тех случаях, когда он не уменьшается или быстро рецидивирует после парацентеза или осложнения диуретической терапии не позволяют назначать диуретики в эффективных дозах. В практике критерии резистентного асцита выявляются менее чем у 10% пациентов с циррозом печени.
Причинами резистентного асцита, как правило, являются:
Многие причины рефрактерности асцита являются потенциально обратимыми, поэтому своевременное их устранение может значительно повысить эффективность проводимой терапии.
Лечение асцита у больных циррозом печени
Следует отметить, что сама по себе задача терапии асцита у больных циррозом печени труднее, чем лечение других форм накопления жидкости в организме, потому что формирование отечно-асцитического синдрома является проявлением значительной декомпенсации заболевания. По результатам контролируемых исследований появление асцита значительно ухудшает качество жизни и увеличивает риск развития фатальных осложнений цирроза печени [27, 39], поэтому его терапия представляет собой одну из важнейших составляющих успешного лечения этих больных. Однако, с учетом того, что в развитии асцита задействованы сложные нейрогормональные механизмы, бездумная дегидратация может вызвать лишь побочные эффекты и «рикошетную» задержку жидкости.
Режим, диета и потребление жидкости больными циррозом печени и асцитом. У пациентов с асцитом, не ограничивающих потребление соли с пищей, суточная экскреция натрия с мочой снижена до 78 ммоль и менее, при этом внепочечные потери натрия могут достигать 10 ммоль/сут.
Употребление больными циррозом печени натрия более 90 ммоль/сут ведет к развитию асцита, так как каждый грамм натрия задерживает до 200 мл жидкости. Поэтому с пищей в течение суток рекомендуется употреблять не более 90 ммоль натрия (5,2 г поваренной соли), в сочетании с ограничением до 1 литра в сутки количества жидкости. При этом важно учитывать, что ограничение жидкости не показано больным с низким содержанием Nа в сыворотке крови (менее 120 ммоль/л) [16].
На сегодняшний день не опубликовано исследований, которые демонстрировали бы положительное или отрицательное влияние ограничения воды на разрешение асцита. Большинство экспертов считают, что у больных с неосложненным асцитом роль ограничения воды отсутствует. Несмотря на это во многих центрах диета с ограничением воды у пациентов с асцитом и гипонатриемией стала стандартом клинической практики. В этом вопросе существует много противоречий, и лучший подход пока не найден. Как правило, гепатологи лечат таких больных со строгим ограничением воды. С точки зрения патогенеза гипонатриемии, такое лечение является алогичным и может ухудшить тяжесть центральной гиповолемии, которая запускает неосмотическую секрецию АДГ. Еще большее повышение концентрации циркулирующего АДГ ведет к дальнейшему снижению почечной функции. Нарушенный клиренс свободной воды имеют 25–60% пациентов с цирротическим асцитом, при этом у них часто развивается спонтанная гипонатриемия.
Погрешности в диете часто служат причиной плохо поддающегося лечению (резистентного, рефрактерного) асцита. При употреблении большого количества соли применение современных мочегонных препаратов даже в высоких дозах окажется неэффективным.
Диета должна быть по существу вегетарианской, так как большинство продуктов с высоким содержанием белка (мясо, яйца и молочные продукты) содержат много натрия, поэтому в связи с этим рацион нужно дополнять белковой пищей с низким содержанием натрия. Рекомендуется употреблять бессолевой хлеб, масло и все блюда готовить без добавления соли. Показаны также продукты, богатые калием и микроэлементами. Энергетическая ценность диеты должна составлять
1500–2000 ккал с содержанием 70 г белка и 90 ммоль натрия в сутки.
Пациенту с асцитом рекомендуется ограничение физической активности, что способствует уменьшению количества метаболитов, образующихся в печени. Также в положении лежа несколько усиливается портальный венозный и почечный кровоток.
Общие подходы к терапии асцита у больных циррозом печени. Стратегические направления терапии асцита включают ограничение соли в пище и медикаментозное выведение избыточной жидкости из организма. Кроме этого, исходя из рассмотренных позиций патогенеза асцита у больных циррозом печени, важно решить терапевтические задачи по коррекции ПГ, ПКН, блокированию периферических вазодилятаторов, подавлению активности САС и РААС, нормализации функции ССС, почек и т. д.
Для безопасного медикаментозного выведения жидкости из организма необходимо соблюдение трех этапов:
Для перевода избыточной жидкости из внеклеточного пространства в сосудистое русло используются:
Наиболее оптимальными бета-блокаторами у пациентов с заболеваниями печени, эффективность которых подтверждена результатами метаанализа, являются неселективные производные группы пропранолола — Анаприлин в индивидуально подобранной дозе — 40–80 мг/сут или карведилол в индивидуальной дозе — 25–50 мг/сут [3, 14, 28, 31].
Среди ИАПФ у больных циррозом печени препаратами выбора является группа лизиноприла в индивидуально подобранной (2,5–20 мг/сут) дозе или препарат с двойным путем выведения спираприл по 6 мг/сут.
В отличие от других представителей этого класса они являются готовой лекарственной формой, а их эффективность подтверждена результатами сравнительных исследований [11, 17].
Из АРА у данной категории пациентов может использоваться эпросартан в индивидуально подобранной дозе — 300–600 мг/сут. В открытых исследованиях продемонстрирована эффективность препаратов данной группы у больных циррозом печени [32, 40].
Для доставки избыточной жидкости к почкам применяют положительные инотропные средства:
Для улучшения почечной фильтрации рекомендованы:
Для блокады реабсорбции первичной мочи в почечных канальцах применяются собственно диуретики (преимущественно петлевые диуретики и антагонисты альдостерона).
Диуретическая терапия больных циррозом печени с асцитом. Принимая во внимание сложный патогенез развития отечно-асцитического синдрома, при его терапии используют диуретики различных фармакологических групп: антагонисты рецепторов альдостерона, калийсберегающие, петлевые, тиазидные диуретики и ингибиторы карбоангидразы. Алгоритм назначения диуретиков больным циррозом печени представлен на схеме 1.
Действие диуретиков при циррозе печени и асците носит многогранный характер и состоит в их влиянии на почечные структуры и внепочечные механизмы регуляции водно-электролитного баланса [9, 10], включая воздействие на уровне:
Основным принципом разгрузочной терапии отечно-асцитического синдрома у больных циррозом печени является получение постепенно развивающегося и стабильного диуретического эффекта, при этом препаратом выбора является спиронолактон [15, 23].
В случаях рефрактерности к терапии антагонистами альдостерона перед назначением других диуретиков, действующих на иных участках нефрона, целесообразно оценить показания для использования дополнительных терапевтических мероприятий, в частности для введения альбумина и кровезамещающих коллоидных растворов.
При выраженном отечно-асцитическом синдроме объем диуретической терапии может быть расширен за счет петлевых или тиазидных диретиков, подавляющих реабсорбцию натрия и воды.
Рекомендуется комбинированное назначение калийвыводящих и калийсберегающих диуретиков, что способствует снижению риска возникновения электролитных нарушений [18, 21, 29].
Дозировку и частоту приема препарата подбирают индивидуально каждому больному. При поступлении пациента в стационар рекомендуется определить суточную экскрецию натрия, что облегчает подбор диуретика и контроль за эффектом лечения [16].
При начальных признаках асцита терапия начинается одним из препаратов группы калийсберегающих диуретиков, обычно спиронолактоном. В случае неэффективности добавляют петлевой диуретик.
Наличие признаков выраженного асцита требует изначального применения комбинированной терапии, при этом спиронолактон назначается в качестве надежного партнера петлевых диуретиков.
У больных циррозом печени с умеренной и выраженной ПГ возможно начало лечения курсами антагонистов альдостерона еще до формирования асцита в минимальных (25–50 мг/сут), не изменяющих диурез, дозировках в качестве нейрогуморального модулятора, однако данная точка зрения является авторской и не подтверждена широкими клиническими испытаниями.
При декомпенсации цирроза печени (в виде развития асцита) применение спиронолактона абсолютно необходимо и можно не бояться его сочетания с ИАПФ или АРА, если параллельно правильно использовать активные диуретики в достижении положительного диуреза. Препарат принимают в высоких дозах (100–300 мг, назначаемых однократно утром или в два приема утром и в обед) на период 1–3 недели до достижения компенсации. После этого доза спиронолактона должна быть уменьшена.
Нужно помнить, что концентрация спиронолактона в плазме крови выходит на плато к третьему дню лечения и после отмены (или уменьшения дозы препарата) его концентрация и действие пропадает (снижается) через трое суток. После достижения компенсации применение высоких доз спироналактона прекращается и рассматривается вопрос о назначении малых доз препарата в качестве дополнительного нейрогормонального модулятора.
Для длительной поддерживающей терапии больных циррозом печени рекомендуется использование малых (25–50 мг) доз спиронолактона дополнительно к ИАПФ и бета-адрено-блокаторам (БАБ), позволяющее более полно блокировать РААС и САС.
В случаях, когда необходима замена спиронолактона, препаратом выбора является амилорид по 10–15 мг/сут.
Оптимальное соотношение спиронолактона и фуросемида 5:2, например 100 мг спиронолактона и 40 мг фуросемида и т. д. Максимальные суточные дозы этих препаратов составляют 400 и 160 мг соответственно.
Фуросемид, в свою очередь, может быть неэффективен при выраженном гиперальдостеронизме, когда натрий, не реабсорбированный в петле Генле, всасывается в дистальном отделе нефрона. Вторая причина — гипокалиемия и алкалоз.
Альтернативными, в случаях неэффективности, фуросемиду петлевыми диуретиками для лечения асцита у больных циррозом печени могут рассматриваться: Урегит (этакриновая кислота) 25–50 мг/сут и буметанид, который не слабее фуросемида и применяется в дозах от 0,5 до 10 мг, что позволяет достичь оптимального диуреза.
Этакриновая кислота и тиазиды, как диуретики длительного действия, менее показаны больным циррозом печени, поскольку они способны усугублять развившиеся электролитные нарушения, и даже после их отмены могут продолжаться потеря калия с мочой и нарастание алкалоза.
Поэтому, в частности, тиазиды применяются преимущественно на этапе поддерживающей терапии и/или невозможности использовать спиронолактон. Принимая во внимания возможные побочные эффекты, тиазидные диуретики у больных циррозом печени назначают курсом не более 7–14 дней с перерывом на 3–4 дня.
Кроме вышеперечисленных, в 2006 году в России был зарегистрирован один из самых эффективных и безопасных петлевых диуретиков — торасемид (Диувер). Его стартовая доза составляет 5–10 мг, а при необходимости она может быть увеличена до 20 мг в сутки. Торасемид обладает не только более выраженным, чем фуросемид, мочегонным эффектом, но и имеет собственную активность в отношении рецепторов к альдостерону, что обеспечивает ему калийсберегающий эффект. Преимуществом является отсутствие нежелательных эффектов антагонистов альдостерона (гиперкалиемия, гирсутизм и другие), препарат обладает высокой биодоступностью (80% против 50% у фуросемида), пролонгированным эффектом (период полувыведения 3–5 часов против 1 часа у фуросемида) и мягким гипотензивным действием. Фармакокинетика торасемида мало зависит от функции почек и состояния кишечника, что обеспечивает низкий риск кумуляции препарата и меньшую, по сравнению с фуросемидом, экскрецию калия, кальция, неорганических фосфатов и магния.
При лечении отечно-асцитического синдрома у больных циррозом печени возможно использовать торасемид как в качестве монотерапии, так и в сочетании с Верошпироном. Терапия торасемидом показана при декомпенсации асцита, а также в целях профилактики его возникновения в дозировках 5–20 мг, не вызывающих гипокалиемии даже при длительном приеме. Рекомендуется использовать ступенчатый подход, начиная с 5 мг/сут, увеличивать дозу на 5 мг каждые 2–3 дня до достижения эффекта. На амбулаторном этапе не рекомендуется превышать суточную дозу 20 мг, так как большее количество препарата требует частого контроля уровня калия.
Для оценки эффективности мочегонной терапии у пациентов с циррозом печени и асцитом был проведен ряд сравнительных исследований торасемида и фуросемида. Так, в двойном слепом перекрестном исследовании были сопоставлены результаты однократного приема фуросемида (80 мг) и торасемида (20 мг) внутрь у 14 больных. Торасемид превосходил фуросемид по диуретической и натрийуретической активности. У 5 пациентов наблюдался слабый ответ на прием фуросемида, при этом торасемид вызвал значительное увеличение натрийуреза и диуреза [30, 33, 36].
Аналогично в двойном слепом рандомизированном исследовании у 28 пациентов с асцитом, получавших спиронолактон (200 мг/сут), были сопоставлены результаты 6-недельной терапии торасемидом (20 мг/сут) и фуросемидом (50 мг/сут). Оба препарата оказывали сопоставимое влияние на массу тела, диурез и экскрецию мочевой кислоты, натрия и хлоридов, однако в группе торасемида экскреция калия, кальция, неорганических фосфатов и магния была ниже [30, 33, 36].
В группе из 46 больных циррозом печени, осложнившимся асцитом (рандомизированное исследование), проводили лечение торасемидом 20 мг/сут или фуросемидом 40 мг/сут в сочетании со спиронолактоном 200 мг/сут. Если не удавалось добиться снижения массы тела на 300 г/сут, дозы диуретиков каждые 3 дня увеличивали до 40, 120 и 400 мг/сут соответственно. Торасемид вызывал более выраженное увеличение диуреза, чем фуросемид, хотя в целом результаты лечения в 2 группах оказались сопоставимыми. Увеличение доз диуретиков потребовалось у 2 больных группы торасемида и у 9 пациентов группы фуросемида [33, 36].
То есть по результатам исследований торасемид может рассматриваться как альтернатива комбинированной терапии Фуросемид + Верошпирон у больных циррозом печени и асцитом.
Ингибиторы карбоангидразы не нашли широкого применения у пациентов с асцитом, так как подавление ими реабсорбции натрия и воды в проксимальном канальце компенсируется усилением ее в дистально расположенных сегментах канальцев.
Препараты этой группы могут использоваться в качестве вспомогательного средства на фоне приема активных мочегонных (петлевых и/или тиазидных). Ингибиторы карбоангидразы блокируют фермент в области проксимальных почечных канальцев, что сопровождается незначительным диурезом (прирост до 10–15%), однако при этом усиливается «загрузка» натрием нижележащих отделов канальцев, что повышает эффективность более сильных диуретиков. При истощении фермента карбоангидразы через 3–4 дня непрерывного применения активность ацетазоламида падает, что требует перерыва в лечении.
Поэтому ацетазоламид (Диакарб) рекомендуется в дозе по 0,25 г трижды в день в течение 3–4 дней с двухнедельным перерывом. Данная терапевтическая тактика способствует подкислению среды, восстанавливает диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых развивается алкалоз. При сочетании с Эуфиллином мочегонный эффект Диакарба увеличивается.
Для избежания развития рефрактерности и побочного действия диуретиков на пациентов с асцитом важно оценивать эффективность лечения и проводить клинико-лабораторный скрининг с определением показаний для последующей коррекции режима дозирования или отмены препаратов.
Продолжение статьи читайте в следующем номере.
С. Н. Мехтиев, доктор медицинских наук, профессор
Ю. А. Кравчук, кандидат медицинских наук
И. В. Субботина
О. А. Мехтиева *
М. В. Шаповалов
ВМА им. С. М. Кирова, *СПб ГМА им. И. И. Мечникова, Санкт-Петербург