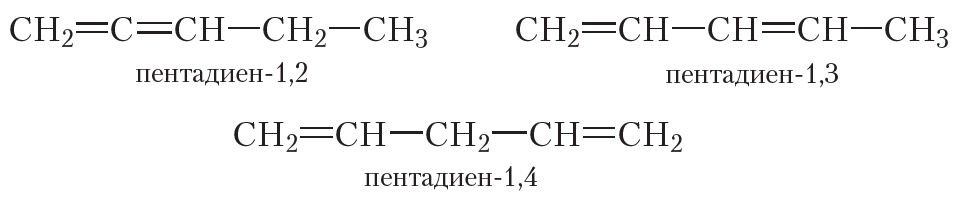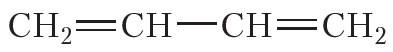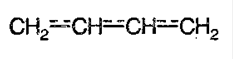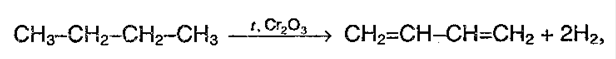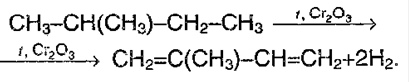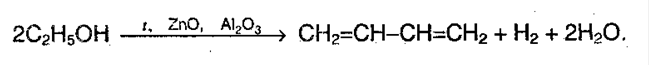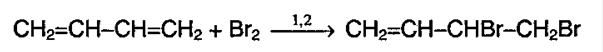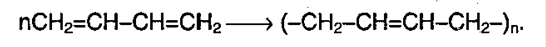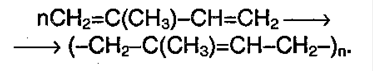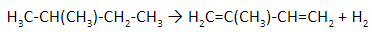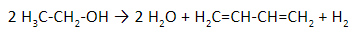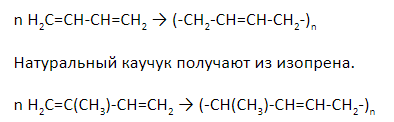если в молекуле алкадиена сопряженные связи то это означает что
Химия. 10 класс
§ 17. Алкадиены
Алкадиены
Известны углеводороды с двумя двойными связями в молекуле. Напомним, что наличие двойной связи углерод-углерод обозначается суффиксом -ен, а соответствующий класс соединений называется алкены. Наличие в молекуле двух двойных связей обозначается -диен, а соответствующий класс соединений называется алкадиены.
Выведем общую молекулярную формулу класса. Напомним, что общая формула класса алканов СnH2n+2. Из предыдущего параграфа вы узнали, что молекула алкена образуется в результате отщепления от молекулы алкана двух атомов водорода. Таким образом, образование одной двойной связи приводит к уменьшению содержания водорода в молекуле на два атома, поэтому общая формула алкенов СnH2n. Образование ещё одной двойной связи уменьшит содержание атомов водорода в молекуле ещё на два, следовательно, общая формула алкадиенов СnH2n–2.
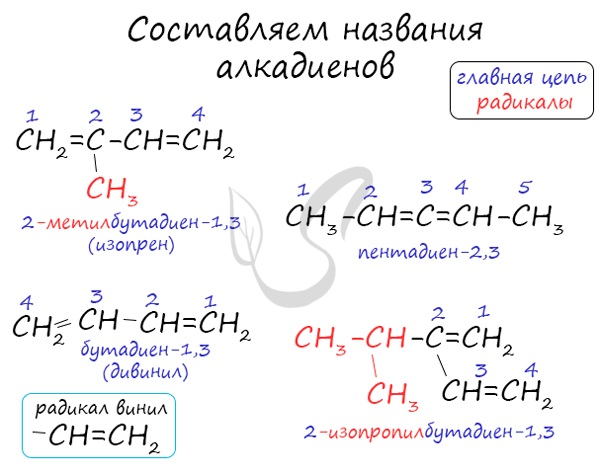
Названия алкадиенов составляются по тем же правилам, как и алкенов, только суффикс -ен заменяется на -диен.
Приведём несколько примеров формул и названий алкадиенов:
Как видно, взаимное расположение двойных связей в молекулах алкадиенов может быть различным.
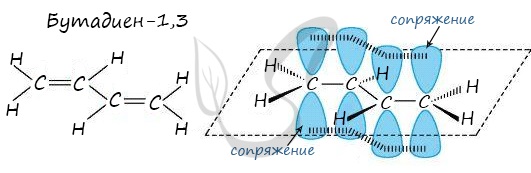
Наибольший практический интерес представляют алкадиены, в молекулах которых двойные связи разделены одной одинарной связью. Такие алкадиены называются сопряжёнными алкадиенами. Простейшим представителем сопряжённых диенов является бутадиен-1,3:
Это бесцветное газообразное вещество с резким запахом (tкип = –4 °С).
Алкадиены. Свойства алкадиенов.
Алкадиены – непредельные углеводороды, в состав которых входят две двойные связи. Общая формула алкадиенов – CnH2n-2.
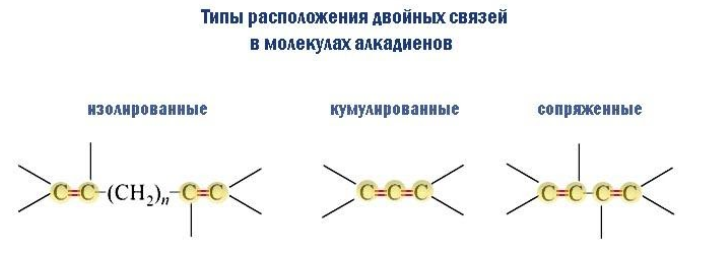
Если двойные связи находятся в углеродной цепи между двумя или боле атомов углерода, то такие связи называются изолированными. Химические свойства таких диенов не отличаются от алкенов, только в реакцию вступают 2 связи, а не одна.
Если же диен выглядит так: С=С=С, то такая связь является кумулированной, а диен называется – алленом.
Строение алкадиенов.
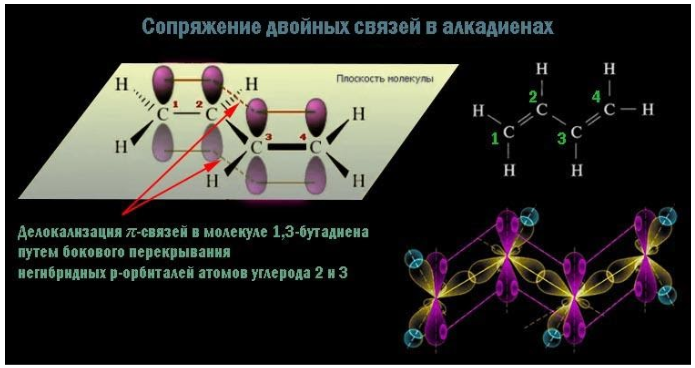
π-электронные облака двойных связей перекрываются между собой, образуя единое π-облако. В сопряженной системе электроны делокализованы по всем атомам углерода:
Чем длиннее молекула, тем она более устойчива.
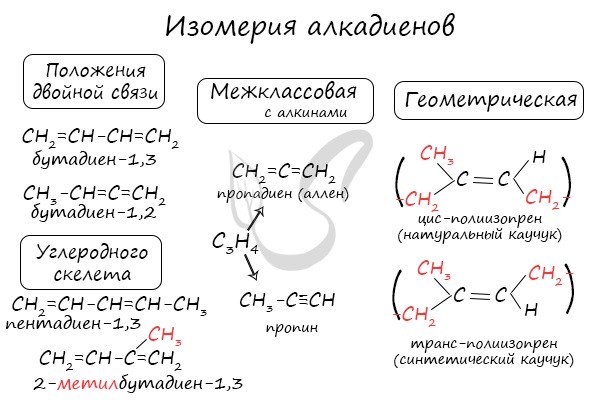
Изомерия алкадиенов.
Для диенов характерна изомерия углеродного скелета, изомерия положения двойных связей и пространственная изомерия.
Физические свойства алкадиенов.
Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. А изопрен – жидкость.
Получение диенов.
1. Дегидрирование алканов:
2. Реакция Лебедева (одновременное дегидрирование и дегидратация):
Химические свойства алкадиенов.
Химические свойства алкадиенов обусловлены наличием двойных связей. Реакция присоединения может протекать в 2х направлениях: 1,4 и 1,2 – присоединение. Например,
Способность алкадиенов к полимеризации:
Для получения изопренового каучука используют реакцию при воздействии металлоорганических катализаторов:
Применение алкадиенов.
Основная сфера использования диенов и их производных – это производство каучука.
Алкадиены
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
В случае, если две двойные связи разделены двумя и более одинарными связями.
Получение алкадиенов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
Химические свойства алкадиенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Гомологический ряд алкадиенов
Углеводороды гомологического ряда диенов, или алкадиенов, отличаются высокой химической активностью, обусловленной особенностями строения молекул. Алкадиенам присуще разнообразие строения, поэтому в гомологическом ряду существует внутренняя классификация. Свойства алкадиенов, принадлежащих к разным типам, заметно отличаются.
Строение молекул и классификация диенов
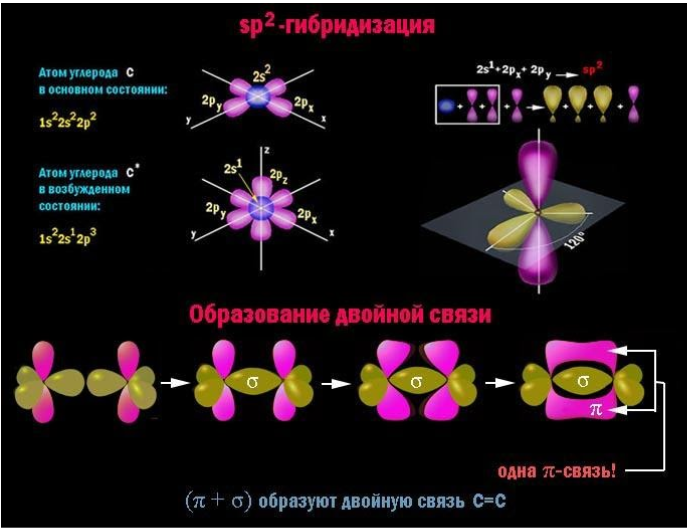
Главный признак алкадиенов – две двойные связи в углеродном скелете. Молекула содержит две пары атомов углерода с sp2-гибридизованными внешними электронными облаками. Для данного состояния атома характерно наличие одной негибридной p-орбитали, располагающейся перпендикулярно плоскости, проходящей через центры взаимодействующих атомов.
В каждой паре таких атомов помимо прочно соединяющей их по кратчайшему расстоянию σ-связи, за счет перекрывающихся p-облаков возникает менее устойчивая π-связь. Сочетание (σ+π) и есть двойная связь C=C. При внешнем воздействии ее π-компонент легче поддается разрыву и освобождает у пары углеродных атомов по одной валентности для химического взаимодействия.
Поскольку у диеновых углеводородов на формирование двойных связей затрачивается по две валентности для каждой углеродной пары, до полного насыщения молекуле не хватает четырех водородных атомов. Химическая формула алкадиенов имеет вид 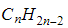
Типология диенов по взаимному положению двойных связей
Различают три типа расположения, при которых различаются степень и характер влияния связей C=C друг на друга:
Соединения этого типа представляют наибольший интерес в плане практического использования.
Изомерия алкадиенов с сопряженной связью
Диены образуют как структурные, так и пространственные изомеры.
Структурная изомерия
Диеновые молекулы могут различаться по следующим признакам:
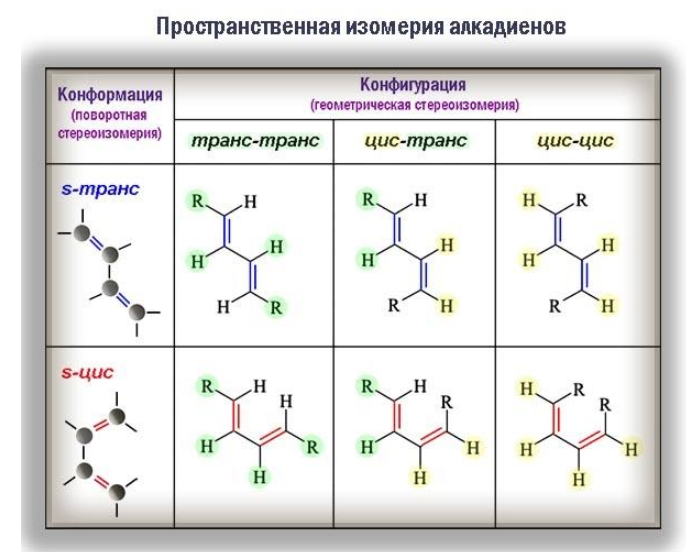
Пространственная изомерия
Стереоизомерия (геометрические различия) возникает вследствие того, что фрагменты молекулы не могут вращаться вокруг кратной связи. Одинаковые заместители при этом оказываются либо по одну сторону от плоскости π-связи (цис-изомеры), либо по разные (транс-изомеры) и оказать влияние на реакционную способность.
В то время как геометрическая изомерия связана с неизменной конфигурацией углеводородной молекулы, поворотные изомеры способны переходить из одного состояния в другое.
В трансоидной конформации молекула диена обладает минимальной энергией и вследствие этого менее реакционноспособна. Определенные химические превращения, например реакции диенового синтеза, протекают избирательно только с участием s-цис-конформера.
Гомологи диенов и их номенклатура
Поскольку в формуле алкадиенов две кратные связи, гомологический ряд должен начинаться с соединения, в котором три углеродных атома. Название соединения образуется из корня, суффикса –диен– и номеров атомов с кратными связями. Например, H2C=CH-CH2-CH=CH-CH2-CH2-CH3 – октадиен-1,4.
Гомологи алкадиенов приведены в таблице ниже:
| Формула | Наименование |
| C3H4 | пропадиен |
| C4H6 | бутадиен |
| C5H8 | пентадиен |
| C6H10 | гексадиен |
| C7H12 | гептадиен |
| C8H14 | октадиен |
| C9H16 | нонадиен |
Классификация диенов
Кратные связи в диенах могут стоять в разных местах. Алкадиены бывают:
Особенности сопряженных диенов
Сопряженные диены имеют атомы углерода в sp2-гибридизации. π – электроны создают единую систему и располагаются равномерно по всей молекуле. Все атомы образуют p-облако. Такой тип называется π,π-сопряжение.
Настоящее строение таких алкадиенов отражает наличие делокализованных «полуторных» связей.
Физические свойства алкадиенов
В нормальных условиях алкадиены схожи с алкенами. Первые два представителя гомологического ряда диеновых углеводородов – газы, не имеющие цвет, но со специфическим запахом. Алкадиены, имеющие до семнадцати углеродных атомов в цепи, — жидкости. Диены, находящиеся ниже по гомологическому ряду, – твердые вещества. Температуры плавления и кипения поднимаются по мере роста молекулярной массы.
Получение алкадиенов
Существует несколько способов получения диенов.
Дегидрирование алканов
В промышленных условиях бутадиен-1,3 получают из 2-метилбутана под действием катализатора Al2O3 и повышенных температур.
Синтез Лебедева
Бутадиен-1,3 также получают из этанола под действием катализаторов Al2O3, ZnO и повышенных температур.
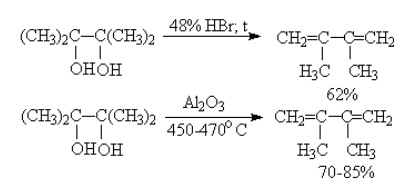
Дегидратация двухатомных спиртов
Реакция проходит под действием бромоводорода HBr (выход диенов – 62%) или оксида алюминия Al2O3 (выход диенов – 70-85 %).
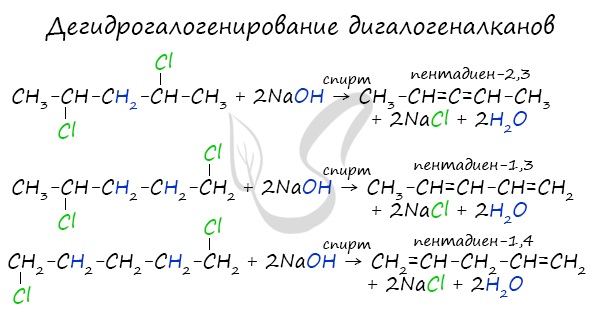
Дегидрогалогенирование дигалогеналканов
Отщепление подчиняется правилу Зайцева и идет под действием спирта.
Химические свойства алкадиенов
Свойства алкадиенов обуславливают возможность вступления в реакции присоединения. Кратная связь увеличивает реакционную способность и обуславливает необычные механизмы некоторых реакций.
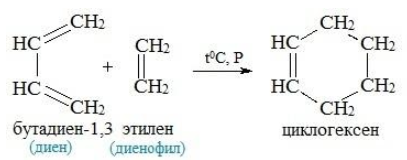
Реакция Дильса-Альдера
Эта реакция заключается во взаимодействии диенов и диенофилов с образованием шестичленных гидроароматических колец. Реакция обратима и проходит при нормальных условиях или слабом нагревании.
Полимеризация диенов
Полимеризация – это реакция последовательного соединения мономеров с целью получения полимера. У алкадиенов полимеризация протекает по 1,4-механизму.
Синтетический каучук получают из дивинила.
Применение алкадиенов
Диены – это ненасыщенные алифатические соединения с двумя двойными связями. Особенности строения алкадиенов указывают на то, что им доступны лишь реакции присоединения. У сопряженных диенов есть единое π – облако, которое позволяет вступать в различные реакции. Алкадиены имеют большое промышленное значение.
Диенами часто используются в промышленности при получении каучуков. Их них изготавливают автомобильные и велосипедные шины.
Органические соединения, имеющие две и более двойные связи, — терпены. Они есть в составе организма, а также их синтезируют и применяют в производстве парфюма.
Алкадиены
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода.
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С.
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp 2 —гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
| Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей. |
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
| Например. Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
| Например. Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен |
| Бутадиен-1,3 | Бутин-1 | Циклобутен |
 |  |  |
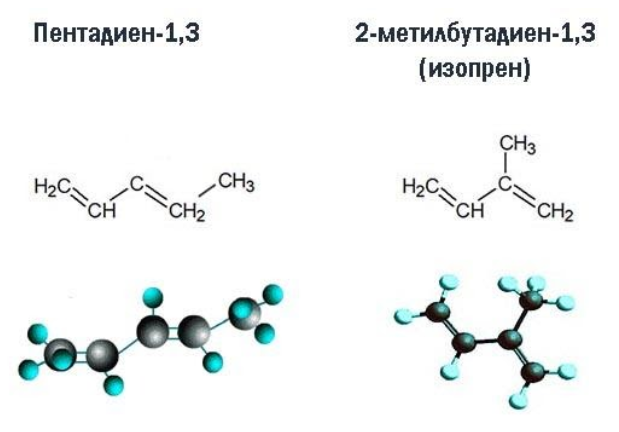
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен) |
| Пентадиен-1,3 | 2-Метилбутадиен-1,3 |
 |  |
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
| Например. Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода) |
CH2=CH–CH=CH2
Номенклатура алкадиенов
| Например, алкадиен имеет название бутадиен-1,3. |
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкадиена |
| Дивинил |  |
| Изопрен |  |
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
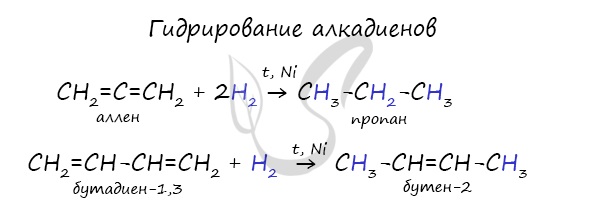
1.1. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
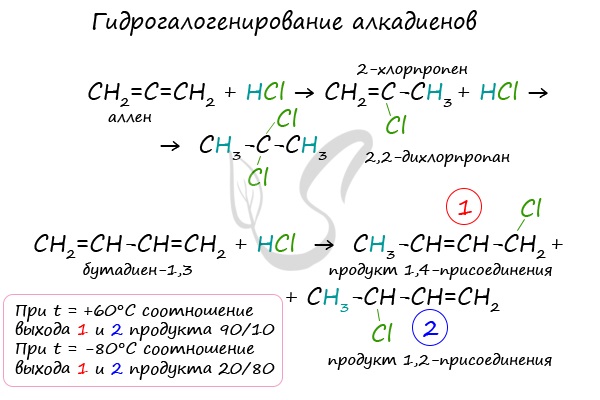
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
| Например, уравнение сгорания бутадиена: |
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):
Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3: