евстахиев клапан в правом предсердии что это
Тромбоэмболия сети Хиари и легочной артерии
ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента РФ, 121356 Москва, ул. Маршала Тимошенко, 15
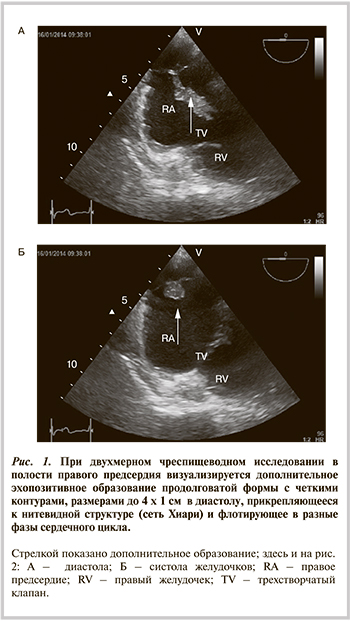
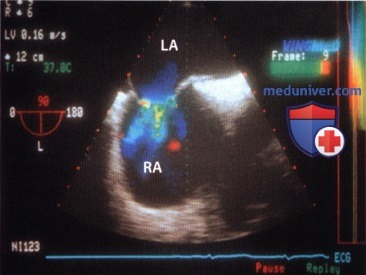
В статье представлено клиническое наблюдение пациента c тромбоэмболией сети Хиари и легочной артерии вследствие тромбоза вен нижних конечностей. Сеть Хиари встречается в небольшом проценте случаев в правом предсердии и обычно не имеет существенного клинического значения. Однако иногда она может быть ассоциирована с такими патологическими изменениями, как открытое овальное окно, внутрипредсердный тромбоз или предсердные аритмии. В данном случае сеть Хиари выступила в качестве преграды, задержавшей продвижение тромба.
Сеть Хиари выявляется в популяции в 2% случаев и представляет собой фиброзно-нитевидную структуру в виде сетки, которая прикрепляется к клапану нижней полой вены (евстахиев клапан) с одной стороны и к различным частям правого предсердия (ПП) — с другой [1]. Наряду с евстахиевым клапаном сеть Хиари может прикрепляться к клапану основного венозного коллектора, впадающего в ПП коронарного синуса (тебезиев клапан), к терминальному гребню, расположенному в зоне устья верхней полой вены, межпредсердной перегородке и стенке предсердия [1].
Обычно сеть Хиари не имеет существенного клинического значения. Однако в литературе периодически появляются описания случаев, в которых сеть Хиари играет определенную функциональную роль. С подобным случаем довелось столкнуться и нам.
Описание клинического наблюдения
Больной М., 68 лет, поступил в отделение нарушений ритма сердца ФГБУ «ЦКБ с поликлиникой» УДП РФ в январе 2014 г. с жалобами на сердцебиение и перебои в работе сердца, общую слабость, головокружение.
Из анамнеза известно, что больной страдает рядом сопутствующих заболеваний, таких как хронический бронхит, эмфизема легких, диффузный пневмосклероз, многоузловой эутиреоидный зоб, аденома предстательной железы, хронический простатит.
При поступлении в стационар состояние средней тяжести, периферических отеков нет, температура тела 36,6 °С. Периферические лимфатические узлы не увеличены. При аускультации легких дыхание жесткое, проводится во все отделы, хрипов нет. При аускультации сердца тоны сердца приглушены, аритмичные. Частота сердечных сокращений около 140 уд/мин, дефицита пульса нет. АД 130/85 мм рт.ст. Живот мягкий, при пальпации безболезненный. Печень выступает на 1 см из-под края реберной дуги. Селезенка не пальпируется. Стул в норме. Дизурических явлений нет.
Пациент в сознании, контактен, ориентирован. Острой очаговой неврологической и менингеальной симптоматики нет.
При поступлении в клиническом анализе крови эритроцитоз (эр. 6,03×1012/л при норме до 5,6×1012/л; Hb 168 г/л при норме до 160 г/л), нейтрофилез за счет сегментоядерных форм (н. 6,16×109/л при норме до 5,9×109/л, с. 78% при норме до 72%), лимфоцитопения (лимф. 1,155×109/л при норме от 1,2×109/л; 15% при норме от 19%), тромбоцитопения (тр. 121×109/л при норме от 180×109/л), остальные показатели в пределах нормы. При динамическом наблюдении за 3 нед лечения показатели красной и белой крови нормализовались.
В анализе мочи регистрировалась протеинурия (бело.
Евстахиев клапан в правом предсердии что это
Клиническая картина характеризуется выраженными симптомами право- или левожелудочковой недостаточности. У части больных появляется выпот в полости перикарда, при ЭхоКГ отмечается также сравнительно небольшой объем желудочков, обусловленный выраженной инфильтрацией эндокарда желудочков и значительными фибринозными и тромботическими наложениями. Несмотря на повышение давления наполнения желудочков, систолическая функция их вначале сохраняется. Кроме того, при ЭхоКГ предсердия часто расширены, отмечается недостаточность митрального клапана и клапана легочной артерии.
б) Внутренние структуры правых отделов сердца. В правом предсердии имеются анатомические структуры, которые можно принять за объемное образование, поэтому их следует включить в дифференциальный диагноз. К таким структурам относятся евстахиева заслонка, пограничный гребень, сеть Хиари и мышечный пучок в устье верхней полой вены.
1. Сеть Хиари. Сеть, или пластинка Хиари представляет собой продырявленную мембрану, которая при нарушении процесса обратного развития правой заслонки венозного синуса сохраняется в правом предсердии в качестве анатомического варианта его строения. Сеть Хиари при ЭхоКГ была впервые описана в 1981 г. в виде очень подвижного образования со значительной вариабельностью места прикрепления. При ЧПЭ сеть Хиари, как правило, имеет вид перепончатого флотирующего образования в правом предсердии, которое прикрепляется к его медиальной и латеральной стенкам. Для исследования этого образования датчик, находящийся в пищеводе, проталкивают примерно на 4 см от плоскости четырех камер и поворачивают.
Частота выявления сети Хиари при ЧПЭ такая же, как при аутопсии, и составляет 5%. Несмотря на отдельные сообщения в литературе о связи сети Хиари с тромбозом правого предсердия, нарушением ритма сердца или образованием аневризмы межпредсердной перегородки, а также несмотря на казуистические случаи обвития тромба или катетера сетью Хиари, эта аномалия развития, как правило, не имеет клинического значения. Эхокардиография в таких случаях позволяет отдифференцировать сеть Хиари от других патологических образований правого предсердия, в частности тромба, вегетаций, инородного тела и редко аневризмы синуса Вальсальвы.
2. Трехпредсердное сердце (удвоение правого предсердия). Персистенция правой заслонки венозного синуса может привести к образованию патологической мембраны и удвоению правого предсердия (правое трехпредсердное сердце).
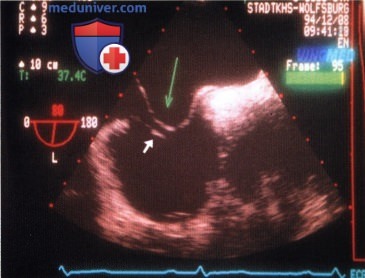
3. Евстахиева заслонка. Евстахиева заслонка, или евстахиев клапан, расположена в устье нижней полой вены и хорошо визуализируется при лоцировании сердца вдоль длинной оси из чреспищеводного доступа.
4. Тебезиев клапан (заслонка) и пограничный гребень. Вблизи венозного синуса расположены также тебезиев клапан и пограничный гребень. Тебезиев клапан прикрепляется к устью коронарного синуса, а пограничный гребень расположен на латеральной стенке правого предсердия. Для идентификации этих структур правого предсердия и дифференцирования их от перечисленных выше объемных образований, как правило, необходимо выполнение многопроекционного УЗИ и, по крайней мере, двумерной ЭхоКГ.
5. Гребешковые мышцы и мышечные пучки. Стенки правого предсердия по сравнению с левым имеют более выраженное трабекулярное строение, и иногда отдельные трабекулы или мышечные пучки бывают настолько крупными, что их приходится включать в дифференциальный диагноз, когда у больного подозревают опухоль предсердия. Указанные анатомические структуры могут особенно увеличиваться при гипертрофии предсердий, например при дефекте межпредсердной перегородки. У устья верхней полой вены иногда наблюдается мышечный пучок, который также может затруднить диагностику и должен быть учтен в дифференциальном диагнозе.
В большинстве случаев эти структуры при многопроекционном чреспищеводном исследовании оказываются нормальным анатомическим вариантом; для большей информативности исследования в горизонтальной (поперечной) плоскости датчик желательно продвинуть несколько дальше или же подтянуть.
Менее затруднительна идентификация так называемой модераторной трабекулы в правом желудочке; ее можно выявить и при трансторакальной ЭхоКГ.
6. Тромбы. При образовании тромбов в правом предсердии или желудочке так или иначе нарушается функция этих камер сердца (мерцание предсердий, дилатационная кардиомиопатия). Лишь в исключительных случаях у больных со злокачественной опухолью сердца или нарушением свертывания крови тромбы могут образоваться без нарушения функции пораженного предсердия или желудочка. Тромбы в правые отделы сердца могут мигрировать также из глубоких вен нижних конечностей или из тазовых вен при их тромбозе.
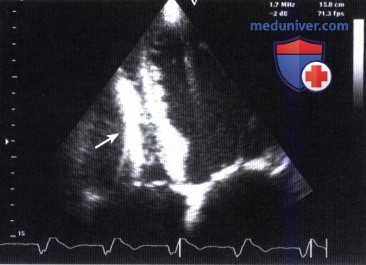
7. Ятрогенные структуры, образующиеся в сердце. Ятрогенными структурами в правых отделах сердца, которые иногда ошибочно принимают за объемное образование, могут быть электрод от электрокардиостимулятора или имплантируемого дефибриллятора, а в исключительно редких случаях также катетеры для эмболизации артерий и кава-фильтры. В этих случаях также необходимо правильно оценить клиническую ситуацию в целом и собрать подробный анамнез.
в) Дополнительные структуры левых отделов сердца:
1. Мышечные пучки и сухожильные хорды. К дополнительным анатомическим структурам левых отделов сердца, которые следует учитывать при проведении дифференциальной диагностики, относятся аномальные сосочковые мышцы и аберрантные сухожильные хорды. Выраженная трабекулярность внутреннего рельефа левых камер сердца или гипертрофия их стенки могут вызвать при ЭхоКГ подозрение на опухоль сердца.
2. Фиброз и обызвествление. В дифференциальной диагностике следует учесть также очаговый фиброз и обызвествление желудочковой стенки, а нередко и области митрального кольца. Полноценное УЗИ, включая трансторакальную ЭхоКГ, в том числе из подреберной позиции датчика, а при необходимости и ЧПЭ, как правило, дает возможность четко дифференцировать эти изменения от опухоли сердца, от тромба и вегетаций.
3. Трехпредсердное сердце (удвоение левого предсердия). Резидуальная ткань общей легочной вены может достигать значительных размеров, располагаясь от устья левой верхней легочной вены до входа в ушко левого предсердия. В результате левое предсердие оказывается как бы разделенным на две камеры (левое трехпредсердное сердце).
4. Другие структуры сердца. За опухоль левого предсердия можно по ошибке принять также грыжу пищеводного отверстия диафрагмы, крупную аневризму коронарной артерии или увеличенный коронарный синус. Локализованная гематома перикарда также может создать впечатление опухоли сердца. В дифференциальный диагноз следует включить также пролапс митрального клапана, вегетации, связанные с эндокардитом, а также разрастания Ламбла на митральном клапане(см. рис. 22.10).
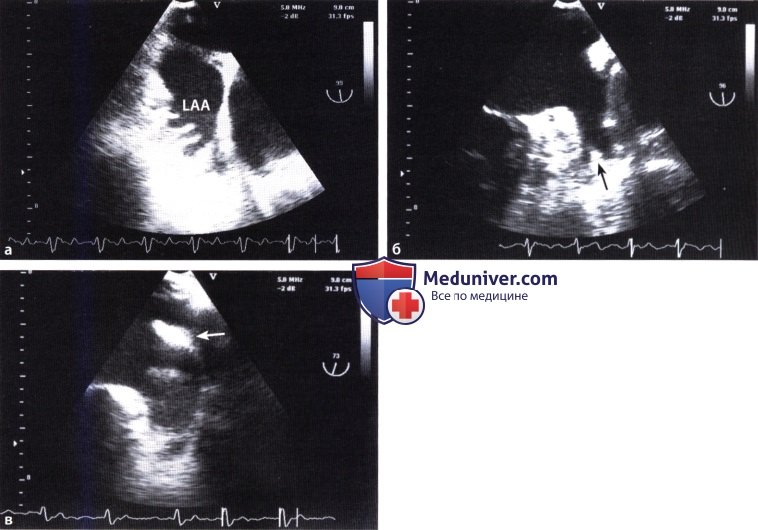
а ЧПЭ: гребешковые мышцы в левом ушке.
б Ушко левого предсердия, разделенное перегородкой (стрелка).
в Утолщенная складка свободной стенки правого желудочка (симптом «ватной палочки») (стрелка).
5. Тромбы. Диагностику тромба в левом предсердии могут усложнить гипертрофированные гребешковые мышцы, патологические эхо-сигналы от крыши левого предсердия в области входа в ушко или резидуальная ткань у устья левой верхней легочной вены. Для проведения дифференциальной диагностики следует выполнить многопроекционную ЧПЭ, а также допплерографию в импульсном режиме, которая позволяет измерить скорость кровотока в ушке левого предсердия. В присутствии тромба кровоток в левом ушке отчетливо снижается и составляет значительно меньше 25 см/с.
Для распознавания тромбоза левого ушка и проведения дифференциальной диагностики следует знать морфологические особенности левого предсердия. Нередко левое ушко состоит из двух или трех отделов, отделенных перегородками, которые также могут создать ложное впечатление тромбоза ушка. Источником диагностической ошибки может стать также образование складки (симптом «ватной палочки») на свободной стенке левого предсердия, впечатление тромбоза может создать также сканирование в косой плоскости к стенеи левого предсердия при переходе ее в крышу предсердия. Во многих случаях ошибочной диагностике тромбоза способствует недостаточный опыт врача-сонолога. Частота ошибочных диагнозов может достигать 60-70%.

г) Аневризмы межпредсердной перегородки:
Согласно определению, под аневризмой обычно понимают выпячивание межпредсердной перегородки в правое или левое предсердие более чем на 10 мм, хотя нередко наблюдаются случаи, когда межпредсердная перегородка смещается в сторону то одного, то другого предсердия. Аневризма может охватывать всю межпредсердную перегородку или только область овальной ямки.
2. Эхокардиография. По данным одного исследования, охватившего 195 больных, аневризму межпредсердной перегородки менее чем в 50% случаев диагностируют с помощью трансторакальной ЭхоКГ и в большинстве случаев диагноз ставят по результатам ЧПЭ. Из 195 больных у половины аневризма охватывала всю межпредсердную перегородку. Более чем в 50% случаев наблюдался сброс крови преимущественно через овальное окно. В отдельных случаях отмечены множественные перфорации аневризматически измененной межпредсердной перегородки, которая напоминала «швейцарский сыр».
3. Эмболии. У 44% больных с аневризмой межпредсердной перегородки и сбросом крови на уровне предсердий в анамнезе отмечаются эпизоды эмболии. У четверти больных, перенесших эмболию, помимо аневризмы межпредсердной перегородки, других возможных источников кардиогенной эмболии не выявляют. Ни размер аневризмы, ни степень ее выпячивания на частоту эмболии не влияют. Но у больных, перенесших эмболию, сброс крови через аневризму межпредсердной перегородки наблюдается существенно чаще. По данным специального исследования «Patent Foramen Ovale and Atrial Septal Aneurysm», при одном лишь открытом овальном окне риск повторного инсульта составляет 2,3%.
Если имеется также аневризма межпредсердной перегородки, риск возрастает до 15,2%. Эти данные говорят об особенно важном клиническом значении парадоксальной эмболии при аневризме межпредсердной перегородки со сбросом крови. В то же время тромбоз аневризмы как источник эмболии существенной роли не играет, так как лишь у 2 больных из 195 был выявлен тромб. Поэтому поиск аневризмы межпредсердной перегородки у лиц молодого возраста, перенесших инсульт, имеет основополагающее значение в установлении этиологического диагноза и особенно для правильного лечения.
Редактор: Искандер Милевски. Дата публикации: 11.1.2020
Публикации в СМИ
Аномалии развития сердца малые
Малые аномалии развития сердца (МАРС) — анатомические врождённые изменения сердца и магистральных сосудов, не приводящие к грубым нарушениям функций ССС. Ряд МАРС имеет нестабильный характер и с возрастом исчезает. Частота — 2,2–10% в популяции, у детей с различной сердечной патологией — 10–25%, увеличивается при наследственных заболеваниях соединительной ткани. Преобладающий возраст — дети первых 3 лет жизни. Этиология. Наследственно детерминированная соединительнотканная дисплазия. Ряд МАРС имеют дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов (химическое, физическое воздействие).
Варианты. В литературе описано около 40 вариантов МАРС. Наиболее часто наблюдают • Эктопические трабекулы • Пролапс митрального клапана • Пролапс трикуспидального клапана • Открытое овальное окно • Длинный евстахиев клапан (заслонка) — нерудиментированная складка эндокарда (элемент эмбрионального кровообращения), расположенная в устье нижней полой вены со стороны полости правого предсердия, длиной от 1 до 2 см. Обычно случайно находят при ЭхоКГ • Аневризма межпредсердной перегородки — выпячивание межпредсердной перегородки в области овальной ямки, не вызывающее гемодинамических нарушений. Клинически при аускультации — систолические щелчки • Аневризма межжелудочковой перегородки — выбухание межжелудочковой перегородки в сторону правого желудочка. При аускультации — систолический шум и клики слева у основания грудины • Дилатация корня аорты и синусов Вальсальвы — расширение устья аорты (у детей в норме — 1,2–2,4 см) и синусов (в норме глубина — 1,5–3 мм). Аускультативно — непостоянные систолические «щелчки», иногда шум «волчка» на сосудах шеи.
Сопутствующая патология • Синдром Марфана • Синдром Элерса–Данло–Русакова • Первичный гипогонадизм • Синдром Бехчета • Врождённые пороки сердца (ВПС) • Аритмии сердца • Инфекционный эндокардит • Клапанная регургитация.
Диагностические критерии • Анамнестические данные (профессиональные вредности, алкоголизм матери в период беременности, заболевания соединительной ткани в семье и др.) • Признаки диспластического развития (внешние малые аномалии развития — короткая шея, высокое нёбо и др.) • Характерная аускультативная картина в зависимости от варианта МАРС • Изменения на ЭКГ • ЭхоКГ-критерии • Рентгенологические критерии.
Дифференциальная диагностика • ВПС • Большие аномалии развития сердца.
Функциональная значимость • Зависит от возраста пациента, варианта МАРС, наличия сопутствующих заболеваний • Маркёр дизэмбриогенетического развития сердца • Предрасполагают к развитию аритмий, клапанной регургитации, левожелудочковой дисфункции.
Лечение определяют вариант МАРС и сопутствующая патология.
Сокращение. МАРС — малые аномалии развития сердца
МКБ-10. Q20.9 Врождённая аномалия сердечных камер и соединений неуточненная
Примечание. Большие аномалии развития сердца — анатомические изменения сердца и магистральных сосудов, сопровождающиеся грубыми нарушениями функций ССС (например, пролапс митрального клапана с регургитацией III степени).
Код вставки на сайт
Аномалии развития сердца малые
Малые аномалии развития сердца (МАРС) — анатомические врождённые изменения сердца и магистральных сосудов, не приводящие к грубым нарушениям функций ССС. Ряд МАРС имеет нестабильный характер и с возрастом исчезает. Частота — 2,2–10% в популяции, у детей с различной сердечной патологией — 10–25%, увеличивается при наследственных заболеваниях соединительной ткани. Преобладающий возраст — дети первых 3 лет жизни. Этиология. Наследственно детерминированная соединительнотканная дисплазия. Ряд МАРС имеют дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов (химическое, физическое воздействие).
Варианты. В литературе описано около 40 вариантов МАРС. Наиболее часто наблюдают • Эктопические трабекулы • Пролапс митрального клапана • Пролапс трикуспидального клапана • Открытое овальное окно • Длинный евстахиев клапан (заслонка) — нерудиментированная складка эндокарда (элемент эмбрионального кровообращения), расположенная в устье нижней полой вены со стороны полости правого предсердия, длиной от 1 до 2 см. Обычно случайно находят при ЭхоКГ • Аневризма межпредсердной перегородки — выпячивание межпредсердной перегородки в области овальной ямки, не вызывающее гемодинамических нарушений. Клинически при аускультации — систолические щелчки • Аневризма межжелудочковой перегородки — выбухание межжелудочковой перегородки в сторону правого желудочка. При аускультации — систолический шум и клики слева у основания грудины • Дилатация корня аорты и синусов Вальсальвы — расширение устья аорты (у детей в норме — 1,2–2,4 см) и синусов (в норме глубина — 1,5–3 мм). Аускультативно — непостоянные систолические «щелчки», иногда шум «волчка» на сосудах шеи.
Сопутствующая патология • Синдром Марфана • Синдром Элерса–Данло–Русакова • Первичный гипогонадизм • Синдром Бехчета • Врождённые пороки сердца (ВПС) • Аритмии сердца • Инфекционный эндокардит • Клапанная регургитация.
Диагностические критерии • Анамнестические данные (профессиональные вредности, алкоголизм матери в период беременности, заболевания соединительной ткани в семье и др.) • Признаки диспластического развития (внешние малые аномалии развития — короткая шея, высокое нёбо и др.) • Характерная аускультативная картина в зависимости от варианта МАРС • Изменения на ЭКГ • ЭхоКГ-критерии • Рентгенологические критерии.
Дифференциальная диагностика • ВПС • Большие аномалии развития сердца.
Функциональная значимость • Зависит от возраста пациента, варианта МАРС, наличия сопутствующих заболеваний • Маркёр дизэмбриогенетического развития сердца • Предрасполагают к развитию аритмий, клапанной регургитации, левожелудочковой дисфункции.
Лечение определяют вариант МАРС и сопутствующая патология.
Сокращение. МАРС — малые аномалии развития сердца
МКБ-10. Q20.9 Врождённая аномалия сердечных камер и соединений неуточненная
Примечание. Большие аномалии развития сердца — анатомические изменения сердца и магистральных сосудов, сопровождающиеся грубыми нарушениями функций ССС (например, пролапс митрального клапана с регургитацией III степени).
Клиническое значение малых аномалий развития сердца у детей
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных видов коллагена и/или нарушение их соотношения, приводящее к снижению прочности соединительной ткани [12, 13, 24, 26].
В развитии ДСТ принимают участие эндогенные (хромосомные и генетические дефекты) и экзогенные (неблагоприятная экологическая обстановка, неадекватное питание, стрессы) факторы [12, 30, 43]. Особенность морфогенеза соединительной ткани заключается в том, что она участвует в формировании каркаса сердца практически на всех этапах онтогенеза, следовательно, влияние любого повреждающего фактора может привести к развитию ДСТ сердца [15].
В 1990 г. в классификации заболеваний сердечно-сосудистой системы Нью-Йоркской ассоциации кардиологов, а также в Омске, на симпозиуме, посвященном проблеме дисплазии соединительной ткани, был впервые выделен синдром ДСТ сердца, сопровождающий как дифференцированные, так и недифференцированные ДСТ. При синдроме ДСТ сердца в патологический процесс вовлекается его соединительно-тканный каркас — сердечные клапаны (атриовентрикулярные, полулунные, евстахиев клапан), подклапанный аппарат, перегородки сердца и магистральные сосуды.
В клинической практике, когда речь идет о морфологической основе изменений сердечно-сосудистой системы без гемодинамических нарушений, Ю. М. Белозеровым (1993) и С. Ф. Гнусаевым (1995) вместо термина «ДСТ сердца» был предложен другой — «малые аномалии развития сердца» (МАРС) [3, 8]. Согласно определению этих авторов, МАРС считаются анатомические изменения архитектоники сердца и магистральных сосудов, не приводящие к грубым нарушениям функций сердечно-сосудистой системы [9].
Классификация МАРС по С. Ф. Гнусаеву, 2001 (с изменениями)
предсердия и межпредсердная перегородка: пролабирующий клапан нижней полой вены, увеличенный евстахиев клапан более 1 см, открытое овальное окно, небольшая аневризма межпредсердной перегородки, пролабирующие гребенчатые мышцы в правом предсердии;
трикуспидальный клапан: смещение септальной створки в полость правого желудочка в пределах 10 мм, дилатация правого атриовентрикулярного отверстия, пролапс трикуспидального клапана;
легочная артерия: дилатация ствола легочной артерии, пролапс створок;
аорта: погранично узкий и широкий корень аорты, дилатация синуса Вальсальвы, двустворчатый клапан аорты, асимметрия и пролапс створок клапана аорты;
левый желудочек: трабекулы (поперечная, продольная, диагональная), небольшая аневризма межжелудочковой перегородки;
митральный клапан: пролапс митрального клапана, эктопическое крепление хорд, нарушенное распределение хорд передней и (или) задней створки, «порхающие» хорды, дополнительные и аномально расположенные папиллярные мышцы.
До сих пор нет единого мнения о клиническом значении МАРС, многие из которых имеют нестабильный характер, связанный с ростом ребенка. Так, возможно обратное развитие увеличенного евстахиева клапана, пролабирующих гребенчатых мышц в правом предсердии, пролапса митрального клапана (ПМК), закрытие открытого овального окна, нормализация длины хорд митрального клапана и диаметра магистральных сосудов. В ряде случаев МАРС изменяются не только в качественном, но и в количественном отношении [3]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 МАРС), по мнению С. Ф. Гнусаева (1995), свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [8].
Учитывая, что МАРС являются вариантом висцеральных ДСТ, дети, как правило, имеют выраженный полиморфизм клинико-морфологических нарушений, зависящий от степени ДСТ и вовлечения в патологический процесс других органов и систем. Выявлена ассоциативная связь между числом внешних фенотипических маркеров ДСТ и МАРС [12, 16, 21, 22]. При этом имеют значение не только число внешних фенотипических маркеров, но и «диагностический вес» каждого из них. Отмечено, что дисплазии кожи и скелета наиболее часто сочетаются с МАРС [12].
Клиническая значимость патологии соединительной ткани у лиц с ДСТ подтверждается данными о высокой частоте нейровегетативных расстройств, изменений центральной нервной системы (энурез, дефекты речи, вегетососудистая дистония (ВСД)), нарушений психики [5, 12, 24]. Как правило, у таких пациентов всегда выявляется ВСД, что, вероятно, обусловлено наследуемыми (наследственными) особенностями структуры и функции лимбико-ретикулярного комплекса, определяющими аномальный характер нейровегетативных реакций [12]. Е. В. Буланкиной (2002) установлена отчетливая взаимосвязь между вегетативной дисфункцией и ДСТ [4]. При этом выраженность диспластических изменений сочеталась с тяжестью процессов дезадаптации регуляторных механизмов и снижением стрессовой устойчивости организма. Наиболее распространенными проявлениями вегетативной дисфункции являются цефалгии, вегетативные кризы, вегетовисцеральные пароксизмы, пре- и синкопальные состояния [12, 16]. Согласно данным С. Ф. Гнусаева (1995), у лиц с ПМК выявлена недостаточность сегментарных вегетативных структур [8]. Исследования Т. М. Домницкой (2000) позволили установить прямую зависимость между ПМК, аномально расположенными трабекулами (АРТ) и распространенностью невротических (невротические реакции, невроз навязчивых состояний, панические расстройства) и энцефалопатических (церебрастенический синдром, заикание, тики, нарушения сна, энурез, гипердинамический синдром, страхи) расстройств [10].
Нередко МАРС сопровождают такие патологические состояния, как нарушения сердечного ритма и проводимости, в том числе синдром ранней реполяризации, синдром слабости синусового узла, синдром Вольф–Паркинсон–Уайта, повышение электрической активности левого желудочка, блокада правой ножки пучка Гиса, экстрасистолия и пароксизмальная тахикардия [4, 6, 8, 34]. По данным Л. А. Балыковой и соавт. (2002), у 90% больных с нарушениями сердечного ритма с помощью эхографии были выявлены МАРС (преимущественно ПМК) [2]. Однако не все МАРС сопровождаются нарушениями сердечного ритма и (или) могут являться их причиной. К аритмогенным МАРС относятся фиброзно-мышечные аномально расположенные хорды (АРХ) и АРТ, ПМК и пролапс трикуспидального клапана (ПТК), аневризма межпредсердной перегородки, увеличенный и/или пролабирующий евстахиев клапан.
Наличие проводящих кардиомиоцитов в фиброзно-мышечных АРХ и АРТ формирует дополнительные проводящие пути, чем объясняется происхождение импульса, опережающего внутрижелудочковое проведение и вызывающего раннее возбуждение прилежащих к нему сегментов с последующей их более ранней реполяризацией [12, 15, 19, 20, 28]. Имеется гистологическое подтверждение наличия проводящих клеток в АРТ с диагонально-базальной, срединно-поперечной и продольной локализацией и в АРХ, соединяющих базальные септальные отделы и боковую стенку левого желудочка [3, 10, 33]. M. Suwa и соавт. (1986) отметили возрастание частоты желудочковых экстрасистол с увеличением толщины хорды. По мнению E. Chesler и соавт. (1983), появление желудочковых экстрасистол связано с миксоматозно измененными хордами, вызывающими механическое раздражение стенки левого желудочка [27]. Факт аритмогенности АРХ и АРТ также подтверждается исчезновением у пациентов экстрасистолии в случае их самостоятельного разрыва или оперативного рассечения либо при физической нагрузке, когда уменьшается степень их натяжения [8, 10, 12]. Довольно распространенным нарушением сердечного ритма при АРХ и АРТ является и синдром раннего возбуждения желудочков [6, 12].
Аритмии при ПМК и ПТК, по данным разных авторов, встречаются от 15 до 90% случаев [11]. Среди причин аритмий рассматриваются вегетативные дисфункции, механическая стимуляция эндокарда, дефицит внутритканевого магния, психологический стресс и миксоматозная дегенерация створок клапанов [3, 10–12, 18, 27, 29, 37, 39]. Установлена прямая корреляционная зависимость между частотой, а также степенью тяжести нарушений ритма и глубиной ПМК [1]. Ряд авторов полагают, что причиной развития аритмий при ПМК и ПТК может являться турбулентный поток, возникающий в результате регургитации через клапанное кольцо во время систолы желудочков, особенно при ПТК, когда происходит механическое раздражение зоны синусового узла [3, 8, 23]. Возможным механизмом развития желудочковых экстрасистол при ПМК большинство исследователей считают избыточное натяжение папиллярных мышц вследствие их аномальной тракции при пролабировании створок [12, 14, 25, 38].
Развитие аритмий может провоцировать пролабирующий евстахиев клапан и аневризма межпредсердной перегородки: условия для возникновения аритмий возникают в результате их холмистых движений и рефлекторного раздражения ими пейсмекерных образований в правом предсердии [42].
Согласно исследованиям О. А. Дианова (1999), нарушения сердечного ритма встречались у детей с погранично узкой аортой, у которых в 32,4% случаев регистрировалась суправентрикулярная и в 10,8% — желудочковая экстрасистолии, свидетельствующие о декомпенсации адаптации, особенно в условиях физической нагрузки [4].
По данным Ю. М. Белозерова, дети с МАРС отличаются сниженными возможностями кардиогемодинамики и демонстрируют плохую переносимость физических нагрузок [3]. По данным Н. А. Мазура, установлена связь между ПМК и синдромом внезапной смерти у взрослых. Накоплено достаточно сведений о том, что дети с МАРС относятся к группе риска по развитию инфекционного эндокардита.
Таким образом, существующие результаты исследований о том, что МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей. В то же время неоправданным было бы преувеличение их роли в функциональных нарушениях сердечно-сосудистой системы. Очевидно, в каждом конкретном случае значимость структурных аномалий сердца должна рассматриваться индивидуально.
Принципы терапии детей с МАРС еще до конца не сформулированы. Однако на сегодняшний день можно предложить следующую тактику ведения детей с МАРС:
Общепризнанным является применение немедикаментозных методов лечения, включающих:
Вопрос о допуске к занятиям спортом решается индивидуально. При наличии ПМК необходимо учитывать семейный анамнез (случаи внезапной смерти у родственников), наличие жалоб на сердцебиения, кардиалгии; синкопальные состояния; изменения на ЭКГ (нарушения сердечного ритма, синдром укороченного и удлиненного QT) являются основанием для принятия решения о противопоказании спортивных тренировок. Это касается и наличия АРХ, АРТ с синдромом раннего возбуждения желудочков, которые, являясь аритмогенными МАРС, могут спровоцировать нарушения сердечного ритма у спортсменов в условиях физического и психоэмоционального напряжения.
Медикаментозное лечение включает применение:
В настоящее время терапия препаратами магния при МАРС приближается к патогенетической. Это обусловлено тем, что магний входит в состав основного вещества соединительной ткани и необходим для правильного формирования волокон коллагена. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген [29, 31]. Кроме того, магний оказывает мембраностабилизирующее действие, удерживает калий внутри клетки, препятствует симпатикотоническим влияниям, что делает возможным его применение для лечения нарушений сердечного ритма [40, 41].
В работах О. Б. Степуры (1999), О. Д. Остроумовой и соавт. (2004) имеются сведения о достоверном уменьшении степени ПМК, симптомов ВСД, количества желудочковых экстрасистол на фоне терапии препаратами магния [17, 18].
Целесообразным может быть признано назначение следующих препаратов:
Магнерота, содержащего соль магния и оротовую кислоту. Последняя не только усиливает реабсорбцию Mg в кишечнике, но и обладает самостоятельным метаболическим действием. Детям назначают по 500 мг магнерота (32,8 мг магния 3 раза в день в течение 1 нед, затем 250 мг 3 раза в день в течение последующих 5 нед. Принимается препарат за 1 ч до еды).
Магне В6. Выпускается в таблетках (48 мг магния или в растворе для приема внутрь (100 мг магния). Детям с массой тела более 10 кг (старше 1 года) — 5–10 мг/кг/сутки в 2–3 приема. Детям старше 12 лет — 3–4 табл. в сут, в 2–3 приема. Продолжительность курса 6–8 нед.
Калия оротата. Детям препарат назначают из расчета 10–20 мг/кг/сут в 2–3 приема за 1 ч до еды или через 4 ч после еды. Продолжительность курса — 1 мес.
Следует проводить повторные курсы терапии этими препаратами (3–4 раза в год).
Для улучшения клеточной энергетикии миокарда применяют препараты, обладающие комплексным влиянием на метаболические процессы в организме, а также являющиеся активными антиоксидантами и мембраностабилизаторами:
Кроме указанных препаратов для улучшения метаболических процессов в соединительной ткани, миокарде и в организме в целом показано применение:
Показаны повторные курсы лечения (до 3 раз в год).
При наличии ВСД проводится комплексная длительная терапия по восстановлению баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы (дифференцированная фитотерапия, вегетотропные препараты, ноотропы, вазоактивные препараты — кавинтон, вазобрал, инстенон, циннаризин и др.).
Таким образом, все вышесказанное позволяет сделать вывод, что МАРС, являясь висцеральным проявлением дисплазии соединительной ткани, составляют морфологическую основу функциональных изменений сердечной деятельности и нейровегетативных расстройств. Выбор индивидуальной программы курсового лечения способствует улучшению обменных процессов в соединительной ткани и профилактирует возможные осложнения ДСТ у детей и подростков.
По вопросам литературы обращайтесь в редакцию.
Н. А. Коровина, доктор медицинских наук, профессор
А. А. Тарасова, кандидат медицинских наук, доцент
Т. М. Творогова, кандидат медицинских наук, доцент
Л. П. Гаврюшова, кандидат медицинских наук, доцент
М. С. Дзис
РМАПО, Москва