к чему чувствительна клебсиелла
К чему чувствительна клебсиелла
Дисбиотические нарушения в настоящее время широко распространены в России и за рубежом. Особенно часто встречается дисбиоз кишечника, от которого, по данным различных исследователей, в той или иной степени страдает до 90 % населения страны [1]. Самым многочисленным как по видовому разнообразию, так и в количественном отношении является ассоциативный симбиоз микробных сообществ толстого кишечника [3]. У детей первого года жизни с высокой частотой и в этиологически значимых количествах выделяются клебсиеллы и золотистый стафилококк, что делает этот возраст уязвимым для развития эндогенных гнойно-воспалительных процессов различной локализации [2]. Микробиоценоз кишечника характеризуется неустойчивостью, связанной с микробной сукцессией при формировании микробиоты, особенностями иммунной системы, неадекватным иммунным ответом организма на заселение кишечника УПМ [1; 3]. Однако мало изученными остаются вопросы, связанные с распространенностью и взаимодействием генетических маркеров патогенности среди клебсиелл и стафилококков, персистирующих совместно в кишечном биотопе. Низкая эффективность эмпирического использования антибиотиков в сочетании с их побочным иммуносупрессивным эффектом приводит к подавлению нормальной микрофлоры кишечника и последующим формированием дисбиозов. Среди альтернативных антимикробных препаратов особый интерес представляют бактериофаги. В то время как антибиотики воздействуют на широкий спектр бактерий, в том числе и на нормальную микрофлору, бактериофаги обладают выраженной специфичностью [6].
Цель исследования. Оценить патогенный потенциал аутоштаммов Klebsiella spp. в ассоциации со Staphylococcus aureus, изолированных от детей первого года жизни с дисбиозами кишечника посредством детекции генетических детерминант патогенности.
Материалы и методы исследования
Были исследованы копрологические пробы 100 детей первого года жизни, у которых на основании микробиологических критериев был установлен дисбиоз кишечника с индикацией клебсиелл в диагностически значимых концентрациях (≥104 КОЕ/г) [8]. Исследуемая выборка была разделена на две группы: группа 1 – 60 детей, у которых аутоштаммы клебсиелл выделялись в монокультуре; группа 2 – 40 детей, у которых клебсиеллы вегетировали в ассоциации с золотистым стафилококком. Антибиотикорезистентность клебсиелл определяли диско-диффузионным методом [7]. Использовались антибиотические препараты (АБП) следующих групп: β-лактамы (амоксициллин, цефтазидим, ампициллин, цефотаксим), аминогликозиды (амикацин), хинолоны (норфлоксацин). Фагочувствительность определялась к коммерческим препаратам бактериофагов – «очищенному фагу клебсиелл пневмонии», «очищенному бактериофагу клебсиелл поливалентному» и «пиобактериофагу поливалентному» («Секстафаг») производства НПО «Микроген» г. Пермь. Тестирование проводилось согласно [4]. Бактериологический анализ содержимого толстой кишки производили согласно [8] и в соответствии с утвержденными методическими рекомендациями. Выделенные микроорганизмы идентифицировали общепринятыми методами [1]. Всего для ПЦР детекции факторов патогенности использовали 140 проб, где в группе 1 были типированы 60 проб с Klebsiella spp., а в группе 2 – по 40 проб Klebsiella spp. и Staphylococcus aureus. Для выделения ДНК бактерий из культуральной среды использовали комплект реагентов «ДНК-сорб-В» (ФГУН ЦНИИЭ Роспотребнадзора, Россия). Типирование проводили с шестью парами праймеров [2], отобранных согласно рекомендациям [5; 9; 10].
Для ПЦР-амплификации использовали коммерческий набор AmpliSens-200-1 (ФГУН ЦНИИЭ Роспотребнадзора, Россия). ПЦР проводили с ДНК-матрицы (3 мкл), прямого и обратного праймеров (1 мкл). ДНК амплифицировали в соответствии с протоколом [2]. Электрофорез ПЦР-фрагментов ДНК клебсиелл проводили с использованием 1,0 %-го агарозного геля в 1 % трис-ацетатном буфере в течение 60 мин при 100 В, окрашивали бромистым этидием (1%) и просматривали с помощью УФ-просвечивания. Выделенные гены были идентифицированы и определены на основе размера фрагмента ДНК продукта [2] при его соответствии с длиной маркерного фрагмента. Исследования проводились в течение 2012–2014 гг. Для статистической обработки результатов использовали Excel из пакета MS Office 2003.
Результаты исследования
и их обсуждение
В обследованной группе детей первого года жизни Klebsiella spp. была выделена в 60 % случаев, в том числе в ассоциации с золотистым стафилококком – в 40 %. Также был выявлен микроэкологический дисбаланс, который характеризовался дефицитом бифидобактерий (63,1±4,8), лактобацилл (6,8±2,5), нормальной кишечной палочки (11,7±3,2) на фоне высокой плотности бактерий рода Klebsiella (>104 КОЕ/г). В мазках 60 % аутоштаммов клебсиелл имели плотную полисахаридную капсулу, которая способствовала усилению гидрофобности клеточной стенки и препятствует проникновению фагов и АБП в клетку. Клебсиеллы чаще встречались в ассоциациях с Enterococcus spp. (78,6±4,1), Staphylococcus aureus (40,8±4,9); реже – с E. coli со слабой ферментативной активностью (26,2±4,4), Clostridium spp. (25,2±4,3) и грибами рода Candida (15,5±3,6). Далее по частоте убывания регистрировались E.coli с гемолитической активностью (13,6±3,4), коагулазонегативные виды стафилококка (4,9±2,2), Proteus spp. (3,0±1,7), Enterobacter spp. (2,0±1,4), Citrobacter frendii (2,0±1,4).
Установлено, что исследуемые штаммы клебсиелл (n=100) были чувствительны практически ко всем тестируемым антибиотикам. Процент штаммов чувствительных к β-лактамным антибиотикам составлял 85±3,5 % (цефтазидим), 83±3,8 % (амоксициллин), 89±3,1 % (цефотаксим). Исключение составил ампициллин, к которому были резистентны 70±4,5 % штаммов. Полученные данные подтверждают факт природной устойчивости клебсиелл к ампициллину. Также был высок процент штаммов чувствительных к амикацину и норфлоксацину (по 92±2,7 % случаев соответственно).
Результаты чувствительности штаммов Klebsiella spp. (n=156) к коммерческим препаратам бактериофагов представлены в табл. 1.
Характеристика чувствительности аутоштаммов Klebsiella spp к бактериофагам, (%)
Klebsiella pneumoniae (клебсиелла пневмонии)

Klebsiella pneumoniae в ЖКТ человека
Klebsiella pneumoniae колонизирует кишечник современного человека в первые 5–6 дней жизни, причем основным источником Klebsiella pneumoniae являются мать и персонал родильных домов. Обнаружение Klebsiella pneumoniae в желудочно-кишечном тракте (ЖКТ) человека, в общем случае, не требует лечения. У здорового человека в 1 г кала насчитывается до 10 5 Klebsiella pneumoniae.
Причиной клебсиеллеза органов ЖКТ может быть дисбактериоз или заражение от больных инфекционной формой клебсиеллеза. Болезнь проявляется в форме острого гастрита, гастродуоденита, кишечной инфекции и характеризуется острым началом, тошнотой, рвотой, болями в животе, поносом, повышением температуры и общей слабостью. Продолжительность клебсиеллеза органов ЖКТ — 1–5 дней.
Klebsiella pneumoniae — причина внутрибольничных инфекций
Klebsiella pneumoniae и инфекции мочевыводящих путей и половой сферы
Klebsiella pneumoniae — один из распространенных возбудителей инфекционных заболеваний мочевыводящих путей. В отличие от ЖКТ или кожи, для мочевыводящих путей Klebsiella pneumoniae всегда является патогенным микроорганизмом. Среди обращающихся за амбулаторной помощью пациентов с неосложненными инфекционными заболеваниями мочевыводящих путей причиной инфекции в 6,4 % случаев является Klebsiella pneumoniae. Для пациентов с осложненными инфекционными заболеваниями мочевыводящих путей эта цифра достигает 9,4 %. Klebsiella pneumoniae в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла пневмонии может встречаться во влагалищной микрофлоре, в частности, после приёма антибиотиков, результатом которого было уничтожение нормальной микрофлоры влагалища. Клебсиелла пневмонии в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла риносклеромы
Клебсиелла озены
Лечение клебсиеллезов
Для лечения клебсиеллезов обычно применяются антибиотики. Также используются лекарственные препараты, действующим веществом которого являются бактериофаги (Бактериофаг клебсиелл пневмонии очищенный жидкий, Секстафаг и др.). Бактериофаги действуют избирательно, не имеют противопоказаний, но они менее эффективны, чем антибиотики.
Антибактериальные средства, активные в отношении Klebsiella pneumoniae (из имеющих описание в данном справочнике): левофлоксацин, норфлоксацин, офлаксацин, а также гентамицин, нафтифин и другие.
Klebsiella pneumoniae устойчива к клотримазолу.
Klebsiella pneumoniae в систематике бактерий
Вид Klebsiella pneumoniae входит в род клебсиелла (лат. Klebsiella), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Устаревшее название Klebsiella pneumoniae — палочка Фридлендера. Карл Фридлендер (нем. Carl Friedländer, 1847–1887) — немецкий микробиолог, выделивший чистую культуру Klebsiella pneumoniae в 1882 году.
Первоначально Klebsiella pneumoniae была определена, как микроорганизм вызывающий пневмонию (отсюда и ее название). Однако её роль не сводится только к инфекциям респираторной системы. В общем случае Klebsiella pneumoniae классифицируется как условно-патогенный микроб, находящийся в нормальной ситуации и в определенных органах в симбиотическом отношении с человеческим организмом, а в иных ситуациях являющийся причиной инфекционных заболеваний.
Klebsiella (клебсиелла)
 |
| Klebsiella pneumoniae |
 |
| Klebsiella oxytoca |
Клебсиелла (лат. Klebsiella) — род грамотрицательных факультативно-анаэробных условно-патогенных бактерий. Имеют форму коротких толстых эллипсовидных палочек размером 0,6–6,0 на 0,3–1,0 мкм. Клебсиеллы неподвижны (подвижностью может обладать Klebsiella aerogenes), не образуют спор, имеют выраженные капсулы, благодаря которым клебсиеллы устойчивы к воздействию окружающей среды и могут долго сохраняться в почве, в воде, на предметах в помещениях.
В молочных продуктах клебсиеллы выживают и размножаются как при комнатной температуре, так и в холодильнике. При нагревании до 65°С погибают в течение часа.
Большинство клебсиеллезных инфекций вызывается Klebsiella pneumonia, на втором месте — Klebsiella oxytoca.
Клебсиелла в систематике бактерий
По современной классификации род Klebsiella входит в семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство Бактерии. Клебсиеллы относятся к так называемым колиформным бактериям.
Вид Klebsiella variicola был недавно выделен из близкого вида Klebsiella pneumoniae
Род Raoultella, в которой были реклассифицированы ряд видов рода Klebsiella, также относится к семейству Enterobacteriaceae.
Klebsiella quasipneumoniae subsp. similipneumoniae ранее именовалась Klebsiella alba. Klebsiella michiganensis была выделена в 2013 году от домашнего держателя зубной щётки.
Клебсиелла в гастроэнтерологии
Клебсиелла (в основном Klebsiella pneumoniae, но также встречаются Klebsiella oxytoca, Klebsiella aerogenes и другие) является представителем нормальной микрофлоры кишечника человека. В то же время, клебсиелла может вызывать ряд гастроэнтерологических заболеваний. Клебсиелла может стать причиной острого гастрита — острого воспаление слизистой оболочки желудка, возникающего по причине воздействия инфекционного фактора непосредственно на слизистую оболочку желудка. Обычно это связано с употреблением недоброкачественной пищи, неправильным хранением смесей и продуктов, несоблюдением гигиенических правил (Шабалов Н.П.).
Клебсиелла может начитать интенсивно развиваться, вызывая патологический процесс в желудочно-кишечном тракте, в частности, после терапии антибактериальными препаратами, побочным действием которых является подавление основных представителей нормальной микрофлоры желудочно-кишечного тракта (бифидобактерий и других), тормозящих чрезмерный рост клебсиелл (Щербаков П.Л.).
У большинства больных клебсибеллез протекает в форме кишечной инфекции и характеризуется острым началом, тошнотой, рвотой, болями в животе, поносом, повышением температуры и общей слабостью. Продолжительность болезни 1–5 дней. Источниками возбудителя инфекции являются больной человек и бактерионоситель. Наиболее частые пути передачи — пищевой, воздушно-капельный и контактно-бытовой. Передача происходит также через загрязненные пищевые продукты, особенно часто через мясные и молочные. Клебсиеллез является одной из распространенных внутрибольничных инфекций.
На сайте GastroScan.ru в разделе «Литература» имеется подраздел «Микрофлора, микробиоценоз, дисбиоз (дисбактериоз)», содержащий публикации для профессионалов здравоохранения, затрагивающие проблемы микробиоценоза и дисбиоза отделов ЖКТ человека.
Анализ кала на клебсиеллу
Количество клебсиелл в кале подсчитывают при анализе на дисбактериоз. Обычно это вид клебсиелла пневмонии. Норма — не более 10 5 клебсиелл на 1 г кала. Наличие клебсиелл в кишечнике далеко не всегда требует противомикробной терапии.
Клебсиеллы — возбудители заболеваний дыхательных путей
Представители рода клебсиелл (Klebsiella pneumoniaе, Klebsiella quasipneumoniae и другие виды) являются причиной небольшого числа внебольничных пневмоний — единицы процентов от всех случаев, однако летальность таких пневмоний, вызванных клебсиеллой, очень велика — 35,7 %.
Klebsiella rhinoscleromatis является возбудителем склеромы, гранулематозного поражения слизистой оболочки носа (риносклерома) и верхних дыхательных путей.
Klebsiella ozaenae вызывает хронические заболевания дыхательной системы, поражающие глотку, гортань, трахеи.
Из зёва больных бронхиальной астмой, хроническими неспецифическими болезнями лёгких выделяют Klebsiella aerogenes
 |
 |
| Донованоз (паховая гранулема), инфекционная венерическая болезнь, возбудитель — Klebsiella granulomatis |
Клебсиеллы — возбудители заболеваний мочеполовых органов
Клебсиеллы, в частности, Klebsiella pneumoniae, Klebsiella oxytoca, Klebsiella aerogenes могут вызывать различные заболевания мочеполовых органов человека, в частности, острый и хронический простатит, цистит, пиелонефрит.
При хронических болезней почек повышается титр Klebsiella spp. (Карпеева Ю.С. и др.).
Klebsiella granulomatis (уст. Calymmatobacterium granulomatis) — возбудитель донованоза, передающегося половым, реже, бытовым путём. Донованоз (другие названия: венерическая гранулема или паховая гранулема) — длительное грануломатозное поражение гениталий и паховой области с образованием язв. Встречаются главным образом в тропических и субтропических странах.
Другие заболевания, вызываемые клебсиеллами
Лечение клебсиеллезных инфекций
Для лечения клебсиеллезов применяются антибиотики: ампициллин, аминогликозиды, тетрациклины, левомицетин, рифаксимин, левофлоксацин, норфлоксацин, доксициклин и другие, однако в последнее время широко распространились штаммы клебсиелл, резистентных к антибиотикам. Также используются лекарственные препараты, действующим веществом которого являются бактериофаги: Бактериофаг клебсиелл пневмонии очищенный жидкий и Бактериофаг клебсиеллезный поливалентный жидкий очищенный, Пиобактериофаг (комбинированный препарат; торговые наименования лекарств: Пиобактериофаг комплексный жидкий, Пиобактериофаг поливалентный, Пиополифаг, Секстафаг). Бактериофаги действуют избирательно, только на клебсиелл (или, для комбинированных бактериофагов, на комплекс бактерий), не имеют противопоказаний, но они значительно менее эффективны, чем антибиотики.
Клебсиелла резистентна к нифуроксазиду.
К чему чувствительна клебсиелла
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЧАСТОТЫ ВСТРЕЧАЕМОСТИ И АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ШТАММОВ KLEBSIELLA PNEUMONIAE И ESCHERICHIA COLI, ПРОДУЦИРУЮЩИХ БЕТА-ЛАКТАМАЗЫ РАСШИРЕННОГО СПЕКТРА В ДЕТСКОМ СТАЦИОНАРЕ
Продукция БЛРС (бета-лактамаз расширенного спектра) у нозокомиальных штаммов семейства Enterobacteriaceae, особенно у Klebsiella pneumoniae и E. coli является одним из наиболее частых и значимых механизмов резистентности к антибактериальным препаратам в стационарах России. В настоящее время описано более 350 бета-лактамаз, из них более 100 обуславливает резистентность к цефалоспоринам I–IV поколения и азтреонаму. Штаммы, вырабатывающие БЛРС, также часто имеют гены резистентности к аминогликозидам, фторхинолонам, ко-тримоксазолу [1].
При изучении распространенности бета-лактамаз расширенного спектра у нозокомиальных штаммов в различных стационарах России в 1997–1998 гг. и в 2003 г. было установлено, что частота встречаемости БЛРС существенно отличается по регионам РФ, между стационарами одного города, даже между отделениями одного стационара. Так в восьми стационарах г. Москвы были обнаружены БЛРС у 10,0; 16,7; 17,0; 23,7; 26,5; 58,3; 87,1 и 90,0 % штаммов соответственно [2].
Частота распространенности БЛРС-продуцирующих энтеробактерий в стационарах некоторых городов России [3] за 2003 г. представлена в табл. 1.
Частота распространенности штаммов энтеробактерий, продуцирующих БЛРС, в стационарах некоторых городов России
Из таблицы видно, что частота выделения штаммов, продуцирующих БЛРС, в стационарах некоторых городов России очень высокая. Распространенность в среднем по России Klebsiella pneumoniae составляет от 60,2 % до 84,3 %, E. coli – от 15,8 % до 54,7 % [3].
Бета-лактамазы расширенного спектра в настоящее время широко распространены в большинстве стран мира. Частота обнаружения БЛРС у штаммов Klebsiella pneumoniae и E. coli в некоторых странах [4–6] представлена в табл. 2.
Частота обнаружения БЛРС в некоторых странах мира
Из таблицы видно, что самая низкая частота встречаемости БЛРС продуцирующих штаммов в Канаде, США и Европе, а самая высокая – в странах Азии, Латинской Америке, Саудовской Аравии.
Резистентность энтеробактерий приобретает все большее распространение и является серьезной проблемой в здравоохра- нении.
Цель работы: изучить распространенность нозокомиальных штаммов Klebsiella pneumoniae и E. coli, продуцирующих БЛРС и их антибиотикорезистентность в детском стационаре Тульской области для проведения более рациональной и эффективной антибактериальной терапии.
Материалы и методы исследования
Материалом для исследования служил биологический материал (моча, кал, мазки из зева и носа, кровь на стерильность и прочее), полученный от детей, находящихся на лечении в детском стационаре ГУЗ «Тульская детская областная клиническая больница» в 2017–2019 гг.
Выделение чистых культур Klebsiella pneumoniae и E. coli проводили классическим бактериологическим методом, а видовую идентификацию, определение БЛРС и чувствительность к антибиотикам – с помощью автоматизированной микробиологической системы Phoenix-100, производителем которой является компания Becton Dickinson (США).
Результаты исследования и их обсуждение
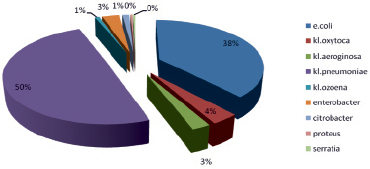
Всего за 2017–2019 гг. было выделено от детей 1017 штаммов (460 – Klebsiella pneumonia, 557 – E. coli) из различного биологического материала (кал, моча, мазки из зева и др.). При изучении пейзажа выделенных культур, продуцирующих БЛРС, установлено, что наибольший удельный вес приходится на Klebsiella pneumonia (50 %) и E. coli (38 %), на другие энтеробактерии – 12 % (рис. 1).
Рис. 1. Пейзаж выделенных культур-продуцентов БЛРС за 2017–2019 гг.
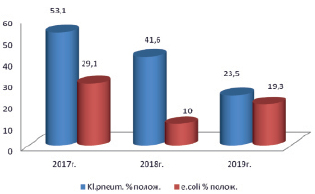
Рис. 2. Частота встречаемости БЛРС продуцирующих Klebsiella pneumonia и E. coli за 2017–2019 гг.
Частота БЛРС-позитивных штаммов у Klebsiella pneumoniae составила от 23,5 % до 53,1 %; у E. coli – от 10 % до 29,1 %.
Количество штаммов Klebsiella pneumoniae, продуцирующих бета-лактамазы расширенного спектра, в 2 раза больше, чем штаммов E. coli. Частота встречаемости штаммов, продуцирующих БЛРС, за 2017–2019 гг. представлена на рис. 2.
Мы видим, что в 2019 г. наметилась тенденция к снижению БЛРС продуцирующих штаммов Klebsiella pneumoniae и E. coli.
Частота встречаемости штаммов, продуцирующих бета-лактамазы расширенного спектра, отличается не только по годам, но и по отделениям детского стационара. Наибольшая частота встречаемости – в отделении анестезиологии и реанимации (около 90 %), педиатрическом – до 48 %, отделении патологии новорожденных (ОПН) – 37 %, нефрологическом – 5,8 %. Самая низкая встречаемость нозокомиальных штаммов-продуцентов БЛРС – в нефрологическом отделении.
Антибиотикорезистентность к бета-лактамным и небета-лактамным препаратам представлена в табл. 3.
Антибиотикорезистентность штаммов, продуцирующих БЛРС в 2019 г.
Из таблицы видно, что наиболее распространенной была резистентность к цефалоспоринам III–IV поколения (цефотаксиму, цефтазидиму, цефтриаксону, цефиксиму, цефепиму), ингибиторозащищенным пенициллинам (амоксициллин/клавуланат, ампициллин/сульбактам) и триметоприму.
Наиболее активными препаратами в отношении E. coli среди бета-лактамных препаратов были пиперациллин/тазобактам (93 %) и карбопенемы: имипенем (97 %), меропенем (91,7 %) и небета-лактамный препарат – фосфомицин (93 %).
Klebsiella pneumoniae была более чувствительна к имипенему (95 %) и из класса аминогликозидов – амикацину (93,8 %).
Отмечается высокая чувствительность Klebsiella pneumoniae и E. coli к цефоперазону/сульбактаму (100 % и 94 %) соответственно.
Выводы
Выявлена распространенность нозокомиальных штаммов Klebsiella pneumoniae и E. coli, продуцирующих БЛРС в детском стационаре, которая составляет от 23,5 % до 53,1 % и от 10 % до 29,1 % в разные годы соответственно. Частота встречаемости Klebsiella pneumoniae в детском стационаре в 2 раза больше, чем у штаммов E. coli. Наметилась положительная тенденция в 2019 г. к снижению БЛРС продуцирующих нозокомиальных штаммов Klebsiella pneumoniae и E. coli.
Наибольшая частота встречаемости Klebsiella pneumoniae и E. coli в отделении анестезиологии и реанимации, отделении патологии новорожденных, педиатрическом отделении. Наименьшая частота встречаемости нозокомиальных штаммов, продуцирующих БЛРС – в нефрологическом отделении.
Отмечается высокая антибиотикорезистентность у штаммов-продуцентов БЛРС к ингибиторозащищенным пенициллинам, цефалоспоринам III–IV поколения и триметоприму.
Также отмечается высокая чувствительность Klebsiella pneumonia к имипенему (95 %), амикацину (93, 8 %) и цефоперазону/сульбактаму (100 %).
Наиболее активными препаратами в отношении E. coli являются пиперациллин/тазобактам (93 %), цефоперазон/сульбактам (94 %), имипенем (97 %), меропенем (91,7 %), фосфомицин (93 %).
Таким образом, необходимо проводить своевременную и регулярную диагностику бета-лактамаз расширенного спектра среди энтеробактерий, которая способствует проведению рациональной и эффективной антибактериальной терапии.