как понять что кандида отмирает
«Молочница»: частая проблема с неправильным лечением
Что такое кандидоз («молочница») знает каждая женщина. И у каждой есть «проверенное» средство. Но что делать, если симптомы возвращаются? Почему кандидоз может «упорствовать»? И как найти индивидуально эффективное лекарство?
Почему «растет» грибок кандида?
1. Дефицит лактобактерий
Основой женской микрофлоры, как известно, служат лактобактерии. Доля которых, в идеале, составляет не менее 85%.
А скорость обновления эпителия, то есть «пополнения продовольственных запасов», в свою очередь, зависит от баланса эстрогенов.
Таким образом, снижение лактобактерий и «разрастание» на этом фоне грибов и прочих возбудителей, часто связано с дисбалансом эстрогенов и наблюдается при:
Механически спровоцировать нарушения могут частые спринцевания и прочие подобные процедуры, «смывающие» поверхностный слой клеток и некоторое количество полезной флоры.
Ну а среди иных причин:
2. Недостаточность иммунитета
«Молочница» может быть связана и с нарушениями иммунитета, поскольку Candida находится «под присмотром» местных защитных сил.
И еще одним фактором риска кандидоза являются:
3. Бытовые причины
Кандидоз или «другое»
Если заподозрить риск кандидоза можно уже по наличию перечисленных факторов. То отличить кандидоз от вагиноза на первый взгляд – непросто.
При этом, лечение одной и другой патологии – принципиально различно. А применение нецелевой терапии ведет к хронизации процесса и развитию осложнений, вплоть до бесплодия.
«На глаз» определить кандидоз может помочь характер выделений – белые, творожистые, с кислым запахом, сопровождаемые сильным зудом. Однако такие «классические» признаки бывают не у всех и не всегда.
Вагиноз (бактериальный вагиноз) чаще «имеет» обильные бело-серые, иногда пенистые, выделения, с щелочным («рыбным») запахом, усиливающимся после полового контакта. Иногда с зудом. Однако и здесь характер симптомов сильно варьирует. А, помимо прочего, нарушения могут быть комбинированными.
Таким образом, чтобы наверняка отличить кандидоз от других форм влагалищного дисбиоза потребуется анализ флоры.
И наиболее полную картину позволяет получить анализ «Флороценоз».
Исследование включает подсчет:
что позволяет дифференцировать сразу несколько видов дисбиозов за «один раз» и применить правильное лечение.
Типирование грибов рода Candida позволяет подобрать эффективный противогрибковый препарат. Ведь не всем известно, но некоторые из перечисленных типов обладают выраженной устойчивостью к популярным средствам. Можно получить результат типирования в тесте «Флороценоз» или сдать вагинальный мазок на отдельный тест типирование грибов, чтобы точно определить вид возбудителя молочницы и подобрать нужный противогрибковый препарат.
Профилактика кандидоза
Резюмируя все вышесказанное и придерживаясь национальных клинических рекомендаций, можно заключить, что профилактика «молочницы», как у женщин, так и у мужчин сводится к:
Женщинам, кроме того, стоит:
И особого внимания требуют беременные, ввиду физиологического ослабления иммунитета, изменения гормонального фона и застоя лимфы в малом тазу из-за повышения внутрибрюшного давления. Что создает «благоприятные» условия для развития влагалищного дисбиоза.
Вагинальный кандидоз
Что такое вагинальный кандидоз? Причины заболевания
Вагинальный кандидоз – это заболевание мочеполового тракта воспалительного характера, обусловленное дрожжеподобными грибами рода Candida.
В большинстве случаев причиной вагинального кандидоза является вид Candida Albicans. Он может успешно размножаться в бескислородной среде и особенно хорошо растет на тканях, в которых содержится большое количество гликогена, в том числе на слизистой женских гениталий. В последнее время врачи все чаще обнаруживают других возбудителей рода кандида, но общая частота их встречаемости не превышает 15-30%.
Симптомы вагинального кандидоза
Классическими признаками вагинального кандидоза являются:
Как правило, дискомфорт усиливается во второй половине дня, а у некоторых женщин перед менструацией. Во время гинекологического осмотра врач обнаруживает отечность и покраснение слизистой половых путей, а также специфические белые или желтовато-белые творожистые густые вагинальные выделения.
При осложненном течении заболевания на коже вульвы и слизистых оболочках, задней спайки и перанальной области появляются трещины; при рецидивирующем кандидозном вульвовагините выражены сухость, атрофичность, лихенификация в области поражения, скудные беловатые вагинальные выделения.
Особенности развития заболевания (патогенез)
Грибки из рода Candida постоянно обитают на коже и слизистых человека. При нормальном иммунитете они не вызывают никаких неприятных симптомов, но при его снижении начинается активное размножение возбудителя. При классическом течении воспаление не выходит за пределы слизистых, но при тяжелой форме он может проникать в подлежащие ткани и кровеносные сосуды, распространяясь таким образом по всему организму.
Классификация
Существует несколько типов классификации вагинального кандидоза. В зависимости от особенностей течения выделяют острую и хроническую (рецидивирующую) формы болезни. В первом случае патология характеризуется яркими симптомами и возникает не чаще четырех раз в год. При хронизации симптоматика, как правило, менее выражена, а само заболевание рецидивирует 4 раза в год и чаще.
В зависимости от наличия осложнений выделяют неосложненный и осложненный вагинальный кандидоз. В первом случае процесс протекает относительно легко и достаточно быстро купируется при подборе адекватной терапии. Как правило, он возникает у женщин, не имеющих дополнительных факторов риска (сахарный диабет, иммунодефицитное состояние различного происхождения).
Осложненная форма вагинального кандидоза характеризуется выраженными признаками, негативным образом влияющими на повседневную жизнь пациентки. Как правило воспаление распространяется на наружные половые органы, провоцирует появление язв и трещин. Такая форма часто рецидивирует.
Локализация патологического процесса позволяет выделить три формы заболевания:
Осложнения
Большинство осложнений вагинального кандидоза связано с распространением воспалительного процесса на расположенные рядом органы и ткани и присоединением бактериального воспаления. Оно возникает на фоне резкого снижения местного иммунитета. Наиболее часто пациентки сталкиваются со следующими проблемами:
Помимо распространения инфекции, вагинальный кандидоз может грозить развитием стеноза (сужения) влагалища. Это состояние возникает при хроническом воспалении, которое приводит к разрастанию рубцовой ткани и сужением просвета органа. Это приводит к значительному затруднению половой жизни.
Вагинальный кандидоз очень опасен для беременных, поскольку без лечения не исключено инфицирование плода, что может привести к его гибели.
В послеродовом периоде у женщин возможно развитие кандидозного эндометрита.
Диагностика
Диагностика вагинального кандидоза начинается со сбора жалоб. Гинеколог уточняет, что беспокоит пациентку, когда и при каких обстоятельствах появились конкретные проблемы, а также какие меры принимались для их устранения и с каким эффектом. Уделяется внимание анамнезу: перенесенным заболеваниям (особенно важны воспаления урогенитального тракта, ЗППП), количеству беременностей и родов, количеству половых партнеров и т.п.
Следующий этап диагностики – это осмотр на гинекологическом кресле, в ходе которого врач выявляет характерные изменения: отечность, покраснения, выделения и налет. При нанесении на ткани раствора Люголя на них визуализируются белые точки, напоминающие манку, что является характерным признаком заболевания. Для подтверждения диагноза врач назначает:
При необходимости (например, при рецидивирующем течении заболевания) проводятся тесты на выявление факторов риска: повышенный уровень глюкозы крови, иммунодефицит и т.п.
Лечение вагинального кандидоза
Специфическое лечение, направленное на устранение вагинального кандидоза, проводится только после выявления возбудителя и при наличии у пациентки признаков заболевания. Основой терапии являются специфические противогрибковые средства: нистатин, клотримазол, кетоконазол, флуконазол, нитрофунгин и другие. Конкретный препарат, его доза, кратность приема и длительность курса подбираются в индивидуальном порядке в зависимости от особенностей течения заболевания, наличия сопутствующих патологий и других факторов.
Если речь идет об остром неосложненном процессе, препараты назначаются в местной форме в виде свечей, вагинальных таблеток или кремов. Они вводятся непосредственно в половые пути, где останавливают активное размножение возбудителя.
При наличии осложнений, а также при хроническом течении заболевания используются препараты системного действия в виде таблеток для приема внутрь. Схема применения подбирается в индивидуальном порядке.
До полного устранения проявлений вагинального кандидоза необходимо соблюдать половой покой, чтобы минимизировать травмирование воспаленных стенок половых путей. При хроническом течении необходимо использовать презервативы. Эффективность терапии оценивается через 14 дней после начала лечения.
Прогноз и профилактика
Чтобы полностью вылечить вагинальный кандидоз, необходимо как своевременно обратиться к врачу, так и выполнять все его рекомендации. Противогрибковые препараты продаются в аптеках без рецепта, но самодеятельность в этом случае не только неэффективна, но и опасна. Только специалист может правильно подобрать необходимые средства, определить особенности их приема, а также проконтролировать действие лекарств.
Важно понимать, что намного проще предупредить вагинальный кандидоз, чем лечить его. Чтобы минимизировать риск развития заболевания, необходимо придерживаться следующих правил:
Вагинальный кандидоз – это неприятное заболевание, которое вполне можно предупредить, а при необходимости – быстро вылечить. Главное своевременно обратиться к врачу и выполнять все его рекомендации.
Современные представления о грибковой патологии пищеварительного тракта
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
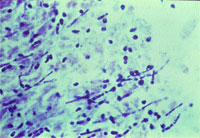 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
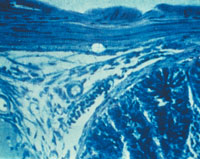 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
II. Кандидозный эзофагит.
III. Кандидоз желудка.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
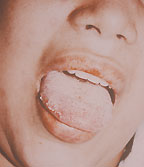 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
Терапия кандидоза
Кандидоз — инфекционное заболевание, обусловленное дрожжеподобными грибами рода Candida. Клинические проявления микоза широко варьируют от поверхностных, слабовыраженных поражений кожи и слизистых оболочек до тяжелых, угрожающих жизни инвазивных висцеральных форм. Диагностика и терапия кандидоза непроста и часто требует привлечения специалистов различного профиля [1, 4, 8].
Число больных поверхностными и глубокими формами кандидоза в последние десятилетия значительно возросло во всех странах мира. Этот факт связывают со снижением естественной иммунной реактивности организма значительной части населения из-за поражения СПИДом, ятрогенных иммунодефицитов, возникающих при химиотерапии онкологических больных, трансплантации органов, вследствие применения глюкокортикоидов, цитостатиков, антиметаболитов, антибиотиков широкого спектра действия, в том числе в отделениях реанимации и интенсивной терапии [4, 8].
Главным возбудителем кандидоза является Candida albicans, которая, как и другие виды грибов Candida, обнаруживается в норме на слизистых и кожных покровах большинства обследованных, но поражает лишь ослабленный организм. Именно в этом кроется сложность проблемы кандидоза.
Природа возбудителя, его взаимоотношения с макроорганизмом, многие аспекты защиты организма от кандидозной инфекции, генетические механизмы резистентности различных видов Candida spp. к основным антимикотикам, применяющимся в лечении кандидоза, подробно изучена. Установлено, что подавляющее большинство штаммов C. albicans, C. tropicalis, C. parapsilosis чувствительны к флуконазолу, однако у ВИЧ-инфицированных и других иммунокомпрометированных больных с инвазивным кандидозом возможна резистентность C. albicans к азольным соединениям. В то же время большинство штаммов C. krusei и часть штаммов C. Glabrata обнаруживают устойчивость к флуконазолу [8].
Адгезия грибов Candida обусловлена их способностью расщеплять секреторный иммуноглобулин А и α-антитрипсин и прикреплять жизнеспособный гриб к протеинам слизистых оболочек за счет гликопротеинадгезина клеточной мембраны гриба. Адгезия гриба к эпителию является основой его инвазии в организм, что происходит уже в первые минуты его взаимодействия со слизистой. Степень адгезии определяет уровень колонизации C. albicans, а степень инвазии — его вирулентность. Грибки продуцируют эндотоксины, гемолизины, дермотоксины, пирогены, протеолитические ферменты, облегчающие адгезию грибковых клеток к ороговевшему эпителию и слизистым оболочкам. Установлено, что у разных штаммов C. albicans способность к продукции этих «факторов агрессии», колонизации и инвазии выражена в различной степени, что должно учитываться при назначении лечения [5, 6]. В «Проекте рекомендаций по лечению кандидоза» указано на важность определения вида возбудителей и их чувствительности к противогрибковым препаратам, даются рекомендации по лечению различных форм инвазивного кандидоза, кандидемии и острого диссеминированного кандидоза — тяжелейших форм кандида-инфекции с высокой летальностью, перечисляются показания к проведению адекватного лечения амфотерицином В и флуконазолом [4]. Замена первого дорогостоящим липосомальным препаратом амбизомом позволяет избежать высокой нефротоксичности амфотерицина В и проводить лечение больных кандидозом с почечной недостаточностью, резистентной к антибиотикам фебрильной нейтропенией, при высоком риске развития острого диссеминированного кандидоза у больных без нейтропении, его органных форм (поражения сердца, сосудов, мочевыводящих путей, желудочно-кишечного тракта). В работе также приводятся рекомендации по лечению кандидоза кожи, ее придатков, хронического кандидоза кожи и слизистых оболочек, профилактике кандидоза у реципиентов трансплантатов органов.
Наиболее полное, систематизированное изложение проблемы кандидоза дано в вышедшей в 2000 году монографии «Кандидоз» [8].
Лечение может быть направлено на предупреждение гиперколонизации организма грибами рода Candida (при назначении антимикотиков широкого спектра действия и иммуносупрессантов). Местные оральные антимикотики — полиены (нистатин, леворин, микогептин) нерастворимы и почти не всасываются из желудочно-кишечного тракта, поэтому редко могут обеспечить элиминацию Candida. Здесь необходимы пероральные препараты системного действия (флуконазол, итраконазол) или препараты для инъекций, такие как флюцитозин, амфотерицин В, амбизом. Если амфотерицин В вследствие его чрезвычайной нефротоксичности назначается при кандидозе в суточной дозе 0,5 мг/кг массы тела, амбизом в 10 раз и более превышает эту дозу и не имеет противопоказаний к назначению [1, 2, 3, 4, 9, 10]. При лечении кандидозов кожи и слизистых оболочек часто используются антимикотики для наружного применения: полиены (леворин, нистатин, натамицин), производные имидазола (кетоконазол, оксиконазол, эконазол, тиоконазол, клотримазол, миконазол, изоконазол, бифоназол, амиказол), триазолы (терконазол), аллиламины (нафтифин, тербинафин), морфолины (аморолфин), прочие препараты (производные унденциленовой кислоты, анилиновые красители и др.).
Одно только перечисление антикандидозных препаратов уже свидетельствует об их множестве и разной степени эффективности, связанной с химической структурой и особенностями фармакокинетики. В частности, наружные средства не всегда создают достаточную концентрацию в подслизистом слое половых путей, глубоких слоях кожи и ее придатках.
В последние годы в России и за рубежом в системной терапии кандидоза с успехом применяется медофлюкон (флуконазол) [2, 3].
Спектр фунгистатического действия флуконазола: Candida albicans, некоторые штаммы Candida nonalbicans (C. guilliermondii, C. pseudotropicalis, C. torulopsis, C. kefyr, C. stellatoidea), Cryptococcus neoformans, Microsporum spp., Trichophyton spp., Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum.
При пероральном и внутривенном применении фармакокинетика флуконазола сходная. При приеме внутрь биодоступность около 90%. Прием пищи не влияет на абсорбцию препарата. Максимальная концентрация достигается через 0,5 — 1,5 ч. После приема 150 мг она составляет 2,44 — 3,58 мкг/мл. Концентрация в крови прямо пропорциональна принятой дозе. Равновесная концентрация устанавливается к 4 — 5-му дню при приеме 1 раз в сутки. При использовании в первый день двойной дозы она достигается ко второму дню. Связь с белками плазмы 11 — 12%. Объем распределения приближается к общему объему воды в организме. Концентрации флуконазола в слюне, мокроте, суставной и перитонеальной жидкостях, вагинальном секрете, грудном молоке аналогичны таковым в плазме крови. Концентрация в ликворе составляет 50 — 90% (в среднем 70 — 80%) уровня в плазме крови, при менингите — до 93%. В роговом слое кожи, эпидермисе, дерме, потовой жидкости и моче концентрации достигают значений, в 10 раз превышающих концентрацию в плазме крови. Концентрация в роговом слое кожи после 12-дневного применения в дозе 50 мг 1 раз в сутки составляет 73 мкг/г. Концентрация в ногтях после 4-месячного применения в дозе 150 мг 1 раз в неделю составляет 4,05 мкг/г в здоровых и 1,8 мкг/г в пораженных ногтях. Препарат определяется в ногтях в течение 6 месяцев после завершения терапии. Т1/2 27 — 30 ч. Биотрансформации не подвергается. Экскретируется почками, на 80% — в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Концентрация флуконазола в плазме крови может быть уменьшена с помощью диализа (на 50% в течение 3 ч).
Медофлюкон применяется внутрь 1 раз в сутки (утром).
Специального подбора доз для пациентов пожилого возраста не требуется, если не угнетена функция почек (клиренс креатинина менее 40 — 50 мл/мин).
У больных с нарушениями функции почек доза должна быть снижена в соответствии со степенью почечной недостаточности.
Пациентам, находящимся на гемодиализе: однократно после каждого сеанса гемодиализа.
Российские авторы [3] приводят собственные данные о применении медофлюкона при различных поражениях, в том числе при висцеральных микозах, обусловленных грибами рода Candida. В частности, опубликованы данные об успешном лечении медофлюконом 9 больных кандидозом кишечника, 11 — полости рта, 3 — пищевода, 18 — вагинальным кандидозом при суточной дозе 50 — 200 мг и длительности курса 14 дней. Отечественные исследователи, оценив эффективность и безопасность препарата, уже в 1996 году назвали медофлюкон безусловным достижением в лечении кандидоза и рекомендовали его для лечения поверхностных и висцеральных форм микоза не только в стационаре, но и в амбулаторных условиях.
К такому же выводу пришли и авторы, проводившие исследования медофлюкона в Московском центре глубоких микозов [2]. По их данным, из 79 больных кандидозным бронхитом, получавших в течение 2 недель 100 — 400 мг медофлюкона в сутки, излечено 74,7%, улучшение наступило у 22,8%, при кандидозной пневмонии выздоровело 66,75%, улучшение отмечено у 33,3%, эрадикация возбудителя — в 97,5 — 100%.
В дерматовенерологии медофлюкон наиболее часто применяется при лечении урогенитальных кандидозов, кандидоза слизистой оболочки полости рта, онихомикозах [4, 6, 7, 8].
Данные, приведенные из литературы, и наш опыт применения медофлюкона при кандидозном вульвовагините и онихомикозе свидетельствуют о его высокой эффективности, хорошей переносимости и безопасности, что делает флуконазол препаратом выбора при лечении различных форм кандидоза слизистых оболочек, кожных покровов и внутренних органов.
В. М. Лещенко, доктор медицинских наук, профессор
Городской микологический центр, Москва