как понять что у ребенка кишечная непроходимость
Низкая кишечная непроходимость
Диагноз кишечной непроходимости можно заподозрить при антенатальном обследовании. При УЗИ плода обнаруживаются расширенные петли кишечника. При антенатальной диагностике кишечной непроходимости следует исключить муковисцидоз. С этой целью производят исследование крови как будущих родителей, так и плода на наличие гена муковисцидоза. Если оба родителя гетерозиготны по гену муковисцидоза, то весьма вероятно рождение больного 
Если кишечная непроходимость была диагностирована антенатальной, сразу после рождения ребенка необходимо установить желудочный зонд и опорожнить желудок, и перевести новорожденного в специализированный стационар.
У ребенка с низкой кишечной непроходимостью с первых суток жизни появляется яркая клиника. Отмечается вздутие живота, отсутствует отхождение мекония, а вместо него из прямой кишки отходит светлая слизь, у ребенка отмечается рвота с примесью желчи, а затем застойным содержимым. При появлении данных симптомов необходимо незамедлительно исключить энтеральное кормление, установить желудочный зонд и опорожнить желудок, и перевести новорожденного в специализированный стационар.
Для уточнения диагноза всем детям в первые часы необходимо производить ирригографию с водорастворимым контрастом. Ирригограмма при низкой кишечной непроходимости позволяет провести дифференциальную диагностику между атрезией тонкой кишки, мекониевым илеусом и болезнью Гиршпрунга.
При болезни Гиршпрунга на первом этапе возможно проведение консервативного лечения. При выявлении мекониевого илеуса проводятся высокие гипертонические клизмы с водорастворимым контрастом, что позволяет у большинства детей разрешить кишечную непроходимость.
Предоперационная подготовка при низкой кишечной непроходимость краткая, не более 3 часов. Определяются группа крови и резус фактор, биохимические показатели крови, кислотно-щелочное состояние, общий анализ крови, проводится инфузионная и антибактериальная терапия.
Объем оперативного пособия зависит от вида патологии и имеющихся осложнений. По возможности формируется первичный косой кишечный анастомоз по типу «конец в конец». Если из-за большой разницы в диаметре приводящего и отводящего отделов кишки сформировать первичный анастомоз не представляется возможным, то создается Т-образный разгрузочный анастомоз, или выводится энтеростома.
В послеоперационном периоде по мере восстановления пассажа по кишечнику начинается энтеральное кормление с постепенным увеличением объема. Выписка пациента из стационара возможна тогда, когда ребенок усваивает физиологический объем питания, и отмечается стойкая прибавка веса. Отдаленные результаты лечения удовлетворительные.
Функциональные нарушения желудочно-кишечного тракта у детей грудного возраста: роль диетотерапии
Функциональные нарушения желудочно-кишечного тракта (ЖКТ) представляют одну из наиболее широко распространенных проблем среди детей первых месяцев жизни [1].
Функциональные нарушения желудочно-кишечного тракта (ЖКТ) представляют одну из наиболее широко распространенных проблем среди детей первых месяцев жизни [1]. Отличительной особенностью данных состояний является появление клинических симптомов при отсутствии каких-либо органических изменений со стороны ЖКТ (структурных аномалий, воспалительных изменений, инфекций или опухолей) и метаболических отклонений. При функциональных нарушениях ЖКТ могут изменяться моторная функция, переваривание и всасывание пищевых веществ, а также состав кишечной микробиоты и активность иммунной системы [2–4]. Причины функциональных расстройств часто лежат вне пораженного органа и обусловлены нарушением нервной и гуморальной регуляции деятельности пищеварительного тракта.
В соответствии с Римскими критериями III, предложенными Комитетом по изучению функциональных расстройств у детей и Международной рабочей группой по разработке критериев функциональных расстройств в 2006 г. [5], к функциональным нарушениям ЖКТ у младенцев и детей второго года жизни относят:
У детей грудного возраста, особенно первых 6 месяцев жизни, наиболее часто встречаются такие состояния, как срыгивания, кишечные колики и функциональные запоры. Более чем у половины детей они наблюдаются в различных комбинациях, реже — как один изолированный симптом. Поскольку причины, приводящие к функциональным нарушениям, оказывают влияние на различные процессы в ЖКТ, сочетание симптомов у одного ребенка представляется вполне закономерным. Так, после перенесенной гипоксии могут возникнуть вегетовисцеральные нарушения с изменением моторики по гипер- или гипотоническому типу и нарушения активности регуляторных пептидов, приводящие одновременно к срыгиваниям (в результате спазма или зияния сфинктеров), коликам (нарушения моторики ЖКТ при повышенном газообразовании) и запорам (гипотоническим или вследствие спазма кишки). Клиническую картину усугубляют симптомы, связанные с нарушением переваривания нутриентов, обусловленным снижением ферментативной активности пораженного энтероцита, и приводящие к изменению микробиоценоза кишечника [6].
Причины функциональных нарушений ЖКТ можно разделить на две группы: связанные с матерью и связанные с ребенком.
К первой группе причин относятся:
Причины, связанные с ребенком, заключаются в:
Частыми и наиболее серьезными причинами, приводящими к возникновению срыгиваний, колик и нарушений характера стула, являются перенесенная гипоксия (вегетовисцеральные проявления церебральной ишемии), частичная лактазная недостаточность и гастроинтестинальная форма пищевой аллергии. Нередко в той или иной степени выраженности они наблюдаются у одного ребенка, поскольку последствиями гипоксии являются снижение активности ферментов и повышение проницаемости тонкой кишки.
Под срыгиваниями (регургитацией) понимают самопроизвольный заброс желудочного содержимого в пищевод и ротовую полость.
Частота синдрома срыгиваний у детей первого года жизни, по данным ряда исследователей, составляет от 18% до 50% [7, 8]. Преимущественно срыгивания отмечаются в первые 4–5 месяцев жизни, значительно реже наблюдаются в возрасте 6–7 месяцев, после введения более густой пищи — продуктов прикорма, практически исчезая к концу первого года жизни, когда ребенок значительную часть времени проводит в вертикальном положении (сидя или стоя).
Степень выраженности синдрома срыгиваний, согласно рекомендациям группы экспертов ESPGHAN, предложено оценивать по пятибалльной шкале, отражающей совокупную характеристику частоты и объема регургитаций (табл. 1).
Нечастые и необильные срыгивания не расцениваются как заболевание, поскольку они не вызывают изменений в состоянии здоровья детей. У детей с упорными срыгиваниями (оценка от 3 до 5 баллов) нередко отмечаются осложнения, такие как эзофагит, отставание в физическом развитии, железодефицитная анемия, заболевания ЛОР-органов. Клиническими проявлениями эзофагита являются снижение аппетита, дисфагия и осиплость голоса.
Следующим, часто встречающимся функциональным расстройством ЖКТ у детей грудного возраста являются кишечные колики — это эпизоды болезненного плача и беспокойства ребенка, которые занимают не менее 3 часов в день, возникают не реже 3 раз в неделю. Обычно их дебют приходится на 2–3 недели жизни, достигают кульминации на втором месяце, постепенно исчезая после 3–4 месяцев. Наиболее типичное время для кишечных колик — вечерние часы. Приступы плача возникают и заканчиваются внезапно, без каких-либо внешних провоцирующих причин [9].
Частота кишечных колик, по разным данным, составляет от 20% до 70% [9, 10]. Несмотря на длительный период изучения, этиология кишечных колик остается не вполне ясной.
Для кишечных колик характерен резкий болезненный плач, сопровождающийся покраснением лица, ребенок принимает вынужденное положение, прижав ножки к животу, возникают трудности с отхождением газов и стула. Заметное облегчение наступает после дефекации.
Эпизоды кишечных колик вызывают серьезное беспокойство родителей, даже если аппетит ребенка не нарушен, он имеет нормальные показатели весовой кривой, хорошо растет и развивается.
Кишечные колики практически с одинаковой частотой встречаются как на естественном, так и на искусственном вскармливании. Отмечено, что чем меньше масса тела при рождении и гестационный возраст ребенка, тем выше риск развития данного состояния.
В последние годы большое внимание уделяется роли микрофлоры кишечника в возникновении колик. Так, у детей с данными функциональными расстройствами выявляются изменения состава кишечной микробиоты, характеризующиеся увеличением количества условно-патогенных микроорганизмов и снижением защитной флоры — бифидобактерий и особенно лактобацилл [11, 12]. Повышенный рост протеолитической анаэробной микрофлоры сопровождается продукцией газов, обладающих потенциальной цитотоксичностью. У детей с выраженными кишечными коликами нередко повышается уровень воспалительного белка — кальпротектина [13].
Функциональные запоры относятся к числу распространенных нарушений функции кишечника и выявляются у 20–35% детей первого года жизни [14, 15].
Под запорами понимают увеличение интервалов между актами дефекации по сравнению с индивидуальной физиологической нормой более 36 часов и/или систематически неполное опорожнение кишечника.
Частота стула у детей считается нормальной, если в возрасте от 0 до 4 месяцев происходит от 7 до 1 акта дефекации в сутки, от 4 месяцев до 2 лет от 3 до 1 опорожнения кишечника. К расстройствам дефекации у младенцев также относятся дисхезия — болезненная дефекация, обусловленная диссинергией мышц дна малого таза, и функциональная задержка стула, для которой характерно увеличение интервалов между актами дефекации, сочетающихся с калом мягкой консистенции, большого диаметра и объема.
В механизме развития запоров у грудных детей велика роль дискинезии толстой кишки. Наиболее частой причиной возникновения запоров у детей первого года жизни являются алиментарные нарушения.
Отсутствие четко очерченной границы между функциональными нарушениями и патологическими состояниями, а также наличие отдаленных последствий (хронические воспалительные гастроэнтерологические заболевания, хронические запоры, аллергические заболевания, расстройства сна, нарушения в психоэмоциональной сфере и др.) диктуют необходимость внимательного подхода к диагностике и терапии данных состояний.
Лечение детей грудного возраста с функциональными нарушениями ЖКТ является комплексным [3, 16] и включает ряд последовательных этапов, которыми являются:
Наличие срыгиваний диктует необходимость использования симптоматической позиционной (постуральной) терапии — изменение положения тела ребенка, направленного на уменьшение степени рефлюкса и способствующего очищению пищевода от желудочного содержимого, тем самым снижается риск возникновения эзофагита и аспирационной пневмонии. Кормить ребенка следует в положении сидя, при положении тела младенца под углом 45–60°. После кормления рекомендуется удерживание ребенка в вертикальном положении, причем достаточно продолжительно, до отхождения воздуха, не менее 20–30 минут. Постуральное лечение необходимо проводить не только на протяжении всего дня, но и ночью, когда нарушается очищение нижнего отдела пищевода от аспирата вследствие отсутствия перистальтических волн (вызванных актом глотания) и нейтрализующего эффекта слюны.
Ведущая роль в лечении функциональных нарушений ЖКТ у детей принадлежит лечебному питанию. Назначение диетотерапии, прежде всего, зависит от вида вскармливания ребенка.
При естественном вскармливании в первую очередь необходимо создать спокойную обстановку для кормящей матери, направленную на сохранение лактации, нормализовать режим кормления ребенка, исключающий перекорм и аэрофагию. Из питания матери исключают продукты, повышающие газообразование в кишечнике (сладкие: кондитерские изделия, чай с молоком, виноград, творожные пасты и сырки, безалкогольные сладкие напитки) и богатые экстрактивными веществами (мясные и рыбные бульоны, лук, чеснок, консервы, маринады, соленья, колбасные изделия).
По мнению ряда авторов, функциональные расстройства ЖКТ могут возникать в результате пищевой непереносимости, чаще всего аллергии к белкам коровьего молока. В таких случаях матери назначается гипоаллергенная диета, из ее рациона исключаются цельное коровье молоко и продукты, обладающие высоким аллергизирующим потенциалом.
В процессе организации диетотерапии необходимо исключить перекорм ребенка, особенно при свободном вскармливании.
При отсутствии эффекта от вышеописанных мероприятий, при упорных срыгиваниях используют «загустители» (например, Био-рисовый отвар), которые разводят грудным молоком и дают с ложечки перед кормлением грудью.
Необходимо помнить, что даже выраженные функциональные расстройства ЖКТ не являются показанием для перевода ребенка на смешанное или искусственное вскармливание. Сохранение симптоматики является показанием к дополнительному углубленному обследованию ребенка.
При искусственном вскармливании необходимо обратить внимание на режим кормления ребенка, на адекватность выбора молочной смеси, соответствующей функциональным особенностям его пищеварительной системы, а также ее объем. Целесообразно введение в рацион адаптированных молочных продуктов, обогащенных пре- и пробиотиками, а также кисломолочных смесей: Агуша кисломолочная 1 и 2, NAN Кисломолочный 1 и 2, Нутрилон кисломолочный, Нутрилак кисломолочный. При отсутствии эффекта используются продукты, специально созданные для детей с функциональными нарушениями ЖКТ: NAN Комфорт, Нутрилон Комфорт 1 и 2, Фрисовом 1 и 2, Хумана АР и др.
Если нарушения обусловлены лактазной недостаточностью, ребенку постепенно вводят безлактозные смеси. При пищевой аллергии могут быть рекомендованы специализированные продукты на основе высокогидролизованного молочного белка. Поскольку одной из причин срыгиваний, колик и нарушений характера стула являются неврологические нарушения вследствие перенесенного перинатального поражения центральной нервной системы, диетологическая коррекция должна сочетаться с медикаментозным лечением, которое назначается детским неврологом.
Как при искусственном, так и при естественном вскармливании между кормлениями целесообразно предлагать ребенку детскую питьевую воду, особенно при склонности к запорам.
Особого внимания заслуживают дети с синдромом срыгиваний. При отсутствии эффекта от использования стандартных молочных смесей целесообразно назначать антирефлюксные продукты (АР-смеси), вязкость которых повышается за счет введения в их состав специализированных загустителей [17, 18]. С этой целью используются два вида полисахаридов:
КРД, безусловно, является интересным компонентом в составе продуктов детского питания, и на ее свойствах хотелось бы остановиться подробнее. Основным физиологически активным компонентом КРД является полисахарид — галактоманнан. Он относится к группе пищевых волокон и выполняет две взаимосвязанные функции. В полости желудка КРД обеспечивает более вязкую консистенцию смеси и препятствует возникновению срыгиваний. Вместе с тем КРД относится к нерасщепляемым, но ферментируемым пищевым волокнам, что и придает этому соединению классические пребиотические свойства.
Под термином «нерасщепляемые пищевые волокна» понимается их устойчивость к воздействию панкреатической амилазы и дисахидаз тонкой кишки. Понятие «ферментируемые пищевые волокна» отражает их активную ферментацию полезной микрофлорой толстой кишки, прежде всего — бифидобактериями. В результате такой ферментации происходит ряд важных для организма физиологических эффектов, а именно:
Положительное влияние КРД на состав кишечной микрофлоры у детей первого года жизни описано в ряде исследований [19]. Это является одним из важных аспектов применения современных АР-смесей в педиатрической практике.
Смеси, включающие КРД (камедь), обладают доказанным клиническим эффектом и при функциональных запорах. Увеличение объема кишечного содержимого за счет развития полезной кишечной микрофлоры, изменение рН среды в кислую сторону и увлажнение химуса способствуют усилению перистальтики кишечника. Примером таких смесей являются Фрисовом 1 и Фрисовом 2. Первая предназначена для детей с рождения до 6 месяцев, вторая — с 6 до 12 месяцев [20]. Эти смеси могут быть рекомендованы как в полном объеме, так и частично, в количестве 1/3–1/2 от необходимого объема в каждое кормление, в сочетании с обычной адаптированной молочной смесью, до достижения стойкого терапевтического эффекта.
Другая группа АР-смесей — продукты, включающие в качестве загустителя крахмалы, которые действуют только в верхних отделах ЖКТ, причем положительный эффект наступает при использовании их в полном объеме. Эти смеси показаны детям с менее выраженными срыгиваниями (1–3 балла), как при нормальном стуле, так и при склонности к разжиженному. Среди продуктов этой группы выделяется смесь NAN Антирефлюкс, обладающая двойной защитой против срыгиваний: за счет загустителя (картофельного крахмала), увеличивающего вязкость желудочного содержимого и умеренно гидролизованного белка, повышающего скорость опорожнения желудка и дополнительно профилактирующего запоры.
В настоящее время на Российском потребительском рынке появилась обновленная антирефлюксная смесь Хумана АР, в состав которой одновременно введены камедь рожкового дерева (0,5 г) и крахмал (0,3 г), что позволяет усилить функциональное действие продукта.
Несмотря на то, что АР-смеси являются полноценными по составу и призваны обеспечить физиологические потребности ребенка в пищевых веществах и энергии, согласно международным рекомендациям они относятся к группе продуктов детского питания «для специального медицинского назначения» (Food for special medical purpose). Поэтому продукты данной группы следует использовать строго при наличии клинических показаний, по рекомендации врача и под медицинским контролем. Продолжительность применения АР-смесей должна определяться индивидуально и может быть достаточно длительной, около 2–3 месяцев. Перевод на адаптированную молочную смесь осуществляется после достижения стойкого терапевтического эффекта.
Литература
*НЦЗД РАМН, **РМАПО, Москва
Как понять что у ребенка кишечная непроходимость
Стадии странгуляционной кишечной непроходимости у детей
К настоящему времени структура острой кишечной непроходимости (ОКН) по сравнению с предшествующими десятилетиями значительно изменилось. Наиболее серьезной проблемой остается острая странгуляционная кишечная непроходимость (ОСКН). Патогенез ее многообразен, сложен, обусловлен сдавлением брыжейки. Диагностика острой странгуляционной кишечной непроходимости затруднена, особенно, в детском возрасте. Сложность диагностики у детей состоит в том, что она нередко распознается на операционном столе. При этом выявляется большой процент некроза кишки. Понятно стремление предупредить и выявить осложнения на дооперационном этапе является актуальным.
Специалисты Рязанского государственного медицинского университета имени академика И.П. Павлова изучили стадии острой странгуляционной кишечной непроходимости (ОСКН) у детей.
Произведен ретроспективный анализ данных 60 детей с острой странгуляцион-ной кишечной непроходимости. Изучены анамнез, клиника, данные объективного исследования, а также биохимические и морфологические изменения у детей с острой странгуляционной кишечной непроходимостью. Произведен статистический анализ полученных данных с помощью применения критерия Стьюдента, определен уровень достоверности используемых показателей между каждой группой. В работе использованы ультразвуковые и рентгенологические методы исследования.
Несмотря на заметные успехи диагностика и лечение острой странгуляцион-ной кишечной непроходимости у детей до сих пор встречаются случаи некроза кишки и летальные исходы, одной из причин которых является тяжелая степень интоксикации. В клинике детской хирургии г. Рязани за последние три года находилось на лечении 60 (100%) детей с острой странгуляционной кишечной непроходимости. Мальчиков было 38 (63%), девочек — 22 (37%). 34 (56%) ребенка поступили через 12 часов от начала заболевания, 15 (25%) — от 12 до 24 часов, 11 (19%) детей поступили через 24 часа и более.
При поступлении компенсированная (I) стадия диагностирована у 37 (61%) детей, субкомпенсированная (II) — у 12 (20%), декомпенсированная (III) — у 11 (19%).
Во II группу вошло 12 (20%) детей с субкомпенсированной стадией острой странгуляционной кишечной непроходимостью. Дети поступали в сроки от 12 до 24 часов. У 8 (67% группы) детей причиной были спайки после предыдущих операций, у 4 (33% группы) — заворот кишки. Детей до 3х лет было 4 (33% группы), от 4 до 9 лет — 3 (25% группы), от 10 до 18 — 5 (42% группы). Оперативное лечение произведено всем детям: рассечение спаек — у 8 (67% группы), ликвидация заворота кишки — у 4 (33% группы).
В III группу вошло 11 (19%) детей с декомпенсированной стадией острой странгуляционной кишечной непроходимостью. Все дети поступали после 24 часов и более с момента заболевания. Возраст детей до 3 лет был у 5 (46% группы), от 4 до
Критериями выделения стадий явились особенности клиники, лабораторные показатели, а также УЗИ и рентгенологические признаки.
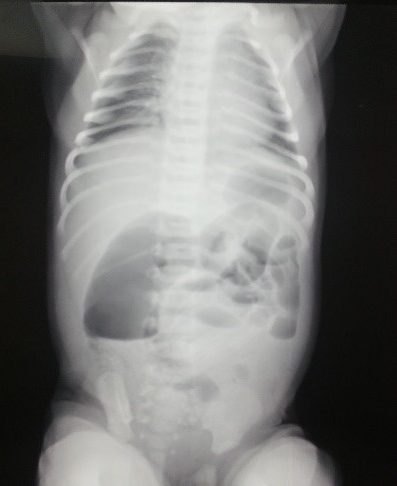
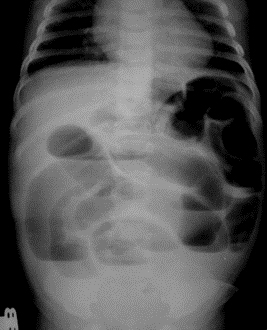
Для I (компенсированной) стадии острой странгуляционной кишечной непроходимости у детей характерно было острое начало, с резких постоянных болей в животе, коллаптоидное состояние, бледность кожных покровов, тахикардия. Рвота съеденной пищей, задержка стула. Живот не вздут, мягкий, болезненный при пальпации. Симптомов раздражения брюшины нет. Нет признаков интоксикации. Пульс учащается незначительно, артериальное давление не падает. На УЗИ — дилатация тонкой кишки, толщина ее стенки не превышает 3 мм. На обзорной рентгенограмме — патологии нет.
При II (субкомпенсированной) стадии острой странгуляционной кишечной непроходимости состояние ухудшается за счет интоксикации и обезвоживания. Стадия длится от 12 до 24 часов. Остаются боли в животе, боли схваткообразные, но меньше, чем в I стадии. Рвота с желчью, урчанье в животе. Язык покрыт белым налетом, сухой. Живот вздут, нарастают явления пареза. При пальпации живот мягкий, болезненный. Симптомов раздражения брюшины нет. Стула нет. Пульс частый, артериальное давление снижено. Имеется дилатация тонкой кишки на УЗИ, толщина кишки — 4 мм. На обзорной рентгенограмме имеются уровни жидкости в вертикальном положении.
При III (декомпенсированной) стадии у детей с острой странгуляционной кишечной непроходимостью появляются симптомы перитонита вследствие некроза ущемленной кишки. Состояние становится тяжелым за счет интоксикации и обезвоживания организма. По зонду из желудка содержимое с примесью желчи или каловое содержимое. Язык сухой, обложен, живот вздутый и напряжен. Симптомы раздражения брюшины положительные. Стула и мочи нет. Ребенок бледен, пульс частый, артериальное давление снижено. На УЗИ имеется дилатация тонкой кишки, толщина стенки ее 5 мм. На обзорной рентгенограмме брюшной полости множество тонкокишечных уровней с локализацией во всех отделах брюшной полости. Мо-торно-эвакуаторная функция отсутствует.
С целью выявления патофизиологических и биохимических сдвигов авторами обследованы дети с ОСКН. В комплекс обследования кроме общепринятых клинических методов были включены лабораторные показатели крови (Гемоглобин, лейкоцитарный индекс интоксикации, общий белок, альбумин, креатинин, калий, гемато-критное число, аланинаминотрансфераза, аспартамаминотрансфераза, молекулы средней массы), определение пульса, систолическое артериальное давление, количество дыханий в минуту. Исследование проводилось при поступлении.
Анализируя клинические и лабораторные данные, авторы статьи попытались уловить динамику токсемии. Известно, что изменения микроциркуляции крови приводят к нарастанию уровня метаболитов, продуктов распада в крови. Их уровень зависит от стадии острой странгуляционной кишечной непроходимости.
Были выявлены наиболее достоверные показатели, отражающие динамику заболевания и степень токсемии. Показатели изучаемых данных отличались в зависимости от стадии заболевания.
В I стадии гемодинамика была стабильной. Незначительные отклонения отмечались в лабораторных показателях: склонность к ацидозу, умеренное повышение веществ средней молекулярной массы. Остальные показатели колебались незначительно.
При II стадии острой странгуляцион-ной кишечной непроходимости отмечалось умеренное повышение величины сердечного индекса за счет тахикардии, имелось снижение насыщения венозной крови кислородом. Регистрировалось повышение количества вещества средней молекулярной массы, склонность к гиперкоагуляции. Регистрировался лейкоцитоз, достоверно увеличивались показатели креати-нина, гемоглобина, аспартамаминотранс-феразы, уменьшалось количество альбумина, при незначительном изменении количества общего белка в крови. Клинически эти дети были стабильны.
У детей с III стадией острой странгу-ляционной кишечной непроходимостью отмечалась нестабильность центральной гемодинамики: склонность к центральной гипотонии, снижение сердечного индекса, артериальная венозная гипоксемия. Наблюдался выраженный лейкоцитоз.
Кроме гипоксемии и метаболического ацидоза появились признаки гиперкоагуляции. Достоверно нарастали показатели молекул средней массы, лейкоцитарный индекс интоксикации, аспартамами-нотрансфераза и аланинаминотрансфераза, снижалось количество альбумина в крови. Следует отметить, что показатели центральной и периферической гемодинамики существенно зависели от выраженности токсемии, состояния реологических свойств крови. Раннее включение в терапию альбумина, дезагрегантов (трентала, курантила, гепарина, реополиглюкина) позволили быстро стабилизировать гемодинамику, скорригировать метаболический ацидоз, коагулирующие свойства крови, уменьшить степень токсемии.
С целью снижения интоксикации за счет улучшения дренажной функции кишечника всем детям с III стадией острой странгуляционной кишечной непроходимости производили интубацию кишечника (у 2 (20% оперированных) — через цекостому, у 5 (50% оперированных) — через илеостому).
Наиболее выраженные сдвиги гематологических и биохимических показателей отмечены у детей III стадии за счет значительного всасывания продуктов распада через поврежденную стенку кишечника.
Ведущими критериями оценки клинических стадий острой странгуляционной кишечной непроходимости у детей (компенсированная, субкомпенсированная, декомпенсированная) является время, прошедшее с момента начала заболевания, данные объективного исследования и степень эндотоксикоза, а также распространенность процесса в брюшной полости.
Оценка степени эндотоксикоза в крови по уровням молекул средней массы и аспартамаминотрансферазы позволяет более точно определить стадию острой странгуляционной кишечной непроходимости.
.gif)
.gif)