как понять что выделяется газ в химии
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 10. Признаки химических реакций
В уроке 10 «Признаки химических реакций» из курса «Химия для чайников» рассмотрим, что из себя представляют физические и химические явления; выясним, что такое химическая реакция, а также признаки и условия протекания химических реакций.
Давайте внимательно посмотрим вокруг себя. Мы уже знаем, что весь окружающий нас мир состоит из различных веществ: органических и неорганических, простых и сложных, твердых, жидких и газообразных. Остаются ли эти вещества в природе неизменными? Нет, в природе происходят различные изменения, которые называются явлениями. В зависимости от того, какие изменения происходят с веществами, различают явления физические и химические. Эти два рода явлений можно отличить друг от друга.
Физические явления
Нальем воду в колбу и нагреем ее до кипения. Каждый из вас знает, что при кипении вода превращается в пар, т. е. переходит в другое агрегатное состояние. Однако несложно доказать, что вода и пар — это одно и то же вещество. Подумайте, как это можно сделать.
Нагреем тонкую стеклянную трубку в пламени спиртовки. Стекло станет мягким, и мы легко изменим форму трубки, но стекло как вещество остается тем же.
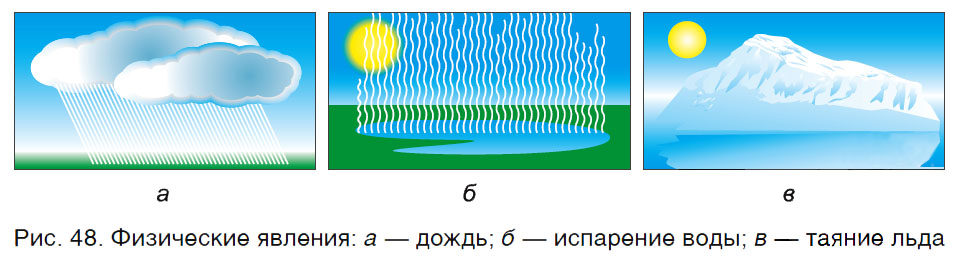
Эти явления физические. При физических явлениях не происходит образования новых веществ. Изменяется только агрегатное состояние веществ, их форма, а состав веществ остается прежним (рис. 48).
Например, вода — это вещество, которое в природе образует не только реки, моря, но и ледники, и облака. Ледники тают, облака роняют капли воды, вода испаряется, т. е. происходит изменение ее агрегатного состояния, но состав молекул остается неизменным.
Сгибание проволоки, дробление соли, плавление металлов (рис. 49), образование мраморной крошки, перемалывание зерна в муку, превращение воды в пар при кипячении — все это физические явления. Они осуществляются в результате деятельности человека. У веществ при этом изменяется только форма или агрегатное состояние.
Физическими называются явления, при которых изменяется только форма или агрегатное состояние веществ.
Химические явления (реакции)
Всегда ли вещества остаются неизменными? Нагреем красную медную проволоку в пламени спиртовки. Проволока покрывается черным налетом, который можно легко соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое превратилась медь. Оно отличается от меди по цвету и плотности. В этом опыте мы наблюдаем химическое явление, которое происходит благодаря химической реакции.
Химические реакции — это явления, при которых происходит превращение одних веществ в другие.
Природа — это огромная лаборатория, в которой непрерывно происходит образование новых веществ. Горные породы и минералы под воздействием солнца, воды, углекислого газа и других веществ постепенно разрушаются и превращаются в новые вещества. В зеленых растениях из углекислого газа и воды образуются глюкоза и крахмал.
Человек превращает взятые из природы вещества (природный газ, нефть, руды) в необходимые ему бензин, резину, пластмассы, волокна, металлы. Часто в результате множества превращений получаются новые вещества, которых нет в природе. При всех этих явлениях происходит разрушение исходных веществ и образование новых веществ.
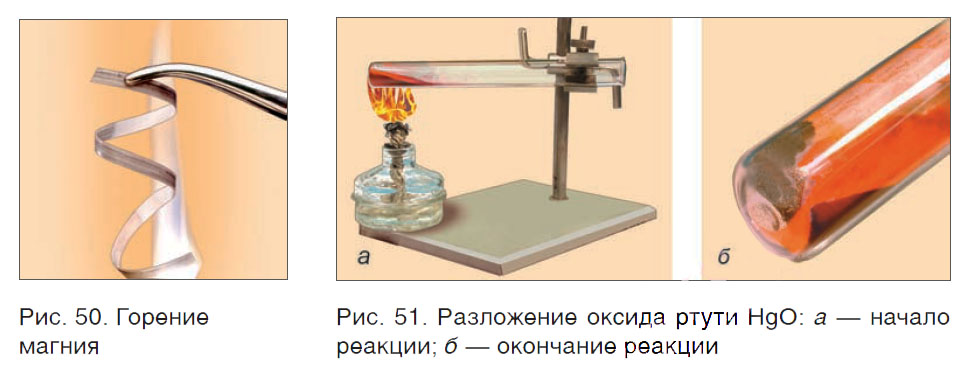
Например, в результате сгорания магния образуется новое вещество MgO (рис. 50). При сгорании метана получаются два вещества: углекислый газ CO2 и вода H2O. Из одного сложного вещества HgO в результате его разложения образуются два новых — ртуть Hg и кислород O2 (рис. 51).
Ржавление железа (рис. 52), кипячение воды, горение лучины, распространение запаха — какие из этих явлений можно отнести к химическим реакциям? По каким признакам можно судить, что химическая реакция произошла?
Признаки химических реакций
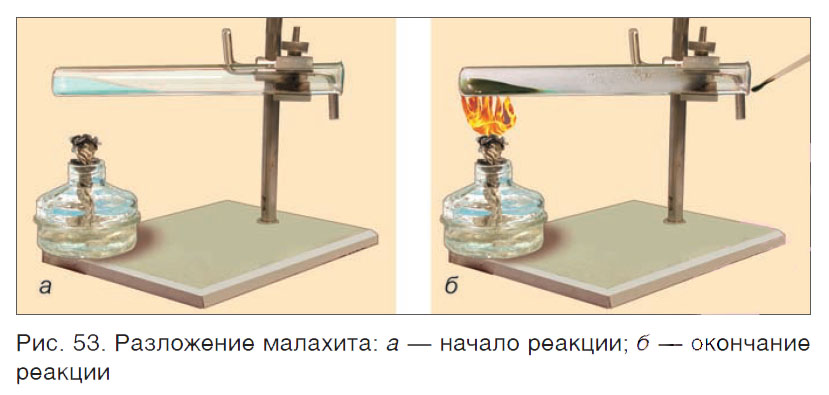
Проведем несколько химических реакций. Нагреем в пробирке зеленый порошок малахита (рис. 53) — минерала, в состав которого входят атомы меди, углерода, водорода и кислорода. Порошок малахита начинает «кипеть» из-за выделяющегося газа. Поднесем к отверстию пробирки спичку, она гаснет — это выделяющийся углекислый газ препятствует ее горению. На стенках пробирки заметны капельки воды, на дне остается черный порошок соединения меди (CuO). Наблюдения доказывают, что образуются новые вещества с другими свойствами. Прекратим нагревание. Сразу прекращается выделение углекислого газа — реакция больше не протекает.
Существуют и другие признаки химических реакций. Например, при горении магния излучается яркий свет и выделяется много теплоты (см. рис. 50).
На заметку: Раньше вспышка магния использовалась для освещения объекта во время фотографирования.
При сливании некоторых растворов наблюдается выпадение осадка (рис. 54). Некоторые осадки можно растворить при помощи других веществ. Например, при сливании растворов соды и известковой воды образуется белый осадок, который легко растворяется в уксусе.
При сгорании спички ощущается резкий запах. Какие еще признаки химических реакций наблюдаются при горении спички?
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Признаки химических реакций:
• Выделение газа.
• Образование или исчезновение осадка.
• Изменение цвета.
• Появление запаха.
• Излучение света.
• Выделение или поглощение теплоты.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия протекания химических реакций
Необходимое и главное условие для протекания большинства реакций между различными веществами — это их соприкосновение. Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Мало знать, как начать химическую реакцию, надо еще знать, при каких условиях она будет протекать дальше. Почему необходимо все время нагревать сахар, чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и она продолжает гореть?
Если при образовании новых веществ выделяется много теплоты, то ее бывает достаточно, чтобы нагревались новые порции вещества и реакция продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии. Примером является горение угля. Другие реакции, например разложение сахара, требуют постоянной затраты энергии на ее продолжение.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Таким образом, окружающий нас мир состоит из множества веществ, которые вступают в различные химические реакции. Изучая химические реакции, человек познает сущность процессов, протекающих в живой и неживой природе. Полученные знания помогают более эффективно использовать вещества для получения больших урожаев, выращивания животных, борьбы с различными болезнями. Человечество учится бережно и грамотно относиться к окружающему нас миру.
Краткие выводы урока:
Надеюсь урок 10 «Признаки химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как определить выделяется газ или нет?
Как понять что вещество осадок?
Ответ, проверенный экспертом
Что бы определить выпадает ли осадок, нужно обратится к таблице растворимости, если вещество нерастворимо, то выпадает осадок. С газами посложнее. … Например, если образуется HCL, он может выделится в виде газа (хлороводород) или остаться в растворе в виде соляной кислоты.
Как образуются осадки в химии?
В большинстве случаев образование осадка вызвано физическими причинами, каждое вещество имеет определённую растворимость, которая при изменении температуры, изменения насыщенности или давления может меняться.
Что является осадком в химии?
ОСАДОК, в химии — нерастворимое твердое вещество, образующееся в РАСТВОРЕ либо прямо в процессе реакции, либо в результате изменения структуры раствора, уменьшающего РАСТВОРИМОСТЬуже растворенного соединения. …
Как понять что это газ в химии?
Что такое соприкосновение в химии?
Соприкосновение — ср. 1. Такое положение двух или нескольких тел, предметов, при котором они соприкасаются своими гранями, частями.
Что такое признаки химических реакций?
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
Что значит уравнение в ионном виде?
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Что показывает сокращённое ионное уравнение?
Сокращённое ионное уравнение характеризует сущность реакции, показывает, какие ионы реагируют между собой, и какое вещество они образуют в результате ионной реакции. При этом неважно, в состав каких веществ-электролитов входили эти ионы до реакции.
Как образуются осадки?
Под действием солнечного тепла вода в Мировом океане нагревается превращается в пар и поднимается в воздух. Там влажные воздушные массы поднимаются вверх,где на высоте становятся холодными. Образуется конденсат. Так формируются облака,которые под действием ветра переносятся на материки,где и выпадают в виде осадков.
Какие бывают виды осадков?
Что такое осадки в погоде?
Атмосфе́рные оса́дки (также — гидрометео́ры) — атмосферные явления, связанные с присутствием в атмосфере воды в жидком или твёрдом состоянии, выпадающей из облаков или осаждающейся из воздуха на земную поверхность и какие-либо предметы.
Каковы условия получения хорошего кристаллического осадка?
Таким образом, можно сформулировать следующие правила осаждения кристаллических осадков. Необходимо: 1) вести осаждение из достаточно разбавленного раствора разбавленным раствором осадителя; 2) прибавлять осадитель очень медленно, по каплям (особенно в начале осаждения);
Что значит осадок?
Какие способы осаждения применяют в промышленности?
В промышленности осаждение осуществляют с помощью отстойников (иногда наз. также сгустителями или осветлителями), которые бывают периодического и непрерывного действия. Продолжительность т пребывания суспензии в отстойнике должна быть равна или больше времени осаждения частицы.
Реакции, идущие с выделением газа
Теория
Реакции между ионами называются ионными реакциями, а уравнения этих реакций — ионными уравнениями.
В соответствии с правилом Бертолле реакции обмена протекают до конца только тогда, когда образуются твердое малорастворимое соединение (осадок), легколетучее вещество (газ) или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода).
Реакцию обмена в растворе принято изображать 3 уравнениями:
— полным ионным уравнением
— сокращенным ионным уравнением
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, т.е. обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
В ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул.
В виде ионов записывают формулы: сильных кислот; сильных оснований; растворимых в воде солей.
В виде молекул записывают формулы: воды; слабых кислот; слабых оснований; малорастворимых солей; амфотерных гидроксидов; оксидов; газообразных веществ.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т.е. протекать до конца;
2) обратимыми, т.е. протекать одновременно в двух противоположных
направлениях.
Рассмотрим примеры реакций ионного обмена, протекающих до конца. 1. Реакции с образованием малорастворимых веществ, выпадающих в осадок.
Составим молекулярное и ионные уравнения реакции между нитратом серебра (I) и хлоридом натрия:
Эта реакция обмена необратима, потому что один из продуктов уходит из раствора в виде нерастворимого вещества (осадка).
2. Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионные уравнения реакции нейтрализации между растворами гидроксида калия и азотной кислоты:
В результате реакции нейтрализации ионы водорода и гидроксид-ионы образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т.е. эта реакция необратима.
3. Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионные уравнения реакции между растворами гидроксида натрия и хлоридом аммония:
Реакции обмена, если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, являются обратимыми, т.е. до конца не протекают.
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Примером данной реакции может служить реакция между хлоридом натрия и нитратом кальция. Уравнения таких реакций обмена не записывают.
Таким образом, реакции ионного обмена идут в направлении связывания ионов.
@Задание. Составьте молекулярные и ионные уравнения реакций между веществами: сульфидом калия и соляной кислотой, гидроксидом меди (II) и азотной кислотой, нитратом свинца (II) и сульфатом калия, карбонатом магния и соляной кислотой, хлоридом железа (III) и нитратом серебра, гидроксидом бария и серной кислотой, гидроксидом натрия и нитратом аммония.
Задача 1.(образец) В 100 г воды растворили 20 г соли. Рассчитайте массовую долю соли в %.
Ответ: массовая доля соли 16,67%.
@Задание. Используя образец решения задачи 1., реши следующую задачу:
Задача 2. В 200 г спирта растворили 50 г йода. Рассчитайте массовую долю йода в %.
Задача 3.(образец) Сколько граммов воды и нитрата натрия нужно взять, чтобы приготовить 80г 5%-го раствора?
Ответ: нужно взять 76 граммов воды и 4 г нитрата натрия.
@Задание. Используя образец решения задачи 3., реши следующую задачу:
Задача 4. Сколько граммов йода и спирта нужно взять для приготовления 30г 5%-го раствора йодной настойки?
Лабораторное занятие №1
«Реакции ионного обмена»
Цель:экспериментальное подтверждение знаний об условиях протекания реакций ионного обмена до конца, выработка умений по составлению ионных уравнений реакций.
Порядок выполнения работы
Оборудование и реактивы:
штатив с пробирками, растворы сульфата меди (II), сульфата алюминия, гидроксида натрия, нитрата бария, сульфита натрия, карбоната натрия, серной кислоты, хлорида железа (III), фенолфталеина.
Реакции, идущие с образованием осадка
Опыт №1
Налейте в пробирку 3-4мл раствора сульфата меди (II) и добавьте немного раствора гидроксида натрия.
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде: ________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №2.
Налейте в пробирку 3-4мл раствора сульфата алюминия и добавьте немного раствора нитрата бария.
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде: ________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №3
Налейте в пробирку 3-4мл раствора сульфита натрия и добавьте столько же раствора серной кислоты.
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде: ________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 4
Налейте в пробирку 3-4мл раствора карбоната натрия и добавьте столько же раствора серной кислоты.
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде: ________________________________________________________________________________________________________________________________________________________________________________________________________________________ Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Реакции, идущие с образованием малодиссоциирующего
Вещества.
Опыт №5
Налейте в пробирку 3-4мл раствора гидроксида натрия и добавьте две-три капли фенолфталеина. Затем прилейте раствор серной кислоты.
Запишите наблюдения: ____________________________________________
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде: ________________________________________________________________________________________________________________________________________________________________________________________________________________________ Вывод:______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Экспериментальные задания. Растворить образовавшийся в опыте № 1 осадок, и записать при этом происходящие реакции в молекулярном, ионном и сокращенном ионном виде:
Запишите наблюдения: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде: _________________________________________________________________________________________________________________________________________________________________________________________________________________
1. Какие реакции называются ионными?
2. В каких случаях реакции ионного обмена протекают до конца?
3. В каком направлении протекают реакции ионного обмена?
4. Объясните, почему в опытах №1 и №2 образовались осадки?
5. Объясните, почему в опытах №3 и №4 выделились газообразные вещества?
6. Какими еще кислотами можно было подействовать на растворы сульфита натрия и карбоната натрия (в опытах №3 и №4), чтобы получить аналогичные результаты?
7. Объясните, почему в опыте №5 произошло обесцвечивание? Как называется реакция между щелочью и сильной кислотой?
8. В каких случаях реакции ионного обмена в растворах электролитов являются необратимыми?
9.В каких случаях реакции ионного обмена в растворах электролитов являются обратимыми?
10.В каких случаях реакции ионного обмена в растворах электролитов не протекают?
12.Формулы каких веществ в ионных уравнениях записывают в виде ионов?
13.Формулы каких веществ в ионных уравнениях записывают в виде молекул?
Лабораторное занятие №2
«Испытание растворов солей индикаторами.
Цель:отработка практических навыков определения среды раствора соли, составления уравнений реакций гидролиза солей по первой стадии.
Теория
Вода по отношению к веществам может быть растворителем, реагентом. В том случае, когда вода выступает средой реакции и реагентом, говорят о процессе гидролиза.
При гидролизе, как правило, степени окисления элементов сохраняются, на основании чего и составляются уравнения гидролиза:
МAn + HOH = MOH + HАn
Соль основание кислота
Гидролизу не подвергаются:
1) соли, нерастворимые в воде;
2) растворимые соли, образованные сильной кислотой и сильным основанием.
Гидролизу подвергаются:
1) растворимые соли, в состав которых входит хотя бы один слабый ион (Na2C03, CuS04, NH4F и т. д.).
Это обратимый гидролиз.
2) Соли, напротив которых в таблице растворимости стоит прочерк, необратимо гидролизируются:
При составлении уравнений обратимого гидролиза по первой стадии следует придерживаться следующего алгоритма:
Образец №1. Соль образована слабой кислотой и сильным основанием
1. Записать уравнение диссоциации соли. Na2C03 Û 2Na + + C03 2-
2. Выбрать слабый ион: катион или анион.
Это случай гидролиза по аниону.
Образец №2. Соль образована сильной кислотой и слабым основанием
2. Выбрать слабый ион: катион или анион.
4. Определить среду раствора кислая
Это случай гидролиза по катиону.
Если соль образована слабой кислотой и слабым основанием (например, NH4NO2), то проходит гидролиз и по катиону и по аниону.
Гидролиз солей, образованных многоосновными кислотами и многокислотными основаниями идет ступенчато. Каждая последующая стадия идет в меньшей степени, чем предыдущая.
Порядок выполнения работы
Оборудование и реактивы:
штатив с пробирками; универсальная индикаторная бумажка, растворы солей
сульфата натрия, нитрата меди (II), сульфида натрия.
Задание №1 Испытание растворов солей индикатором.Налейте в пробирку немного раствора каждой соли, а затем испытайте действие растворов этих солей на универсальной индикаторной бумажке. Занесите данные в таблицу, укажите среду раствора знаком «+».
| Формула соли | Среда раствора | Укажите, каким основанием и кислотой (сильными или слабыми) образована соль. |
| Нейтральная | Кислая | Щелочная |
Сделайте вывод: ______________________________________________________________________________________________________________________________________________________________________________________________________________.
Задание №2.Напишите уравнения реакций гидролиза соли, раствор которой имел кислую среду.
Задание №3.Напишите уравнения реакций гидролиза соли, раствор которой имел щелочную среду.
1. Что называется гидролизом соли?
2. В чем сущность гидролиза солей?
3. Какие соли подвергаются гидролизу?
4. Какие соли гидролизуются по аниону? Почему? Приведите примеры таких солей.
5. Какие соли гидролизуются по катиону? Почему? Приведите примеры таких солей.
6. Какие соли гидролизуются и по катиону и по аниону? Приведите примеры таких солей.
7. Для каких солей гидролиз протекает необратимо? Приведите примеры таких солей.
8. Какие соли не гидролизуются? Почему?
9. Какие соли гидролизуются ступенчато? Приведите примеры таких солей.
Практическое занятие №2
«Составление уравнений окислительно-восстановительных реакций методом электронного баланса».
Цель: систематизация и углубление знания об окислительно-восстановительных реакциях, отработка практического навыка всоставлении уравнений окислительно-восстановительных реакций методом электронного баланса.
Теория.
Окислительно-восстановительными называются реакции, в ходе которых хотя бы один элемент изменил свою степень окисления.
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ
(с примерами)
1.У свободных атомов и у простых веществ с. о. равна 0.
а) у металлов главной подгруппы I группы +1;
б) у металлов главной подгруппы II группы +2;
4. В соединениях с неметаллами у водорода с. о. +1,
а с металлами-1:
5. В соединениях сумма с. о. всех атомов равна 0.
Метод электронного баланса.
При расстановки коэффициентов методом электронного баланса придерживаются следующего алгоритма:
1. Расставить степени окисления всех элементов.
2. Выбрать элементы, изменившие степень окисления.
3. Выписать эти элементы и показать схематично переход электронов (составить электронный баланс).
4. Число перешедших электронов снести крест накрест и, если нужно, сократить. Эти числа будут коэффициентами в уравнении.
5. Расставить коэффициенты из электронного баланса.
6. Сравнением числа атомов каждого элемента в левой и правой части уравнения реакции определить и проставить недостающие коэффициенты.
Примечание: Индекс в молекулах простых веществ переносится в электронный баланс, индексы из формул сложных веществ в баланс не переносятся.
Коэффициенты, взятые из электронного баланса, подчеркнуты одной чертой.
@Задание. Расставьте коэффициенты в схемах реакций методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления.
1.Какие реакции называются окислительно-восстановительными?
2.Какова с.о. простых веществ?
3.У каких элементов с.о. постоянная?
4.Кто такие восстановители? Какой процесс с ними при этом происходит? Приведите примеры.
5.Кто такие окислители? Какой процесс с ними при этом происходит? Приведите примеры.
6.На конкретном примере покажите алгоритм проставления коэффициентов методом электронного баланса.
Лабораторное занятие №3
«Свойства алюминия и его соединений»
Цель:закрепление знаний о свойствах алюминия и его соединений; проведение опытов, подтверждающих химические свойства алюминия по отношению к различным кислотам, получение гидроксида алюминия косвенным способом, экспериментальное подтверждение амфотерных свойств гидроксида алюминия.
Теория:
Алюминий является восстановителем и реагирует со многими простыми и сложными веществами.
Порядок выполнения работы
Оборудование и реактивы:штатив с пробирками, спиртовка, алюминиевые стружки, лучинка; растворы серной, соляной и азотной кислоту, растворы сульфата или хлорида алюминия, азотная кислота (плотность 1,4 г/см 3 ), 30 %-ный раствор гидроксида натрия.
Теория.
Химические свойства железа. В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними.
1. При нагревании с хлором образует хлорид железа (III)
2. При нагревании с кислородом образует Fe304
образованием гидроксида железа (III)
8. Восстановительная способность у железа меньше, чем у щелочных,
щелочноземельных металлов и алюминия. Поэтому с водой реагирует при высокой температуре раскаленное железо с образованием Fe304 и выделением газообразного водорода.
9. Реагирует с разбавленными серной и соляной кислотами, вытесняя из них
водород и образуя двухвалентные соли. При обычной температуре железо не реагирует с концентрированной серной кислотой, т.к. пассивируется ею. Но при нагревании концентрированная серная кислота реагирует с железом с образованием сульфата железа (III), оксида серы (IV) и воды.
10. Концентрированная азотная кислота пассивирует железо, а разбавленная окисляет его до нитрата железа (III), оксида азота (II) и воды.
12. Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений.
Порядок выполнения работы.
Оборудование и реактивы:
штатив с пробирками; растворы сульфата железа (II), хлорида железа (III), гидроксида натрия или калия, серной и соляной кислот, перманганата калия.
Теория
Качественный анализ позволяет определить из каких элементарных веществ состоит данное сложное вещество или смесь.
Таблица распознавания анионов
Порядок выполнения работы
Оборудование и реактивы: растворы карбоната натрия, хлорида бария, хлорида натрия, бромида натрия, иодида калия, фосфата натрия, нитрата серебра, соляной кислоты, серной кислоты, известковая вода, универсальная индикаторная бумага, пробирки, пробиркодержатель.
Теория
Алканы – это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула
Первые четыре члена гомологического ряда метана получили исторически сложившиеся названия. Основой названия следующих алканов нормального строения стали греческие числительные (см. таблицу).
Для составления названий органических веществ по номенклатуре ИЮПАК необходимо знать формулы и названия радикалов. Радикал – это одновалентная частица, которая получается при отщеплении от молекулы алкана атома водорода, т.е. частица, содержащая неспаренный электрон. Название радикала происходит от названия соответствующего алкана с заменой суффикса –ан на суффикс –ил(см. таблицу).
| Название | Формула | Формула радикала | Название радикала |
| Метан | СН4 | СН3— | Метил |
| Этан | С2Н6 | С2Н5— | Этил |
| Пропан | С3Н8 | С3Н7— | Пропил |
| Бутан | С4Н10 | С4Н9— | Бутил |
| Пентан | С5Н12 | С5Н11— | Пентил |
| Гексан | С6Н14 | С6Н13— | Гексил |
| Гептан | С7Н16 | С7Н15— | Гептил |
| Октан | С8Н18 | С8Н17— | Октил |
| Нонан | С9Н20 | С9Н19— | Нонил |
| Декан | С10Н22 | С10Н21— | децил |
Изомеры – это вещества, имеющие одинаковые молекулярные, но разные структурные формулы и, следовательно, разные свойства.
Например, у вещества бутана, имеющего формулу С4Н10, есть два изомера, имеющие следующие структурные формулы
В соответствии с международной номенклатурой следует придерживаться следующих правил при составлении названия алканов.
1. В структурной формуле выбирают самую длинную цепь атомов углерода (главную цепь).
2. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление – боковая цепь.
3. В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствуют несколько одинаковых радикалов (два, три, четыре и т.д.), то перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
4. Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Задание 1.(образец) Назовите вещества